Entacapone Orion
alt informationenZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
ANHANGI
Entacapone Orion 200 mg Filmtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine Filmtablette enthält 200 mg Entacapon.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtablette.
Bräunlich-orange, ovale, bikonvexe Filmtablette mit der Prägung „COMT“ auf einer Seite.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Entacapon wird in Kombination mit Standardpräparaten von Levodopa/Benserazid oder Levodopa/Carbidopa bei erwachsenen Patienten mit Morbus Parkinson eingesetzt, bei denen „end-of-dose“-Fluktuationen im Krankheitsbild auftreten und die mit diesen Kombinationspräparaten nicht ausreichend stabilisiert sind.
4.2 Dosierung und Art der Anwendung
Entacapon darf nur in Kombination mit Levodopa/Benserazid oder Levodopa/Carbidopa angewendet werden. Die Angaben zur Anwendung dieser Levodopa-Präparate gelten auch bei gleichzeitiger Anwendung mit Entacapon.
Dosierung
Eine Tablette zu 200 mg wird zusammen mit jeder Dosis Levodopa/Dopadecarboxylase-Hemmer eingenommen. Die empfohlene Höchstdosis beträgt 200 mg zehnmal täglich, d.h. 2.000 mg Entacapon.
Entacapon verstärkt die Wirkung von Levodopa. Um die von Levodopa verursachten unerwünschten dopaminergen Reaktionen, z.B. Dyskinesien, Übelkeit, Erbrechen und Halluzinationen, zu vermindern, ist es daher häufig nötig, die Levodopa-Dosis während der ersten Tage bis Wochen nach Beginn der Behandlung mit Entacapon anzupassen. Die Tagesdosis von Levodopa kann um etwa 10-30% verringert werden, indem je nach dem klinischen Zustandsbild des Patienten das Dosierungsintervall verlängert und/oder die Einzeldosis von Levodopa verringert wird.
Wird Entacapon abgesetzt, muss die Dosierung anderer Antiparkinson-Mittel, insbesondere von Levodopa, angepasst werden, um die Symptome der Parkinson-Krankheit ausreichend unter Kontrolle zu halten.
Entacapon erhöht die Bioverfügbarkeit von Levodopa aus Standardkombinationen von Levodopa mit Benserazid geringfügig stärker (5-10%) als aus Standardkombinationen von Levodopa mit Carbidopa. Daher kann bei Patienten, die mit Standardkombinationen von Levodopa mit Benserazid behandelt werden, nach Beginn der Behandlung mit Entacapon möglicherweise eine stärkere Verringerung der Levodopa-Dosis erforderlich sein.
Patienten mit Niereninsuffizienz
Eine Niereninsuffizienz beeinflusst die Pharmakokinetik von Entacapon nicht und es ist keine Dosisanpassung erforderlich. Bei Dialysepatienten ist unter Umständen ein längeres Dosierungsintervall zu erwägen (siehe Abschnitt 5.2).
Patienten mit Leberinsuffizienz Siehe Abschnitt 4.3.
Ältere Personen
Für ältere Personen ist keine Dosisanpassung erforderlich.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Entacapone Orion bei Kindern und Jugendlichen im Alter unter 18 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Entacapon wird oral und gleichzeitig mit jeder Dosis Levodopa/Carbidopa oder Levodopa/Benserazid angewendet.
Entacapon kann unabhängig von den Mahlzeiten eingenommen werden (siehe Abschnitt 5.2).
4.3 Gegenanzeigen
- Überempfindlichkeit gegenüber dem Wirkstoff oder gegenüber einem der in Abschnitt 6.1 genannten sonstigen Bestandteile.
- Leberinsuffizienz.
- Phäochromozytom.
- Gleichzeitige Gabe von Entacapon mit nichtselektiven Monoaminoxidase(MAO-A und MAO-
B)-Hemmern (z.B. Phenelzin, Tranylcypromin).
- Gleichzeitige Gabe eines selektiven MAO-A- und eines selektiven MAO-B-Hemmers zusammen mit Entacapon (siehe Abschnitt 4.5).
- Malignes neuroleptisches Syndrom und/oder atraumatische Rhabdomyolyse in der Anamnese.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
In seltenen Fällen wurde bei Patienten mit Morbus Parkinson nach schweren Dyskinesien oder malignem neuroleptischem Syndrom eine Rhabdomyolyse beobachtet.
Das maligne neuroleptische Syndrom, einschließlich Rhabdomyolyse und Fieber, wird durch motorische Symptome (Rigor, Myoklonien, Tremor), Bewusstseinsveränderungen (z.B. Erregung, Verwirrtheit, Koma), Fieber, Störungen des autonomen Nervensystems (Tachykardie, labiler Blutdruck) und erhöhte Spiegel der Serumkreatinphosphokinase gekennzeichnet. Im Einzelfall können jeweils nur einzelne dieser Symptome und/oder Befunde auffällig sein.
In Zusammenhang mit der Entacapon-Behandlung in kontrollierten Studien, bei denen Entacapon abrupt abgesetzt wurde, wurde weder über ein malignes neuroleptisches Syndrom noch über Rhabdomyolyse berichtet. Seit der Markteinführung wurde in Einzelfällen über ein malignes neuroleptisches Syndrom berichtet, insbesondere nach einer abrupten Dosisreduzierung oder Unterbrechung der Behandlung mit Entacapon und anderen dopaminergen Begleitmedikationen.
Wenn notwendig, sollte das Absetzen von Entacapon bzw. einer anderen dopaminergen Medikation langsam erfolgen und es kann, falls trotz des langsamen Absetzens von Entacapon Anzeichen und/oder Symptome auftreten, eine Erhöhung der Levodopa-Dosis notwendig werden.
Eine Behandlung mit Entacapon sollte bei Patienten mit einer koronaren Herzkrankheit vorsichtig erfolgen.
Aufgrund seines Wirkungsmechanismus kann Entacapon den Metabolismus von Arzneimitteln, die eine Katecholgruppe enthalten, beeinflussen und ihre Wirkung verstärken. Bei Patienten, die mit Arzneimitteln behandelt werden, welche durch das Enzym Catechol-O-methyltransferase (COMT) metabolisiert werden, z.B. Rimiterol, Isoprenalin, Adrenalin, Noradrenalin, Dopamin, Dobutamin, Alpha-Methyldopa und Apomorphin, ist Entacapon daher mit Vorsicht anzuwenden (siehe auch Abschnitt 4.5).
Entacapon wird stets als Zusatzmedikation zu Levodopa verwendet. Die Vorsichtsmaßnahmen, welche für die Behandlung mit Levodopa gelten, sind daher auch bei der Behandlung mit Entacapon zu beachten. Entacapon erhöht die Bioverfügbarkeit von Levodopa aus Standardkombinationen von Levodopa mit Benserazid um 5-10% stärker als aus Standardkombinationen von Levodopa mit Carbidopa. Daher können dopaminerge Nebenwirkungen häufiger auftreten, wenn Entacapon zusätzlich zu einer Behandlung mit Levodopa/Benserazid gegeben wird (siehe auch Abschnitt 4.8). Um die von Levodopa verursachten unerwünschten dopaminergen Reaktionen zu vermindern, muss häufig während der ersten Tage bis Wochen nach Beginn der Behandlung mit Entacapon die Dosierung von Levodopa entsprechend dem klinischen Zustandsbild des Patienten angepasst werden (siehe Abschnitte 4.2 und 4.8).
Entacapon kann eine durch Levodopa verursachte orthostatische Hypotonie verstärken. Bei Patienten, die andere Arzneimittel einnehmen, die eine orthostatische Hypotonie hervorrufen können, ist Entacapon daher mit Vorsicht anzuwenden.
In klinischen Studien traten einige dopaminerge Nebenwirkungen, z.B. Dyskinesien, häufiger bei Patienten auf, die Entacapon zusammen mit Dopamin-Agonisten (z.B. Bromocriptin), mit Selegilin oder mit Amantadin erhielten, verglichen mit Patienten, die Placebo mit dieser Kombination erhielten. Die Dosierung anderer Antiparkinson-Mittel muss möglicherweise angepasst werden, wenn die Behandlung mit Entacapon begonnen wird.
Die Einnahme von Entacapon zusammen mit Levodopa wurde bei Patienten mit Parkinsonerkrankung mit Somnolenz und Episoden plötzlich eintretender Schlafanfälle in Zusammenhang gebracht. Daher ist beim Führen von Fahrzeugen oder Bedienen von Maschinen Vorsicht geboten (siehe Abschnitt 4.7).
Für Patienten, die eine Diarrhöe entwickeln, wird eine Überwachung des Gewichtes empfohlen, um einen möglichen übermäßigen Gewichtsverlust zu vermeiden. Falls während der Behandlung mit Entacapon eine Diarrhöe über einen längeren Zeitraum bzw. anhaltend auftritt, kann es sich um ein Anzeichen einer Kolitis handeln. Im Falle einer über einen längeren Zeitraum bzw. anhaltend auftretenden Diarrhöe sollte das Arzneimittel abgesetzt und eine angemessene Behandlung sowie Untersuchung in Erwägung gezogen werden.
Die Patienten sollten regelmäßig auf das Auftreten von Impulskontrollstörungen hin überwacht werden. Patienten und ihre Betreuer sollten darüber informiert werden, dass als Impulskontrollstörungen Verhaltensweisen wie Spielsucht/ pathologisches Spielen, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Kaufsucht sowie Ess-Sucht und zwanghafte Nahrungsaufnahme bei Patienten, die Dopamin-Agonisten und/oder andere dopaminerge Arzneimittel einschließlich Entacapone Orion mit Levodopa zur Behandlung der Parkinson-Erkrankung anwenden, auftreten können. Falls solche Symptome auftreten, wird eine Überprüfung der Behandlung empfohlen.
Bei Patienten, die innerhalb eines relativ kurzen Zeitraums eine progrediente Anorexie, Asthenie und Gewichtsverlust entwickeln, ist eine umfassende medizinische Untersuchung einschließlich der
Leberfunktion in Erwägung zu ziehen
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Unter dem empfohlenen Dosierungsschema wurde keine Wechselwirkung von Entacapon mit Carbidopa beobachtet. Die pharmakokinetische Wechselwirkung mit Benserazid wurde nicht untersucht.
In Einzeldosisstudien an gesunden Probanden wurden keine Wechselwirkungen zwischen Entacapon und Imipramin oder zwischen Entacapon und Moclobemid beobachtet. Ebenso wurden in Studien an Parkinson-Patienten nach Mehrfachdosierung keine Wechselwirkungen zwischen Entacapon und Selegilin festgestellt. Jedoch liegen über die klinische Anwendung von Entacapon zusammen mit anderen Arzneimitteln wie MAO-A-Hemmern, trizyklischen Antidepressiva, NoradrenalinWiederaufnahmehemmern wie Desipramin, Maprotilin und Venlafaxin sowie Substanzen, die durch COMT metabolisiert werden (z.B. solche, die eine Katecholgruppe besitzen: Rimiterol, Isoprenalin, Adrenalin, Noradrenalin, Dopamin, Dobutamin, alpha-Methyldopa, Apomorphin und Paroxetin) bisher nur begrenzte Erfahrungen vor. Bei der Gabe derartiger Substanzen zusammen mit Entacapon ist Vorsicht geboten (siehe auch Abschnitt 4.3 und Abschnitt 4.4).
Entacapon kann zusammen mit Selegilin (einem selektiven MAO-B-Hemmer) angewendet werden, jedoch darf die Tagesdosis von Selegilin 10 mg nicht überschreiten.
Entacapon kann im Magen-Darm-Trakt Chelatkomplexe mit Eisen bilden. Daher müssen Entacapon und Eisenpräparate im Abstand von mindestens 2-3 Stunden eingenommen werden (siehe auch Abschnitt 4.8).
Entacapon wird von Humanalbumin an der Bindungsstelle II gebunden, die auch verschiedene andere Arzneimittel wie z.B. Diazepam und Ibuprofen bindet. Klinische Studien zur Wechselwirkung mit Diazepam und nichtsteroidalen Antirheumatika (NSAIDs) wurden nicht durchgeführt. Aufgrund von in-vitro-Studien ist bei therapeutischen Konzentrationen des Arzneimittels keine signifikante Verdrängung zu erwarten.
Aufgrund seiner in-vitro-Affinität zu Cytochrom P450 2C9 (siehe Abschnitt 5.2) kann es potentiell zu Wechselwirkungen mit Arzneimitteln kommen, deren Metabolisierung von diesem Isoenzym abhängig ist, wie z.B. S-Warfarin.
In einer Interaktionsstudie an gesunden Probanden veränderte Entacapon jedoch die Plasmaspiegel von S-Warfarin nicht, während die AUC von R-Warfarin im Mittel um 18% [90% Konfidenzintervall 11%-26%] erhöht war. Die INR-Werte erhöhten sich im Mittel um 13% [90% Konfidenzintervall 6%-19%]. Daher wird bei mit Warfarin behandelten Patienten zu Beginn der Behandlung mit Entacapon eine Kontrolle der INR-Werte empfohlen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
In Tierexperimenten, in denen die Exposition mit Entacapon deutlich höher war als die therapeutische Exposition, wurden keine offenkundigen teratogenen oder primär fetotoxischen Wirkungen festgestellt. Da bei schwangeren Frauen keine Erfahrungen vorliegen, darf Entacapon in der Schwangerschaft nicht angewendet werden.
Stillzeit
Bei Tieren wird Entacapon mit der Milch ausgeschieden. Über die Sicherheit von Entacapon bei Säuglingen ist nichts bekannt. Frauen dürfen während der Behandlung mit Entacapon nicht stillen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Einnahme von Entacapone Orion in Kombination mit Levodopa kann einen großen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben. Entacapon kann zusammen mit Levodopa Benommenheit und orthostatische Symptome hervorrufen. Daher ist bei der aktiven Teilnahme am Straßenverkehr und beim Bedienen von Maschinen Vorsicht geboten.
Patienten, die mit Entacapon in Kombination mit Levodopa behandelt werden und bei denen Somnolenz oder Episoden plötzlich eintretender Schlafanfälle auftreten, müssen darauf hingewiesen werden, dass sie kein Fahrzeug führen oder keinen anderen Tätigkeiten nachgehen dürfen, bei denen sie sich selbst oder Andere aufgrund verminderter Aufmerksamkeit dem Risiko schwerer Verletzungen oder des Todes aussetzen (z.B. beim Bedienen von Maschinen). Sie dürfen erst dann wieder ein Fahrzeug führen oder solche Tätigkeiten wieder aufnehmen, wenn diese Episoden nicht mehr auftreten (siehe auch Abschnitt 4.4).
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Die häufigsten Nebenwirkungen bei der Anwendung von Entacapon hängen mit der erhöhten dopaminergen Aktivität zusammen und treten meist zu Beginn der Behandlung auf. Das Herabsetzen der Levodopa-Dosis vermindert den Schweregrad und die Häufigkeit dieser Nebenwirkungen. Die zweite bedeutende Gruppe von Nebenwirkungen sind gastrointestinale Beschwerden, zu denen Übelkeit, Erbrechen, Abdominalschmerzen, Obstipation und Diarrhöe gehören. Entacapon kann eine rötlich-braune Verfärbung des Urins hervorrufen, die jedoch harmlos ist.
Die durch Entacapon verursachten Nebenwirkungen sind in der Regel leicht bis mittelschwer. Die Nebenwirkungen, welche in klinischen Studien einen Abbruch der Behandlung mit Entacapon zur Folge hatten, waren meist gastrointestinale Beschwerden (z.B. Diarrhöe, 2,5%) und vermehrte Nebenwirkungen durch die dopaminerge Aktivität von Levodopa (z.B. Dyskinesien, 1,7%).
Bei einer gemeinsamen Auswertung von klinischen Studien, in denen 406 Patienten das Arzneimittel und 296 Patienten Placebo erhielten, wurde unter Entacapon signifikant häufiger als unter Placebo über Dyskinesien (27%), Übelkeit (11%), Diarrhöe (8%), Abdominalschmerzen (7%) und Mundtrockenheit (4,2%) berichtet.
Einige der Nebenwirkungen, z.B. Dyskinesien, Übelkeit und Abdominalschmerzen, können bei höherer Dosierung (1.400 bis 2.000 mg täglich) häufiger auftreten als bei niedrigerer Dosierung von Entacapon.
Tabellarische Zusammenstellung der Nebenwirkungen
Die in der nachfolgenden Tabelle 1 aufgeführten Nebenwirkungen traten in klinischen Studien mit Entacapon und seit Markteinführung von Entacapon auf:
Tabelle 1: Nebenwirkungen*
|
Psychiatrische Erkrankungen Häufig: Sehr selten: Erkrankungen des Nervensystems Sehr häufig: Häufig: |
Schlaflosigkeit, Halluzinationen, Verwirrtheit, Paroniria (unangenehme Träume) Agitiertheit (Unruhe) Dyskinesie Verstärkung der Parkinson-Symptome, Benommenheit, Dystonie, Hyperkinesie |
|
Herzerkrankungen** | |
|
Häufig: |
Symptome der koronaren Herzkrankheit, außer Herzinfarkt |
|
(z. B. Angina pectoris) | |
|
Gelegentlich: |
Herzinfarkt |
Erkrankungen des Gastrointestinaltrakts
|
Sehr häufig: |
Übelkeit |
|
Häufig: |
Diarrhöe, Abdominalschmerzen, Mundtrockenheit, |
|
Obstipation, Erbrechen | |
|
Sehr selten: |
Anorexie |
|
Nicht bekannt: |
Kolitis |
|
Leber- und Gallenerkrankungen | |
|
Selten: |
Leberfunktionswerte außerhalb der Norm |
|
Nicht bekannt: |
Hepatitis mit vorwiegend cholestatischen Erscheinungen |
|
(siehe Abschnitt 4.4) | |
|
Erkrankungen der Haut und des Unterhautzellgewebes | |
|
Selten: |
erythematöser oder makulopapulöser Ausschlag |
|
Sehr selten: |
Urtikaria |
|
Nicht bekannt: |
Verfärbungen der Haut, der Körperhaare einschließlich der |
|
Barthaare sowie der Nägel | |
|
Erkrankungen der Nieren und Harnwege | |
|
Sehr häufig: |
Verfärbung des Urins |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
|
Häufig: |
Müdigkeit, verstärktes Schwitzen, Stürze |
|
Sehr selten: |
Gewichtsverlust |
* Die Nebenwirkungen sind entsprechend ihrer Häufigkeit geordnet, wobei die häufigste
Nebenwirkung zuerst genannt wird. Folgende Häufigkeitsangaben wurden verwendet: Sehr häufig (> 1/10); häufig (>1/100, <1/10); gelegentlich (> 1/1000, < 1/100); selten (>1/10000,
< 1/1000); sehr selten (<1/10000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar, da aus klinischen oder epidemiologischen Studien keine valide Schätzung abgeleitet werden kann).
** Die Häufigkeitsangaben zum Herzinfarkt und Symptomen der koronaren Herzkrankheit (0,43 % bzw. 1,54 %) wurden aus 13 doppelblinden Studien ermittelt, bei welchen 2.082 Patienten mit „end-of-dose“-Fluktuationen Entacapon erhielten.
Beschreibung ausgewählter Nebenwirkungen
Die Einnahme von Entacapon in Kombination mit Levodopa wurde in Einzelfallen mit übermäßiger Schläfrigkeit während des Tages sowie mit Episoden plötzlicher Schlafanfälle in Zusammenhang gebracht.
Impulskontrollstörungen: Spielsucht/ pathologisches Spielen, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Kaufsucht sowie Ess-Sucht und zwanghafte Nahrungsaufnahme können bei Patienten, die Dopamin-Agonisten und/oder andere dopaminerge Arzneimittel einschließlich Entacapone Orion mit Levodopa zur Behandlung der Parkinson-Erkrankung anwenden, auftreten (siehe Abschnitt 4.4).
In Einzelfällen wurde über ein malignes neuroleptisches Syndrom nach einer abrupten Dosisreduzierung oder Unterbrechung der Behandlung mit Entacapon und anderen dopaminergen Arzneimitteln berichtet.
In Einzelfällen wurde über eine Rhabdomyolyse berichtet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das in Anhang V aufgeführte nationale Meldesystem anzuzeigen.
4.9 Überdosierung
Seit der Markteinführung wurde in Einzelfällen von Überdosierungen berichtet. Die höchste in diesem Zusammenhang genannte Tagesdosis betrug 16.000 mg Entacapon. Die akuten Symptome und Anzeichen solcher Überdosierungen umfassten Verwirrtheit, verminderte Aktivität, Schläfrigkeit, Hypotonie, Verfärbungen der Haut und Urtikaria. Die Behandlung einer akuten Überdosierung erfolgt symptomatisch.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere dopaminerge Mittel, ATC-Code: N04BX02
Entacapon gehört zu einer neuen therapeutischen Klasse, den Catechol-O-methyltransferase(COMT)-Hemmern. Es ist ein spezifischer und hauptsächlich peripher wirksamer COMT-Hemmer mit reversibler Wirkung, der dazu bestimmt ist, in Kombination mit einem Levodopa-Präparat verabreicht zu werden. Entacapon vermindert den durch Metabolisierung zu 3-O-Methyldopa (3-OMD) verursachten Verlust von Levodopa, indem es das Enzym COMT hemmt. Dies führt zu einer höheren AUC von Levodopa. Die Menge des im Gehirn verfügbaren Levodopas wird erhöht. Auf diese Weise verlängert Entacapon die klinische Wirksamkeit von Levodopa.
Entacapon hemmt das Enzym COMT hauptsächlich im peripheren Gewebe. Die Hemmung von COMT in roten Blutzellen korreliert eng mit den Plasmakonzentrationen von Entacapon und zeigt so die Reversibilität der COMT-Hemmung.
Klinische Studien
In zwei klinischen Studien (Phase III) an insgesamt 376 Patienten mit Morbus Parkinson und „end-of-dose“-Fluktuationen wurden Entacapon oder Placebo zusammen mit jeder Dosis Levodopa/Dopadecarboxylase-Hemmer gegeben. Die Ergebnisse sind in Tabelle 2 zusammengestellt. In Studie I wurde die tägliche „On-Zeit“ in Stunden aus Patiententagebüchern ermittelt, und in Studie II der prozentuale Anteil der „On-Zeit“ pro Tag.
Tabelle 2. On-Zeit pro Tag (Mittelwert ± SD)
|
Studie I: On-Zeit pro Tag (h) | ||||
|
Entacapon (n=85) |
Placebo (n=86) |
Unterschied | ||
|
Ausgangswert |
9,3±2,2 |
9,2±2,5 | ||
|
Woche 8-24 |
10,7±2,2 |
9,4±2,6 |
1 h 20 min (8,3%) 95% Konfidenzintervall 45 min, 1 h 56 min | |
|
Studie II: Anteil der On-Zeit pro Tag (%) | ||||
|
Entacapon (n=103) |
Placebo (n=102) |
Unterschied | ||
|
Ausgangswert |
60,0±15,2 |
60,8±14,0 | ||
|
Woche 8-24 |
66,8±14,5 |
62,8±16,80 |
4,5% (0 h 35 min) 95% Konfidenzintervall 0,93%, 7,97% | |
Die „Off-Zeit“ verminderte sich entsprechend.
In Studie I betrug die prozentuale Änderung der „Off-Zeit“ verglichen mit dem Ausgangswert -24% in der Entacapon-Gruppe und 0% in der Placebo-Gruppe. Die entsprechenden Werte für Studie II betrugen -18% und -5%.
5.2 Pharmakokinetische Eigenschaften
Allgemeine Substanzeigenschaften
Resorption
Die Resorption von Entacapon unterliegt großen intra- und interindividuellen Schwankungen.
Die maximale Plasmakonzentration (Cmax) wird in der Regel ca. eine Stunde nach Einnahme einer Tablette mit 200 mg Entacapon erreicht. Die Substanz unterliegt einem sehr starken First-PassMetabolismus. Die Bioverfügbarkeit von Entacapon nach oraler Gabe beträgt ca. 35%. Die Resorption von Entacapon wird durch Nahrungsaufnahme nicht wesentlich beeinflusst.
Verteilung
Nach Resorption aus dem Magen-Darm-Trakt verteilt sich Entacapon rasch im peripheren Gewebe mit einem Verteilungsvolumen von 20 Litern im Steady-State (Vdss). Etwa 92% der Dosis werden in der ß-Phase mit einer kurzen Eliminationshalbwertszeit von 30 min eliminiert. Die Gesamt-Clearance von Entacapon beträgt ca. 800 ml/min.
Entacapon wird stark an Plasmaproteine, vor allem Albumin, gebunden. Im menschlichen Plasma beträgt der ungebundene Anteil im therapeutischen Konzentrationsbereich ca. 2,0%. In therapeutischen Konzentrationen verdrängt Entacapon andere stark gebundene Substanzen (z.B. Warfarin, Salizylsäure, Phenylbutazon und Diazepam) nicht, ebenso wenig wird es von einer dieser Substanzen in therapeutischen oder höheren Konzentrationen in signifikantem Ausmaß verdrängt.
Biotransformation
Eine geringe Menge Entacapon, das (E)-Isomer, wird in sein (Z)-Isomer umgewandelt. Auf das (E)-Isomer entfallen 95% der AUC von Entacapon. Das (Z)-Isomer und Spuren anderer Metaboliten stellen die übrigen 5%.
Daten aus in-vitro-Studien mit menschlichen Lebermikrosomen zeigen, dass Entacapon das Cytochrom P450 2C9 hemmt (IC50 ~4 pM). Entacapon zeigte eine geringe oder keine Hemmung anderer P450 Isoenzyme (CYP1A2, CYP2A6, CYP2D6, CYP2E1, CYP3A und CYP2C19) (siehe Abschnitt 4.5).
Elimination
Die Elimination von Entacapon erfolgt hauptsächlich nicht-renal auf metabolischem Weg. Es wird angenommen, dass 80-90% der Dosis mit den Faeces ausgeschieden werden, obwohl dieser Wert beim Menschen nicht bestätigt ist. Etwa 10-20% werden mit dem Urin ausgeschieden. Im Urin werden lediglich Spuren von unverändertem Entacapon gefunden. Die Hauptmenge der im Urin ausgeschiedenen Substanz (95%) ist mit Glukuronsäure konjugiert. Nur 1% der im Urin gefundenen Metaboliten wird durch Oxidation gebildet.
Eigenschaften bei der Anwendung am Patienten
Die Pharmakokinetik von Entacapon ist bei jungen und älteren Personen vergleichbar. Der Metabolismus des Arzneimittels ist bei Patienten mit leichter bis mittelschwerer Leberinsuffizienz (Child-Pugh Klassen A und B) verlangsamt, wodurch es in der Resorptions- und in der Eliminationsphase zu erhöhten Plasmaspiegeln von Entacapon kommt (siehe Abschnitt 4.3). Niereninsuffizienz beeinflusst die Pharmakokinetik von Entacapon nicht. Jedoch kann bei Dialysepatienten eine Verlängerung des Dosierungsintervalls erforderlich sein.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. In Studien zur chronischen Toxizität wurde eine Anämie beobachtet, die höchstwahrscheinlich auf die Bildung von Chelatkomplexen von Entacapon mit Eisen
zurückzuführen ist. In Studien zur Reproduktionstoxizität wurden an Kaninchen bei systemischer Exposition im therapeutischen Bereich ein vermindertes Gewicht der Feten und eine geringfügig verzögerte Knochenentwicklung beobachtet.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Tablettenkern:
Mikrokristalline Cellulose
Croscarmellose-Natrium
Povidon
Magnesiumstearat
Filmüberzug:
Polyvinylalkohol
Talkum
Macrogol
Sojalecithin
Eisenoxidhydrat (E172)
Eisen(III)-oxid (E172)
Titandioxid (E171).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Weiße Flaschen aus Polyethylen hoher Dichte (HDPE) mit weißem kindergesichertem Verschluss aus Polypropylen (PP) mit je 30, 60, 100 oder 175 Tabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen für die Beseitigung.
7. INHABER DER ZULASSUNG
Orion Corporation Orionintie 1 FI-02200 Espoo Finnland
8. ZULASSUNGSNUMMER(N)
EU/1/11/708/001-004
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 18. August 2011 Datum der letzten Verlängerung der Zulassung: 8 April 2016
10. STAND DER INFORMATION
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel Agentur (EMA) http://www.ema.europa.eu/ verfügbar.
A. HERSTELLER, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST
B. BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE ABGABE UND DEN GEBRAUCH
C. SONSTIGE BEDINGUNGEN UND AUFLAGEN DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN
D. BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE SICHERE UND WIRKSAME ANWENDUNG DES ARZNEIMITTELS
A. HERSTELLER, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST
Name und Anschrift des Herstellers, der für die Chargenfreigabe verantwortlich ist
Orion Corporation Orionintie 1 FI-02200 Espoo Finnland
B. BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE ABGABE UND DEN GEBRAUCH,
Arzneimittel. das der Verschreibungspflicht unterliegt.
C. SONSTIGE BEDINGUNGEN UND AUFLAGEN DER GENEHMIGUNG FÜR DAS INVERKEHRBRINGEN
• Regelmäßig aktualisierte Unbedenklichkeitsberichte
Der Inhaber der Genehmigung für das Inverkehrbringen legt regelmäßig aktualisierte Unbedenklichkeitsberichte für dieses Arzneimittel gemäß den Anforderungen der - nach Artikel 107 c Absatz 7 der Richtlinie 2001/83/EG vorgesehenen und im europäischen Internetportal für Arzneimittel veröffentlichten - Liste der in der Union festgelegten Stichtage (EURD-Liste) vor.
D. BEDINGUNGEN ODER EINSCHRÄNKUNGEN FÜR DIE SICHERE UND WIRKSAME ANWENDUNG DES ARZNEIMITTELS
• Risikomanagement-Plan (RMP)
Nicht zutreffend
ETIKETTIERUNG UND PACKUNGSBEILAGE
A. ETIKETTIERUNG
ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG UND AUF DEM BEHÄLTNIS UMKARTON UND FLASCHENETIKETT
1. BEZEICHNUNG DES ARZNEIMITTELS
Entacapone Orion 200 mg Filmtabletten Entacapon
2. WIRKSTOFF(E)
1 Filmtablette enthält 200 mg Entacapon
3. SONSTIGE BESTANDTEILE
4. DARREICHUNGSFORM UND INHALT
30 Filmtabletten 60 Filmtabletten 100 Filmtabletten 175 Filmtabletten
5. HINWEISE ZUR UND ART(EN) DER ANWENDUNG
Packungsbeilage beachten. Zum Einnehmen
6. WARNHINWEIS, DASS DAS ARZNEIMITTEL FÜR KINDER UNERREICHBAR UND
NICHT SICHTBAR AUFZUBEWAHREN IST
Arzneimittel für Kinder unzugänglich aufbewahren.
7. WEITERE WARNHINWEISE, FALLS ERFORDERLICH
8. VERFALLDATUM
Verwendbar bis:
9. BESONDERE VORSICHTSMASSNAHMEN FÜR DIE AUFBEWAHRUNG
10. GEGEBENENFALLS BESONDERE VORSICHTSMASSNAHMEN FÜR DIE
BESEITIGUNG VON NICHT VERWENDETEM ARZNEIMITTEL ODER DAVON STAMMENDEN ABFALLMATERIALIEN
11. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS
Orion Corporation Orionintie 1 FI-02200 Espoo Finnland
12. ZULASSUNGSNUMMER(N)
|
EU/1/11/708/001 |
30 Filmtabletten |
|
EU/1/11/708/002 |
60 Filmtabletten |
|
EU/1/11/708/003 EU/1/11/708/004 |
100 Filmtabletten 175 Filmtabletten |
13. CHARGENBEZEICHNUNG
Ch.-B.:
14. VERKAUFSABGRENZUNG
Verschreibungspflichtig
15. HINWEISE FÜR DEN GEBRAUCH
16. ANGABEN IN BLINDENSCHRIFT
entacapone orion 200 mg [nur auf dem Umkarton]
B. PACKUNGSBEILAGE
Gebrauchsinformation: Information für Anwender
Entacapone Orion 200 mg Filmtabletten
Entacapon
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
• Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
• Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt
4.
Was in dieser Packungsbeilage steht
1. Was ist Entacapone Orion und wofür wird es angewendet?
2. Was sollten Sie vor der Einnahme von Entacapone Orion beachten?
3. Wie ist Entacapone Orion einzunehmen?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Entacapone Orion aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Entacapone Orion und wofür wird es angewendet?
Entacapone Orion Filmtabletten enthalten Entacapon und werden zusammen mit Levodopa zur Behandlung der Parkinson-Krankheit angewendet. Entacapone Orion unterstützt Levodopa bei der Linderung der Symptome der Parkinson-Krankheit. Ohne Levodopa besitzt Entacapone Orion keine Wirkung bei der Linderung der Symptome der Parkinson-Krankheit.
2. Was sollten Sie vor der Einnahme von Entacapone Orion beachten?
Entacapone Orion darf nicht eingenommen werden,
• wenn Sie allergisch gegenüber Entacapon oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind;
• wenn Sie einen Tumor der Nebenniere haben (bekannt als Phäochromozytom; dies kann das Risiko für schwerwiegende Blutdrucksteigerungen erhöhen);
• wenn Sie bestimmte Antidepressiva einnehmen. Fragen Sie bitte Ihren Arzt oder Apotheker, ob Sie Ihr Antidepressivum zusammen mit Entacapone Orion einnehmen können.
• wenn Sie eine Lebererkrankung haben;
• wenn bei Ihnen früher eine seltene Reaktion auf antipsychotische Arzneimittel, malignes neuroleptisches Syndrom (NMS) genannt, aufgetreten ist. Die Anzeichen des malignen neuroleptischen Syndroms sind nachstehend im Abschnitt 4 „Welche Nebenwirkungen sind möglich?“ beschrieben.
• wenn bei Ihnen früher eine seltene Form der Muskelerkrankung, atraumatische Rhabdomyolyse genannt, aufgetreten ist, die nicht durch eine Verletzung ausgelöst wurde.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, bevor Sie Entacapone Orion einnehmen:
• wenn Sie eine Herzattacke oder andere Erkrankungen des Herzens hatten oder haben;
• wenn Sie ein anderes Arzneimittel einnehmen / anwenden, das Schwindel oder Benommenheit (einen Blutdruckabfall) beim Aufstehen aus dem Sitzen oder Liegen verursachen kann;
• wenn bei Ihnen länger anhaltender Durchfall auftritt. Dieser kann auf eine Entzündung des Dickdarms hinweisen. Suchen Sie Ihren Arzt auf.
• wenn bei Ihnen Durchfall auftritt; in diesem Fall wird eine Überwachung Ihres Körpergewichts empfohlen, um einen möglichen übermäßigen Gewichtsverlust zu vermeiden;
• wenn Sie innerhalb eines relativ kurzen Zeitraums eine zunehmende Appetitlosigkeit, Schwäche, Erschöpfungszustände und Gewichtsverlust entwickeln. In diesem Fall ist eine umfassende medizinische Untersuchung einschließlich der Leberfunktion in Erwägung zu ziehen.
Wenn Sie selbst, Familienangehörige oder Pflegekräfte bemerken, dass Sie den Drang oder das Verlangen entwickeln, sich in einer für Sie ungewöhnlichen Weise zu verhalten, oder Sie dem Drang, dem Trieb oder dem Verlangen zur Ausführung bestimmter Handlungen, die für Sie oder andere möglicherweise schädlich sind, nicht widerstehen können, so sprechen Sie mit Ihrem Arzt. Solche Verhaltensweisen werden als Impulskontrollstörungen bezeichnet und können Spielsucht, Ess- oder Kaufsucht, ungewöhnlich gesteigertes sexuelles Verlangen oder übermäßige Inanspruchnahme durch sexuelle Gedanken oder Gefühle umfassen. Ihr Arzt muss Ihre Behandlung möglicherweise überprüfen.
Entacapone Orion Filmtabletten werden zusammen mit anderen Arzneimitteln zur Behandlung der Parkinson-Krankheit eingenommen, die Levodopa enthalten. Bitte lesen Sie auch sorgfältig die Packungsbeilage Ihres Levodopa enthaltenden Arzneimittels.
Die Dosis anderer Arzneimittel zur Behandlung der Parkinson-Krankheit muss möglicherweise angepasst werden, wenn Sie mit der Einnahme von Entacapone Orion beginnen. Bitte folgen Sie den Anweisungen, die Ihr Arzt Ihnen gegeben hat.
Das maligne neuroleptische Syndrom ist eine schwere, aber seltene Reaktion auf bestimmte Arzneimittel. Es kann insbesondere nach einer abrupten Dosisreduzierung oder abrupten Unterbrechung der Behandlung mit Entacapone Orion und anderen Arzneimitteln zur Behandlung der Parkinson-Krankheit auftreten. Die Anzeichen des malignen neuroleptischen Syndroms sind nachstehend im Abschnitt 4 „Welche Nebenwirkungen sind möglich?“ beschrieben. Ihr Arzt wird Sie möglicherweise auffordern, die Behandlung mit Entacapone Orion und anderen Arzneimitteln zur Behandlung der Parkinson-Krankheit langsam zu beenden.
Entacapone Orion kann bei der Einnahme mit Levodopa Schläfrigkeit und plötzlich einsetzende Schlafepisoden verursachen. Falls dieses bei Ihnen eintritt, dürfen Sie kein Fahrzeug führen sowie keine Werkzeuge benutzen oder Maschinen bedienen (siehe unter „Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen“.
Einnahme von Entacapone Orion zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen bzw. kürzlich andere Arzneimittel eingenommen haben oder beabsichtigen, andere Arzneimittel einzunehmen. Besonders wichtig ist es, dass Sie Ihren Arzt darüber informieren, wenn Sie eines der nachfolgend aufgeführten Arzneimittel einnehmen / anwenden:
• Rimiterol, Isoprenalin, Adrenalin, Noradrenalin, Dopamin, Dobutamin, Alpha-Methyldopa und Apomorphin;
• Arzneimittel zur Behandlung einer Depression, einschließlich Desipramin, Maprotilin, Venlafaxin und Paroxetin;
• Warfarin, ein Arzneimittel, das zur Hemmung der Blutgerinnung angewendet wird;
• Eisen-Zusatzstoffe. Es kann sein, dass Entacapone Orion bei Ihnen die Aufnahme von Eisen erschwert. Daher nehmen Sie bitte Entacapone Orion und Eisen-Zusatzstoffe nicht gleichzeitig ein. Nachdem Sie eines davon eingenommen haben, warten Sie mindestens 2 bis 3 Stunden bevor Sie das andere einnehmen.
Schwangerschaft, Stillzeit und Zeugungs-/Gebärfähigkeit
Nehmen Sie Entacapone Orion während einer Schwangerschaft nicht ein. Nehmen Sie Entacapone Orion nicht ein, wenn Sie stillen.
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein, oder beabsichtigen, schwanger zu werden, fragen Sie vor der Einnahme dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Die Einnahme von Entacapone Orion zusammen mit Levodopa kann Ihren Blutdruck senken, es kann sein, dass Sie sich dann benommen oder schwindlig fühlen. Seien Sie besonders vorsichtig, wenn Sie Auto fahren oder Geräte oder Maschinen bedienen.
Zudem kann Sie die Einnahme von Entacapone Orion zusammen mit Levodopa sehr schläfrig machen oder dazu führen, dass Sie manchmal plötzlich einschlafen. Wenn Sie diese Nebenwirkungen bemerken, dürfen Sie sich nicht an das Steuer eines Fahrzeugs setzen. Sie dürfen keine Werkzeuge oder Maschinen bedienen.
3. Wie ist Entacapone Orion einzunehmen?
Nehmen Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt oder Apotheker ein. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
Entacapone Orion wird zusammen mit Arzneimitteln, die Levodopa enthalten, eingenommen, und zwar entweder mit Levodopa/Carbidopa-haltigen Arzneimitteln oder Levodopa/Benserazid-haltigen Arzneimitteln. Sie können auch gleichzeitig andere Arzneimittel zur Behandlung der ParkinsonKrankheit anwenden.
Die empfohlene Dosis ist eine Entacapone Orion 200 mg Tablette zusammen mit jeder Dosis Levodopa. Die maximale empfohlene Dosis beträgt 10 Tabletten pro Tag, d.h. 2.000 mg Entacapone Orion.
Wenn Sie wegen einer Nierenfunktionsstörung dialysiert werden, kann Ihr Arzt es für erforderlich halten, dass der Zeitabstand zwischen den einzelnen Dosen verlängert werden muss.
Bild 1
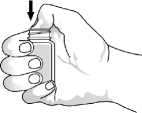
Um die Flasche das erste Mal zu öffnen: Öffnen Sie den Verschluss und drücken Sie mit den Daumen auf die Versiegelung bis diese bricht. Siehe Bild 1.
Anwendung bei Kindern und Jugendlichen
Die Erfahrungen mit Entacapone Orion bei Patienten unter 18 Jahren sind begrenzt. Daher kann die Einnahme von Entacapone Orion durch Kinder und Jugendliche nicht empfohlen werden.
Wenn Sie eine größere Menge von Entacapone Orion eingenommen haben, als Sie sollten
Falls Sie eine zu hohe Dosis eingenommen haben, wenden Sie sich sofort an Ihren Arzt, Apotheker oder an das nächstgelegene Krankenhaus.
Wenn Sie die Einnahme von Entacapone Orion vergessen haben
Wenn Sie einmal vergessen haben, die Entacapone Orion-Tablette mit Ihrer Dosis Levodopa einzunehmen, setzen Sie die Behandlung fort, indem Sie die nächste Entacapone Orion-Tablette mit Ihrer nächsten Dosis Levodopa einnehmen.
Nehmen Sie nicht die doppelte Menge ein, wenn Sie die vorherige Einnahme vergessen haben.
Wenn Sie die Einnahme von Entacapone Orion abbrechen
Beenden Sie die Einnahme von Entacapone Orion nicht, es sei denn, Ihr Arzt rät Ihnen dazu. Bei einer
Beendigung der Einnahme kann es sein, dass Ihr Arzt die Dosis für Ihre anderen Arzneimittel zur Behandlung der Parkinson-Krankheit anpassen muss. Die abrupte Beendigung einer Behandlung mit Entacapone Orion wie auch mit anderen Arzneimitteln zur Behandlung der Parkinson-Krankheit kann zum Auftreten unerwünschter Nebenwirkungen führen. Siehe hierzu auch Abschnitt 2 „Warnhinweise und Vorsichtsmaßnahmen“.
Wenn Sie weitere Fragen zur Einnahme dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann Entacapone Orion Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Im Allgemeinen sind die durch Entacapone Orion verursachten Nebenwirkungen gering bis mäßig ausgeprägt.
Einige der Nebenwirkungen werden oft durch die verstärkten Wirkungen der Levodopa-Therapie verursacht und treten am häufigsten zu Behandlungsbeginn auf. Wenn Sie solche Wirkungen bei Beginn der Behandlung mit Entacapone Orion erleben, sollten Sie sich an Ihren Arzt wenden, der über eine Anpassung Ihrer Levodopa-Dosis entscheiden wird.
Sehr häufig (kann mehr als 1 von 10 Behandelten betreffen):
• Nicht kontrollierbare Bewegungen mit Schwierigkeiten bei der Ausführung willkürlicher Bewegungen (Dyskinesien);
• Übelkeit;
• unbedenkliche rotbraune Verfärbung des Urins.
Häufig (kann bis zu 1 von 10 Behandelten betreffen):
• Übermäßige Bewegungen (Hyperkinesien), verschlechterte Symptomatik der ParkinsonKrankheit, länger anhaltende Muskelkrämpfe (Dystonie);
• Erbrechen, Durchfall, Bauchschmerzen, Verstopfung, Mundtrockenheit;
• Benommenheit, Müdigkeit, verstärktes Schwitzen, Stürze;
• Halluzinationen (das Sehen, Hören, Fühlen oder Riechen von Dingen, die nicht wirklich vorhanden sind), Schlaflosigkeit, lebhafte Träume und Verwirrtheit;
• Anzeichen einer Erkrankung des Herzens oder der Arterien (z. B. Brustschmerzen).
Gelegentlich (kann bis zu. 1 von 100 Behandelten betreffen):
• Herzinfarkt.
Selten (kann bis zu 1 von 1.000 Behandelten betreffen):
• Hautausschlag;
• Leberfunktionswerte außerhalb der Norm.
Sehr selten (kann bis zu 1 von 10.000 Behandelten betreffen):
• Unruhe;
• verminderter Appetit, Gewichtsabnahme;
• Nesselsucht.
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar):
• Entzündung des Dickdarms (Kolitis), Entzündung der Leber (Hepatitis) mit gelber Verfärbung der Haut und der Augäpfel;
• Verfärbungen der Haut, der Körperhaare einschließlich der Barthaare sowie der Nägel.
Wenn Entacapone Orion in hohen Dosen eingenommen wird:
Bei Tagesdosen von 1.400 bis 2.000 mg können die folgenden Nebenwirkungen häufiger auftreten:
• Nicht kontrollierbare Bewegungen;
• Übelkeit;
• Bauchschmerzen.
Weitere bedeutsame Nebenwirkungen, die auftrctcn können:
• Die Einnahme von Entacapone Orion zusammen mit Levodopa kann Sie in seltenen Fällen tagsüber sehr schläfrig machen und dazu führen, dass Sie plötzlich einschlafen.
• Das maligne neuroleptische Syndrom ist eine seltene, schwere Reaktion auf Arzneimittel, die zur Behandlung von Störungen des zentralen Nervensystems eingesetzt werden. Anzeichen des malignen neuroleptischen Syndroms sind Steifheit, Muskelzuckungen, Zittern, Unruhe, Verwirrtheit, Koma, Fieber, beschleunigter Herzschlag, nicht stabiler Blutdruck.
• Eine seltene, schwere Erkrankung der Skelettmuskulatur (Rhabdomyolyse), die mit Schmerzen,
Schmerzempfindlichkeit sowie Schwäche der Muskulatur einhergeht und Probleme mit den Nieren verursachen kann.
Möglicherweise treten bei Ihnen auch folgende Nebenwirkungen auf:
• Unfähigkeit, dem Verlangen zur Ausführung möglicherweise schädlicher Handlungen zu widerstehen. Hierzu gehören:
• Spielsucht trotz ernster Folgen für sich selbst oder Angehörige;
• verändertes oder gesteigertes sexuelles Verlangen bzw. Verhalten, an dem Sie oder andere Anstoß nehmen, wie übersteigerte Triebhaftigkeit;
• unkontrolliertes, übermäßiges Geldausgeben bzw. Kaufsucht;
• Ess-Störungen bzw. Ess-Sucht (Verzehr großer Mengen von Nahrungsmitteln innerhalb eines kurzen Zeitraums bzw. über den tatsächlichen Bedarf hinaus gesteigerte Nahrungsaufnahme).
Teilen Sie es Ihrem Arzt mit, wenn eine oder mehrere derartige Verhaltensweisen bei Ihnen auftreten. Er wird mit Ihnen besprechen, wie diese kontrolliert bzw. vermindert werden können.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über das in Anhang V aufgeführte nationale Meldesystem anzeigen . Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Entacapone Orion aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und dem Umkarton angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Entsorgen Sie Arzneimittel nicht im Abwasser. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen
Was Entacapone Orion enthält
- Der Wirkstoff ist Entacapon. Jede Tablette enthält 200 mg Entacapon.
- Die sonstigen Bestandteile im Tablettenkern sind mikrokristalline Cellulose, Croscarmellose-Natrium, Povidon und Magnesiumstearat.
- Der Filmüberzug enthält Polyvinylalkohol, Talkum, Macrogol, Sojalecithin, Eisenoxidhydrat (E172), Eisen(III)-oxid (E172) und Titandioxid (E171).
Wie Entacapone Orion aussieht und Inhalt der Packung
Entacapone Orion 200 mg Filmtabletten sind braun-orange, ovale Tabletten mit der Prägung „COMT“ auf einer Seite. Sie sind in Flaschen abgepackt. Es gibt vier verschiedene Packungsgrößen (Flaschen mit 30, 60, 100 oder 175 Tabletten). Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer und Hersteller:
Orion Corporation Orionintie 1 FI-02200 Espoo Finnland
Falls Sie weitere Informationen über Entacapone Orion wünschen, setzen Sie sich bitte mit dem örtlichen Vertreter des pharmazeutischen Unternehmers in Verbindung:
|
Belgique/Belgie/Belgien Orion Corporation Tel./Tel: +358 10 4261 |
Lietuva UAB Orion Pharma Tel: +370 5 276 9499 |
|
Etnrapna Orion Corporation Ten.: +358 10 4261 |
Luxembourg/Luxemburg Orion Corporation Tel./Tel: +358 10 4261 |
|
Ceska republika Orion Corporation Tel: +358 10 4261 |
Magyarorszag Orion Corporation Tel.: +358 10 4261 |
|
Danmark Orion Pharma A/S Tlf +45 8614 0000 |
Malta Orion Corporation Tel: +358 10 4261 |
|
Deutschland Orion Pharma GmbH Tel: +49 40 899 689-0 |
Nederland Orion Corporation Tel: +358 10 4261 |
|
Eesti Orion Pharma Eesti OÜ Tel: +372 6 616 863 |
Norge Orion Pharma AS Tlf.: +47 40 00 42 10 |
|
EXXäöa ORION PHARMA HELLAS M.E.n.E Tn^: +30 210 9803355 |
Österreich Orion Corporation Tel: +358 10 4261 |
|
Espana Orion Corporation Tel.: +358 10 4261 |
Polska Orion Pharma Poland Sp. z o.o. Tel.: +48 22 8333177, 8321036 |
|
France Orion Corporation Tel.: +358 10 4261 |
Portugal Orionfin Unipessoal Lda Tel: +351 21 924 9910/17 |
|
Hrvatska Orion Corporation Tel.: +358 10 4261 |
Romania Orion Corporation Tel: +358 10 4261 |
|
Ireland Orion Pharma (Ireland) Ltd. c/o Allphar Services Ltd. Tel: +353 1 428 7777 |
Slovenija Orion Corporation Tel: +358 10 4261 |
|
Island Vistor hf. Simi: +354 535 7000 |
Slovenska republika Orion Corporation Tel: +358 10 4261 |
|
Italia Orion Corporation Tel: +358 10 4261 |
Suomi/Finland Orion Corporation Puh./Tel: +358 10 4261 |
|
Künpoq Orion Corporation T^: +358 10 4261 |
Sverige Orion Pharma AB Tel: +46 8 623 6440 |
|
Latvija JSC Olainfarm Tel: +371 67013701 |
United Kingdom Orion Pharma (UK) Ltd. Tel: +44 1635 520 300 |
Diese Packungsbeilage wurde zuletzt überarbeitet im Weitere Informationsquellen
Ausführliche Informationen zu diesem Arzneimittel sind auf den Intemetseiten der Europäischen Arzneimittel-Agentur (EMA) http://www.ema.europa.eu/verfugbar.
25