Numeta G 13 % E Emulsion Zur Infusion
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Numeta G 13 % E Emulsion zur Infusion
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Dieses Arzneimittel wird in einem Dreikammer-Beutel geliefert. Jeder Beutel enthält eine sterile, pyrogenfreie Kombination aus einer Glucoselösung, einer pädiatrischen Aminosäurenlösung mit Elektrolyten und einer Lipidemulsion, wie im Folgenden beschrieben.
|
Beutelgröße |
50 %ige Glucoselösung |
5,9 %ige Aminosäurenlösungen mit Elektrolyten |
12,5%ige Lipidemulsion |
|
300 mL |
80 mL |
160 mL |
60 mL |
Falls keine Lipide verabreicht werden sollen, kann nur die Trenn-Naht zwischen der Kammer mit Aminosäuren/Elektrolyten und Glucose geöffnet werden, sodass die Trenn-Naht zwischen Aminosäuren- und Lipid-Kammer verschlossen bleibt. Der Inhalt des Beutels kann anschließend mit oder ohne Lipide infundiert werden. Nach dem Mischen der Inhalte der zwei (Aminosäuren und Glucose, 2-Kammer-Beutel, 240 mL Lösung) oder drei Kammern (Aminosäuren, Glucose und Lipide, 3-Kammer-Beutel, 300 mL Emulsion) erhält man die in der folgenden Tabelle angegebene Zusammensetzung:
|
Zusammensetzung | ||
|
Wirkstoffe |
Aktivierter 2KB |
Aktivierter 3KB |
|
(240 mL) |
(300 mL) | |
|
Aminosäure-Kammer | ||
|
Alanin |
0,75 g |
0,75 g |
|
Arginin |
0,78 g |
0,78 g |
|
Asparaginsäure |
0,56 g |
0,56 g |
|
Cystein |
0,18 g |
0,18 g |
|
Glutaminsäure |
0,93 g |
0,93 g |
|
Glycin |
0,37 g |
0,37 g |
|
Histidin |
0,35 g |
0,35 g |
|
Isoleucin |
0,62 g |
0,62 g |
|
Leucin |
0,93 g |
0,93 g |
|
Lysin-Monohydrat |
1,15 g |
1,15 g |
|
(entspricht Lysin) |
(1,03 g) |
(1,03 g) |
|
Methionin |
0,22 g |
0,22 g |
|
Ornithinhydrochlorid |
0,30 g |
0,30 g |
|
(entspricht Ornithin) |
(0,23 g) |
(0,23 g) |
|
Phenylalanin |
0,39 g |
0,39 g |
|
Prolin |
0,28 g |
0,28 g |
|
Serin |
0,37 g |
0,37 g |
|
Taurin |
0,06 g |
0,06 g |
|
Threonin |
0,35 g |
0,35 g |
|
Tryptophan |
0,19 g |
0,19 g |
|
Tyrosin |
0,07 g |
0,07 g |
|
Valin |
0,71 g |
0,71 g |
|
Kaliumacetat |
0,61 g |
0,61 g |
|
Calciumchlorid-Dihydrat |
0,55 g |
0,55 g |
|
Magnesiumacetat-T etrahydrat |
0,10 g |
0,10 g |
|
Wasserhaltiges Natriumglycerophosphat (Ph.Eur.) |
0,98 g |
0,98 g |
|
Glucose-Kammer | ||
|
Glucose-Monohydrat (Ph.Eur.) |
44,00 g |
44,00 g |
|
(entspricht Glucose) |
(40,00 g) |
(40,00 g) |
|
Lipid-Kammer | ||
|
Raffiniertes Olivenöl (ca. 80 %) + raffiniertes Sojaöl (Ph.Eur.) (ca. 20 %) |
- |
7,5 g |
2KB= Zweikammerbeutel, 3KB = Dreikammerbeutel Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. Die gebrauchsfertig gemischte Lösung/Emulsion enthält:
|
Zusammensetzung | ||||
|
Aktivierter 2KB |
Aktivierter 3KB | |||
|
Pro Volumeneinheit (mL) |
240 |
100 |
300 |
100 |
|
Stickstoff (g) |
1,4 |
0,59 |
1,4 |
0,47 |
|
Aminosäuren (g) |
9,4 |
3,9 |
9,4 |
3,1 |
|
Glucose (g) |
40,0 |
16,7 |
40,0 |
13,3 |
|
Lipide (g) |
0 |
0 |
7,5 |
2,5 |
|
Energie | ||||
|
Gesamtkalorien (kcal) |
198 |
82 |
273 |
91 |
|
Nichteiweiß-Kalorien (kcal) |
160 |
67 |
235 |
78 |
|
Glucosekalorien (kcal) |
160 |
67 |
160 |
53 |
|
Fettkalorien (kcal) a |
0 |
0 |
75 |
25 |
|
Nichteiweiß-Kalorien/Stickstoff (kcal/g N) |
113 |
113 |
165 |
165 |
|
Fettkalorien ( % Nichteiweiß-Kalorien) |
- |
- |
32 |
32 |
|
Fettkalorien ( % Gesamtkalorien) |
- |
- |
28 |
28 |
|
Elektrolyte | ||||
|
Natrium (mmol) |
6,4 |
2,7 |
6,6 |
2,2 |
|
Kalium (mmol) |
6,2 |
2,6 |
6,2 |
2,1 |
|
Magnesium (mmol) |
0,47 |
0,20 |
0,47 |
0,16 |
|
Calcium (mmol) |
3,8 |
1,6 |
3,8 |
1,3 |
|
Phosphat (mmol) b |
3,2 |
1,3 |
3,8 |
1,3 |
|
Acetat (mmol) |
7,2 |
3,0 |
7,2 |
2,4 |
|
L-Malat (mmol) |
3,2 |
1,3 |
3,2 |
1,1 |
|
Chlorid (mmol) |
9,3 |
3,9 |
9,3 |
3,1 |
|
pH-Wert (ca.) |
5,5 |
5,5 |
5,5 |
5,5 |
|
Osmolarität ca. (mOsm/L) |
1400 |
1400 |
1150 |
1150 |
a Einschließlich der Kalorien aus Eilecithin
b Einschließlich Phosphat aus der Eilecithin-Komponente der Lipide
3. DARREICHUNGSFORM
Emulsion zur Infusion.
Aussehen vor dem Mischen:
• Die Lösungen in den Aminosäuren- und Glucosekammern sind klar und farblos bis hellgelb.
• Die Lipidemulsion ist homogen und milchig-weiß.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Numeta G 13 % E dient der parenteralen Ernährung von frühgeborenen Säuglingen, wenn eine orale oder enterale Ernährung nicht möglich, unzureichend oder kontraindiziert ist.
4.2 Dosierung und Art der Anwendung
Dosierung
Die Dosierung hängt von Energiebedarf, Gewicht, Alter, klinischem Zustand und der Fähigkeit des Patienten ab, die Bestandteile von Numeta zu metabolisieren, sowie von der zusätzlichen oralen/enteralen Energie-/oder Proteinzufuhr. Die gesamte Elektrolyt- und
Makronährstoffzusammensetzung hängt von der Anzahl der miteinander vermischten Kammern ab (siehe Abschnitt 2).
Die maximale Tagesdosis sollte nicht überschritten werden. Aufgrund der festgelegten Zusammensetzung des Mehrkammerbeutels kann der komplette Nährstoffbedarf eines Patienten möglicherweise nicht gleichzeitig abgedeckt werden.
In einigen klinischen Situationen benötigen die Patienten möglicherweise eine Nährstoffmenge, die sich von der statischen Zusammensetzung unterscheidet.
Die maximal empfohlene Infusionsrate pro Stunde und das maximal empfohlene Volumen pro Tag hängen von den Inhaltsstoffen ab. Sobald bei einem der genannten Inhaltsstoffe die maximale Dosis erreicht ist, ist damit die maximale Tagesdosis erreicht. Folgende Richtlinien gelten für die maximal empfohlene Infusionsrate pro Stunde und das maximal empfohlene Volumen pro Tag:
|
Aktivierter 2KB (240 mL) |
Aktivierter 3KB (300 mL) | |
|
Maximale Infusionsrate in mL/kg/Stunde |
5,1 |
6,4 |
|
Dies entspricht: | ||
|
Aminosäure in g/kg/Stunde |
0,20 a |
0,20 a |
|
Glucose in g/kg/Stunde |
0,85 |
0,85 |
|
Lipide in g/kg/Stunde |
0 |
0,16 |
|
Maximal zulässige Menge in mL/kg/Tag |
102,3 |
127,9 |
|
Dies entspricht: | ||
|
Aminosäure in g/kg/Tag |
4,0 a |
4,0 a |
|
Glucose in g/kg/Tag |
17,1 |
17,1 |
|
Lipide in g/kg/Tag |
0 |
3,2 |
Limitierender Parameter gemäß ESPEN-ESPGHAN-Richtlinien
Numeta G 13 % E ist eventuell bei manchen Frühgeborenen nicht angezeigt, da der klinische Zustand des Patienten die Verabreichung individualisierter Formulierungen erfordert. Der spezifische Bedarf des Patienten wird vom Arzt bestimmt.
Art der Anwendung
Hinweise zur Zubereitung und Handhabung der Lösung/Emulsion zur Infusion siehe Abschnitt 6.6.
Wegen seiner hohen Osmolarität darf Numeta G 13 % E unverdünnt nur durch eine zentrale Vene verabreicht werden. Wird Numeta G 13 % E jedoch ausreichend mit Wasser für Injektionszwecke verdünnt, wird die Osmolarität gesenkt und die Infusion kann periphervenös erfolgen. Die folgende Tabelle gibt an, wie die Verdünnung die Osmolarität der Lösungen beeinflusst.
Beispiele für die Osmolarität der aktivierten 2KB- und 3KB-Mischungen nach Zusatz von Spurenelementen, Vitaminen und Wasser für Injektionszwecke:
|
Aminosäuren und Glucose (Aktivierter 2KB) |
Aminosäuren, Glucose und Lipide (Aktivierter 3KB) | |
|
Ausgangsvolumen im Beutel (mL) |
240 |
300 |
|
Ausgangsosmolarität (mOsm/L ca.) |
1400 |
1150 |
|
Volumen des hinzugefügten Wassers (mL) |
240 |
300 |
|
Zugesetzte Spurenelemente (SE)a |
2,5 mL SE1 |
2,5 mL SE1 |
|
Zugesetzte Vitamine a |
% Durchstechflasche V1 |
% Durchstechflasche V1 + % Durchstechflasche V2 |
|
Endvolumen nach Zusatz (mL) |
485 |
605 |
|
Osmolarität nach Zusatz (mOsm/L ca.) |
695 |
570 |
Die Zusammensetzung der Vitamin- und Spurenelement-Präparate ist nachfolgend dargestellt.
Zusammensetzung der handelsüblichen Spurenelement-Präparate
|
Zusammensetzung pro Durchstechflasche |
SE1 (10 mL) |
|
Zink |
38,2 ^mol oder 2,5 mg |
|
Selen |
0,253 ^mol oder 0,02 mg |
|
Kupfer |
3,15 ^mol oder 0,2 mg |
|
Iod |
0,0788 ^mol oder 0,01 mg |
|
Fluor |
30 ^mol oder 0,57 mg |
|
Mangan |
0,182 ^mol oder 0,01 mg |
Zusammensetzung der handelsüblichen Vitaminpräparate
|
Zusammensetzung pro Durchstechflasche |
V1 |
V2 |
|
Vitamin B1 |
2,5 mg |
- |
|
Vitamin B2 |
3,6 mg |
- |
|
Nicotinamid |
40 mg |
- |
|
Vitamin B6 |
4,0 mg |
- |
|
Pantothensäure |
15,0 mg |
- |
|
Biotin |
60 hg |
- |
|
Folsäure |
400 hg |
- |
|
Vitamin B12 |
5,0 hg |
- |
|
Vitamin C |
100 mg |
- |
|
Vitamin A |
- |
2300 I.E. |
|
Vitamin D |
- |
400 I.E. |
|
Vitamin E |
- |
7 I.E. |
|
Vitamin K |
- |
200 hg |
Die Infusionsgeschwindigkeit soll während der ersten Stunde der Infusion schrittweise erhöht werden. Zum Absetzen von Numeta G 13 % E soll die Infusionsgeschwindigkeit während der letzten Stunde schrittweise verringert werden. Die Infusionsrate ist unter Berücksichtigung der verordneten Dosis, des täglich aufgenommenen Volumens und der Infusionsdauer anzupassen, siehe Abschnitt 4.9.
Bei Frühgeborenen wird normalerweise eine kontinuierliche parenterale Verabreichung über 24 Stunden empfohlen. Derselbe Beutel darf jedoch nicht länger als 24 Stunden aktiviert, angehängt und infundiert werden. Zyklische Infusionen müssen sich nach der metabolischen Toleranz des Patienten richten.
Die parenterale Ernährung kann so lange fortgesetzt werden, wie es der klinische Zustand des Patienten erfordert.
Dieses Produkt enthält Elektrolyte und kann durch handelsübliche Elektrolytpräparate nach Ermessen des behandelnden Arztes und dem klinischen Bedarf des Patienten ergänzt werden, siehe Abschnitt 6.6.
Vitamine und Spurenelemente können nach Ermessen des behandelnden Arztes und dem klinischen Bedarf des Patienten hinzugefügt werden, siehe Abschnitt 6.6.
4.3 Gegenanzeigen
Allgemeine Gegenanzeigen einer intravenösen Infusion von Numeta bei Verwendung als Zweikammerbeutel sind:
• Überempfindlichkeit gegen Ei-, Soja- oder Erdnussproteine, die Wirkstoffe, einen der sonstigen in Abschnitt 6.1 aufgeführten Bestandteile oder Bestandteile des Beutels
• Kongenitale Anomalie des Aminosäurestoffwechsels
• Pathologisch erhöhte Plasmaspiegel von Natrium, Kalium, Magnesium, Calcium und/oder Phosphor
• Gleichzeitige Verabreichung mit Ceftriaxon bei Neugeborenen, sogar bei Verwendung verschiedener venöser Zugänge. Siehe Abschnitte 4.4, 4.5 und 6.2
• Schwere Hyperglykämie
Die Verabreichung von Lipiden (Anwendung von Numeta G 13 % E als intravenöse Emulsion im Dreikammerbeutel) ist außerdem in folgenden klinischen Situationen kontraindiziert:
• Schwere Hyperlipidämie oder schwere Störungen des Lipidmetabolismus, gekennzeichnet durch Hypertriglyceridämie
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Beim Auftreten von Anzeichen oder Symptomen einer allergischen Reaktion (wie z. B. Fieber, Schwitzen, Schüttelfrost, Kopfschmerzen, Hautausschläge oder Dyspnoe) ist die Infusion unverzüglich abzubrechen.
Bei Frühgeborenen wurden Todesfälle in Zusammenhang mit Calcium-Ceftriaxon-Präzipitaten in Lunge und Niere berichtet.
Bei Frühgeborenen ist die gleichzeitige Behandlung mit Ceftriaxon kontraindiziert (siehe Abschnitt 4.3).
Präzipitate in den Lungengefäßen, die eine Lungenembolie und Atemnot hervorrufen, wurden bei Patienten mit parenteraler Ernährung berichtet. In einigen Fällen führte dies zum Tod. Übermäßige Calcium- und Phosphatzufuhr erhöht das Risiko von Calciumphosphat-Ausfällungen (siehe Abschnitt 6.2). Außerdem wurde der Verdacht auf Bildung von Präzipitaten im Blut berichtet.
Zusätzlich zur Kontrolle der Lösung müssen auch das Infusionsset und der Katheter regelmäßig auf Präzipitate überprüft werden.
Wenn Anzeichen von Atemnot auftreten, sollte die Infusion abgebrochen und eine medizinische Beurteilung eingeleitet werden.
Vor dem Hinzufügen von Zusätzen die Kompatibilität überprüfen, da es durch Ausfällungen oder Destabilisierung der Lipidemulsion zu einem Gefäßverschluss kommen kann, siehe Abschnitte 6.2 und 6.6.
Bei Verwendung von Venenkathetern zur Verabreichung parenteraler Arzneimittel oder bei schlecht gepflegten Kathetern kann es zu Infektionen und Sepsis kommen. Immunsuppression, verursacht durch Erkrankungen oder Arzneimittel kann Infektionen und Sepsis begünstigen. Durch sorgfältige Überwachung der Laborwerte und Symptome des Patienten wie Fieber/Schüttelfrost, Leukozytose, technische Komplikationen mit dem Gefäßzugang und Hyperglykämie können Infektionen frühzeitig erkannt werden. Patienten, die parenteral ernährt werden müssen, sind häufig aufgrund der Mangelernährung und/oder ihrer Grunderkrankungen anfällig für Infektionen. Durch eine streng aseptische Arbeitsweise beim Legen und bei der Handhabung des Katheters sowie bei der Zubereitung der Nährlösung kann das Auftreten septischer Komplikationen reduziert werden.
Bei vergleichbaren Arzneimitteln wurde über ein so genanntes Fettüberlagerungssyndrom berichtet. Eine verminderte oder eingeschränkte Fähigkeit zur Metabolisierung der in Numeta enthaltenen Lipide kann zu einem Fettüberlagerungssyndrom führen.
Die erhöhte Nährstoffzufuhr eines stark mangelernährten Patienten kann zum Refeeding-Syndrom führen, das durch intrazelluläre Verschiebung von Kalium, Phosphor und Magnesium gekennzeichnet ist, während beim Patienten ein anaboler Effekt eintritt. Darüber hinaus kann es zu Thiamin-Mangel und Flüssigkeitsretention kommen. Daher wird empfohlen die parenterale Ernährung möglichst langsam und vorsichtig einzuleiten und dabei Flüssigkeitshaushalt, Elektrolyte, Spurenelemente und Vitamine engmaschig zu kontrollieren.
Numeta G 13 % E darf nur über eine zentrale Vene verabreicht werden, außer es wurde entsprechend verdünnt (siehe Abschnitt 4.2).
Werden Zusätze verwendet, muss vor der Verabreichung über eine periphere Vene die Osmolarität der Mischlösung bestimmt werden, um eine Venenreizung zu vermeiden.
Nicht mehrere Beutel in Serie miteinander verbinden, da sonst die Gefahr einer Luftembolie durch Lufteinschlüsse im ersten Beutel besteht
Lipide, Vitamine, zusätzliche Elektrolyte und Spurenelemente sind nach Bedarf zuzuführen.
V orsichtsmaßnahmen
Es dürfen keine anderen Arzneimittel oder Substanzen in eine der drei Beutelkammern oder in die gebrauchsfertig gemischte Lösung/Emulsion hinzugefügt werden ohne vorher die Kompatibilität und die Stabilität der resultierenden Zubereitung zu überprüfen (vor allem die Stabilität der LipidEmulsion) (siehe Abschnitte 6.2 und 6.6)
Während der gesamten Therapie sind Wasser- und Elektrolythaushalt, einschließlich Magnesium, Serumosmolarität, Triglyceride im Serum, Säure-Basen-Haushalt, Blutzuckerspiegel, Leber- und Nierenfunktion, Blutbild einschließlich Thrombozyten und Gerinnungsparameter zu überwachen.
Bei instabilen Zuständen (z. B. nach schwerem Trauma, nicht kompensierter Diabetes mellitus, akute Phase eines Kreislaufschocks, akuter Myokardinfarkt, schwere metabolische Azidose, schwere Sepsis und hyperosmolares Koma) ist die Verabreichung von Numeta G 13 % E unbedingt zu überwachen und an den klinischen Bedarf des Patienten anzupassen.
Es sind nur begrenzt Informationen zur Verabreichung von Numeta G 13 % E an Frühgeborene mit einem Gestationsalter von weniger als 28 Wochen vorhanden.
Herz-Kreislauf-System
Bei Patienten mit Lungenödem oder Herzinsuffizienz nur mit Vorsicht anwenden. Flüssigkeitshaushalt sorgfältig überwachen.
Niere
Bei Patienten mit Niereninsuffizienz nur mit Vorsicht anwenden. Elektrolyt- und Flüssigkeitsstatus, einschließlich Magnesium, bei diesen Patienten engmaschig überwachen.
Schwere Störungen des Wasser- und Elektrolytgleichgewichts, schwere Flüssigkeitsüberladung und schwere Stoffwechselstörungen müssen vor Beginn der Infusion korrigieret werden.
Leber/Gastrointestinaltrakt
Bei Patienten mit schwerer Leberinsuffizienz, einschließlich Cholestase oder erhöhten Leberenzymen nur mit Vorsicht anwenden. Leberfunktionsparameter sorgfältig überwachen.
Endokrines System und Stoffwechsel
Stoffwechselkomplikationen können auftreten, wenn die Nährstoffzufuhr nicht an den Bedarf des Patienten angepasst wird oder die Stoffwechselkapazität eines bestimmten Nahrungsbestandteils nicht exakt ermittelt wurde. Durch inadäquate oder übermäßige Nährstoffzufuhr oder Verabreichung einer Mischlösung, die nur unzureichend auf den Bedarf des betreffenden Patienten abgestimmt wurde, kann es zu negativen Auswirkungen auf den Stoffwechsel kommen.
Die Konzentrationen der Triglyceride im Serum und die Fähigkeit des Körpers, die enthaltenen Lipide zu metabolisieren, müssen regelmäßig überprüft werden. Bei Verdacht auf eine Lipidstoffwechselstörung wird empfohlen, die Konzentrationen der Triglyzeride im Serum zu überwachen, sofern dies klinisch erforderlich ist.
Bei Hyperglykämie muss die Infusionsrate von Numeta G 13 % E angepasst und/oder Insulin verabreicht werden, siehe Abschnitt 4.9.
Hämatologie
Bei Patienten mit schweren Blutgerinnungsstörungen nur mit Vorsicht anwenden. Blutbild und die Gerinnungsparameter sorgfältig überwachen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine pharmakodynamischen Interaktionsstudien mit Numeta G 13 % E durchgeführt.
Numeta G 13 % E darf aufgrund des Risikos einer Pseudoagglutination nicht gleichzeitig mit Blut durch dasselbe Infusionsset verabreicht werden.
Wie für andere calciumhaltige Infusionslösungen ist die gleichzeitige Verabreichung von Ceftriaxon und Numeta G 13 % E bei Frühgeborenen kontraindiziert (siehe Abschnitte 4.3, 4.4 und 6.2).
Oliven- und Sojaöl haben einen natürlichen Gehalt an Vitamin K1, das der blutgerinnungshemmenden Wirkung von Cumarin (oder Cumarin-Derivaten einschließlich Warfarin) entgegenwirken kann.
Wegen des Kaliumgehalts von Numeta G 13% E ist aufgrund des Hyperkaliämie-Risikos bei Patienten, die gleichzeitig mit kaliumsparenden Diuretika (z.B. Amilorid, Spironolacton, Triamteren), ACE-Inhibitoren, Angiotensin-II-Rezeptor Antagonisten oder Immunsuppressiva wie Tacrolimus und Cyclosporin behandelt werden, besondere Vorsicht geboten.
Die in dieser Emulsion enthaltenen Lipide können die Ergebnisse bestimmter Labortuntersuchungen verfälschen (z. B. Bestimmung von Bilirubin, Lactatdehydrogenase, Sauerstoffsättigung, Hämoglobinkonzentration), wenn die Blutproben entnommen werden, bevor alle Lipide ausgeschieden wurden. Die Lipide werden im Allgemeinen innerhalb von 5 bis 6 Stunden eliminiert, sofern keine zusätzlichen Lipide verabreicht werden.
Siehe Abschnitt 6.2.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Nicht zutreffend, da das Produkt für Frühgeborene bestimmt ist.
Stillzeit
Nicht zutreffend, da das Produkt für Frühgeborene bestimmt ist.
Fertilität
Das Produkt enthält Glucose, eine pädiatrische Aminosäurenlösung, Elektrolyte und eine Lipidemulsion. Auswirkungen auf die Fertilität sind unwahrscheinlich.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend
4.8 Nebenwirkungen
Die Sicherheit und Verabreichung von Numeta wurden in einer einzelnen Phase-III-Studie bewertet. Einhundertneunundfünfzig (159) pädiatrische Patienten wurden in die Studie eingeschlossen und erhielten Numeta.
In der folgenden Tabelle sind die in dieser Studie beobachteten Nebenwirkungen zusammengefasst.
|
System-Organklasse (SOC) |
Bevorzugter MedDRA-Begriff |
Häufigkeitb |
|
STOFFWECHSEL- UND |
Hypophosphatämiea |
Häufig |
|
ERNÄHRUNGSSTÖRUNGEN |
Hyperglykämiea |
Häufig |
|
Hypercalciämiea |
Häufig | |
|
Hypertriglyceridämiea |
Häufig | |
|
Hyperlipidämiea |
Gelegentlich | |
|
Hyponatriämiea |
Häufig | |
|
LEBER- UND GALLENERKRANKUNGEN |
Cholestase |
Gelegentlich |
a Während der Infusion entnommene Blutproben (nicht in nüchternem Zustand). b Die Häufigkeit ist wie folgt definiert: Sehr häufig (>1/10), häufig (>1/100 - <1/10), gelegentlich (>1/1.000 - <1/100), selten (>1/10.000 - <1/1.000), sehr selten (<1/10.000).
Die folgenden Nebenwirkungen wurden mit anderen Mischlösungen zur parenteralen Ernährung berichtet:
• Fettüberladungssyndrom: Es kann durch unsachgemäße Anwendung (z.B. Überdosierung und/oder eine höhere Infusionsrate als empfohlen, siehe Abschnitt 4.9) hervorgerufen werden. Die Anzeichen und Symptome dieses Syndroms können jedoch auch bei sachgemäßer Anwendung des Produkts auftreten. Eine verminderte oder eingeschränkte Fähigkeit zur Metabolisierung der in Numeta G 13 % E enthaltenen Lipide, begleitet von einer verlängerten Plasma Clearance, können zu dem so genannten Fettüberladungssyndrom führen. Dieses Syndrom geht mit einer plötzlichen Verschlechterung des klinischen Zustands des Patienten einher und wird durch Symptome wie Hyperlipidämie, Fieber, Fettinfiltration der Leber (Hepatomegalie), Verschlechterung der Leberfunktion, Anämie, Leukopenie, Thrombozytopenie, Gerinnungsstörungen und Manifestationen im zentralen Nervensystem (z.B. Koma) charakterisiert. Das Syndrom bildet sich normalerweise wieder zurück, nachdem die Infusion der Lipidemulsion beendet wurde.
Präzipitate in den Lungengefäßen (Lungenembolie und Atemnot) (siehe Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei nicht bestimmungsgemäßer Anwendung (Überdosierung und/oder höherer Infusionsrate als empfohlen) kann es zu Übelkeit, Erbrechen, Schüttelfrost, Elektrolytstörungen und Anzeichen von Hypervolämie oder Azidose kommen, die zum Tod führen können. In diesen Fällen muss die Infusion sofort abgebrochen werden. Falls medizinisch angemessen, kann eine weitere Intervention erforderlich sein.
Wenn die Infusionsrate von Glucose die Clearance-Rate übersteigt, kann dies zu Hyperglykämie, Glucosurie oder hyperosmolarem Syndrom führen.
Eine verminderte oder eingeschränkte Fähigkeit zur Metabolisierung der Lipide kann zu einem Fettüberladungssyndrom führen. Die Symptome dieses Krankheitsbildes sind nach Abbruch der Lipidinfusion in der Regel reversibel, siehe Abschnitt 4.8.
Es gibt kein spezifisches Antidot bei Überdosierung. Notfallmaßnahmen sollten allgemeine, unterstützende Maßnahmen umfassen, unter besonderer Berücksichtigung der Atemwege und des Herz-Kreislauf-Systems. In schwerwiegenden Fällen kann eine Hämodialyse, Hämofiltration oder Hämodiafiltration erforderlich sein.
Eine strenge Überwachung der biochemischen Parameter ist unbedingt erforderlich und spezifische Auffälligkeiten sollten unbedingt entsprechend behandelt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lösungen zur parenteralen Ernährung / Kombinationen, ATC-Code: B05BA10
Der Gehalt von Numeta an Stickstoff (20 L-Aminosäuren, einschließlich 8 essenzieller Aminosäuren) und Energie (Glucose und Triglyceride) dient der Aufrechterhaltung eines angemessenen Stickstoff-Energiehaushalts. Stickstoff und Energie sind erforderlich, damit alle Körperzellen normal funktionieren. Zudem spielen sie eine wichtige Rolle für die Proteinsynthese, das Wachstum, die Wundheilung, die Immunfunktion, die Muskelfunktion und viele andere Zellaktivitäten.
Diese Formulierung enthält darüber hinaus Elektrolyte.
Das Aminosäuren-Profil ist wie folgt:
• Essenzielle Aminosäuren/Gesamt-Aminosäuren: 47,5 %
• Verzweigtkettige Aminosäuren/Gesamt-Aminosäuren: 24,0 %
Die Lipidemulsion in Numeta ist eine Zusammensetzung aus raffiniertem Olivenöl und raffiniertem Sojaöl (Verhältnis ca. 80/20). Die ungefähre relative Verteilung der Fettsäuren ist wie folgt:
• 15 % gesättigte Fettsäuren (GFS)
• 65 % einfach ungesättigte Fettsäuren (EUFS)
• 20 % mehrfach ungesättigte Fettsäuren (MUFS)
Das Verhältnis Phospholipide/Triglyceride beträgt 0,06. Der mäßige Gehalt an essenziellen Fettsäuren (EFS) verbessert den Status deren höherer Derivate und gleicht zudem einen EFS-Mangel aus.
Olivenöl enthält größere Mengen Alpha-Tocopherol, das bei mäßiger Aufnahme von mehrfach ungesättigten Fettsäuren den Vitamin-E-Status verbessert und die Lipid-Peroxidation reduziert.
Die Kohlenhydrat-Quelle ist Glucose. Glucose gehört zu den wichtigsten Energiequellen des Körpers.
5.2 Pharmakokinetische Eigenschaften
Die Inhaltsstoffe der Emulsion zur Infusion (Aminosäuren, Elektrolyte, Glucose, Lipide) werden auf gleiche Weise verteilt, metabolisiert und ausgeschieden wie bei einzelnen Infusionen dieser Substanzen. Das Produkt wird intravenös verabreicht. Dadurch ist es zu 100 % bioverfügbar, und die Bestandteile werden in alle Körperzellen verteilt und dort metabolisiert.
5.3 Präklinische Daten zur Sicherheit
Präklinische Studien zu den Bestandteilen des 3-Kammer-Beutels haben über die in anderen Abschnitten dieser Fachinformation bereits erwähnten Risiken hinaus keine zusätzlichen Risiken ergeben.
Untersuchungen am Tier wurden mit Numeta (im Doppel- oder Dreikammerbeutel) nicht durchgeführt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
L-Äpfelsäure
Salzsäure 25 % (zur pH-Einstellung)
Eilecithin
Glycerol
Natriumoleat
Natriumhydroxid (zur pH-Einstellung) Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Andere Arzneimittel oder Substanzen dürfen erst dann den drei Beutelkammern oder der gebrauchsfertig gemischten Lösung/Emulsion zugesetzt werden, wenn die Kompatibilität und die Stabilität der resultierenden Gesamtlösung (vor allem die Stabilität der Lipidemulsion bzw. die Bildung von Präzipitaten) geprüft wurde, siehe Abschnitt 6.6.
Wie bei allen Zusätzen zur parenteralen Ernährung muss auch bei Zusatz von Calcium und Phosphaten auf die Mischungsverhältnisse geachtet werden. Übermäßige Calcium- und Phosphatzufuhr - insbesondere in Form von Mineralsalzen - kann zu Calciumphosphat-Ausfällungen führen.
Wie für andere calciumhaltige Infusionslösungen ist die gleichzeitige Verabreichung von Ceftriaxon und Numeta G 13 % E bei Frühgeborenen kontraindiziert. ( siehe Abschnitte 4.3, 4.4 und 4.5).
Numeta G 13 % E darf nicht gleichzeitig mit Blut durch dasselbe Infusionsset verabreicht werden, siehe Abschnitt 4.5.
Numeta G 13 % E enthält Calciumionen, die ein zusätzliches Risiko für die Präzipitatbildung in mit Citrat antikoaguliertem/konserviertem Blut oder Blutbestandteilen darstellen
6.3 Dauer der Haltbarkeit
18 Monate
Verwendbarkeit nach dem Mischen
Nach Öffnen der Trenn-Nähte zwischen den zwei oder drei Kammern wird empfohlen, das Produkt unverzüglich zu verwenden. Es wurde jedoch nachgewiesen, dass gebrauchsfertige Mischungen über einen Zeitraum von 7 Tagen bei 2 °C und 8 °C stabil sind und anschließend noch 48 Stunden bei 30 °C gelagert werden können.
Verwendbarkeit nach Hinzufügen von Zusätzen (Elektrolyte, Spurenelemente, Vitamine, Wasser): In Bezug auf spezielle Mischlösungen wurde die physikalische Stabilität der Numeta Formulierung über einen Zeitraum von 7 Tagen bei Lagerung zwischen 2 °C und 8 °C gefolgt von 48 Stunden bei einer Aufbewahrungstemperatur von 30 °C nachgewiesen. Informationen zu diesen Zusätzen finden Sie in Abschnitt 6.6.
Aus mikrobiologischer Sicht sollte das Produkt grundsätzlich sofort verwendet werden. Wird das Präparat nicht umgehend verabreicht, ist der Anwender für Lagerdauer und Lagerbedingungen der gebrauchsfertigen Lösung verantwortlich. Im Regelfall darf dann ein Zeitraum von 24 h bei 2 °C -8 °C nicht überschritten werden, es sei denn, die Lösung wurde unter kontrollierten und validierten aseptischen Bedingungen hergestellt/verdünnt/mit Zusätzen versehen.
Siehe hierzu auch Abschnitt 4.2 und Abschnitt 6.6.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht einfrieren.
Im Umbeutel aufbewahren.
6.5Art und Inhalt des Behältnisses
Der vollständig PVC-freie Dreikammer-Beutel besteht aus folgenden Komponenten:
• Eine mehrschichtige Kunststoff-Folie.
• Ein Anschluss an der Kammer mit der Lipidemulsion. Dieser wird nach dem Befüllen versiegelt, damit dieser Kammer keine weiteren Zusätze hinzugefügt werden können.
• Zwei Anschlüsse an den Kammern mit Aminosäurelösung und Glucoselösung:
o Ein Zuspritzanschluss, mit dem der Anschluss der Glucose-Kammer verschlossen wird.
o Ein Infusionsanschluss, mit dem der Anschluss der Aminosäure-Kammer verschlossen wird.
Alle Komponenten sind frei von natürlichem Latex.
Um Kontakt mit Luft zu vermeiden, ist der Beutel in einem sauerstoffdichten Umbeutel verpackt, in dem sich ein Sauerstoff-Absorber und ein Sauerstoff-Indikator befinden.
Verfügbare Packungsgrößen:
300-mL-Beutel: 10 Beutel pro Karton 1 Beutel zu 300 mL
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nur zum einmaligen Gebrauch.
Es wird empfohlen, den Inhalt nach Öffnen der Trenn-Nähte zwischen den Kammern unverzüglich zu verwenden und nicht für spätere Infusionen aufzubewahren.
Nicht mehrere Beutel in Serie miteinander verbinden, da sonst die Gefahr einer Luftembolie durch Lufteinschlüsse im ersten Beutel besteht.
Den Beutel und die Trenn-Nähte auf Beschädigungen überprüfen. Nur verwenden, wenn der Beutel unbeschädigt ist, die Trenn-Nähte intakt sind (also der Inhalt der drei Beutelkammern noch nicht vermischt ist), die Aminosäuren- und die Glucoselösung klar, farblos bis hellgelb und praktisch frei von sichtbaren Partikeln sind, und die Lipidemulsion eine homogene und milchig-weiße Flüssigkeit ist.
Vor dem Öffnen des Umbeutels die Farbe des Sauerstoffindikators überprüfen. Die Farbe des Indikators mit der Farbe vergleichen, die auf dem Etikett des Indikators neben dem OK-Symbol abgedruckt ist. Das Produkt nicht verwenden, wenn sich die tatsächliche Farbe des Sauerstoffindikators von der Vergleichsfarbe neben dem OK-Symbol unterscheidet.
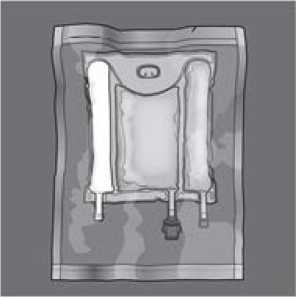
Öffnen: Den Schutz-Umbeutel entfernen. Umbeutel und Sauerstoffadsorber/Sauerstoffindikator entsorgen.
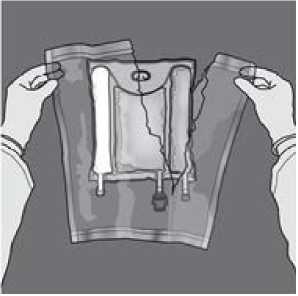
Mischen: Sicherstellen, dass das Produkt Raumtemperatur hat, bevor die Trenn-Nähte geöffnet werden. Den Beutel auf eine ebene, saubere Fläche legen. Nicht verwenden, wenn der Inhalt des Beutels bereits gemischt ist, weil sich die Trenn-Nähte während des Transports versehentlich geöffnet haben.
Aktivierung des Dreikammerbeutels (Öffnen der beiden Trenn-Nähte)
Den Beutel von der Seite mit der Aufhängung her zusammenrollen.
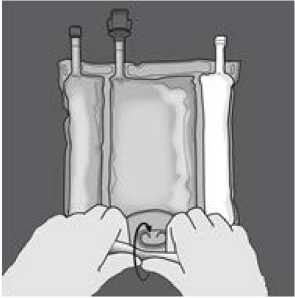
Druck ausüben, bis sich die Trenn-Nähte öffnen.
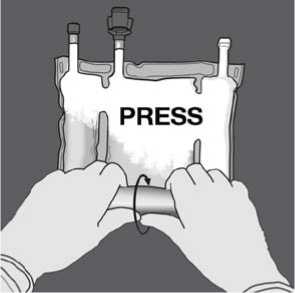
Dann die Richtung ändern und den Beutel in Richtung der Aufhängung zusammenrollen. Fortfahren, bis die Trenn-Naht vollständig offen ist. Zum vollständigen Öffnen der zweiten TrennNaht gleichermaßen vorgehen.
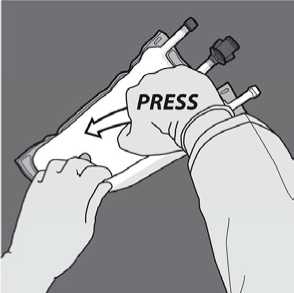
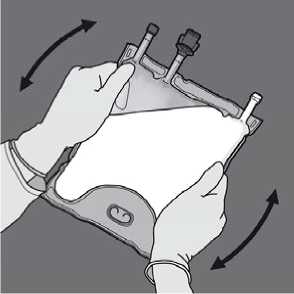
Den Beutel mindestens dreimal umdrehen, um die Kammerinhalte gründlich durchzumischen. Die Lösung sollte nach dem Mischen eine milchig-weiße Emulsion ergeben.
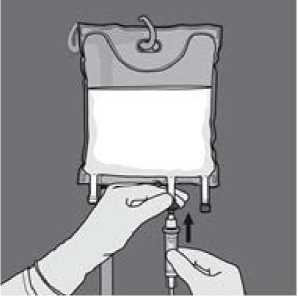
Die Schutzkappe vom Infusionsanschluss abnehmen und das Infusionsset anschließen
Aktivierung des Zweikammerbeutels (Öffnen der Trenn-Nähte nur zwischen der Aminosäuren- und der Glucose-Kammer)
Um nur die Trenn-Naht zwischen Aminosäuren- und Glucose-Kammer zu öffnen, den Beutel von der Seite mit der Aufhängung der Trenn-Naht zwischen den Aminosäuren- und Glucose-Lösungen zusammenrollen. Druck ausüben, um die Trenn-Naht zwischen Glucose- und AminosäurenKammer zu öffnen.

Den Beutel so ausrichten, dass die Kammer mit der Lipidemulsion zum Anwender zeigt. Beim Zusammenrollen des Beutels die Kammer mit der Lipidemulsion zum Schutz mit der Handfläche abdecken.
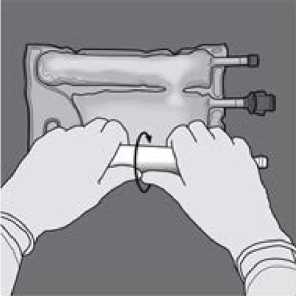
Den Beutel mit einer Hand nach unten drücken und in Richtung der Anschlüsse zusammenrollen.
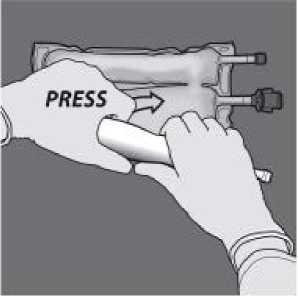
Dann den Beutel in die andere Richtung (zur Seite mit der Aufhängung) hin aufrollen. Mit der anderen Hand nach unten drücken und den Beutel weiter aufrollen, bis die Trenn-Naht zwischen der Aminosäurelösung und der Glucoselösung vollständig geöffnet ist.
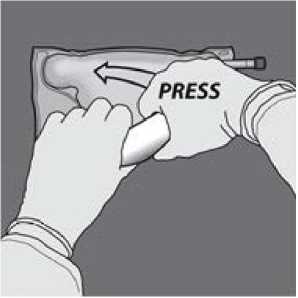
Den Beutel mindestens dreimal umdrehen, um die Kammerinhalte gründlich durchzumischen. Die Mischlösung sollte klar und farblos bis hellgelb sein.
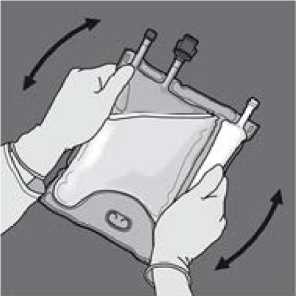
Die Schutzkappe vom Infusionsanschluss abnehmen und das Infusionsset anschließen.
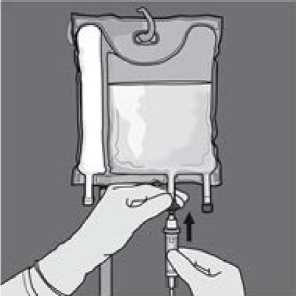
Zusätze: Das Fassungsvermögen des Beutels erlaubt den Zusatz von Elektrolyten, Spurenelementen, Vitaminen und Wasser für Injektionszwecke. Eventuelle Zusätze (einschließlich Vitamine) können zur gebrauchsfertigen Mischung (nach dem Öffnen der Trenn-Nähte und dem Mischen der Inhalte der zwei oder drei Kammern) hinzufügt werden. Vitamine können der Glucose-Kammer auch vor dem Mischen der gebrauchsfertigen Lösung (vor dem Öffnen der Trenn-Nähte und dem Mischen der Lösungen mit der Emulsion) zugesetzt werden.
Bei der Zugabe von Zusätzen sollten die im Beutel bereits vorhandene Menge an Elektrolyten berücksichtigt werden, um den klinischen Bedarf des Patienten gerecht zu werden. Informationen zu maximalen Elektrolytkonzentrationen und den handelsüblichen Vitamin- und Spurenelementformulierungen, die zu Numeta als aktiviertem Zwei- bzw. Dreikammerbeutel hinzugefügt werden können, sind unten angegeben. .
Die Zusammensetzung der Vitamin- und Spurenelement-Zubereitungen ist in Abschnitt 4.2 aufgeführt.
|
Zusätze |
Maximale Menge an Zusätzen pro Beutel | |
|
Aminosäuren und Glucose (Aktivierter 2KB) |
Aminosäuren, Glucose, und Fette (Aktivierter 3KB) | |
|
Natrium |
17.6 mmol |
5.0 mmol |
|
Kalium |
17.8 mmol |
4.2 mmol |
|
Magnesium |
1.3 mmol |
0.0 mmol |
|
Calcium |
3.5 mmol |
1.9 mmol |
|
Phosphat3 |
4.0 mmol |
2.5 mmol |
|
Spurenelemente |
2.5 mL SE1 |
2.5 mL SE1 |
|
Vitamine |
% Durchstechflasche V1 |
% Durchstechflasche V1 + % Durchstechflasche V2 |
a Organische Phosphate
Hinzufügen von Zusätzen:
• Aseptische Bedingungen sicherstellen.
• Den Zuspritzanschluss des Beutels vorbereiten.
• Den Anschluss durchstechen und die Zusätze über eine Injektionsnadel oder einen Mischadapter injizieren.
• Den Beutelinhalt mit den Zusätzen mischen.
Vorbereitung der Infusion:
• Aseptische Bedingungen sicherstellen.
• Den Beutel aufhängen.
• Die Kunststoff-Schutzabdeckung vom Infusionsanschluss entfernen.
• Den Dorn des Infusionssets fest in den Infusionsanschluss einführen.
Verabreichung der Infusion:
• Nur zum einmaligen Gebrauch.
• Das Arzneimittel erst verabreichen, wenn die Trenn-Nähte zwischen den zwei oder drei Kammern geöffnet sind und der Inhalt der zwei oder drei Kammern gemischt wurde.
• Sicherstellen, dass die gebrauchsfertige Emulsion zur Infusion (aktivierter Dreikammerbeutel) keine Anzeichen von Phasentrennung bzw. die gebrauchsfertige Infusionslösung (aktivierter Zweikammerbeutel) keine Partikel aufweist.
• Nach dem Öffnen des Beutels muss der Inhalt unverzüglich verwendet und nie für eine spätere Infusion aufbewahrt werden.
• Angebrochene Beutel nicht erneut anschließen.
• Nicht mehrere Beutel in Serie miteinander verbinden, da sonst die Gefahr einer Luftembolie aufgrund von Luftresten im ersten Beutel besteht.
• Nicht verwendetes Arzneimittel oder Abfallmaterial und alle erforderlichen Einweggeräte sind angemessen zu entsorgen und dürfen nicht wiederverwendet werden.
7. INHABER DER ZULASSUNG
Baxter Deutschland GmbH
Edisonstraße 4
85716 Unterschleißheim
Telefon: 089/31701-0
Fax: 089/31701-177
E-Mail-Adresse: info_de@baxter.com
8. ZULASSUNGSNUMMER(N)
94744.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
30. Mai 2016
10. STAND DER INFORMATION
Mai 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
20