Aciclo Basics 200Mg
ACICLO BASICS 200 mg Tabletten
ACICLO BASICS 400 mg Tabletten
ACICLO BASICS 800 mg Tabletten
Fachinformation
1. Bezeichnung des Arzneimittels
ACICLO BASICS 200 mg ACICLO BASICS 400 mg ACICLO BASICS 800 mg
Tabletten
2. Qualitative und quantitative Zusammensetzung
ACICLO BASICS 200 mg:
Eine Tablette enthält 200 mg Aciclovir.
ACICLO BASICS 400 mg:
Eine Tablette enthält 400 mg Aciclovir.
ACICLO BASICS 800 mg:
Eine Tablette enthält 800 mg Aciclovir.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. Darreichungsform
Tablette
ACICLO BASICS 200 mg:
Weiße bis cremeweiße, kapselförmige, unbeschichtete Tabletten mit „200“ auf der einen Seite und „ACV“ auf der anderen Seite.
ACICLO BASICS 400 mg:
Weiße bis cremeweiße kapselförmige unbeschichtete Tabletten mit „400“ auf der einen Seite und „ACV“ auf der anderen Seite
ACICLO BASICS 800 mg:
Weiße bis cremeweiße kapselförmige unbeschichtete Tabletten mit „800“ auf der einen Seite und „ACV“ auf der anderen Seite
4. Klinische Angaben
4.1 Anwendungsgebiete
ACICLO BASICS 200 mg
ACICLO BASICS 200 mg ist angezeigt zur Behandlung von Herpes-simplex-, insbesondere Herpes-genitalis-Infektionen der Haut und der Schleimhäute (primärer sowie häufig rezidivierender Herpes genitalis), nicht jedoch bei Herpes-simplex-Infektionen bei Neugeborenen sowie schweren HSV-Erkrankungen bei immunsupprimierten Kindern.
Der Versuch einer vorbeugenden Behandlung bei erwachsenen Patienten, die an sehr schweren Verlaufsformen sehr häufig rezidivierender genitaler Herpes-simplex-Infektionen leiden, ist angezeigt.
ACICLO BASICS 400 mg
Herpes zoster (Gürtelrose)
Zur Vorbeugung von schweren Herpes-simplex-Infektionen bei stark immunsupprimierten erwachsenen Patienten, wenn diese einem erhöhten Infektionsrisiko ausgesetzt sind, z.B. nach Organtransplantationen.
ACICLO BASICS 800 mg Herpes zoster (Gürtelrose)
4.2 Dosierung und Art der Anwendung
Art der Anwendung
Die Einnahme der Tabletten sollte möglichst nach den Mahlzeiten mit Flüssigkeit erfolgen.
Besonders bei eingeschränkter Nierenfunktion, wie sie insbesondere bei älteren Patienten vermehrt auftreten kann, ist auf eine angemessene Flüssigkeitszufuhr während der Therapie zu achten.
ACICLO BASICS 200 mg
Für Erwachsene
Bei Herpes-simplex-Infektionen:
Eine Einzeldosis von 200 mg Aciclovir (1 Tablette) 5-mal tagsüber im Abstand von 4 Stunden.
Dauer der Anwendung
Bei Herpes-simplex-Infektionen beträgt die Behandlungsdauer 5 Tage, kann jedoch abhängig vom klinischen Zustand des Patienten verlängert werden.
Zur Prophylaxe von schweren Verlaufsformen und sehr häufig rezidivierenden genitalen Herpes-simplexInfektionen:
Immunologisch gesunde Patienten erhalten eine Einzeldosis von 200 mg Aciclovir (1 Tablette) 4-mal täglich im Abstand von 6 Stunden. Alternativ dazu können auch 400 mg Aciclovir (2 Tabletten ACICLO BASICS 200 mg) täglich im Abstand von 12 Stunden eingenommen werden. In Einzelfällen kann eine wirksame Vorbeugung auch mit einer Dosierung von 3-mal täglich 200 mg Aciclovir im Abstand von 8 Stunden oder 2-mal täglich 200 mg Aciclovir im Abstand von 12 Stunden erzielt werden.
Kommt es trotz dieser täglichen Gesamtdosis von 800 mg zum Rezidiv (Durchbruchinfektion), so sind - wie bei der Dosierung bei Herpes-simplex-Infektionen angegeben - 200 mg Aciclovir tagsüber 5-mal im Abstand von 4 Stunden über 5 Tage zu verabreichen. Danach wird erneut die obengenannte Dosierung gegeben.
Dauer der Anwendung
Zur Vorbeugung von Herpes-simplex-Infektionen bei immunologisch gesunden Patienten ist die Dauer der Behandlung abhängig von der Schwere der Verlaufsformen und der Häufigkeit der Rezidive. Sie sollte jedoch einen Zeitraum von 6-12 Monaten nicht überschreiten.
Immunsupprimierte Patienten erhalten zur Vorbeugung eine Einzeldosis von 200 mg Aciclovir (1 Tablette) 4-mal täglich im Abstand von 6 Stunden.
Stark immunsupprimierten Patienten, z.B. nach Organtransplantationen, kann eine Einzeldosis von 400 mg Aciclovir (2 Tabletten) 4-mal täglich im Abstand von 6 Stunden verabreicht werden. Alternativ kann auch - insbesondere bei Patienten mit gestörter enteraler Resorption - Aciclovir-T rockensubstanz zur intravenösen Infusion angewendet werden.
Dauer der Anwendung
Die Dauer der Anwendung bei der Prophylaxe von Herpes-simplex-Infektionen bei stark immunsupprimierten Patienten wird von der Schwere der Immunsuppression und von der Dauer des Infektionsrisikos bestimmt.
Hinweis:
Mögliche Resistenzentwicklungen wurden bei Immunsupprimierten beschrieben. Dies sollte bei der Dosierung beachtet werden.
Für Kinder
Zur Behandlung von Herpes-simplex-Infektionen erhalten Kinder über 5 Jahre die Erwachsenendosis. Für Kinder unter 5 Jahren stehen andere Darreichungsformen zur Verfügung.
ACICLO BASICS 400 mg
Für Erwachsene
Bei Herpes zoster (Gürtelrose):
Eine Einzeldosis von 800 mg Aciclovir (2 Tabletten) 5-mal tagsüber im Abstand von 4 Stunden. Die Behandlungsdauer beträgt 5 - 7 Tage.
Zur Vorbeugung von Herpes-simplex-Infektionen in bestimmten Fällen:
Zur Vorbeugung von schweren Herpes-simplex-Infektionen bei Patienten mit stark geschädigter körpereigener Abwehr in der Zeit eines erhöhten Infektionsrisikos, z. B. nach Organtransplantationen, kann eine Einzeldosis von 400 mg Aciclovir (1 Tablette) 4-mal täglich im Abstand von 6 Stunden verabreicht werden. Die Dauer der vorbeugenden Anwendung ist abhängig vom Schweregrad der Schädigung der körpereigenen Abwehr und wird vom Arzt im Einzelfall festgelegt.
Dauer der Anwendung
Beim Herpes zoster beträgt die Behandlungsdauer 5 bis 7 Tage.
Die Dauer der Anwendung bei der Prophylaxe von schweren Herpes-simplex-Infektionen bei stark immunsupprimier-ten Patienten (siehe Abschnitt 4.) wird von der Schwere der Immunsuppression und von der Dauer des Infektionsrisikos bestimmt.
ACICLO BASICS 800 mg
Für Erwachsene
Bei Herpes zoster (Gürtelrose):
Eine Einzeldosis von 800 mg Aciclovir (1 Tablette) 5-mal tagsüber im Abstand von 4 Stunden. Die Behandlungsdauer beträgt 5-7 Tage.
Dauer der Anwendung
ACICLO BASICS 800 mg
Bei Herpes zoster beträgt die Behandlungsdauer 5 bis 7 Tage.
ACICLO BASICS 200 mg /ACICLO BASICS 400 mg/ACICLO BASICS 800 mg Ältere Patienten
Die Möglichkeit einer Niereninsuffizienz muss bei älteren Patienten in Betracht gezogen werden und die Dosierung entsprechend angepasst werden (siehe Abschnitt weiter unten „Dosierung für Patienten mit Niereninsuffizienz“).
Bei älteren Patienten, die hohe Aciclovir-Dosen einnehmen, sollte auf eine angemessene Flüssigkeitszufuhr geachtet werden.
Dosierung für Patienten mit Niereninsuffizienz
(siehe Abschnitt 5)
Besonders bei eingeschränkter Nierenfunktion - wie sie insbesondere bei älteren Patienten vermehrt auftreten kann-ist auf eine angemessene Flüssigkeitszufuhr bei der Einnahme von Aciclovir-T abletten zu achten.
Bei Patienten mit eingeschränkter Nierenfunktion kann eine geringere Aciclovir-Dosis - wie nachfolgend angegeben-zur Behandlung ausreichen:
|
Indikation |
K reati n i n-C lea ran ce (ml/min/1,73 m2) |
Serumkreatinin (pmol/l bzw. mg/dl) |
Dosierung der Einzeldosis | |
|
Frau en |
Män ner | |||
|
Herpes- |
< 10 |
> 550 |
> 750 |
200 mg Aciclovir (1 Tablette ACICLO BASICS |
|
simplex Infektionen |
> 6,22 |
> 8,48 |
200 mg) 2-mal täglich alle 12 Stunden | |
|
Herpes zos- |
25-10 |
280-550 |
370-750 |
800 mg Aciclovir (2 Tabletten ACICLO BASICS |
|
ter |
400 mg bzw. 1 Tablette ACICLO BASICS | |||
|
3,17-6,22 |
4,18-8,48 |
800 mg) 3-mal täglich alle 8 Stunden | ||
|
< 10 |
> 550 |
> 750 |
800 mg Aciclovir (2 Tabletten ACICLO BASICS | |
|
400 mg bzw. 1 Tablette ACICLO BASICS | ||||
|
> 6,22 |
> 8,48 |
800 mg) 2-mal täglich alle 12 Stunden |
4.3 Gegenanzeigen
Überempfindlichkeit gegen Aciclovir, Valaciclovir oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Da über die vorbeugende Anwendung von Aciclovir-Tabletten bei Patienten mit eingeschränkter Nierenfunktion oder Anurie noch keine Angaben vorliegen, sollte ein Einsatz des Präparates unter diesen Bedingungen nicht erfolgen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Hydratationsstatus
Bei Patienten, die hohe Aciclovir-Dosen einnehmen, sollte auf eine angemessene Flüssigkeitszufuhr geachtet werden.
Das Risiko einer Beeinträchtigung der Nierenfunktion wird durch die Anwendung von anderen nephrotoxischen Arzneimitteln erhöht.
Anwendung bei Patienten mit eingeschränkter Nierenfunktion und älteren Patienten
Aciclovir wird renal eliminiert, daher muss die Dosis bei Patienten mit eingeschränkter Nierenfunktion reduziert werden (siehe Abschnitt 4.2). Bei älteren Patienten ist eine verringerte Nierenfunktion wahrscheinlich, daher sollte die Notwendigkeit einer Dosisreduktion für diese Patientengruppe in Betracht gezogen werden.
Sowohl ältere Patienten als auch Patienten mit eingeschränkter Nierenfunktion haben ein erhöhtes Risiko für die Entwicklung neurologischer Nebenwirkungen und sollten daher sorgfältig auf das Auftreten derartiger Wirkungen hin beobachtet werden. Aus den berichteten Fällen geht hervor, dass diese Reaktionen nach Absetzen der Behandlung im Allgemeinen reversibel waren (siehe Abschnitt 4.8).
Langdauernde oder wiederholte Behandlung kann bei stark immunsupprimierten Patienten eine längere oder wiederholte Behandlung mit Aciclovir zu einer Selektion von Virusstämmen mit reduzierter Empfindlichkeit führen, mit der Folge, dass diese Patienten auf die Behandlung mit Aciclovir möglicherweise nicht mehr ansprechen (siehe Abschnitt 5.1).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Aciclovir wird hauptsächlich unverändert renal durch aktive tubuläre Sekretion über den Urin ausgeschieden. Gleichzeitig angewendete Arzneimittel, die ebenfalls über diesen Mechanismus ausgeschieden werden, können die Plasmakonzentration von Aciclovir erhöhen.
Probenecid und Cimetidin erhöhen die AUC von Aciclovir über diesen Mechanismus und verringern die renale Clearance von Aciclovir.
Bei einer gemeinsamen Anwendung von Aciclovir und Mycophenolatmofetil, ein nach Organtransplantationen eingesetztes Immunsuppressivum, wurde ein ähnlicher Anstieg der AUC von Aciclovir sowie des inaktiven Metaboliten von Mycophenolatmofetil gefunden. Aufgrund der großen therapeutischen Breite von Aciclovir ist eine Dosisanpassung jedoch nicht erforderlich.
Eine experimentelle Studie an 5 männlichen Probanden zeigt, dass die gleichzeitige Behandlung mit Aciclovir die AUC von verabreichtem Theophyllin um ca. 50 % erhöht. Es wird empfohlen, die Plasmakonzentrationen während der gleichzeitigen Behandlung mit Aciclovir zu überwachen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Fertilität
Zu den klinischen Studien siehe Abschnitt 5.3.
Schwangerschaft
Die Anwendung von Aciclovir in der Schwangerschaft sollte nur dann erfolgen, wenn der potenzielle Nutzen die möglichen Risiken überwiegt.
Nach Markteinführung wurde der Ausgang von Schwangerschaften unter der Behandlung mit allen Formen von Aciclovir in einem Schwangerschaftsregister dokumentiert. Die Befunde aus dem Register lassen keine erhöhte Zahl an Fehlbildungen bei mit Aciclovir behandelten Patienten im Vergleich zur allgemeinen Bevölkerung erkennen. Erfasste Fehlbildungen zeigten weder einzigartige noch konstante Muster, die auf einen Zusammenhang hindeuten könnten. Die systemische Verabreichung von Aciclovir in international anerkannten Standardtests verursachte keine embryotoxischen oder teratogenen Effekte bei Kaninchen, Ratten oder Mäusen. In einem Nicht-Standard-Test an Ratten wurden fötale Missbildungen beobachtet, jedoch nur nach solch hohen, subkutanen Dosen, die maternale Toxizität hervorriefen. Die klinische Relevanz dieser Ergebnisse ist unklar.
Stillzeit
Nach oraler Verabreichung von 200 mg Aciclovir 5-mal täglich wurden in der Muttermilch Aciclovir-Konzentrationen, die dem 0,6- bis 4,1-fachen der jeweiligen Aciclovir-Plasmaspiegel entsprachen, gefunden. Ein Säugling wäre demnach Aciclovir-Konzentrationen von bis zu 0,3 mg/kg pro Tag ausgesetzt. Deshalb ist bei der Behandlung stillender Frauen mit Aciclovir Vorsicht geboten.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Bei der Bewertung der Verkehrstüchtigkeit sowie Fähigkeit zum Bedienen von Maschinen eines Patienten ist der klinische Zustand des Patienten sowie das mögliche Nebenwirkungsprofil von Aciclovir zu berücksichtigen.
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Die mit den unerwünschten Wirkungen weiter unten verbundenen Häufigkeitseinteilungen sind Schätzungen. Für die meisten Ereignisse liegen keine geeigneten Daten zur Berechnung der Häufigkeiten vor. Ferner können unerwünschte Ereignisse abhängig von der Indikation in ihrer Häufigkeit variieren.
Die am häufigsten berichteten Nebenwirkungen waren Schwindel, Kopfschmerzen, Übelkeit, Erbrechen, Durchfall und Abdominalschmerz, sowie Juckreiz, Hautausschlag (einschließlich Photosensibilitätsreaktionen), Müdigkeit und Fieber.
|
Systemorganklasse |
Sehr häufig >1/10 |
Häufig > 1/100 bis < 1/10 |
Gelegentlich >1/1.000 bis < 1/100 |
Selten >1/10.000 bis < 1/1.000 |
Sehr selten < 1/10.000 |
|
Erkrankungen des Blutes und des Lymphsystems |
Anämie, Leukopenie, Thrombozytopenie | ||||
|
Erkrankungen des Immunsystems |
anaphylaktische Reaktionen | ||||
|
Psychiatrische Erkrankungen und Erkrankungen des Nervensystems1 |
Schwindel, Kopfschmer zen |
Allgemeine körperliche Unruhe, Verwirrtheitszustände, Tremor, Ataxie, Dysarthrie, Halluzinationen, Symptome von Psychosen, Krampfanfälle, Schläfrigkeit, Enzephalopathie, Bewusstseinsstörungen bis hin zum Koma | |||
|
Erkrankungen der Atemwege, des Brustraums und des Mediastinums |
Dyspnoe | ||||
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit, Erbrechen, Durchfall, Abdominal- |
Die oben genannten Ereignisse waren im Allgemeinen reversibel und wurden überwiegend bei Patienten mit eingeschränkter Nierenfunktion mit oder ohne prädisponierende Faktoren berichtet (siehe Abschnitt 4.4). Nierenschmerzen können mit Nierenversagen einhergehen
|
Systemorganklasse |
Sehr häufig >1/10 |
Häufig > 1/100 bis < 1/10 |
Gelegentlich >1/1.000 bis < 1/100 |
Selten >1/10.000 bis < 1/1.000 |
Sehr selten < 1/10.000 |
|
schmerz | |||||
|
Leber- und Gallenerkrankungen |
Vorübergehende Bilirubin- und Leberenzym-Anstiege |
Hepatitis, Gelbsucht | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Juckreiz, Hautausschlag (einschließlich Photosensibi- litätsreaktio- nen) |
Urtikaria, diffuser Haarausfall3 |
Angioödem | ||
|
Erkrankungen der Nieren und Harnwege |
vorübergehender Anstieg von Blutharnstoff und Kreatinin |
akutes Nierenversagen, Nierenschmerzen2 | |||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Müdigkeit, Fieber |
1
2 3
Da diese Art des Haarausfalls einer großen Vielzahl von Krankheitsverläufen und Arzneimitteln zugeordnet wird, ist der Zusammenhang mit der Einnahme von Aciclovir-haltigen Arzneimitteln unklar.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen.
Deutschland
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de
4.9 Überdosierung
Symptome
Aciclovir wird nur zum Teil aus dem Gastrointestinaltrakt resorbiert (s. a. Abschnitt Bioverfügbarkeit).
Nach der Einnahme von Einzeldosen von bis zu 20 g Aciclovir traten im Allgemeinen keine toxischen Effekte auf. Eine versehentliche, wiederholte Überdosierung von oral eingenommenem Aciclovir über mehrere Tage war verbunden mit gastrointestinalen Symptomen (Übelkeit und Erbrechen) und neurologischen Symptomen (Kopfschmerzen und Verwirrtheit).
Eine Überdosierung von intravenös verabreichtem Aciclovir führte zu einem Anstieg des Serumkreatinins und Blutharnstoff-Stickstoffs und nachfolgend zu Nierenversagen. Neurologische Effekte einschließlich Verwirrtheit, Halluzination, Agitation, Krampfanfälle und Koma wurden im Zusammenhang mit dieser intravenösen Überdosierung beschrieben.
Maßnahmen
Patienten sollten auf Anzeichen von Toxizität beobachtet werden. Durch Hämodialyse kann die Elimination von Aciclovir aus dem Blut signifikant beschleunigt werden. Daher kann eine Hämodialyse im Fall einer symptomatischen Überdosierung in Betracht gezogen werden.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Guanosin-Analogon, Virostatikum, Virus-DNS-Polymerase-Hemmstoff,
ATC-Code: J05AB01
Wirkungsweise
Aciclovir ist eine pharmakologisch inaktive Substanz, die erst nach der Penetration in eine Zelle, die mit Herpessimplex-Viren (HSV) oder Varicella-zoster-Viren (VZV) infiziert ist, zu einem Virostatikum wird.
Diese Aktivierung des Aciclovir wird katalysiert durch die HSV- oder VZV- Thymidinkinase, einem Enzym, das die Viren zu ihrer Replikation dringend benötigen. Vereinfacht kann man sagen, dass das Virus sein eigenes Virostatikum synthetisiert. Im Einzelnen laufen dabei folgende Schritte ab:
1. Aciclovir penetriert vermehrt in Herpes-infizierte Zellen.
2. Die in diesen Zellen vorliegende Virus-Thymidinkinase phosphoryliert Aciclovir zum Aciclovir- Monophosphat.
3. Zelluläre Enzyme überführen Aciclovir-Monophosphat in das eigentliche Virostatikum, das Aciclovir- Triphosphat.
4. Aciclovir-Triphosphat besitzt eine 10 - bis 30-mal stärkere Affinität zur Virus-DNS-Polymerase als zur zellulären DNS-Polymerase und hemmt somit selektiv die Aktivität des viralen Enzyms.
5. Die Virus-DNS-Polymerase baut darüber hinaus Aciclovir in die Virus-DNS ein, wodurch ein Kettenabbruch bei der DNS-Synthese erfolgt.
Diese Einzelschritte führen insgesamt zu einer sehr wirkungsvollen Reduktion der Virusproduktion.
Im Plaque-Reduktions-Test wurde für HSV-infizierte Vero-Zellen (= Zellkulturen aus dem Nierenparenchym des grünen afrikanischen Affen) ein ED50-Hemmwert von 0,1 pmol Aciclovir/l gemessen, dagegen war ein ED50-Wert von 300 pmol Aciclovir/l erforderlich, um das Wachstum nicht infizierter Vero-Zellkulturen zu verhindern. Somit ermittelt man für Zellkulturen ein Verhältnis der Hemmkonzentrationen bis zu 3000.
Wirkungsspektrum in vitro:
Sehr empfindlich:
Herpes-simplex-Virus Typ I und II,
Varicella-zoster-Virus
Empfindlich:
Epstein-Barr-Virus
Teilweise empfindlich bis resistent:
Zytomegalie-Virus
Resistent:
RNS-Viren
Adenoviren
Pockenviren
5.2 Pharmakokinetische Eigenschaften
Resorption, Plasmaspiegel
Aciclovir wird nur teilweise aus dem Gastrointestinaltrakt resorbiert. Die im steady state ermittelten Plasmaspitzenwerte nach wiederholter oraler Gabe von 200 mg, 400 mg und 800 mg Aciclovir in einem Abstand von 4 Stunden 5-mal am Tag liegen bei durchschnittlich 3,02 ± 0,5 pmol/l (200 mg), 5,21 ± 1,32 pmol/l (400 mg) bzw. 8,16 ± 1,98 pmol/l (800 mg). Diese Werte werden nach etwa 1,5 ± 0,6 Stunden erreicht. Die entsprechenden PlasmaBasiswerte betragen etwa 4 Stunden nach oraler Gabe von Aciclovir 1,61 ± 0,3 pmol/l (200 mg), 2,59 ± 0,53 pmol/l (400 mg) bzw. 4,0 ± 0,72 pmol/l (800 mg). 24 Stunden nach Absetzen von Aciclovir-Tabletten ist kein Aciclovir im Körper mehr nachweisbar.
Bei immunsupprimierten Kindern im Alter von 3 - 11 Jahren, denen Aciclovir per os in Dosen von 400 mg, entsprechend 300 - 650 mg Aciclovir/m2 Körperoberfläche (KO), 5-mal am Tag verabreicht wurde, konnten Plasmaspitzenwerte von durchschnittlich 5,7 bis 15,1 pmol/l ermittelt werden. Bei Säuglingen im Alter von 1 - 6 Wochen wurden nach der oralen Verabreichung von 600 mg Aciclovir/m2 KO alle 6 Stunden Plasmaspitzenwerte von 17,3 bzw. 8,6 pmol/l gemessen.
Aus dem biexponentiellen Verlauf der Aciclovir-Kinetik kann man schlußfolgern, dass Aciclovir in hohen Konzentrationen ins Gewebe und in die Organe gelangt und aus diesen wieder langsam abflutet.
Das Verteilungsvolumen bei Erwachsenen im steady state beträgt 50 ± 8,7 l/1,73 m1, bei Neugeborenen und Säuglingen bis zu 3 Monaten 28,8 ± 9,3 l/1,73 m1
Für die Eiweißbindung wurden Werte zwischen 9 und 33 % ermittelt.
Verteilung in den Organen
Tierexperimentelle Versuche belegen, dass im Vergleich zum Serumspiegel höhere Aciclovirspiegel im Darm, in der Niere, der Leber und Lunge, niedrigere Spiegel im Muskel, im Herzen, im Hirn, in Ovarien und Testes der Tiere erreicht werden.
Post-mortem-Untersuchungen beim Menschen ergaben, dass Aciclovir im Speichel, im Vaginalsekret und in der Vesikelflüssigkeit von Herpesbläschen sowie in einigen Organen angereichert wird. 50 % der entsprechenden Serumkonzentrationen werden im Liquor erreicht.
Biotransformation und Elimination
Aciclovir wird bei nierengesunden Patienten zu 62 - 91 % in unveränderter Form und zu 10 - 15 % als 9-Carboxy-methoxymethylguanin renal eliminiert. Für Erwachsene wurden nach i.v.-Gabe von Aciclovir Plasmahalbwertszeiten (t1/2ß) von 2,87 ± 0,76 Stunden und für Neugeborene und Säuglinge bis zu 3 Monaten von 4,1 ± 1,2 Stunden ermittelt. Aciclovir wird sowohl glomerulär filtriert als auch tubulär sezerniert. Wird Aciclovir eine Stunde nach Verabreichung von 1 g Probenecid gegeben, so wird die Plasmahalbwertzeit (t1/2ß) um 18 % verlängert und die Fläche unter der Plasmakonzentrationszeitkurve um 40 % vergrößert. Bei einer Bioverfügbarkeit von etwa 20 % werden ca. 80 % der Gesamt-Aciclovir-Dosis mit den Faeces ausgeschieden.
Bei Patienten mit chronischer Niereninsuffizienz beträgt die durchschnittliche Plasmahalbwertszeit etwa 19,5 Stunden. Die mittlere Plasmahalbwertszeit während der Hämodialyse beträgt 5,7 Stunden. Während der Hämodialyse fallen die Aciclovir-Plasmaspiegel um etwa 60 %. Bei eingeschränkter Nierenfunktion besteht eine Kumulationsgefahr bei Kreatinin-Clearance-Werten von 10 ml/min/ 1,73 m1 bei einer Dosierung von 5-mal 200 mg/Tag. Eine Dosisreduktion ist deshalb ab diesem Wert angezeigt (s.a. Abschnitt 4.2).
Bei Neugeborenen und Säuglingen bis zu 3 Monaten, bei denen alle 8 Stunden 10 mg/kg Aciclovir als 1-stündige Infusion angewendet wurden, wurden eine Cmax von 61,2 pmol/l(13,8 pg/ml) und eine Cmin von 10,1 pmol/l(2,3 pg/ml) ermittelt. Eine andere Gruppe von Neugeborenen und Säuglingen (bis zu 3 Monaten), bei denen alle 8 Stunden 15 mg/kg Aciclovir angewendet wurde, wiesen etwa dosisproportionale Anstiege mit einer Cmax von 83,5 pmol (18,8 pg/ml) und einer Cmin von 14.1 pmol/l (3,2 pg/ml) auf.
5.3 Präklinische Daten zur Sicherheit
Toxikologische Eigenschaften
a) Akute Toxizität
Die LD50 konnte bei oraler Verabreichung von Aciclovir an Mäusen und Ratten nicht ermittelt werden, weil Dosen von über 10 g/kg bei der Maus und 20 g/kg bei der Ratte aus physiologischem Grund nicht überschritten werden konnten und die Tiere diese Dosen überlebten.
b) Chronische Toxiztät
Bis zu 450 mg Aciclovir/kg wurden über 4 Wochen an Mäusen oral verabreicht. Alle Tiere überlebten und wiesen keine Anomalien auf.
In einer 12-Monats-Studie wurden Beagle-Hunden bis zu 60 mg Aciclovir/kg/Tag oral verabreicht. Bei dieser Dosis traten häufiger mukoide Durchfälle und Erbrechen auf. Bei einigen Hunden wurden Veränderungen an den Pfoten und Krallenverlust beobachtet. Diese Erscheinungen waren jedoch reversibel. Weitere Auffälligkeiten wurden nicht beobachtet.
Ratten und Mäusen wurden über einen Zeitraum von 775 Tagen täglich bis zu 450 mg Aciclovir/kg verabreicht, ohne dass Veränderungen beobachtet wurden.
c) Mutagenes und tumorerzeugendes Potential
In folgenden Tests wurden keine mutagenen Effekte von Aciclovir beobachtet:
Ames-Test mit S. typhimurium, Säugetierzellen (CHO-Zellen) und Mauslymphomtest (6-Thioguanin-, AA und Ouabainresistenz) in vitro. Dominat-Letal-Test in vivo bei der Maus (25 und 50 mg/kg i.p.) und Lymphozyten von Patienten, die 5 Tage lang 3-mal täglich 5 mg/kg i.v. oder 5-mal 200 mg Aciclovir/Tag oral erhielten.
In folgenden Tests wurden bei hohen und zum Teil zytotoxischen Konzentrationen von Aciclovir mutagene Effekte beobachtet:
Mauslymphomzellen am Thymidinkinase (TK+/-)Locus.
Wegen der Besonderheit des TK-Locus in bezug auf die Aktivierung des Aciclovir könnten Klone als Folge der Chromosomenveränderung, aber auch als Folge einer Selektion aufgetreten sein.
In vitro traten bei menschlichen Lymphozytenkulturen Chromosomenbrüche erst ab 550 pmol/l auf. In vivo wurden lediglich an Knochenmarkzellen von weiblichen Ratten Chromosomenbrüche bei 100 mg/kg i.v. beobachtet, nicht jedoch bei männlichen Ratten.
Die i.p-Gabe von 100 mg/kg verursachte bei chinesischen Hamstern keine Chromosomenveränderung, wohl aber 500 mg/kg, die aber auch mit einer generellen Toxizität verbunden war. Dosen von 50 mg/kg i.v. führten weder bei Ratten noch bei chinesischen Hamstern zu Chromosomenbrüchen, was einem „no effect level" von etwa 200 pmol/l entspricht.
Untersuchungen über die Gonadenkonzentration von Aciclovir nach i.v.-Gabe bei männlichen und weiblichen Ratten ergaben Gewebewerte, die 1/3 des "no effect levels" bei weiblichen und weniger als 1/10 des „no effect levels" bei männlichen Ratten betrugen.
Bei Zugrundelegung eines Schwellenwertes für eine mögliche mutagene Wirkung des Aciclovir ist selbst durch die Verabreichung der oralen Höchstdosis von 5-mal 800 mg Aciclovir das Erreichen eines solchen Wertes auszuschließen. Ein mutagenes Risiko besteht demnach nicht.
Im Transformationstest an Mäusefibroblasten bewirkte Aciclovir bei 200 pmol/l ein verändertes Wachstumsverhalten der Monolayer-Zellkulturen (Typ III foci).
In Langzeitstudien (2 Jahre) bei Ratten und Mäusen erwies sich Aciclovir als nicht kanzerogen.
d) Reproduktionstoxizität
1. Teratogenität / Embryotoxizität
Nach subkutaner Verabreichung von bis zu 25 mg Aciclovir/kg 2-mal am Tag an Ratten während der Organogenese zwischen dem 7. und 17. bzw. 6. und 15. Tag der Trächtigkeit waren weder maternal toxische Effekte noch Entwicklungsstörungen oder Mißbildungen bei den Feten oder Jungtieren feststellbar. Nach der intravenösen bzw. subkutanen Verabreichung von bis zu 25 mg Aciclovir/kg 2-mal am Tag an Kaninchen zwischen dem 6. und 18. Tag der Trächtigkeit (Organogenese-phase) waren ebenfalls weder maternal toxische Effekte noch nachteilige Wirkungen auf die Entwicklung der Embryos bzw. Feten feststellbar.
Während die o.g. Standardtests keine Hinweise auf embryotoxische bzw. teratogene Wirkungen von Aciclovir erkennen ließen, wurden in einer weiteren Untersuchung nach subkutaner Verabreichung von 3-mal 100 mg Aciclovir/kg an Ratten am 10. Tag der Trächtigkeit (während der Organogenese) Fehlbildungen der Feten (Anophthalmien und Schwanzanomalien) beobachtet.
Bei der o.g. Dosis traten maternal toxische Effekte (Nephrotoxizität) auf. Darüber hinaus waren die maternalen AciclovirPlasmakonzentrationen 43 - 58fach, 67 - 90fach bzw. 153 - 167fach höher als die beim Menschen nach wiederholter Verabreichung von 800 mg, 400 mg bzw. 200 mg (tagsüber 5-mal, alle 4 Stunden) im steady state gemessenen durchschnittlichen Aciclovir-Konzentrationen im Plasma, so dass die klinische Bedeutung dieser Untersuchung sehr fraglich ist. 1
Weitgehend reversible ungünstige Wirkungen auf die Spermatogenese bei Ratten und Beagle-Hunden traten nur bei der Verabreichung von Aciclovir-Dosen auf, die weit über dem normalen therapeutischen Bereich lagen.
Versuche über 2 Generationen von Mäusen zeigten bei oral verabreichtem Aciclovir (bis zu 450 mg/kg/Tag) keinerlei Auswirkungen auf die Fertilität.
Erfahrungen bei der oralen Anwendung von Aciclovir bei Frauen liegen nicht vor.
Oral verabreichtes Aciclovir hat beim Mann keine Auswirkung auf die Zahl, Morphologie und Motilität der Spermien. Bioverfügbarkeit
Die Bioverfügbarkeit oral applizierten Aciclovirs beträgt etwa 20 % der verabreichten Dosis.
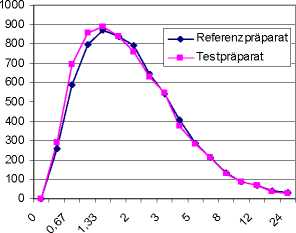
Eine im Jahr 1995 durchgeführte Bioverfügbarkeitsuntersuchung an 11 Probanden ergab im Vergleich zum Referenzpräparat:
|
Testpräparat |
Referenzpräparat | |
|
maximale Plasmakonzentration (Cmax): |
909,583 ± 30,0 |
929,399 ± 30,2 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax): |
1,394 ± 29,9 |
1,303 ± 29,1 |
|
Fläche unter der Konzentrations-ZeitKurve (AUC0.t): |
4091,58 ± 25,2 |
4053,00 ± 28,8 |
Angabe der Werte als Mittelwert und Streubreite.
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
mikrokristalline Cellulose Natriumstärkeglykolat (Typ A) vorverkleisterte Stärke (Ph.Eur.) Magnesiumstearat (Ph.Eur.) hochdisperses Siliciumdioxid
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtshinweise für die Aufbewahrung
Keine.
6.5 Art und Inhalt des Behältnisses
ACICLO BASICS 200 mg OP mit 25 Tabletten OP mit 100 Tabletten Klinikpackung mit 200 Tabletten (8x25)
ACICLO BASICS 400 mg
OP mit 30 Tabletten
OP mit 35 Tabletten
OP mit 50 Tabletten
OP mit 70 Tabletten
OP mit 100 Tabletten
Klinikpackung mit 140 Tabletten (4x35)
ACICLO BASICS 800 mg
OP mit 30 Tabletten
OP mit 35 Tablette
OP mit 50 Tabletten
Klinikpackung mit 140 Tabletten (4x35)
7. Inhaber der Zulassung
Basics GmbH Hemmelrather Weg 201 51377 Leverkusen Tel.: 0214-40399-0 Fax: 0214-40399-199 Internet: www.basics.de E-Mail: info@ranbaxy.de
8. Zulassungsnummern
ACICLO BASICS 200 mg
24566.00. 00
ACICLO BASICS 400 mg
30096.00. 00
ACICLO BASICS 800 mg 30096.01.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
ACICLO BASICS 200 mg
12.10.1995
ACICLO BASICS 400 mg
04.10.1995
ACICLO BASICS 800 mg
04.10.1995
10. Stand der Information
Februar 2014
11. Verkaufsabgrenzung
Verschreibungspflichtig
V03-00
Seite 13 von 13
Fertilität