Actiq 200 Mikrogramm Lutschtablette, Gepresst, Mit Integriertem Applikator Zur Anwendung In Der Mundhöhle
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Actiq 200 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Actiq 400 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Actiq 600 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Actiq 800 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Actiq 1200 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
Actiq 1600 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine Lutschtablette enthält 200, 400, 600, 800, 1200, 1600 Mikrogramm Fentanyl (als Citrat).
Sonstige Bestandteile:
Jede Lutschtablette enthält als sonstige Bestandteile Dextrate (ca. 2 Gramm Glucose entsprechend), Sucrose (ca. 30 Milligramm Puderzucker) und Propylenglycol (Teil des künstlichen Beerenaromas und der Druckfarbe).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle.
Actiq liegt als weiße bis cremefarbene gepresste Pulverarzneimittelmatrix vor, die mit essbarem Klebstoff an einem bruchfesten strahlenundurchlässigen Applikator aus Kunststoff angebracht ist, auf dem die Wirkstärke angegeben ist.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Actiq ist für die Behandlung von Durchbruchschmerzen bei Patienten bestimmt, deren chronische Tumorschmerzen bereits mit Opioiden als Basistherapie behandelt werden. Durchbruchschmerzen manifestieren sich als vorübergehende Exazerbation von chronischen Schmerzen, die ansonsten unter Kontrolle gebracht sind.
Zu den Patienten, die eine Opioid-Basistherapie erhalten, werden diejenigen gezählt, die mindestens 60 mg orales Morphin täglich, mindestens 25 Mikrogramm transdermales Fentanyl pro Stunde, mindestens 30 mg Oxycodon täglich, mindestens 8 mg orales Hydromorphon täglich oder eine analgetisch gleichwertige Dosis eines anderen Opioids über eine Woche oder länger erhalten.
1/13
Zur Minimierung der Risiken Opioid-bedingter Nebenwirkungen und zur Bestimmung der "erfolgreichen" Dosis ist die engmaschige ärztliche Kontrolle der Patienten in der Titrationsphase unbedingt erforderlich.
Actiq ist nicht auf Basis der gleichen Dosierung (pg zu pg) mit anderen zur Behandlung von Durchbruchschmerzen zugelassenen kurzwirksamen Fentanyl-Präparaten austauschbar, da sich die pharmakokinetischen Profile und/oder Dosierschemata für diese Produkte signifikant unterscheiden. Die Patienten sollten angewiesen werden, für die Behandlung von Durchbruchschmerzen jeweils nur ein kurzwirksames Fentanyl-Präparat anzuwenden. Andere Fentanyl-Präparate zur Behandlung von Durchbruchschmerzen sollten daher abgesetzt werden, wenn die Behandlung auf Actiq umgestellt wird. Es sollte dem Patienten nur eine minimale Anzahl an verschiedenen Actiq-Wirkstärken gleichzeitig zur Verfügung stehen, um eine Verwechslung und mögliche Überdosierung zu verhindern.
Alle nicht verwendeten Actiq-Lutschtabletten, die der Patient nicht mehr benötigt, müssen ordnungsgemäß entsorgt werden. Die Patienten müssen daran erinnert werden, Actiq für Kinder unzugänglich aufzubewahren.
Art der Anwendung
Actiq ist zur Anwendung in der Mundhöhle bestimmt. Aus diesem Grund sollte es im Mund an die Wange gelegt und mit Hilfe des Applikators im Mund hin und her bewegt werden, um den Kontakt der Schleimhaut mit dem Produkt zu maximieren. Actiq sollte gelutscht und nicht gekaut werden, da die Resorption von Fentanyl über die Wangenschleimhaut im Vergleich zur systemischen Resorption über den Magen-Darm-Trakt schnell erfolgt. Patienten, die unter Mundtrockenheit leiden, können die Wangenschleimhaut mit Wasser anfeuchten.
Die Actiq-Lutschtablette sollte über einen Zeitraum von 15 Minuten angewendet werden. Wenn Zeichen übermäßiger Opioid-Wirkungen auftreten bevor die Actiq-Lutschtablette vollständig aufgebraucht ist, sollte Actiq sofort aus dem Mund entfernt werden, und es sollte in Erwägung gezogen werden, künftig die Dosierung zu reduzieren.
Erwachsene
Dosistitration und Erhaltungstherapie
Actiq sollte individuell auf eine "erfolgreiche" Dosis eingestellt werden, die für eine ausreichende Schmerzlinderung sorgt und Nebenwirkungen minimiert. In klinischen Studien konnte die erfolgreiche Dosis von Actiq gegen Durchbruchschmerzen anhand der täglichen Erhaltungsdosis des Opioids nicht vorhergesagt werden.
a) Titration
Bevor die Patienten auf Actiq eingestellt werden, wird davon ausgegangen, dass die vorbestehenden chronischen Schmerzen durch eine Opioid-Therapie unter Kontrolle gebracht sind und dass in der Regel höchstens vier Episoden mit Durchbruchschmerzen pro Tag auftreten.
Die Anfangsdosis von Actiq sollte 200 Mikrogramm betragen, wobei die Dosis nach Bedarf schrittweise durch die Palette der verfügbaren Wirkstärken (200, 400, 600, 800, 1200 und 1600 Mikrogramm) hochtitriert wird. Die Patienten sollten sorgfältig überwacht werden, bis eine Dosis erreicht ist, die mit einer einzelnen Lutschtablette pro Durchbruchschmerzepisode bei akzeptablen Nebenwirkungen ausreichend schmerzstillend wirkt. Diese Dosis wird als erfolgreiche Dosis bezeichnet.
Wenn in der Titrationsphase nicht innerhalb von 30 Minuten nach Anbruch der ersten Lutschtablette (d. h. 15 Minuten nach vollständiger Aufnahme einer einzelnen Actiq-Lutschtablette) eine ausreichende Analgesie erreicht wird, kann eine zweite Actiq-Lutschtablette der gleichen Wirkstärke angewendet werden. Zur Behandlung einer einzelnen Schmerzepisode sollten nicht mehr als zwei
Actiq-Lutschtabletten verwendet werden. Bei einer Dosis von 1600 Mikrogramm werden vermutlich nur wenige Patienten eine zweite Dosis benötigen.
Wenn zur Behandlung von aufeinanderfolgenden Episoden von Durchbruchschmerzen pro Episode mehr als eine Lutschtablette benötigt wird, sollte eine Erhöhung der Dosis auf die nächst höhere verfügbare Wirkstärke in Erwägung gezogen werden.
Actiq Dosistitration
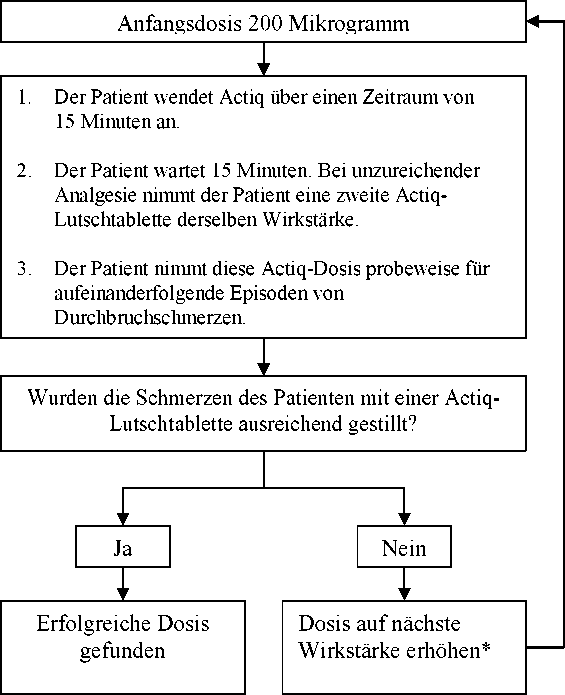
* Verfügbare Wirkstärken: 200, 400, 600, 800, 1200 und 1600 Mikrogramm b) Erhaltungstherapie
Sobald eine erfolgreiche Dosis gefunden wurde (d. h. wenn durchschnittlich eine einzelne Lutschtablette zur wirksamen Behandlung einer Episode ausreicht), sollten die Patienten auf dieser Dosis gehalten werden, und der Verbrauch sollte auf eine Höchstmenge von vier Actiq-Lutschtabletten pro Tag beschränkt werden.
Die Patienten sollten ärztlich überwacht werden, um sicherzustellen, dass die Höchstmenge von vier Actiq-Lutschtabletten pro Tag nicht überschritten wird.
Erneute Dosisanpassung
Die Actiq-Erhaltungsdosis sollte dann erhöht werden, wenn mehrere aufeinander folgende Schmerzepisoden mit einer einzelnen Lutschtablette nicht wirksam behandelt werden können. Für die erneute Dosisanpassung gilt die gleiche Vorgehensweise wie unter „a) Titration“ angegeben. Wenn pro Tag mehr als vier Durchbruchschmerzepisoden auftreten, sollte die Dosis des zur Behandlung der chronischen Schmerzen verwendeten langwirksamen Opioids überprüft werden. Wird die Dosis des langwirksamen Opioids erhöht, sollte die zur Behandlung von Durchbruchschmerzen verwendete Dosierung von Actiq gegebenenfalls überprüft werden.
Es ist zwingend erforderlich, dass jede erneute Dosisanpassung eines Schmerzmittels unter ärztlicher Aufsicht erfolgt.
Therapiebeendigung
Wenn die Therapie mit Actiq zur Behandlung von Durchbruchschmerzen nicht mehr benötigt wird, kann sie in der Regel sofort abgebrochen werden, aber nur bei Patienten, die sich wegen ihrer chronischen Schmerzen weiterhin ihrer langfristigen Opioid-Therapie unterziehen.
Bei Patienten, bei denen die gesamte Opioid-Therapie abgesetzt werden muss, sollte die Actiq-Dosis bei der allmählichen Senkung der Opioid-Dosis berücksichtigt werden, um ein mögliches Auftreten abrupter Entzugserscheinungen zu vermeiden.
Anwendung bei älteren Patienten
Ältere Patienten reagieren nachweislich empfindlicher auf die Wirkungen intravenös verabreichten Fentanyls. Die Dosistitration muss daher mit besonderer Sorgfalt erfolgen. Bei älteren Patienten wird Fentanyl langsamer eliminiert, und die terminale Eliminationshalbwertszeit ist länger, was zu einer Akkumulation des arzneilich wirksamen Bestandteils und zu einem höheren Risiko für Nebenwirkungen führen kann.
Speziell auf ältere Patienten ausgerichtete klinische Studien mit Actiq wurden nicht durchgeführt. Es wurde in klinischen Studien jedoch beobachtet, dass über 65-jährige Patienten zur erfolgreichen Linderung von Durchbruchschmerzen niedrigere Actiq-Dosen benötigten.
Anwendung bei Patienten mit Leber- oder Nierenfunktionsstörungen
Bei Patienten mit Nieren- oder Leberfunktionsstörungen sollte die Titration mit besonderer Sorgfalt vorgenommen werden (siehe Abschnitt 4.4).
Kinder und Jugendliche
Kinder ab 16 Jahren: Siehe Dosierung bei Erwachsenen.
Kinder von 2 bis 16 Jahren:
Die klinischen Daten zur Anwendung von Actiq bei Kindern unter Opioid-Basistherapie sind begrenzt (siehe Abschnitte 5.1 und 5.2). Die Unbedenklichkeit und Wirksamkeit bei Kindern unter 16 Jahren ist nicht nachgewiesen; daher wird Actiq für die Anwendung bei dieser Altersgruppe nicht empfohlen.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen Fentanyl oder einen der sonstigen Bestandteile.
- Patienten ohne Opioid-Basistherapie, da dies mit einem erhöhten Risiko für eine Atemdepression einhergeht.
- Behandlung akuter Schmerzen, die keine Durchbruchschmerzen sind.
- Gleichzeitige Anwendung von Monoaminoxidase (MAO)-Hemmern oder innerhalb von zwei Wochen nach Beendigung einer Therapie mit MAO-Hemmern.
- Schwerwiegende Ateminsuffizienz oder schwerwiegende obstruktive Lungenerkrankungen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Patienten und ihre Betreuungspersonen müssen darüber in Kenntnis gesetzt werden, dass Actiq einen Wirkstoff in einer Menge enthält, die für ein Kind tödlich sein kann. Es wurde über Todesfälle bei Kindern berichtet, die versehentlich Actiq eingenommen haben.
Die Patienten und ihre Betreuungspersonen müssen darauf hingewiesen werden, alle Lutschtabletten für Kinder unzugänglich aufzubewahren und angebrochene oder nicht verwendete Lutschtabletten ordnungsgemäß zu entsorgen. Jeder ambulante Patient sollte dahingehend beurteilt werden, ob versehentlich Kinder mit dem Arzneimittel in Berührung kommen könnten.
Dieses Arzneimittel darf nicht bei Patienten angewendet werden, die keine Opioid-Basistherapie erhalten, da dies mit einem erhöhten Risiko für eine Atemdepression und Todesfälle verbunden ist.
Es ist wichtig, dass vor Beginn der Therapie mit Actiq die zur Behandlung der Dauerschmerzen des Patienten verwendete Opioid-Basistherapie stabilisiert wurde, und dass der Patient während der Einnahme von Actiq die Opioid-Basistherapie weiterführt.
Wie bei allen Opioiden kann auch bei der Anwendung von Fentanyl Toleranzentwicklung und physische und/oder psychische Abhängigkeit auftreten. Eine iatrogene Suchtentwicklung in Folge einer therapeutischen Anwendung von Opioiden ist jedoch selten. Das Risiko wird bei Krebspatienten mit Durchbruchschmerzen als gering eingestuft, jedoch kann es bei Patienten mit Arzneimittel-/ Drogen- oder Alkoholmissbrauch in der Vorgeschichte möglicherweise erhöht sein.
Alle Patienten unter Opioid-Therapie sollten sorgfältig auf Anzeichen von Missbrauch und Abhängigkeit überwacht werden.
Wie bei allen Opioiden besteht auch bei Anwendung von Actiq das Risiko einer klinisch signifikanten Atemdepression. Bei der Dosistitration mit Actiq sollte daher bei Patienten mit nicht schwerwiegender chronisch obstruktiver Lungenerkrankung oder anderen Erkrankungen, die mit einer Anfälligkeit für Atemdepression einhergehen, mit besonderer Sorgfalt vorgegangen werden, da bei diesen Patienten schon normale therapeutische Dosen von Actiq den Atemantrieb soweit erniedrigen können, dass eine Ateminsuffizienz eintritt.
Bei Patienten, die auf die intrakraniellen Wirkungen einer CO2-Retention besonders empfindlich reagieren können, beispielsweise Patienten mit Hinweisen auf erhöhten intrakraniellen Druck oder mit Bewusstseinsstörungen, sollte Actiq nur mit äußerster Vorsicht angewendet werden.
Bei Patienten mit Kopfverletzungen können Opioide den klinischen Verlauf der Therapie verschleiern und sollten daher nur verabreicht werden, wenn dies klinisch angezeigt ist.
Fentanyl kann Bradykardien hervorrufen. Bei Patienten mit früheren oder vorbestehenden Bradyarrhythmien sollte Fentanyl mit Vorsicht angewendet werden.
Darüber hinaus sollte Actiq bei Patienten mit Leber- oder Nierenfunktionsstörungen mit Vorsicht angewendet werden. Der Einfluss einer Funktionsstörung der Leber oder der Niere auf die Pharmakokinetik des Arzneimittels wurde bislang nicht untersucht; bei intravenöser Verabreichung war die Clearance von Fentanyl bei Leber- und Nierenerkrankungen jedoch aufgrund von Veränderungen der metabolischen Clearance und der Plasmaproteine verändert. Nach Verabreichung von Actiq kann durch eine Leber- oder Nierenfunktionsstörung sowohl die Bioverfügbarkeit von eingenommenem Fentanyl erhöht, als auch dessen systemische Clearance verringert werden, was zu verstärkten und verlängerten Opioid-Wirkungen führen könnte. Bei Patienten mit mäßigen oder schweren Leber- oder Nierenerkrankungen sollte daher in der Titrationsphase mit besonderer Vorsicht vorgegangen werden.
Besondere Vorsicht ist bei Patienten mit Hypovolämie und Hypotonie geboten.
Diabetiker sollten darüber in Kenntnis gesetzt werden, dass das Arzneimittel Dextrate enthält (Dextrate bestehen zu 93 % aus Glucose-Monohydrat und zu 7 % aus Maltodextrin. Die Glucosegesamtbelastung beträgt etwa 1,89 Gramm pro Lutschtablette).
Patienten mit der seltenen hereditären Fructose-/Galactose-Intoleranz, einer Glucose-Galactose-Malabsorption oder einer Sucrase-Isomaltase-Insuffizienz sollten dieses Arzneimittel nicht anwenden.
Zur Verminderung möglicher Zahnschäden wird eine normale Mundhygiene empfohlen. Da Actiq ca. 2 Gramm Zucker enthält, erhöht eine häufige Anwendung das Karies-Risiko. Das Auftreten von Opioid-assoziierter Mundtrockenheit trägt möglicherweise zu diesem erhöhten Risiko bei.
Vorsicht ist geboten, wenn Actiq zusammen mit Arzneimitteln angewendet wird, die die serotonergen Neurotransmittersysteme beeinflussen.
Die Entstehung eines potentiell lebensbedrohlichen Serotonin-Syndroms kann mit der gleichzeitigen Anwendung von serotonergen Arzneimitteln, wie selektiven Serotonin-Wiederaufnahmehemmern (SSRI) und Serotonin-Noradrenalin-Wiederaufnahmehemmern (SNRI) sowie mit Arzneimitteln, welche den Metabolismus von Serotonin beeinträchtigen (einschließlich Monoaminooxidasehemmern (MAOH)), auftreten. Dies kann im Rahmen der empfohlenen Dosierung auftreten.
Das Serotonin-Syndrom kann Bewusstseinsänderungen (z. B. Agitation, Halluzinationen, Koma), autonome Instabilität (z. B. Tachykardie, instabilen Blutdruck, Hyperthermie), neuromuskuläre Veränderungen (z. B. Hyperreflexie, Koordinationsstörung, Rigidität) und/oder gastrointestinale Symptome (z. B. Nausea, Erbrechen, Diarrhö) beinhalten.
Falls ein Serotonin-Syndrom vermutet wird, sollte die Behandlung mit Actiq abgebrochen werden. Doping
Die Anwendung von Actiq kann bei Dopingkontrollen zu positiven Ergebnissen führen. Die Anwendung von Actiq als Dopingmittel kann zu einer Gefährdung der Gesundheit führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Fentanyl wird in der Leber und der Mukosa des Magen-Darm-Trakts durch das CYP3A4-Isoenzym metabolisiert. Potente Hemmer von CYP3A4 wie Antibiotika vom Typ der Makrolide (wie z. B. Erythromycin), Azol-Antimykotika (wie z. B. Ketoconazol, Itraconazol und Fluconazol) und bestimmte Proteaseinhibitoren (wie z. B. Ritonavir) können die Bioverfügbarkeit des geschluckten Fentanyls erhöhen und auch dessen systemische Clearance verringern, was verstärkte oder länger anhaltende Opioid-Wirkungen hervorrufen kann. Ähnliche Wirkungen könnten sich auch nach gleichzeitiger Einnahme von Grapefruitsaft zeigen, der bekanntlich CYP3A4 hemmt. Daher ist Vorsicht geboten, wenn Fentanyl gleichzeitig mit CYP3A4-Inhibitoren angewendet wird.
Die gemeinsame Verabreichung mit Wirkstoffen, die eine 3A4-Aktivität induzieren, kann zu einer erniedrigten Wirksamkeit von Actiq führen.
Die gleichzeitige Anwendung anderer ZNS-dämpfender Arzneimittel wie andere Opioide, Sedativa oder Hypnotika, Allgemeinanästhetika, Phenothiazine, Tranquilizer, Skelettmuskelrelaxantien, sedierende Antihistaminika und Alkohol kann zu zusätzlichen sedierenden Wirkungen führen.
Durch Verabreichung von Arzneimitteln mit Opioid-antagonistischer Wirkung, z. B. Naloxon, oder Analgetika mit gemischter Agonisten-/Antagonistenwirkung (z. B. Pentazocin, Butorphanol, Buprenorphin, Nalbuphin) können Entzugserscheinungen ausgelöst werden.
Die gleichzeitige Anwendung von Fentanyl mit einem serotonergen Wirkstoff, wie z. B. einem selektiven Serotonin-Wiederaufnahmehemmer (SSRI), einem Serotonin-Noradrenalin-Wieder-aufnahmehemmer (SNRI) oder einem Monoaminooxidasehemmer (MAOH) kann das Risiko eines Serotonin-Syndroms, eines potentiell lebensbedrohenden Zustands, erhöhen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Zur Anwendung von Fentanyl bei Schwangeren liegen keine hinreichenden Daten vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). OpioidAnalgetika können eine Atemdepression beim Neugeborenen hervorrufen. Bei Langzeitanwendung während der Schwangerschaft besteht das Risiko neonataler Entzugserscheinungen. Actiq sollte während einer Schwangerschaft nicht angewendet werden, außer wenn es eindeutig notwendig ist.
Es wird davon abgeraten, Fentanyl während der Geburt anzuwenden, da es die Plazentaschranke durchdringt und beim Foetus zu einer Atemdepression führen kann. Das plazentare Transferverhältnis beträgt 0,44 (Verhältnis Foetus : Mutter 1,00 : 2,27).
Fentanyl geht in die Muttermilch über und kann beim gestillten Kind eine Sedierung und Atemdepression hervorrufen. Fentanyl soll von stillenden Frauen nicht angewendet werden und das Stillen sollte frühestens 48 Stunden nach der letzten Fentanylgabe wieder aufgenommen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Opioid-Analgetika können jedoch die geistigen und/oder physischen Fähigkeiten herabsetzen, die zur Ausübung potenziell gefährlicher Aufgaben notwendig sind (z. B. Führen eines Fahrzeugs oder Bedienen von Maschinen). Die Patienten sollten angewiesen werden, kein Fahrzeug zu führen und keine Maschinen zu bedienen, wenn sie bei Anwendung von Actiq Schläfrigkeit, Schwindel, verschwommenes Sehen oder Doppelsehen bemerken.
4.8 Nebenwirkungen
Bei der Anwendung von Actiq sind typische Opioid-Nebenwirkungen zu erwarten. Häufig verschwinden diese bei fortgesetzter Anwendung des Präparats oder verlieren an Intensität, während der Patient auf die am besten geeignete Dosis eingestellt wird. Die schwerwiegendsten Nebenwirkungen sind Atemdepression (die möglicherweise zu Apnoe oder Atemstillstand führt), Kreislaufdepression, Hypotonie und Schock; alle Patienten sollten diesbezüglich genau überwacht werden.
Seit der Markteinführung wurde über Nebenwirkungen am Applikationsort wie Zahnfleischbluten, Reizung, Schmerzen und Ulzeration berichtet.
Da die klinischen Studien mit Actiq geplant wurden, um Unbedenklichkeit und Wirksamkeit bei der Behandlung von Durchbruchschmerzen zu beurteilen, erhielten alle Patienten gegen ihre chronischen Schmerzen gleichzeitig auch andere Opioide, wie z. B. Morphin mit verzögerter Freisetzung oder transdermales Fentanyl. Es ist daher nicht möglich, die Wirkungen von Actiq allein eindeutig von den Wirkungen der anderen Opioide abzugrenzen.
Die folgenden Nebenwirkungen wurden während der Behandlung mit Actiq und/oder anderen Fentanyl-haltigen Präparaten in klinischen Studien sowie bei der Anwendung seit Erteilung der Zulassung berichtet.
Die Nebenwirkungen sind unten nach Systemorganklassen und Häufigkeit gemäß MedDRA-Konvention geordnet aufgeführt.
Die Häufigkeiten sind wie folgt definiert:
Sehr häufig (>1/10), häufig (>1/100- <1/10), gelegentlich (>1/1.000- <1/100), selten (>1/10.000-<1/1.000), sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar):
Erkrankungen des Immunsystems
Nicht bekannt: Anaphylaktische Reaktion, Zungenödem, Lippenödem
Stoffwechsel- und Ernährungsstörungen
Häufig: Appetitlosigkeit
Psychiatrische Erkrankungen
Häufig: Verwirrtheit, Angst, Halluzinationen, Depressionen, emotionale Labilität
Gelegentlich: Albträume, Depersonalisierung, Denkstörungen, Euphorie
Erkrankungen des Nervensystems
Sehr häufig: Schläfrigkeit, Schwindelgefühl, Kopfschmerzen
Häufig: Bewusstlosigkeit, Krampfanfälle, Schwindel, Myoklonien, Sedierung,
Parästhesien (einschließlich Hyperästhesie/periorale Parästhesien), abnormer Gang/Koordinationsstörungen, Geschmacksstörungen Gelegentlich: Koma, schleppende Sprache
Augenerkrankungen
Häufig: Sehstörungen (verschwommenes Sehen, Doppelsehen)
Gefäßerkrankungen
Gelegentlich: Vasodilatation Nicht bekannt: Flush, Hitzewallungen
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Dyspnoe
Nicht bekannt: Pharynxödem, Atemdepression
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit, Erbrechen, Obstipation, Bauchschmerzen
Häufig: Mundtrockenheit, Dyspepsie, Stomatitis, Zungenerkrankungen (z. B. Brennen,
Ulzera), Blähungen, aufgetriebenes Abdomen Gelegentlich: Ileus, Mundulzera, Karies, Zahnfleischbluten Nicht bekannt: Zahnverlust, Zahnfleischschwund, Gingivitis, Diarrhoe
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Juckreiz, Schwitzen, Ausschlag
Gelegentlich: Urtikaria
Erkrankungen der Nieren und Harnwege
Häufig: Harnverhalten
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Asthenie
Häufig: Reaktionen an der Applikationsstelle einschließlich Reizungen, Schmerzen und
Ulzerationen, Unwohlsein Nicht bekannt: Fatigue, periphere Ödeme
Untersuchungen
Häufig: Gewicht erniedrigt
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Häufig: Unfallbedingte Verletzungen (z. B. durch Stürze)
4.9 Überdosierung
Es ist davon auszugehen, dass die Symptome einer Fentanyl-Überdosierung denen von intravenös verabreichtem Fentanyl und anderen Opioiden entsprechen und eine Verstärkung der pharmakologischen Wirkungen darstellen. Die schwerwiegendsten unerwünschten Wirkungen sind dabei ein veränderter Bewusstseinszustand, Bewusstlosigkeit, Koma, Herz-Kreislauf-Versagen, Atemdepression, Atemnot und Atemstillstand, die tödlich enden können.
Zur unmittelbaren Behandlung einer Opioid-Überdosierung muss die Actiq-Lutschtablette mittels des Applikators entfernt werden, falls sie sich noch im Mund befindet. Es muss sichergestellt werden, dass die Atemwege frei sind. Der Patient muss körperlich und verbal stimuliert, seine Bewusstseinslage und der Zustand von Atmung und Kreislauf müssen beurteilt werden und bei Bedarf muss mechanisch beatmet werden (assistierte Beatmung).
Zur Behandlung einer Überdosierung (versehentliches Verschlucken) bei Patienten, die noch nicht mit Opioiden vorbehandelt waren, ist ein intravenöser Zugang zu legen und je nach klinischer Indikation Naloxon oder andere Opioid-Antagonisten zu geben. Die durch die Überdosis verursachte Atemdepression kann länger andauern als die Wirkungen des Opioid-Antagonisten (z. B. liegt die Halbwertszeit von Naloxon im Bereich von 30 bis 81 Minuten), so dass eine wiederholte Verabreichung notwendig sein kann. Einzelheiten dazu sind in der Fachinformation des jeweiligen Opioid-Antagonisten zu finden.
Zur Behandlung einer Überdosierung bei Patienten unter einer Opioid-Basistherapie sollte ein intravenöser Zugang gelegt werden. In einigen Fällen kann die wohlüberlegte Anwendung von Naloxon oder einem anderen Opioid-Antagonisten angezeigt sein, dabei besteht jedoch das Risiko, ein akutes Entzugssyndrom auszulösen.
Obwohl nach Anwendung von Actiq kein Fall beobachtet wurde, bei dem ein die Atmung beeinträchtigender erhöhter Muskeltonus auftrat, besteht diese Möglichkeit nach Verabreichung von Fentanyl und anderen Opioiden. Wenn dieser Fall auftritt, sollte durch mechanische Beatmung, durch Verabreichung eines Opioid-Antagonisten und als letzte Alternative mit einem peripheren Muskelrelaxans behandelt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Opioid-Analgetikum, Phenylpiperidon-Derivat.
ATC-Code: N02A B03.
Der reine Opioid-Agonist Fentanyl wirkt primär durch Wechselwirkung mit p-Opioid-Rezeptoren im Gehirn, dem Rückenmark und der glatten Muskulatur. Der primäre Angriffspunkt der therapeutischen Wirkung ist das zentrale Nervensystem (ZNS). Die aus klinischer Sicht nützlichste pharmakologische Wirkung der Wechselwirkung von Fentanyl mit den p-Opioid-Rezeptoren ist die Analgesie. Die analgetische Wirkung von Fentanyl korreliert mit dem Blutspiegel des Wirkstoffs, unter Berücksichtigung der Verzögerung durch den Übergang in das bzw. aus dem ZNS (ein Prozess mit einer Halbwertszeit von 3-5 Minuten). Bei Patienten ohne Vorbehandlung mit Opioiden tritt die analgetische Wirkung bei Blutspiegeln von 1-2 ng/ml auf, während Blutspiegel von 10-20 ng/ml zu einer Allgemeinanästhesie und starker Atemdepression führen würden.
Bei Patienten mit chronischen Tumorschmerzen, die mit gleichbleibenden Dosen regelmäßig angewendeter Opioide wirksam eingestellt sind, erreichte Actiq 15, 30, 45 und 60 Minuten nach der Anwendung eine signifikant stärkere Linderung der Durchbruchschmerzen als Placebo.
Sekundäre Wirkungen sind u. a. ein Anstieg des Tonus und eine Verminderung der Kontraktionen der glatten Muskulatur im Magen-Darm-Trakt, was zu einer Verlängerung der Durchgangszeit im MagenDarm-Trakt führt und für die Opioid-bedingte Obstipation verantwortlich sein dürfte.
Während Opioide im Allgemeinen den Tonus der glatten Muskulatur im Harntrakt erhöhen, schwankt die Gesamtwirkung, wobei in einigen Fällen Harndrang und in anderen Fällen Schwierigkeiten beim Harnlassen ausgelöst werden.
Alle Opioid-p-Rezeptor-Agonisten, einschließlich Fentanyl, verursachen eine dosisabhängige Atemdepression. Das Risiko einer Atemdepression ist bei Schmerzpatienten und bei Patienten unter Opioid-Langzeittherapie geringer, da hier eine Toleranzentwicklung gegenüber Atemdepression und anderen Opioid-Wirkungen eintritt. Bei Personen ohne Toleranzentwicklung treten die stärksten Wirkungen auf den Respirationstrakt in der Regel 15-30 Minuten nach Anwendung von Actiq auf und können mehrere Stunden lang anhalten.
Die Erfahrung zur Anwendung von Actiq bei Kindern unter 16 Jahren ist begrenzt. In einer klinischen Studie wurden 15 Kinder (von 38) unter Opioid-Basistherapie und mit Durchbruchschmerzen im Alter von 5-15 Jahren mit Actiq behandelt. Die Studie war zu klein, um Rückschlüsse auf die Unbedenklichkeit und Wirksamkeit in dieser Patientengruppe zu erlauben.
5.2 Pharmakokinetische Eigenschaften
Allgemeine Einführung
Fentanyl ist stark lipophil und kann sehr rasch über die Mundschleimhaut sowie langsamer über den herkömmlichen gastrointestinalen Weg absorbiert werden. Es unterliegt einem First-PassMetabolismus in der Leber und dem Darm; die Metaboliten tragen nicht zu den therapeutischen Wirkungen des Fentanyls bei.
Resorption
Die Resorptionspharmakokinetik von Fentanyl aus Actiq besteht aus dem Zusammenspiel einer schnellen Resorption durch die Mundschleimhaut und einer langsameren Resorption von geschlucktem Fentanyl aus dem Magen-Darm-Trakt. Etwa 25 % der Gesamtdosis von Actiq werden schnell über die Wangenschleimhaut resorbiert. Die restlichen 75 % der Gesamtdosis werden geschluckt und langsam aus dem Magen-Darm-Trakt resorbiert. Etwa 1/3 dieser Menge (25 % der Gesamtdosis) wird nicht über einen First-Pass-Effekt in der Leber oder im Darm eliminiert und wird systemisch verfügbar. Die absolute Bioverfügbarkeit im Vergleich zu intravenös verabreichtem Fentanyl beträgt etwa 50 %, die sich zu gleichen Teilen aus der schnellen Resorption über die Mundschleimhaut und der langsameren Resorption aus dem Magen-Darm-Trakt zusammensetzen.
Cmax liegt nach Einnahme von Actiq (200 Mikrogramm bis 1600 Mikrogramm) zwischen 0,39 und 2,51 ng/ml. Tmax beträgt nach Einnahme einer Actiq-Lutschtablette zwischen 20 und 40 Minuten (Bereich 20-480 Minuten).
Verteilung
Tierexperimentelle Daten zeigen, dass Fentanyl zunächst schnell in Gehirn, Herz, Lunge, Nieren und Milz verteilt und dann langsamer in Muskeln und Fett umverteilt wird. Die Plasmaproteinbindung von Fentanyl beträgt 80-85 %. Das wichtigste Bindungsprotein ist das saure Alpha-1-Glykoprotein, aber auch Albumin und Lipoproteine tragen bis zu einem gewissen Maß dazu bei. Der freie Anteil von Fentanyl steigt bei Azidose. Das mittlere Verteilungsvolumen im Steady state (Vss) beträgt 4 l/kg.
Biotransformation
Fentanyl wird in der Leber und in der Darmschleimhaut über CYP3A4 zu Norfentanyl metabolisiert. In tierexperimentellen Studien ist Norfentanyl pharmakologisch nicht aktiv. Über 90 % der verabreichten Fentanyldosis wird durch Biotransformation zu N-desalkylierten und -hydroxylierten inaktiven Metaboliten eliminiert.
Elimination
Weniger als 7 % der Dosis wird unverändert mit dem Harn ausgeschieden, und nur ca. 1 % wird unverändert mit den Faeces ausgeschieden. Die Metaboliten werden hauptsächlich im Harn ausgeschieden, während die fäkale Ausscheidung eine geringere Rolle spielt. Die Gesamtplasmaclearance von Fentanyl liegt bei 0,5 l/h/kg (Bereich 0,3-0,7 l/h/kg). Die terminale Eliminationshalbwertszeit nach Anwendung von Actiq beträgt ca. 7 Stunden.
Linearität/Nicht-Linearität
Die Dosisproportionalität über den Bereich der zur Verfügung stehenden Wirkstärken von Actiq (200 Mikrogramm bis 1600 Mikrogramm) wurde nachgewiesen.
Kinder
In einer klinischen Studie wurden 15 Kinder im Alter von 5-15 Jahren unter Opioid-Basistherapie und mit Durchbruchschmerzen mit Actiq bei Dosierungen von 200 pg bis 600 pg behandelt. Die auf den untersuchten Konzentrationen basierenden AUC-Werte waren bei jüngeren Kindern doppelt so hoch wie bei Jugendlichen (5,25 versus 2,65 ngh/ml) und viermal so hoch wie bei Erwachsenen (5,25 versus 1,20 ngh/ml). Unter Berücksichtigung des Körpergewichts waren Clearance und Verteilungsvolumen in diesen Altersgruppen vergleichbar.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Verabreichung, Genotoxizität und Kanzerogenität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Studien zur embryo-fetalen Entwicklung an Ratten und Kaninchen zeigten keine Substanz-induzierten Missbildungen oder Entwicklungsstörungen bei Verabreichung während der Organogenese.
In einer Studie zur Fertilität und frühen embryonalen Entwicklung an Ratten wurde bei hohen Dosierungen (300 pg/kg/Tag, s.c.) ein durch die männlichen Tiere vermittelter Effekt beobachtet. Dieser Effekt stimmt mit den sedierenden Wirkungen von Fentanyl im Tierversuch überein. In Studien zur prä- und postnatalen Entwicklung an Ratten war bei ausgeprägt maternal toxischen Dosierungen die Überlebensrate der Nachkommen signifikant herabgesetzt. Weitere Befunde nach Verabreichung von maternal toxischen Dosen waren bei F1-Jungtieren eine Verzögerung der physischen Entwicklung, der sensorischen Funktionen, der Reflexe und des Verhaltens. Diese Effekte könnten entweder indirekt durch ein verändertes Pflegeverhalten der Mutter und/oder eine verminderte Milchproduktion oder durch eine direkte Wirkung von Fentanyl auf die Jungtiere ausgelöst worden sein.
Kanzerogenitätsstudien mit Fentanyl ergaben keine Hinweise auf ein krebsauslösendes Potenzial (26-wöchiger alternativer Haut-Bioassay an transgenen Tg-AC-Mäusen; 2-jährige Kanzerogenitätsstudie an Ratten mit subkutaner Applikation). Bei der Untersuchung von Hirnschnitten aus der Kanzerogenitätsstudie an Ratten wurden bei Tieren, die hohe Dosen Fentanylcitrat erhalten hatten, Hirnläsionen festgestellt. Die Bedeutung dieser Befunde für den Menschen ist nicht bekannt.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Lutschtablette:
Stärkehydrolysat (enthält Glucose)
Citronensäure
Dinatriumhydrogenphosphat
Künstliches Beerenaroma (Maltodextrin, Propylenglycol, künstliche Aromastoffe und Triethylcitrat) Magnesiumstearat
Essbarer Klebstoff, der verwendet wird, um die Lutschtablette am Stiel zu befestigen: Poly-{O-[hydrogen-(oct-1-en-1-yl)succinyl]stärke}, Natriumsalz (E 1450)
Puderzucker (Sucrose (Saccharose) und Maisstärke)
Gereinigtes Wasser
Druckfarbe:
Gereinigtes Wasser
Entwachster weißer Schellack Propylenglycol Brillantblau FCF (E 133)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30 °C lagern.
6.5 Art und Inhalt des Behältnisses
Jede Actiq-Lutschtablette ist in einer hitzeversiegelten Blisterpackung enthalten, die aus einem mit Papier und Folie laminierten Deckel und einem thermogeformten Blister aus PVC/Aclar besteht. Sie wird in Umkartons zu 3 oder 30 Lutschtabletten verpackt.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Lutschtabletten mit restlichem Wirkstoff sollten niemals weggeworfen oder verlegt werden. Gebrauchtes oder ungebrauchtes aber nicht länger benötigtes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
TEVA GmbH Graf-Arco-Str. 3 89079 Ulm
8. ZULASSUNGSNUMMERN
Actiq 200 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der
Mundhöhle
51724.00.00
Actiq 400 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
51724.01.00
Actiq 600 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
51724.02.00
Actiq 800 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
51724.03.00
Actiq 1200 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
51724.04.00
Actiq 1600 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung in der Mundhöhle
51724.05.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 28. September 2001 Datum der letzten Verlängerung der Zulassung: 08. Oktober 2010
10. STAND DER INFORMATION
September 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Betäubungsmittel
13/13