Actiq 800 Mikrogramm Lutschtablette, Gepresst, Mit Integriertem Applikator Zur Anwendung In Der Mundhöhle
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
Actiq 200 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung
in der Mundhöhle
Actiq 400 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung
in der Mundhöhle
Actiq 600 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung
in der Mundhöhle
Actiq 800 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung
in der Mundhöhle
Actiq 1200 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung
in der Mundhöhle
Actiq 1600 Mikrogramm Lutschtablette, gepresst, mit integriertem Applikator zur Anwendung
in der Mundhöhle
Fentanyl
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses
Arzneimittels beginnen.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
• Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
• Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker.
Diese Packungsbeilage beinhaltet:
1. Was ist Actiq und wofür wird es angewendet?
2. Was müssen Sie vor der Anwendung von Actiq beachten?
3. Wie ist Actiq anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Actiq aufzubewahren?
6. Weitere Informationen
1. WAS IST ACTIQ UND WOFÜR WIRD ES ANGEWENDET?
Actiq enthält den Wirkstoff Fentanyl, ein starkes Schmerzmittel, das als Opioid bezeichnet wird.
Actiq besteht aus einer Lutschtablette, die an einem Stiel befestigt ist.
• Actiq wird zur Behandlung von Durchbruchschmerzen bei erwachsenen Krebspatienten angewendet, die gegen ihre chronischen (andauernden) Tumorschmerzen bereits andere OpioidSchmerzmittel anwenden. Durchbruchschmerzen sind zusätzliche Schmerzen, die plötzlich auftreten, obwohl Sie Ihre gewohnten Opioid-Schmerzmittel eingenommen/angewendet haben.
• Sie dürfen Actiq nur anwenden, wenn Sie gegen Ihre chronischen (andauernden) Schmerzen ein vom Arzt verschriebenes Opioid-Arzneimittel regelmäßig jeden Tag über mindestens eine Woche angewendet haben. Wenn Sie solche Arzneimittel nicht anwenden, kann Actiq das Risiko für eine verlangsamte oder flache Atmung bis hin zum Atemstillstand erhöhen.
• Verwenden Sie Actiq nicht zur Behandlung von Schmerzen durch Verletzungen, Operationen, Kopfschmerzen oder Migräne.
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON ACTIQ BEACHTEN?
Actiq darf nicht angewendet werden,
• wenn Sie zur Behandlung Ihrer Dauerschmerzen nicht regelmäßig ein verordnetes Opioid (z. B. Codein, Fentanyl, Hydromorphon, Morphin, Oxycodon, Pethidin) jeden Tag nach einem festen
Dosierplan über mindestens eine Woche eingenommen haben. Wenn Sie diese Arzneimittel nicht erhalten haben, dürfen Sie Actiq nicht einnehmen, da dies ansonsten das Risiko für eine gefährlich verlangsamte und/oder flache Atmung oder sogar einen Atemstillstand erhöhen kann.
• wenn Sie überempfindlich (allergisch) gegen Fentanyl oder einen der sonstigen Bestandteile von Actiq sind (siehe Abschnitt 6).
• wenn Sie momentan Monoaminoxidase (MAO)-Hemmer, bestimmte Arzneimittel gegen schwere Depressionen, einnehmen (oder in den vergangenen 2 Wochen eingenommen haben).
• wenn Sie unter schweren Atemproblemen oder einer schweren Lungenerkrankung mit einer Einengung der Atemwege leiden.
• wenn Sie unter kurzzeitigem Schmerz (aber keinem Durchbruchschmerz) leiden.
Wenden Sie Actiq nicht an, wenn eine der oben genannten Situationen auf Sie zutrifft. Wenn Sie sich nicht sicher sind, fragen Sie Ihren Arzt oder Apotheker vor der Anwendung von Actiq um Rat.
Besondere Vorsicht bei der Anwendung von Actiq ist erforderlich
Wenden Sie das Opioid-Schmerzmittel, das Sie bereits gegen Ihre chronischen (andauernden) Schmerzen einnehmen, während der Behandlung mit Actiq weiter an.
Actiq wird für die Anwendung bei Kindern unter 16 Jahren nicht empfohlen.
Bitte sprechen Sie vor der Behandlung mit Actiq mit Ihrem Arzt oder Apotheker, wenn eine der folgenden Situationen auf Sie zutrifft:
• Wenn die Behandlung mit Ihrem anderen Opioid-Schmerzmittel, das Sie gegen Ihre chronischen (andauernden) Schmerzen einnehmen, noch nicht richtig eingestellt ist.
• Wenn Sie an einer Krankheit leiden, die Ihre Atmung beeinflusst (z. B. Asthma, pfeifende Atmung oder Kurzatmigkeit).
• Wenn Sie eine Kopfverletzung haben oder Bewusstlosigkeit erlitten haben.
• Wenn Sie Herzprobleme haben, insbesondere bei einem langsamen Herzschlag.
• Wenn Sie Leber- oder Nierenprobleme haben, da dadurch der Abbau des Arzneimittels in Ihrem Körper beeinflusst wird.
• Wenn Sie einen niedrigen Blutdruck aufgrund eines geringen Flüssigkeitsvolumens in Ihrem Kreislauf haben.
• Wenn Sie Diabetes haben.
• Wenn Sie über 65 Jahre alt sind - in diesem Fall werden Sie möglicherweise eine niedrigere Dosierung benötigen, und alle Dosiserhöhungen werden sehr sorgfältig von Ihrem Arzt überprüft.
• wenn Sie Antidepressiva oder Antipsychotika einnehmen, lesen Sie bitte den Abschnitt „Bei Anwendung von Actiq mit anderen Arzneimitteln“.
Auswirkungen bei Fehlgebrauch zu Dopingzwecken
• Die Anwendung des Arzneimittels Actiq kann bei Dopingkontrollen zu positiven Ergebnissen führen.
• Die Anwendung von Actiq als Dopingmittel kann zu einer Gefährdung der Gesundheit führen.
Bei Anwendung von Actiq mit anderen Arzneimitteln
Wenden Sie dieses Arzneimittel nicht an und informieren Sie Ihren Arzt oder Apotheker, wenn Sie folgende Arzneimittel anwenden:
• Andere Fentanyl-Präparate, die Ihnen in der Vergangenheit bereits gegen Ihre Durchbruchschmerzen verschrieben wurden; wenn Sie noch solche Fentanyl-Präparate zu Hause haben, informieren Sie sich bitte bei Ihrem Apotheker, wie diese zu entsorgen sind.
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden bzw. vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige oder pflanzliche Arzneimittel handelt. Es ist besonders wichtig, dass Sie Ihren Arzt oder Apotheker informieren, wenn Sie eines der folgenden Arzneimittel anwenden:
• Arzneimittel, die Sie schläfrig machen können - wie z. B. Schlaftabletten, Arzneimittel zur Behandlung von Angstzuständen, manche Arzneimittel gegen allergische Reaktionen (Antihistaminika) oder Beruhigungsmittel.
• Manche Muskelrelaxanzien (Arzneimittel gegen Muskelverspannungen) - wie z. B. Baclofen, Diazepam.
• Alle Arzneimittel, die den Abbau von Actiq in Ihrem Körper beeinflussen können - wie z. B. Ritonavir oder andere Arzneimittel zur Behandlung einer HIV-Infektion, andere sogenannte „CYP3A4-lnhibitoren“ - wie z. B. Ketoconazol, Itraconazol oder Fluconazol (Arzneimittel gegen Pilzinfektionen) und Troleandomycin, Clarithromycin oder Erythromycin (Arzneimittel gegen bakterielle Infektionen), und sogenannte „CYP3A4-lnduktoren“ wie z. B. Rifampicin oder Rifabutin (Arzneimittel gegen bakterielle Infektionen), Carbamazepin, Phenobarbital oder Phenytoin (Arzneimittel zur Behandlung von Krämpfananfällen).
• Arzneimittel, die die Wirkung von Actiq abschwächen oder umkehren können - wie z. B. Naloxon, Pentazocin, Buprenorphin; diese Arzneimittel können zu Entzugserscheinungen führen.
• Wenn Ihnen eine Operation bevorsteht, die die Anwendung eines Narkosemittels erfordert.
• Das Risiko für Nebenwirkungen steigt, wenn Sie Arzneimittel wie bestimmte Antidepressiva oder Antipsychotika einnehmen. Actiq kann Wechselwirkungen mit diesen Arzneimitteln eingehen, und es kann zu Veränderungen der psychischen Verfassung (z. B. Erregtheit, Halluzinationen, Koma) und anderen Wirkungen wie eine Körpertemperatur über 38 °C, eine Beschleunigung des Herzschlags, einen instabilen Blutdruck sowie gesteigerte Reflexe, Muskelsteife, Koordinationsmangel und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall) kommen. Ihr Arzt wird Ihnen mitteilen, ob Actiq für Sie geeignet ist.
Bei Anwendung von Actiq zusammen mit Nahrungsmitteln und Getränken
• Actiq kann vor oder nach den Mahlzeiten angewendet werden. Wenden Sie Actiq jedoch nicht während der Mahlzeiten an.
• Vor der Anwendung von Actiq können Sie etwas Wasser trinken, um Ihren Mund anzufeuchten. Während der Anwendung von Actiq dürfen Sie jedoch nichts trinken oder essen.
• Sie dürfen während der Behandlung mit Actiq keinen Grapefruitsaft trinken. Grapefruitsaft kann den Abbau von Actiq in Ihrem Körper beeinflussen.
• Trinken Sie keinen Alkohol während der Anwendung von Actiq. Alkohol kann das Risiko gefährlicher Nebenwirkungen erhöhen.
Schwangerschaft und Stillzeit
Sie sollten Actiq während der Schwangerschaft nicht anwenden, es sei denn, Sie haben dies mit Ihrem Arzt so besprochen. Sie sollten Actiq nicht während der Geburt anwenden, da Fentanyl beim Neugeborenen Atemschwierigkeiten verursachen kann. Bei längerfristiger Anwendung während der Schwangerschaft besteht außerdem das Risiko von Entzugserscheinungen beim Neugeborenen.
Fentanyl geht in die Muttermilch über und kann beim Säugling Nebenwirkungen hervorrufen. Wenden Sie Actiq in der Stillzeit nicht an. Das Stillen sollte frühestens 48 Stunden nach der letzten Dosis von Actiq wieder begonnen werden.
Wenn Sie schwanger sind oder stillen, fragen Sie bitte vor der Einnahme aller Arzneimittel Ihren Arzt oder Apotheker um Rat.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Dieses Arzneimittel kann Ihre Fähigkeit einschränken ein Fahrzeug zu führen oder Werkzeuge oder Maschinen zu bedienen. Fragen Sie Ihren Arzt, ob es sicher ist, wenn Sie in den ersten Stunden nach der Anwendung von Actiq ein Fahrzeug führen oder Werkzeuge oder Maschinen bedienen.
Sie dürfen sich nicht an das Steuer eines Fahrzeugs setzen und keine Werkzeuge oder Maschinen bedienen, wenn Sie sich schläfrig oder schwindelig fühlen; verschwommen oder doppelt sehen; Konzentrationsschwierigkeiten haben.
Es ist wichtig, dass Sie wissen, wie Sie auf Actiq reagieren, bevor Sie sich an das Steuer eines Fahrzeugs setzen oder Werkzeuge oder Maschinen bedienen.
Wichtige Informationen über bestimmte sonstige Bestandteile von Actiq
• Actiq enthält Glucose und Sucrose (zwei Arten von Zucker). Bitte wenden Sie Actiq erst nach Rücksprache mit Ihrem Arzt an, wenn Ihnen bekannt ist, dass Sie unter einer
Zuckerunverträglichkeit leiden, d. h. wenn Sie manche Arten von Zucker nicht vertragen bzw. verdauen können.
• Jede Lutschtablette enthält ca. 2 Gramm Glucose. Sie müssen dies berücksichtigen, wenn Sie Diabetes haben.
• Der Glucoseanteil in der Lutschtablette kann schädlich für die Zähne sein. Achten Sie immer darauf, Ihre Zähne regelmäßig zu putzen.
3. WIE IST ACTIQ ANZUWENDEN?
Bei der ersten Anwendung von Actiq wird Ihr Arzt mit Ihnen gemeinsam nach der Dosis suchen, die Ihre Durchbruchschmerzen lindern kann. Es ist sehr wichtig, dass Sie sich bei der Anwendung von Actiq genau an die Anweisungen Ihres Arztes halten.
• Ändern Sie nicht eigenmächtig die Dosierung von Actiq oder Ihren anderen Schmerzmitteln. Dosisänderungen müssen vom Arzt angeordnet und überprüft werden.
• Bitte sprechen Sie mit Ihrem Arzt, wenn Sie sich bezüglich der richtigen Dosis nicht sicher sind, oder wenn Sie Fragen zur Anwendung dieses Arzneimittels haben.
Wie das Arzneimittel in Ihren Körper gelangt
Sobald Sie die Lutschtablette in den Mund legen:
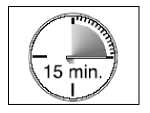
• Löst sich die Lutschtablette auf und der Wirkstoff wird freigesetzt. Dieser Vorgang dauert ca. 15 Minuten.
• Der Wirkstoff wird über die Mundschleimhaut in die Blutbahn aufgenommen.
Durch diese Art der Anwendung kann der Arzneistoff schnell aufgenommen werden. Somit werden Ihre Durchbruchschmerzen schnell gelindert.
Während die richtige Dosierung bestimmt wird
Bei der Anwendung von Actiq sollten Sie schnell eine gewisse Linderung spüren. Während Sie zusammen mit Ihrem Arzt die richtige Dosis ermitteln, die Ihre Durchbruchschmerzen wirksam lindern kann, kann es vorkommen, dass Sie auch 30 Minuten nach Anbruch der Actiq-Lutschtablette (15 Minuten nach Aufbrauchen der Actiq-Lutschtablette) noch keine ausreichende Schmerzlinderung verspüren. In diesem Fall wird Ihr Arzt Ihnen möglicherweise erlauben, für die weitere Behandlung dieser Durchbruchschmerzattacke eine zweite Actiq-Lutschtablette der gleichen Stärke anzuwenden. Wenden Sie nur auf ausdrückliche Anordnung des Arztes eine zweite Lutschtablette an. Sie dürfen niemals mehr als zwei Lutschtabletten zur Behandlung einer einzelnen Durchbruchschmerzattacke anwenden.
Während der Dosisfindung haben Sie möglicherweise gleichzeitig mehrere Stärken der Actiq-Lutschtabletten bei sich zu Hause. Behalten Sie immer nur die Stärken, die Sie zu Hause benötigen. Dies dient zur Vermeidung von Verwechslungen oder einer versehentlichen Überdosierung. Sprechen Sie mit Ihrem Apotheker über die Entsorgung ungebrauchter Actiq-Lutschtabletten.
Wie viele Lutschtabletten Sie anwenden sollten
Sobald zusammen mit Ihrem Arzt die richtige Dosierung gefunden wurde, verwenden Sie eine Lutschtablette pro Durchbruchschmerzattacke. Informieren Sie Ihren Arzt, wenn die für Sie ermittelte Dosierung Ihre Durchbruchschmerzen für mehrere Durchbruchschmerzattacken in Folge nicht lindert. Ihr Arzt wird dann entscheiden, ob Ihre Dosierung verändert werden muss.
Informieren Sie sofort Ihren Arzt, wenn Sie Actiq mehr als vier Mal täglich anwenden. Ihr Arzt wird Sie in diesem Fall möglicherweise zur Behandlung Ihrer chronischen (andauernden) Schmerzen auf ein anderes Arzneimittel umstellen. Wenn eine Umstellung erfolgt ist und Ihre chronischen (andauernden) Schmerzen unter Kontrolle gebracht sind, muss Ihr Arzt Ihre Dosierung von Actiq unter Umständen weiter ändern. Um die optimale Schmerzlinderung zu erreichen, sprechen Sie bitte mit Ihrem Arzt über Ihre Schmerzen und über die Wirkung von Actiq; so kann die Dosis bei Bedarf angepasst werden.
Wie Sie das Arzneimittel anwenden
Öffnen der Packung
• Jede Actiq-Lutschtablette ist in einer eigenen Blisterpackung versiegelt.
• Öffnen Sie die Packung erst, wenn Sie bereit zur Anwendung sind. Öffnen Sie die Packung nicht im Voraus.
• Halten Sie die Blisterpackung so, dass die bedruckte Seite von Ihnen weg zeigt.
• Greifen Sie das kurze Laschenende der Blisterpackung.
• Setzen Sie die Schere nahe beim Ende der Actiq-Lutschtablette an und schneiden Sie das Ende mit der langen Lasche knapp oberhalb der Lutschtablette mit der Schere vollständig ab (siehe Abbildung).
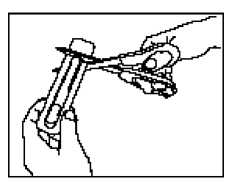
• Trennen Sie die bedruckte Rückseite von der Blisterpackung und ziehen Sie sie vollständig von der Blisterpackung ab.
• Entnehmen Sie die Actiq-Lutschtablette aus der Blisterpackung, und legen Sie sie sofort in den Mund.
Anwendung der Actiq-Lutschtablette
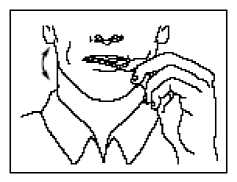
• Legen Sie die Lutschtablette zwischen Wange und Zahnfleisch.
• Greifen Sie die Lutschtablette am Stiel und bewegen Sie sie kontinuierlich in Ihrem Mund hin
und her. Streichen Sie dabei insbesondere an den Wangen entlang. Drehen Sie den Stiel häufig.
• Um die optimale Schmerzlinderung zu erreichen, sollten Sie die Dosiereinheit innerhalb von 15 Minuten vollständig aufbrauchen. Wenn Sie Actiq zu schnell aufbrauchen, schlucken Sie eine zu große Menge des Arzneimittels und Ihre Durchbruchschmerzen werden weniger gut gelindert.
• Sie dürfen die Lutschtablette nicht zerbeißen, lutschen oder kauen; dies würde zu geringeren Blutspiegeln und weniger Schmerzlinderung führen als bei bestimmungsgemäßer Anwendung.
• Wenn Sie aus irgendeinem Grund bei jeder Durchbruchschmerzattacke die Lutschtablette nicht vollständig aufbrauchen, sprechen Sie bitte mit Ihrem Arzt.
Wie oft Sie Actiq anwenden sollten
Sobald eine Dosis ermittelt ist, mit der Ihre Schmerzen wirksam behandelt werden können, sollten Sie nicht mehr als vier Actiq-Lutschtabletten pro Tag anwenden. Wenn Sie denken, dass Sie mehr als vier Actiq-Lutschtabletten pro Tag benötigen, sprechen Sie bitte sofort mit Ihrem Arzt.
Wie viele Actiq-Lutschtabletten Sie anwenden sollten
Verwenden Sie nicht mehr als zwei Dosiereinheiten zur Behandlung einer einzelnen Durchbruchschmerzattacke.
Wenn Sie eine größere Menge von Actiq angewendet haben, als Sie sollten
Die häufigsten Nebenwirkungen bei einer Überdosierung sind Schläfrigkeit, Übelkeit oder Schwindel.
• Wenn Sie sich schwindelig fühlen, Ihnen übel wird oder Sie sich sehr schläfrig fühlen, bevor die Lutschtablette vollständig aufgelöst ist, nehmen Sie sie aus Ihrem Mund heraus und bitten eine andere Person in Ihrem Haushalt um Hilfe.
Eine schwerwiegende Nebenwirkung von Actiq ist eine verlangsamte und/oder flache Atmung. Dies kann auftreten, wenn die Dosierung von Actiq für Sie zu hoch ist oder wenn Sie Actiq zu oft anwenden.
• Falls dies eintritt, rufen Sie bitte sofort den medizinischen Notdienst.
Was zu tun ist, wenn ein Kind oder Erwachsener Actiq versehentlich anwendet
Wenn Sie glauben, dass jemand Actiq versehentlich angewendet hat, rufen Sie bitte sofort den medizinischen Notdienst. Versuchen Sie, die Person wach zu halten (indem Sie ihren Namen rufen und sie am Arm oder an der Schulter schütteln), bis der Notdienst eintrifft.
Wenn Sie die Anwendung von Actiq vergessen haben
Wenn Ihre Durchbruchschmerzen noch andauern, können Sie Actiq wie von Ihrem Arzt verordnet anwenden. Wenn der Durchbruchschmerz aufgehört hat, wenden Sie Actiq bitte erst wieder bei der nächsten Durchbruchschmerzattacke an.
Wenn Sie die Anwendung von Actiq abbrechen
Brechen Sie die Anwendung von Actiq nicht ohne vorherige Rücksprache mit Ihrem Arzt ab. Normalerweise führt der Abbruch der Behandlung mit Actiq nicht zu merklichen Auswirkungen. Zur Behandlung Ihrer chronischen (andauernden) Schmerzen sollten Sie auch weiterhin Ihr gewohntes Opioid-Arzneimittel nach Anweisung Ihres Arztes einnehmen.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann Actiq Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Informieren Sie bitte Ihren Arzt, wenn Sie eine der aufgeführten Nebenwirkungen bemerken. Die schwerwiegendsten Nebenwirkungen sind eine flache Atmung, niedriger Blutdruck und Schock.
Wenn Sie eine der folgenden schwerwiegenden Nebenwirkungen bemerken, sollten Sie oder Ihre Betreuungsperson die Actiq-Lutschtablette aus Ihrem Mund ENTFERNEN sowie sofort Ihren Arzt benachrichtigen und den medizinischen Notdienst rufen, da Sie möglicherweise umgehend ärztliche Hilfe benötigen:
• Wenn Sie sehr schläfrig werden oder eine verlangsamte und/oder flache Atmung haben.
• Bei Atemschwierigkeiten oder Schwindelgefühl, Anschwellen von Zunge, Lippe oder Hals, was frühe Anzeichen auf eine schwere allergische Reaktion sein können.
Hinweis für Betreuungspersonen:
Wenn Sie beobachten, dass der Patient bei der Anwendung von Actiq langsam und/oder flach atmet, oder wenn Sie ihn nur schwer aufwecken können, ergreifen Sie SOFORT die folgenden Maßnahmen:
- Ziehen Sie die Actiq-Lutschtablette am Stiel aus dem Mund der Person und lagern Sie sie bis zur Entsorgung für Kinder und Haustiere unzugänglich.
- RUFEN SIE DEN MEDIZINISCHEN NOTDIENST.
- Wenn die Atmung der Person verlangsamt zu sein scheint, während Sie auf den medizinischen Notdienst warten, fordern Sie sie alle 5-10 Sekunden auf zu atmen.
Wenn Sie sich während der Anwendung von Actiq übermäßig schwindelig, schläfrig oder anderweitig krank fühlen, nehmen Sie die Lutschtablette am Stiel aus dem Mund heraus und entsorgen Sie sie gemäß den Anweisungen in dieser Gebrauchsinformation (siehe Abschnitt 5). Für weitere Anweisungen zur Anwendung von Actiq wenden Sie sich dann bitte an Ihren Arzt.
Sehr häufige Nebenwirkungen (betreffen mehr als 1 Behandelten von 10)
• Erbrechen, Übelkeit, Verstopfung, Magen-(Bauch-)Schmerzen
• Asthenie (Kraftlosigkeit), Schläfrigkeit, Schwindelgefühl, Kopfschmerzen
• Kurzatmigkeit
Häufige Nebenwirkungen (betreffen 1-10 Behandelte von 100)
• Verwirrtheit, Angst, Sehen oder Hören von Dingen, die es nicht gibt (Halluzinationen), Depressionen, Stimmungsschwankungen
• Unwohlsein
• epileptische Anfälle, Muskelzuckungen, Schwindel, Bewusstlosigkeit, Ruhigstellung, Kribbeln oder Taubheit, Koordinationsstörungen, gesteigerte oder veränderte Empfindlichkeit gegenüber Berührungen, Konvulsionen (Krämpfe)
• Mundtrockenheit, Entzündungen der Mundschleimhaut, Zungenerkrankungen (z. B. Brennen oder Geschwüre), Geschmacksstörungen
• Blähungen, aufgetriebener Bauch, Verdauungsbeschwerden, verminderter Appetit, Gewichtsverlust
• Verschwommenes Sehen oder Doppeltsehen
• Schwitzen, Hautausschlag, Juckreiz
• Schwierigkeiten beim Wasserlassen
• Unfallbedingte Verletzungen (z. B. durch Stürze)
• Unwohlsein
Gelegentliche Nebenwirkungen (betreffen 1-10 Behandelte von 1000)
• Zahnverfall, Darmlähmung, Geschwüre der Mundschleimhaut, Zahnfleischbluten
• Koma, schleppende Sprache
• Albträume, Depersonalisierung (Unwirklichkeitsgefühl gegenüber sich selbst oder der Umgebung), Denkstörungen, Euphorie (übermäßiges Glücksgefühl)
• Erweiterung der Blutgefäße
• Nesselausschlag
Über folgende Nebenwirkungen wurde ebenfalls während der Anwendung von Actiq berichtet, es ist
jedoch nicht bekannt, wie häufig sie auftreten können:
• Zahnfleischschwund, Zahnfleischentzündung, Zahnverlust, schwere Atemprobleme, Hitzegefühl, starkes Wärmegefühl, Durchfall, Schwellungen an Armen oder Beinen, Ermüdung
Während Sie Actiq anwenden, können Irritationen, Schmerzen und Geschwüre am Verabreichungsort und Zahnfleischbluten auftreten.
Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind.
5. WIE IST ACTIQ AUFZUBEWAHREN?
Der schmerzstillende Wirkstoff in Actiq ist sehr stark wirksam und könnte lebensbedrohlich sein, wenn er versehentlich von einem Kind eingenommen wird. Actiq muss für Kinder unzugänglich aufbewahrt werden.
• Sie dürfen Actiq nach dem auf der Blisterpackung und dem Umkarton angegebenen Verfalldatum nicht mehr verwenden.
• Nicht über 30 °C lagern.
• Lassen Sie Actiq immer so lange in der Blisterpackung, bis Sie bereit zur Anwendung sind. Sie dürfen Actiq nicht verwenden, wenn die Blisterpackung beschädigt oder geöffnet wurde.
• Wenn Sie Actiq nicht länger anwenden, oder wenn Sie ungebrauchte Actiq-Lutschtabletten zu Hause haben, bringen Sie alle ungebrauchten Packungen zu Ihrem Arzt oder Apotheker zurück.
Entsorgung von Actiq nach der Anwendung
Eine teilweise aufgebrauchte Actiq-Lutschtablette kann genug Wirkstoff enthalten, um für ein Kind
gesundheitsschädlich oder lebensbedrohlich zu sein. Auch wenn nur noch wenig oder überhaupt kein
Arzneimittel mehr auf dem Stiel zurückgeblieben ist, muss der Stiel selbst ordnungsgemäß wie folgt
entsorgt werden:
• Wenn überhaupt keine Arzneimittelreste mehr vorhanden sind, werfen Sie den Stiel in einen Abfallbehälter, der für Kinder und Haustiere unzugänglich ist.
• Wenn auf dem Stiel noch Arzneimittelreste haften, halten Sie die Lutschtablette unter fließendes heißes Wasser, um die Reste aufzulösen und werfen den Stiel danach in einen Abfallbehälter, der für Kinder und Haustiere unzugänglich ist.
• Wenn Sie die Lutschtablette nicht vollständig aufgebraucht haben und die Arzneimittelreste nicht sofort auflösen können, lagern Sie die Lutschtablette für Kinder und Haustiere unzugänglich, bis Sie die teilweise aufgebrauchte Lutschtablette wie oben beschrieben entsorgen können.
• Spülen Sie die teilweise aufgebrauchte Lutschtablette, den Stiel oder die Blisterpackung nicht die Toilette herunter.
6. WEITERE INFORMATIONEN
Was Actiq enthält
Der Wirkstoff ist Fentanyl.
Jede einzelne Lutschtablette enthält jeweils:
• 200 Mikrogramm Fentanyl (als Citrat),
• 400 Mikrogramm Fentanyl (als Citrat),
• 600 Mikrogramm Fentanyl (als Citrat),
• 800 Mikrogramm Fentanyl (als Citrat),
• 1200 Mikrogramm Fentanyl (als Citrat),
• 1600 Mikrogramm Fentanyl (als Citrat).
Die sonstigen Bestandteile sind:
Lutschtablette
Stärkehydrolysat (entspricht ca. 2 Gramm Glucose).
Citronensäure, Dinatriumhydrogenphosphat, künstliches Beerenaroma (Maltodextrin, Propylenglycol, künstliche Aromastoffe und Triethylcitrat), Magnesiumstearat
Essbarer Klebstoff zur Befestigung der Lutschtablette am Stiel
Poly-{O-[hydrogen-(oct-1-en-1-yl)succinyl]stärke}, Natriumsalz (E 1450), Puderzucker (Sucrose (Saccharose) und Maisstärke), Gereinigtes Wasser
Drucktinte
Gereinigtes Wasser, entwachster weißer Schellack, Propylenglycol, Brillantblau FCF (E 133)
Wie Actiq aussieht und Inhalt der Packung
Actiq besteht aus einer weißen bis cremefarbenen festen Lutschtablette zur Anwendung in der Mundhöhle, die an einem Stiel befestigt ist. Die Lutschtablette kann durch die Lagerung leicht gesprenkelt aussehen. Dies liegt an geringfügigen Veränderungen des Geschmacksstoffs im Produkt und beeinflusst in keiner Weise die Wirkung.
Actiq ist in sechs verschiedenen Stärken erhältlich: 200, 400, 600, 800, 1200 und 1600 Mikrogramm. Die Wirkstärke ist auf der weißen Lutschtablette, dem Stiel, der Blisterpackung und dem Karton
angegeben, um sicherzustellen, dass Sie das richtige Arzneimittel anwenden. Jeder Stärke ist eine eigene Farbe zugeordnet.
Die Actiq Lutschtabletten sind in einzelnen Blisterpackungen verpackt.
Die Blisterpackungen sind in Umkartons zu 3 oder 30 einzelnen Actiq Dosiereinheiten verpackt.
Pharmazeutischer Unternehmer
TEVA GmbH Graf-Arco-Str. 3 89079 Ulm
Hersteller
Teva Pharmachemie B.V. Europe Swensweg 5 2031 GA Haarlem Niederlande
Diese Gebrauchsinformation wurde zuletzt überarbeitet im September 2014.
Versionscode: Z04
9/9