Aida
Jenapharm + Logo
Gebrauchsinformation: Information für die Anwenderin
aida®
0,020 mg/3,0 mg Filmtabletten
Ethinylestradiol/Drospirenon
Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt/Ihre Ärztin oder Apotheker/Apothekerin.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker.
Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4._
Wichtige Informationen über kombinierte hormonale Kontrazeptiva (KHK):
• Bei korrekter Anwendung zählen sie zu den zuverlässigsten reversiblen Verhütungsmethoden.
• Sie bewirken eine leichte Zunahme des Risikos für ein Blutgerinnsel in den Venen und Arterien, insbesondere im ersten Jahr der Anwendung oder bei Wiederaufnahme der Anwendung eines kombinierten hormonalen Kontrazeptivums nach einer Unterbrechung von 4 oder mehr Wochen.
• Achten Sie bitte aufmerksam auf Symptome eines Blutgerinnsels und wenden Sie sich an Ihren Arzt, wenn Sie vermuten, diese zu haben (siehe Abschnitt 2, „Blutgerinnsel“).
Was in dieser Packungsbeilage steht:
1. Was ist aida und wofür wird es angewendet? 3
2. Was Sollten Sie vor der Anwendung von aida beachten? 3
Wann aida nicht eingenommen werden darf 3
Warnhinweise und Vorsichtsmaßnahmen 4
Was ist zu beachten, wenn eine Blutung während der Einnahmepause ausbleibt? 9
Andere Arzneimittel und aida 9
aida zusammen mit Nahrungsmitteln und Getränken 9
Verkehrstüchtigkeit und das Bedienen von Maschinen 10
3. Wie ist aida einzunehmen? 10
Wann beginnen Sie mit der Einnahme aus dem ersten Folienstreifen? 10
Wenn Sie eine größere Menge von aida eingenommen haben, als Sie sollten 11
Wenn Sie die Einnahme von aida vergessen haben 11
Was müssen Sie beachten, wenn Sie an Erbrechen oder schwerem Durchfall leiden? 13
Verschieben der Blutungstage: Was müssen Sie beachten? 13
4. Welche Nebenwirkungen sind möglich? 14
5. Wie ist aida aufzubewahren? 15
6. Inhalt der Packung und weitere Informationen 15
1. Was ist aida und wofür wird es angewendet?
• aida ist ein Arzneimittel zur Schwangerschaftsverhütung ("Pille").
• Eine Tablette enthält eine geringe Menge zweier verschiedener weiblicher Geschlechtshormone, und zwar Drospirenon und Ethinylestradiol.
• "Pillen", die zwei Hormone enthalten, werden als "Kombinationspillen" bezeichnet.
2. Was Sollten Sie vor der Anwendung von aida beachten?
Allgemeine Anmerkungen
Bitte lesen Sie die Informationen zu Blutgerinnseln in Abschnitt 2, bevor Sie mit der Anwendung von aida beginnen. Es ist besonders wichtig, die Informationen zu den Symptomen eines Blutgerinnsels zu lesen - siehe Abschnitt 2, „Blutgerinnsel“).
Bevor Sie aida anwenden, wird Ihr behandelnder Arzt/Ihre behandelnde Ärztin Sie sorgfältig zu Ihrer Krankengeschichte und zu der Ihrer nahen Verwandten befragen. Der Arzt/die Ärztin wird Ihren Blutdruck messen und abhängig von Ihrer persönlichen Situation weitere Untersuchungen durchführen.
In dieser Gebrauchsinformation sind verschiedene Fälle beschrieben, bei deren Auftreten Sie aida absetzen sollten oder bei denen die Zuverlässigkeit von aida herabgesetzt sein kann. In diesen Fällen sollten Sie entweder keinen Geschlechtsverkehr haben oder andere, nichthormonale Verhütungsmethoden anwenden, wie z.B. Kondome oder eine andere Barrieremethode. Wenden Sie aber keine Kalender- oder Temperaturmethoden an. Diese Methoden können versagen, weil aida die monatlichen Schwankungen der Körpertemperatur und des Gebärmutterhalsschleims verändert.
Wie alle hormonalen Empfängnisverhütungsmittel bietet aida keinerlei Schutz vor einer HIV-Infektion (AIDS) oder anderen sexuell übertragbaren Erkrankungen.
Wann aida nicht eingenommen werden darf
aida darf nicht angewendet werden, wenn einer der nachstehend aufgeführten Punkte auf Sie zutrifft.
Wenn einer der nachstehend aufgeführten Punkte auf Sie zutrifft, müssen Sie dies Ihrem Arzt
mitteilen. Ihr Arzt wird dann mit Ihnen besprechen, welche andere Form der Empfängnisverhütung für
Sie besser geeignet ist.
Nehmen Sie aida nicht ein
• wenn Sie ein Blutgerinnsel in einem Blutgefäß der Beine (tiefe Beinvenenthrombose, TVT), der Lunge (Lungenembolie, LE) oder eines anderen Organs haben (oder in der Vergangenheit hatten)
• wenn Ihnen bekannt ist, dass Sie an einer Störung der Blutgerinnung leiden - beispielsweise Protein-C-Mangel, Protein-S-Mangel, Antithrombin-III-Mangel, Faktor-V-Leiden oder Antiphospholipid-Antikörper
• wenn Sie operiert werden müssen oder längere Zeit bettlägerig sind (siehe Abschnitt „Blutgerinnsel“)
• wenn Sie jemals einen Herzinfarkt oder Schlaganfall hatten
• wenn Sie eine Angina pectoris (eine Erkrankung, die schwere Brustschmerzen verursacht und ein erstes Anzeichen auf einen Herzinfarkt sein kann) oder eine transitorische ischämische Attacke (TIA - vorübergehende Symptome eines Schlaganfalls) haben (oder früher einmal hatten)
• wenn Sie an einer der folgenden Krankheiten leiden, die das Risiko für ein Blutgerinnsel in einer Arterie erhöhen können:
- schwerer Diabetes mit Schädigung der Blutgefäße
- sehr hoher Blutdruck
- sehr hoher Blutfettspiegel (Cholesterin oder Triglyceride)
- eine Krankheit, die als Hyperhomocysteinämie bekannt ist.
• wenn Sie an einer bestimmten Form von Migräne (sog. „Migräne mit Aura“) leiden oder in der Vergangenheit gelitten haben
• bei bestehenden oder vorausgegangenen Lebererkrankungen, solange sich Ihre Leberwerte nicht wieder normalisiert haben
• wenn Ihre Nieren nicht richtig funktionieren (Niereninsuffizienz)
• bei bestehenden oder vorausgegangenen Lebergeschwülsten
• bei bestehendem oder vorausgegangenem Brustkrebs oder Krebs der Genitalorgane bzw. bei Verdacht darauf
• bei jeglichen unerklärlichen Blutungen aus der Scheide
• wenn Sie allergisch gegen Ethinylestradiol, Drospirenon oder einen der sonstigen Bestandteile von aida sind. Dies kann Jucken, Ausschlag oder Schwellungen verursachen
Warnhinweise und Vorsichtsmaßnahmen_
Wann sollten Sie sich an Ihren Arzt wenden?
Suchen Sie unverzüglich ärztliche Hilfe auf
- wenn Sie mögliche Anzeichen eines Blutgerinnsels bemerken, die bedeuten
könnten, dass Sie ein Blutgerinnsel im Bein (d. h. tiefe Beinvenenthrombose), ein Blutgerinnsel in der Lunge (d. h. Lungenembolie), einen Herzinfarkt oder einen Schlaganfall haben (siehe den Abschnitt „Blutgerinnsel “ unten).
Für eine Beschreibung der Symptome dieser schwerwiegenden Nebenwirkungen siehe den Abschnitt „So erkennen Sie ein Blutgerinnsel“._
Informieren Sie Ihren Arzt, wenn einer der folgenden Punkte auf Sie zutrifft.
In einigen Situationen ist besondere Vorsicht bei der Einnahme von aida oder anderen "Kombinationspillen" erforderlich und es können regelmäßige Kontrolluntersuchungen beim Arzt/bei der Ärztin notwendig sein. Wenn einer der nachfolgenden Fälle auf Sie zutrifft, informieren Sie Ihren Arzt/Ihre Ärztin darüber, bevor Sie mit der Einnahme von aida beginnen. Wenn die Krankheit ausbricht oder sich während der Anwendung von aida verschlimmert, sollten Sie ebenfalls Ihren Arzt informieren.
• wenn Brustkrebs bei einer nahen Verwandten auftritt oder früher aufgetreten ist
• wenn bei Ihnen eine Leber- oder Gallenblasenerkrankung bekannt ist
• wenn Sie an Zuckerkrankheit leiden (Diabetes mellitus)
• wenn Sie unter Depressionen leiden
• wenn Sie Morbus Crohn oder Colitis ulcerosa (chronisch entzündliche Darmerkrankung) haben;
• wenn Sie systemischen Lupus erythematodes (SLE - eine Krankheit, die Ihr natürliches Abwehrsystem beeinträchtigt) haben;
• wenn Sie ein hämolytisches urämisches Syndrom (HUS - eine Störung der Blutgerinnung, die zu Nierenversagen führt) haben;
• wenn Sie Sichelzellanämie (eine erbliche Erkrankung der roten Blutkörperchen) haben;
• wenn Sie erhöhte Blutfettspiegel (Hypertriglyceridämie) haben oder diese Erkrankung in Ihrer Familie vorgekommen ist. Hypertriglyceridämie wurde mit einem erhöhten Risiko für eine Pankreatitis (Entzündung der Bauchspeicheldrüse) verbunden;
• wenn Sie operiert werden müssen oder längere Zeit bettlägerig sind (siehe Abschnitt 2, „Blutgerinnsel“);
• wenn Sie vor kurzem entbunden haben, ist Ihr Risiko für Blutgerinnsel erhöht. Fragen Sie Ihren Arzt, wie bald nach der Entbindung Sie mit der Anwendung von aida beginnen können;
• Wenn Sie in den Venen unter der Haut eine Entzündung haben (oberflächliche Thrombophl ebitis);
• Wenn Sie Krampfadern (Varizen) haben.
• wenn Sie an Epilepsie leiden (siehe Seite 9 „Bei Einnahme von aida mit anderen Arzneimitteln“)
• wenn bei Ihnen eine Erkrankung während einer Schwangerschaft oder früheren Anwendung von Geschlechtshormonen zum ersten Mal aufgetreten ist, z. B. Schwerhörigkeit, eine Blutkrankheit, die Porphyrie heißt, Bläschenausschlag während der Schwangerschaft (Herpes gestationes), eine Nervenerkrankung, bei der plötzliche unwillkürliche Körperbewegungen auftreten (Chorea Sydenham)
• bei bestehendem oder vorausgegangenem Chloasma (einer Verfärbung der Haut, vorwiegend im Gesicht oder am Hals, auch als "Schwangerschaftsflecken" bekannt). In diesem Fall empfiehlt es sich, direktes Sonnenlicht oder ultraviolettes Licht zu meiden.
• wenn Sie an einem erblichen Angioödem leiden, können Arzneimittel, die Estrogene enthalten, Symptome eines Angioödems auslösen oder verschlimmern. Sie sollten umgehend Ihren Arzt/Ihre Ärztin aufsuchen, wenn Sie Symptome eines Angioödems an sich bemerken, wie Schwellungen von Gesicht, Zunge und/oder Rachen und/oder Schluckschwierigkeiten oder Hautausschlag zusammen mit Atemproblemen.
BLUTGERINNSEL
Bei der Anwendung eines kombinierten hormonalen Kontrazeptivums wie aida ist Ihr Risiko für die Ausbildung eines Blutgerinnsels höher als wenn Sie keines anwenden. In seltenen Fällen kann ein Blutgerinnsel Blutgefäße verstopfen und schwerwiegende Probleme verursachen.
Blutgerinnsel können auftreten
■ in Venen (sog. „Venenthrombose“, „venöse Thromboembolie“ oder VTE)
■ in den Arterien (sog „Arterienthrombose“, „arterielle Thromboembolie“ oder ATE).
Die Ausheilung eines Blutgerinnsels ist nicht immer vollständig. Selten kann es zu schwerwiegenden anhaltenden Beschwerden kommen, und sehr selten verlaufen Blutgerinnsel tödlich.
Es ist wichtig, nicht zu vergessen, dass das Gesamtrisiko eines gesundheitsschädlichen Blutgerinnsels aufgrund von aida gering ist.
SO ERKENNEN SIE EIN BLUTGERINNSEL
Suchen Sie dringend ärztliche Hilfe auf, wenn Sie eines der folgenden Anzeichen oder Symptome bemerken.
|
Tritt bei Ihnen eines dieser Anzeichen auf? |
Woran könnten Sie leiden? |
|
• Schwellung eines Beins oder längs einer Vene im Bein oder Fuß, vor allem, wenn gleichzeitig Folgendes auftritt: • Schmerz oder Druckschmerz im Bein, der möglicherweise nur beim Stehen oder Gehen bemerkt wird • Erwärmung des betroffenen Beins • Änderung der Hautfarbe des Beins, z. B. aufkommende Blässe, Rot- oder Blaufärbung |
Tiefe Beinvenenthrombose |
|
• plötzliche unerklärliche Atemlosigkeit oder schnelle Atmung; • plötzlicher Husten ohne offensichtliche Ursache, bei dem Blut ausgehustet werden kann; • stechender Brustschmerz, der bei tiefem Einatmen zunimmt; • starke Benommenheit oder Schwindelgefühl; • schneller oder unregelmäßiger Herzschlag; |
Lungenembolie |
|
• starke Magenschmerzen. | |
|
Wenn Sie sich nicht sicher sind, sprechen Sie mit einem Arzt, da einige dieser Symptome wie Husten oder Kurzatmigkeit mit einer leichteren Erkrankung wie z. B. einer Entzündung der Atemwege (z. B. einem grippalen Infekt) verwechselt werden können. | |
|
Symptome, die meistens in einem Auge auftreten: • sofortiger Verlust des Sehvermögens oder • schmerzloses verschwommenes Sehen, welches zu einem Verlust des Sehvermögens fortschreiten kann. |
Thrombose einer Netzhautvene (Blutgerinnsel in einer Vene im Auge) |
|
• Brustschmerz, Unwohlsein, Druck, Schweregefühl • Enge- oder Völlegefühl in Brust, Arm oder unterhalb des Brustbeins; • Völlegefühl, Verdauungsstörungen oder Erstickungsgefühl; • in den Rücken, Kiefer, Hals, Arm und Magen ausstrahlende Beschwerden im Oberkörper; • Schwitzen, Übelkeit, Erbrechen oder Schwindelgefühl; • extreme Schwäche, Angst oder Kurzatmigkeit; • schnelle oder unregelmäßige Herzschläge |
Herzinfarkt |
|
• plötzliche Schwäche oder Taubheitsgefühl des Gesichtes, Arms oder Beins, die auf einer Körperseite besonders ausgeprägt ist; • plötzliche Verwirrtheit, Sprech- oder Verständnisschwierigkeiten; • plötzliche Sehstörungen in einem oder beiden Augen; • plötzliche Gehschwierigkeiten, Schwindelgefühl, Gleichgewichtsverlust oder Koordinationsstörungen; • plötzliche schwere oder länger anhaltende Kopfschmerzen unbekannter Ursache; • Verlust des Bewusstseins oder Ohnmacht mit oder ohne Krampfanfall. |
Schlaganfall |
|
In manchen Fällen können die Symptome eines Schlaganfalls kurzfristig sein und mit einer nahezu sofortigen und vollständigen Erholung einhergehen. Sie sollten sich aber trotzdem dringend in ärztliche Behandlung begeben, da Sie erneut einen Schlaganfall erleiden könnten. | |
|
• Schwellung und leicht bläuliche Verfärbung einer Extremität; • starke Magenschmerzen (akutes Abdomen) |
Blutgerinnsel, die andere Blutgefäße verstopfen |
BLUTGERINNSEL IN EINER VENE
Was kann passieren, wenn sich in einer Vene ein Blutgerinnsel bildet?
• Die Anwendung kombinierter hormonaler Kontrazeptiva wurde mit einem höheren Risiko für Blutgerinnsel in einer Vene (Venenthrombose) in Verbindung gebracht. Diese Nebenwirkungen kommen jedoch nur selten vor. Meistens treten sie im ersten Jahr der Anwendung eines kombinierten hormonalen Kontrazeptivums auf.
• Wenn es in einer Vene im Bein oder Fuß zu einem Blutgerinnsel kommt, kann dieses eine tiefe Beinvenenthrombose (TVT) verursachen.
• Wenn ein Blutgerinnsel vom Bein in die Lunge wandert und sich dort festsetzt, kann es eine Lungenembolie verursachen.
• Sehr selten kann sich ein Blutgerinnsel in einer Vene eines anderen Organs wie z. B. dem Auge
(Thrombose einer Netzhautvene) bilden.
Wann ist das Risiko für die Bildung eines Blutgerinnsels in einer Vene am größten?
Das Risiko für die Bildung eines Blutgerinnsels in einer Vene ist im ersten Jahr der erstmaligen Anwendung eines kombinierten hormonalen Kontrazeptivums am größten. Das Risiko kann außerdem erhöht sein, wenn Sie die Anwendung eines kombinierten hormonalen Kontrazeptivums (gleiches oder anderes Arzneimittel) nach einer Unterbrechung von 4 oder mehr Wochen wieder aufnehmen.
Nach dem ersten Jahr sinkt das Risiko, es bleibt aber stets geringfügig höher als wenn kein kombiniertes hormonales Kontrazeptivum angewendet würde.
Wenn Sie die Anwendung von aida beenden, kehrt das Risiko für ein Blutgerinnsel in wenigen Wochen auf den Normalwert zurück.
Wie groß ist das Risiko für die Bildung eines Blutgerinnsels?
Das Risiko ist abhängig von Ihrem natürlichen Risiko für VTE und der Art des von Ihnen angewendeten kombinierten hormonalen Kontrazeptivums.
Das Gesamtrisiko für ein Blutgerinnsel in Bein oder Lunge (TVT oder LE) mit aida ist gering.
- Ungefähr 2 von 10.000 Frauen, die weder schwanger sind noch ein kombiniertes hormonales Kontrazeptivum anwenden, erleiden im Verlauf eines Jahres ein Blutgerinnsel.
- Ungefähr 5-7 von 10.000 Frauen, die ein Levonorgestrel, Norethisteron oder ein Norgestimat enthaltendes kombiniertes hormonales Kontrazeptivum anwenden, erleiden im Verlauf eines Jahres ein Blutgerinnsel.
- Ungefähr 9 bis 12 von 10.000 Frauen, die ein Drospirenon enthaltendes kombiniertes hormonales Kontrazeptivum (wie aida) anwenden, erleiden im Verlauf eines Jahres ein Blutgerinnsel.
- Das Risiko für die Bildung eines Blutgerinnsels ist entsprechend Ihrer persönlichen medizinischen Vorgeschichte unterschiedlich hoch (siehe folgenden Abschnitt „Faktoren, die das Risiko für ein Blutgerinnsel in einer Vene erhöhen“).
|
Risiko für die Bildung eines Blutgerinnsels pro Jahr | |
|
Frauen, die kein kombiniertes hormonales Präparat in Form einer Pille/eines Pflasters/eines Rings anwenden und nicht schwanger sind |
Ungefähr 2 von 10.000 Frauen |
|
Frauen, die eine Levonorgestrel, Norethisteron oder Norgestimat enthaltende kombinierte hormonale Pille anwenden |
Ungefähr 5-7 von 10.000 Frauen |
|
Frauen, die aida anwenden |
Ungefähr 9-12 von 10.000 Frauen |
Faktoren, die das Risiko für ein Blutgerinnsel in einer Vene erhöhen
Das Risiko für ein Blutgerinnsel mit aida ist gering, wird aber durch einige Erkrankungen und
Risikofaktoren erhöht. Das Risiko ist erhöht:
• wenn Sie stark übergewichtig sind (Body-Mass-Index oder BMI über 30 kg/m2);
• wenn bei einem Ihrer nächsten Angehörigen in jungen Jahren (d. h. jünger als 50 Jahre) ein Blutgerinnsel im Bein, in der Lunge oder in einem anderen Organ aufgetreten ist. In diesem Fall haben Sie womöglich eine erbliche Blutgerinnungsstörung;
• wenn Sie operiert werden müssen oder aufgrund einer Verletzung oder Krankheit längere Zeit bettlägerig sind oder ein Bein eingegipst ist. Es kann erforderlich sein, dass die Anwendung von aida mehrere Wochen vor einer Operation oder bei eingeschränkter Beweglichkeit beendet werden muss. Wenn Sie die Anwendung von aida beenden müssen, fragen Sie Ihren Arzt, wann Sie die Anwendung wieder aufnehmen können.
• wenn Sie älter werden (insbesondere ab einem Alter von ungefähr 35 Jahren);
• wenn Sie vor wenigen Wochen entbunden haben.
Das Risiko für die Bildung eines Blutgerinnsels steigt mit der Anzahl der vorliegenden Erkrankungen und Risikofaktoren.
Flugreisen (> 4 Stunden) können Ihr Risiko für ein Blutgerinnsel vorübergehend erhöhen, insbesondere wenn bei Ihnen weitere der aufgeführten Faktoren vorliegen.
Es ist wichtig, dass Sie Ihren Arzt informieren, wenn einer dieser Punkte auf Sie zutrifft, auch wenn Sie sich nicht sicher sind. Ihr Arzt kann dann entscheiden, aida abzusetzen.
Teilen Sie Ihrem Arzt mit, wenn es bei einem der oben erwähnten Punkte während der Anwendung von aida zu einer Veränderung kommt, zum Beispiel wenn bei einem nahen Angehörigen aus unbekannter Ursache eine Thrombose auftritt oder wenn Sie stark zunehmen.
BLUTGERINNSEL IN EINER ARTERIE
Was kann passieren, wenn sich in einer Arterie ein Blutgerinnsel bildet?
Genau wie ein Blutgerinnsel in einer Vene kann auch ein Gerinnsel in einer Arterie schwerwiegende Probleme verursachen. Es kann zum Beispiel einen Herzinfarkt oder Schlaganfall hervorrufen.
Faktoren, die das Risiko für ein Blutgerinnsel in einer Arterie erhöhen
Es ist wichtig zu beachten, dass das Risiko für einen Herzinfarkt oder Schlaganfall aufgrund der Anwendung von aida sehr gering ist, jedoch ansteigen kann:
• mit zunehmendem Alter (älter als 35 Jahre);
• wenn Sie rauchen. Bei der Anwendung eines kombinierten hormonalen Kontrazeptivums wie aida wird geraten, mit dem Rauchen aufzuhören. Wenn Sie nicht mit dem Rauchen aufhören können und älter als 35 Jahre sind, kann Ihr Arzt Ihnen raten, eine andere Art von Verhütungsmittel anzuwenden;
• wenn Sie übergewichtig sind;
• wenn Sie einen hohen Blutdruck haben;
• wenn einer Ihrer nächsten Angehörigen in jungen Jahren (jünger als 50 Jahre) einen Herzinfarkt oder Schlaganfall hatte. In diesem Fall könnten Sie ebenfalls ein erhöhtes Risiko für einen Herzinfarkt oder Schlaganfall haben;
• wenn Sie oder einer Ihrer nächsten Angehörigen einen hohen Blutfettspiegel (Cholesterin oder Triglyceride) haben;
• wenn Sie Migräne und insbesondere Migräne mit Aura haben;
• wenn Sie an Herzproblemen leiden (Herzklappenerkrankung, Rhythmusstörung namens Vorhofflimmern);
• wenn Sie Zucker (Diabetes) haben.
Wenn mehr als einer dieser Punkte auf Sie zutrifft oder eine dieser Erkrankungen besonders schwer ist, kann Ihr Risiko für die Ausbildung eines Blutgerinnsels zusätzlich erhöht sein.
Teilen Sie Ihrem Arzt mit, wenn es bei einem der oben erwähnten Punkte während der Anwendung von aida zu einer Veränderung kommt, zum Beispiel wenn Sie mit dem Rauchen anfangen, bei einem nahen Angehörigen aus unbekannter Ursache eine Thrombose auftritt oder wenn Sie stark zunehmen.
Brustkrebs wird bei Frauen, die "Kombinationspillen" nehmen, etwas häufiger festgestellt. Aber es ist nicht bekannt, ob dies durch die Behandlung verursacht wird. Zum Beispiel kann es sein, dass bei Frauen, die die "Pille" einnehmen, häufiger Tumoren entdeckt werden, da sie öfter von Ihrem Arzt/Ihrer Ärztin untersucht werden. Das Auftreten von Brusttumoren nimmt nach Absetzen von hormonalen "Kombinationspillen" langsam ab. Es ist wichtig, dass Sie regelmäßig Ihre Brüste untersuchen. Wenn Sie Knoten spüren, müssen Sie Ihren Arzt/Ihre Ärztin aufsuchen.
In seltenen Fällen wurden gutartige Lebertumoren und noch seltener bösartige Lebertumoren bei "Pillenanwenderinnen" festgestellt. Suchen Sie Ihren Arzt/Ihre Ärztin auf, wenn Sie ungewöhnlich starke Bauchschmerzen haben.
Zwischenblutungen
Bei der Anwendung von aida kann es in den ersten Monaten zu unerwarteten Blutungen kommen (Blutungen außerhalb der Einnahmepause). Wenn diese Blutungen länger als einige Monate auftreten oder wenn sie nach einigen Monaten erneut beginnen, muss Ihr Arzt/Ihre Ärztin die Ursache ermitteln.
Was ist zu beachten, wenn eine Blutung während der Einnahmepause ausbleibt?
Wenn Sie alle "Pillen" ordnungsgemäß eingenommen haben, nicht erbrochen oder schweren Durchfall gehabt und keine anderen Arzneimittel eingenommen haben, ist eine Schwangerschaft sehr unwahrscheinlich.
Wenn die erwartete Blutung in zwei aufeinander folgenden Zyklen ausbleibt, kann es sein, dass Sie schwanger sind. Sie sollten dann unverzüglich Ihren Arzt/Ihre Ärztin aufsuchen und nicht mit dem nächsten Folienstreifen beginnen bevor eine Schwangerschaft mit Sicherheit ausgeschlossen wurde.
Bei Einnahme von aida mit anderen Arzneimitteln_
Informieren Sie immer Ihren Arzt/Ihre Ärztin, welche Arzneimittel oder pflanzlichen Produkte Sie bereits anwenden. Informieren Sie auch jeden anderen Arzt/jede andere Ärztin oder Zahnarzt/Zahnärztin, der/die Ihnen andere Arzneimittel verschreibt (oder den Apotheker/die Apothekerin), dass Sie aida einnehmen. Diese können Ihnen sagen, ob Sie zusätzliche empfängnisverhütende Vorsichtsmaßnahmen anwenden müssen (z. B. Kondome) und, falls ja, wie lange.
Einige Arzneimittel können einen Einfluss auf die Blutspiegel von aida haben und zu einer Minderung der empfängnisverhütenden Wirksamkeit von aida oder zu unerwarteten Blutungen führen. Dazu gehören:
■ Arzneimittel zur Behandlung von
o Epilepsie (z. B. Primidon, Phenytoin, Barbiturate, Carbamazepin, Oxcarbazepin) o Tuberkulose (z. B. Rifampicin)
o HIV- und Hepatitis-C-Virus-Infektionen (sogenannte Proteaseinhibitoren und nicht-
nukleosidische Reverse-Transkriptase-Inhibitoren wie Ritonavir, Nevirapin, Efavirenz) oder anderen Infektionen (Griseofulvin) o hohem Blutdruck in den Blutgefäßen der Lunge (Bosentan)
■ das pflanzliche Heilmittel Johanniskraut
aida kann die Wirksamkeit bestimmter anderer Arzneimittel beeinflussen, z. B.
■ Arzneimittel, die Ciclosporin enthalten
■ das Antiepileptikum Lamotrigin (dies könnte zu einer erhöhten Häufigkeit von Krampfanfällen führen)
Fragen Sie vor der Einnahme von allen Arzneimitteln Ihren Arzt/Ihre Ärztin oder Apotheker/Apothekerin um Rat.
Bei Einnahme von aida zusammen mit Nahrungsmitteln und Getränken
aida kann zusammen mit oder ohne Nahrungsmittel eingenommen werden, wenn notwendig mit etwas Wasser.
Labortests
Hormonale Verhütungsmittel können die Ergebnisse bestimmter Labortests beeinflussen. Informieren Sie daher Ihren Arzt/Ihre Ärztin oder das Laborpersonal, dass Sie die „Pille“ einnehmen, wenn bei Ihnen ein Bluttest durchgeführt werden muss.
Schwangerschaft
Wenn Sie schwanger sind, dürfen Sie aida nicht einnehmen. Falls Sie während der Einnahme von aida schwanger werden, beenden Sie die Einnahme von aida sofort und suchen Sie Ihren Arzt/Ihre Ärztin
auf. Wenn Sie schwanger werden möchten, können Sie aidajederzeit absetzen (siehe auch Seite 14 „Wenn Sie die Einnahme von aida abbrechen wollen“).
Fragen Sie vor der Einnahme von allen Arzneimitteln Ihren Arzt/Ihre Ärztin oder Apotheker/Apothekerin um Rat.
Stillzeit
Frauen sollten aida generell nicht in der Stillzeit anwenden. Fragen Sie Ihren Arzt/Ihre Ärztin, wenn Sie stillen und die "Pille" einnehmen möchten.
Fragen Sie vor der Einnahme von allen Arzneimitteln Ihren Arzt/Ihre Ärztin oder Apotheker/Apothekerin um Rat.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Es gibt keine Hinweise, dass die Einnahme von aida einen Einfluss auf die Verkehrstüchtigkeit und das Bedienen von Maschinen hat.
aida enthält Lactose.
Bitte nehmen Sie aida daher erst nach Rücksprache mit Ihrem Arzt/Ihre Ärztin ein, wenn Ihnen bekannt ist, dass Sie unter einer Unverträglichkeit gegenüber bestimmten Zuckern leiden.
3. Wie ist aida einzunehmen?
Nehmen Sie 1 Tablette aida täglich, gegebenenfalls zusammen mit etwas Wasser ein. Die Einnahme der Tabletten sollte jeden Tag etwa zur gleichen Zeit erfolgen. Dabei spielt es keine Rolle, ob Sie die Tabletten nüchtern oder zu den Mahlzeiten einnehmen.
Jeder Folienstreifen enthält 21 Tabletten. Neben jeder Tablette ist der Wochentag gekennzeichnet, an dem sie eingenommen werden muss. Wenn Sie mit der Einnahme z. B. an einem Mittwoch beginnen, nehmen Sie die mit "Mittwoch" gekennzeichnete Tablette. Die weitere Einnahme erfolgt in der Pfeilrichtung auf dem Folienstreifen, bis alle 21 Tabletten aufgebraucht sind.
Dann nehmen Sie 7 Tage keine Tablette ein. Während dieser 7-tägigen Pause (auch Einnahmepause genannt) sollte eine Blutung einsetzen. Diese so genannte "Entzugsblutung" beginnt in der Regel am 2. oder 3. Tag der Einnahmepause.
Beginnen Sie mit der Einnahme aus der nächsten Packung am 8. Tag nach der letzten Tablette aida (d. h. nach der 7-tägigen Einnahmepause), ungeachtet dessen, ob die Blutung noch anhält oder nicht. Dies bedeutet zum einen, dass Sie immer am gleichen Wochentag mit dem neuen Folienstreifen beginnen, und zum anderen, dass Ihre Entzugsblutung jeden Monat an den gleichen Tagen auftreten sollte.
Wenn Sie aida vorschriftsmäßig einnehmen, besteht der Empfängnisschutz auch an den 7 Tagen, an denen Sie keine Tablette einnehmen.
Wann beginnen Sie mit der Einnahme aus dem ersten Folienstreifen?
• Wenn Sie im vergangenen Monat noch keine „ Pille “ mit Hormonen zur Schwangerschaftsverhütung eingenommen haben:
Beginnen Sie mit der Einnahme von aida am ersten Tag Ihres Zyklus (d. h. am ersten Tag Ihrer Monatsblutung). Wenn Sie mit der Einnahme von aida am ersten Tag Ihrer Monatsblutung beginnen, besteht ein sofortiger Empfängnisschutz. Sie können auch zwischen Zyklustag 2 und 5 beginnen, müssen dann aber während der ersten 7 Tage der Einnahme zusätzliche empfängnisverhütende Maßnahmen (z. B. ein Kondom) anwenden.
• Wenn Sie von einem kombinierten hormonalen Verhütungsmittel („Pille “ mit zwei hormonellen Wirkstoffen) oder von einem kombinierten empfängnisverhütenden Vaginalring oder Pflaster wechseln:
Sie können mit der Einnahme von aida vorzugsweise am Tag nach Einnahme der letzten wirkstoffhaltigen Tablette (die letzte Tablette, die Wirkstoffe enthält) Ihrer zuvor eingenommenen „Pille“ beginnen, spätestens aber am Tag nach den einnahmefreien Tagen Ihres Vorgängerpräparates (oder nach Einnahme der letzten wirkstofffreien Tablette Ihres Vorgängerpräparates). Wenn Sie bisher einen kombinierten empfängnisverhütenden Vaginalring oder ein Pflaster angewendet haben, folgen Sie den Anweisungen Ihres Arztes/Ihrer Ärztin.
• Wenn Sie von einem Mittel, das nur ein Hormon (Gelbkörperhormon) enthält (sog. „Minipille “, einem Injektionspräparat, einem Implantat oder einem gestagenfreisetzenden Intrauterinpessar ("Spirale")) wechseln:
Sie können die „Minipille“ an jedem beliebigen Tag absetzen und am nächsten Tag direkt mit der Einnahme von aida beginnen (nach Umstellung von einem Implantat oder einer "Spirale" beginnen Sie mit der Einnahme von aida an dem Tag, an dem das Implantat oder die "Spirale" entfernt wird bzw. nach einer Injektion zu dem Zeitpunkt, an dem normalerweise die nächste Injektion erfolgen müsste). Wenden Sie in allen Fällen während der ersten 7 Tage eine zusätzliche Methode zur Empfängnisverhütung an (z. B. ein Kondom).
• Wenn Sie eine Fehlgeburt hatten:
Sprechen Sie bitte mit Ihrem Arzt/Ihrer Ärztin.
• Wenn Sie gerade ein Kind bekommen haben:
Wenn Sie ein Kind bekommen haben, beginnen Sie die Einnahme von aida nicht früher als 21 bis 28 Tage nach der Geburt. Wenn Sie nach dem 28. Tag mit der Einnahme beginnen, wenden Sie während der ersten 7 aida-Einnahmetage zusätzlich eine so genannte Barrieremethode (z. B. ein Kondom) zur Empfängnisverhütung an.
Wenn Sie nach der Geburt bereits Geschlechtsverkehr hatten, müssen Sie vor (erneutem) Beginn der Einnahme von aida sicher sein, dass Sie nicht schwanger sind oder warten Sie die nächste Monatsblutung ab.
• Wenn Sie nach der Geburt des Kindes stillen und (wieder) mit der Einnahme von aida beginnen wollen:
Lesen Sie den Abschnitt "Stillzeit", Seite 10.
Wenn Sie nicht sicher sind, wann Sie beginnen können, fragen Sie Ihren Arzt/Ihre Ärztin.
Wenn Sie eine größere Menge von aida eingenommen haben, als Sie sollten
Es liegen keine Berichte zu schwerwiegenden schädlichen Folgen nach Einnahme von zu vielen aida-Tabletten vor.
Wenn Sie mehrere Tabletten auf einmal eingenommen haben, kann es zu Übelkeit und Erbrechen kommen. Bei jungen Mädchen können Blutungen aus der Scheide auftreten.
Wenn Sie zu viele Tabletten aida eingenommen haben oder feststellen, dass ein Kind versehentlich Tabletten verschluckt hat, fragen Sie Ihren Arzt/Ihre Ärztin oder Apotheker/Apothekerin um Rat.
Wenn Sie die Einnahme von aida vergessen haben
• Wenn Sie die Einnahmezeit einmalig um weniger als 12 Stunden überschritten haben, ist die empfängnisverhütende Wirkung nicht herabgesetzt. Sie müssen die Einnahme der vergessenen Tablette so schnell wie möglich nachholen und die folgenden Tabletten dann wieder zur gewohnten Zeit einnehmen.
• Wenn Sie die Einnahmezeit einmalig um mehr als 12 Stunden überschritten haben, kann die empfängnisverhütende Wirkung herabgesetzt sein. Je mehr Tabletten Sie vergessen haben, desto größer ist das Risiko einer Schwangerschaft.
Das Risiko einer ungewollten Schwangerschaft ist besonders hoch, wenn Sie eine Tablette am Anfang oder am Ende des Folienstreifens vergessen. Sie sollten dann die nachfolgenden Regeln beachten (siehe Schema auf Seite 13):
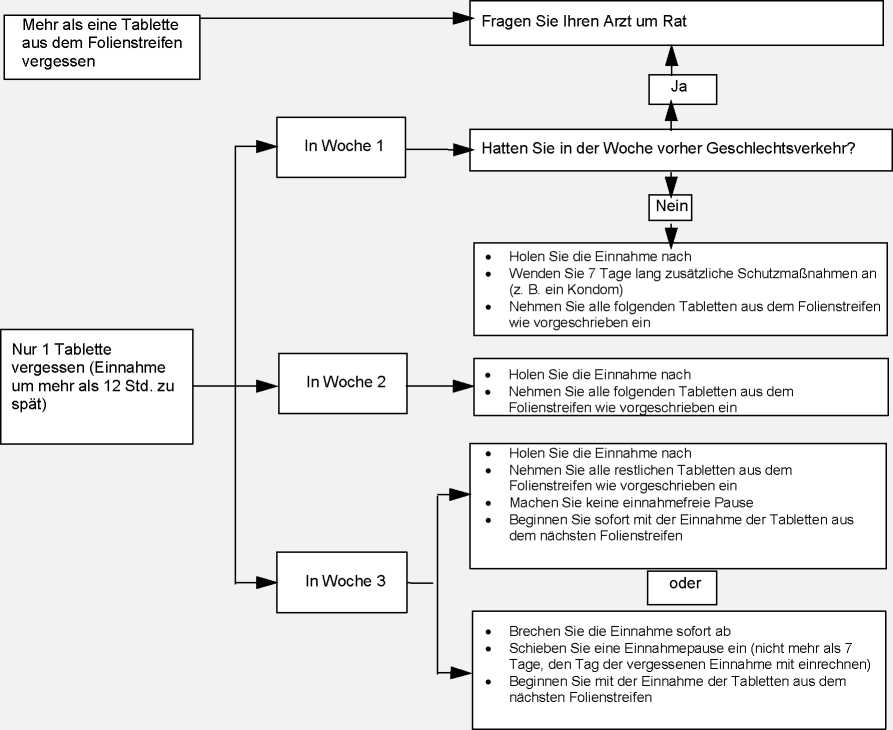
• Sie haben mehr als eine Tablette im aktuellen Folienstreifen vergessen
Fragen Sie Ihren Arzt/Ihre Ärztin.
• Sie haben eine Tablette in Woche 1 vergessen
Holen Sie die Tabletteneinnahme so schnell wie möglich nach, auch wenn dies bedeutet, dass Sie zwei Tabletten zur gleichen Zeit einnehmen müssen. Setzen Sie danach die Tabletteneinnahme wie gewohnt fort. Sie müssen jedoch in den nächsten 7 Tagen zusätzliche empfängnisverhütende Schutzmaßnahmen z. B. ein Kondom anwenden. Wenn Sie in der Woche vor der vergessenen Einnahme Geschlechtsverkehr hatten, besteht das Risiko einer Schwangerschaft. Informieren Sie in diesem Fall Ihren Arzt/Ihre Ärztin.
• Sie haben eine Tablette in Woche 2 vergessen
Holen Sie die Tabletteneinnahme so schnell wie möglich nach, auch wenn dies bedeutet, dass Sie zwei Tabletten zur gleichen Zeit einnehmen müssen. Setzen Sie die Tabletteneinnahme wie gewohnt fort. Die empfängnisverhütende Wirkung ist gewährleistet und Sie müssen keine zusätzlichen Schutzmaßnahmen anwenden.
• Sie haben eine Tablette in Woche 3 vergessen
Sie können zwischen zwei Möglichkeiten wählen:
1. Holen Sie die Einnahme so schnell wie möglich nach, auch wenn dies bedeutet, dass Sie zwei Tabletten zur gleichen Zeit einnehmen müssen. Setzen Sie die Tabletteneinnahme wie gewohnt fort. Lassen Sie die einnahmefreie Pause aus und beginnen Sie gleich mit der Einnahme aus dem nächsten Folienstreifen.
Höchstwahrscheinlich kommt es erst am Ende des zweiten Folienstreifens zu einer Entzugsblutung, jedoch treten möglicherweise leichte oder menstruationsähnliche Blutungen während der Einnahme aus dem zweiten Folienstreifen auf.
2. Sie können die Einnahme aus dem aktuellen Folienstreifen auch abbrechen und sofort mit der einnahmefreien Pause von 7 Tagen beginnen (der Tag, an dem Sie die Tablette vergessen haben, muss mitgezählt werden). Wenn Sie mit der Einnahme aus der neuen Packung an Ihrem gewohnten Wochentag beginnen möchten, können Sie eine einnahmefreie Pause von
weniger als 7 Tagen einschieben.
Wenn Sie einer der beiden Alternativen folgen, ist der Empfängnisschutz nicht eingeschränkt.
• Wenn Sie eine der Tabletten aus einem Folienstreifen vergessen haben und während der folgenden ersten einnahmefreien Pause keine Blutung auftritt, sind Sie möglicherweise schwanger geworden. Suchen Sie in diesem Fall Ihren Arzt/Ihre Ärztin auf, bevor Sie mit einem neuen Folienstreifen beginnen.
Was müssen Sie beachten, wenn Sie an Erbrechen oder schwerem Durchfall leiden?
Wenn Sie in den ersten 3 bis 4 Stunden nach der Einnahme der Tablette erbrechen oder wenn schwerer Durchfall auftritt, sind die Wirkstoffe der "Pille" möglicherweise noch nicht vollständig von Ihrem Körper aufgenommen worden. Diese Situation ist ähnlich wie das Vergessen einer Tablette. Nehmen Sie nach Erbrechen oder Durchfall so schnell wie möglich eine Tablette aus einem Ersatzfolienstreifen ein, wenn möglich innerhalb von 12 Stunden nach dem üblichen Einnahmezeitpunkt der "Pille". Wenn dies nicht möglich ist oder 12 Stunden überschritten sind, folgen Sie den Anweisungen im Abschnitt "Wenn Sie die Einnahme von aida vergessen haben", Seite 11.
Verschieben der Blutungstage: Was müssen Sie beachten?
Auch wenn es nicht empfohlen wird, können Sie Ihre Monatsblutung hinausschieben, indem Sie direkt ohne Einnahmepause mit der Einnahme aus dem nächsten Folienstreifen aida fortfahren und diesen bis zum Ende aufbrauchen. Während der Einnahme aus diesem zweiten Folienstreifen kann es zu leichten oder menstruationsähnlichen Blutungen kommen. Beginnen Sie nach der darauf folgenden regulären 7-tägigen Einnahmepause wie üblich mit dem nächsten Folienstreifen.
Sie sollten Ihren Arzt/Ihre Ärztin um Rat fragen, bevor Sie sich entscheiden, die Blutung zu verschieben.
Änderung des Wochentages, an dem die Monatsblutung einsetzt: Was müssen Sie beachten?
Wenn Sie Ihre Tabletten vorschriftsmäßig einnehmen, setzt Ihre Monatsblutung während der einnahmefreien Woche ein. Wenn Sie diesen Wochentag ändern müssen, verkürzen Sie die Anzahl der einnahmefreien Tage (aber erhöhen Sie die Anzahl niemals - 7 Tage sind das Maximum!). Wenn Ihre Einnahmepause z. B. normalerweise an einem Freitag beginnt und Sie möchten den Beginn auf einen Dienstag (also 3 Tage früher) verschieben, beginnen Sie mit der Einnahme aus dem neuen Folienstreifen 3 Tage früher als üblich. Wenn Sie sich für eine sehr kurze Einnahmepause entscheiden (z. B. 3 Tage oder weniger) kann es sein, dass es während dieser Tage zu keiner Blutung kommt. Möglicherweise treten dann jedoch leichte oder menstruationsähnliche Blutungen auf.
Wenn Sie die Einnahme von aida abbrechen
Sie können die Einnahme von aida zu jeder Zeit beenden. Wenn Sie nicht schwanger werden wollen, sprechen Sie mit Ihrem Arzt/Ihrer Ärztin über andere sichere Verhütungsmethoden. Wenn Sie schwanger werden möchten, beenden Sie die Einnahme von aida und warten Ihre Monatsblutung ab, bevor Sie versuchen, schwanger zu werden. So können Sie das Datum der voraussichtlichen Entbindung einfacher berechnen.
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt/Ihre Ärztin oder Apotheker/Apothekerin.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Wenn Sie Nebenwirkungen bekommen, insbesondere wenn diese schwerwiegend und anhaltend sind, oder wenn sich Ihr Gesundheitszustand verändert, und Sie dieses auf aida zurückführen, sprechen Sie bitte mit Ihrem Arzt.
Alle Frauen, die kombinierte hormonale Kontrazeptiva anwenden, haben ein erhöhtes Risiko für Blutgerinnsel in den Venen (venöse Thromboembolie [VTE]) oder Arterien (arterielle Thromboembolie [ATE]). Weitere Einzelheiten zu den verschiedenen Risiken im Zusammenhang mit der Anwendung kombinierter hormonaler Kontrazeptiva siehe Abschnitt 2, „Was sollten Sie vor der Anwendung von aida beachten?“
Die nachstehend aufgeführten Nebenwirkungen wurden mit der Einnahme von aida in Verbindung gebracht:
Häufige Nebenwirkungen (1 bis 10 von 100 Anwenderinnen können betroffen sein):
• Stimmungsschwankungen
• Kopfschmerzen
• Bauchschmerzen (Magenschmerzen)
• Akne
• Brustschmerzen, Vergrößerung der Brust, Druckempfindlichkeit der Brust, schmerzhafte oder unregelmäßige Monatsblutungen
• Gewichtszunahme.
Gelegentliche Nebenwirkungen (1 bis 10 von 1.000 Anwenderinnen können betroffen sein):
• Candidose (Pilzinfektion)
• Fieberbläschen (Herpes simplex)
• allergische Reaktionen
• Zunahme des Appetits
• Depression, Nervosität, Schlafstörungen
• Hautkribbeln, Schwindel (Vertigo)
• Sehstörungen
• unregelmäßiger oder ungewöhnlich schneller Herzschlag
• Blutgerinnsel (Thrombose) in der Lunge (Lungenembolie), Bluthochdruck, niedriger Blutdruck, Migräne, Krampfadern
• Entzündung im Rachenraum
• Übelkeit, Erbrechen, Entzündung des Magens und/oder des Darms, Durchfall, Verstopfung
• Plötzliche Schwellung der Haut und/oder Schleimhäute (z.B. Zunge oder Rachen), und/oder Schluckbeschwerden oder Nesselsucht zusammen mit Atembeschwerden (Angioödem), Haarausfall (Alopezie), Ekzem, Juckreiz, Hautausschläge, trockene Haut, fettige Haut (Seborrhoische Dermatitis)
• Nackenschmerz, Schmerzen in den Armen und Beinen, Muskelkrämpfe
• infektiöse Harnblasenentzündung
• Knoten in der Brust (gutartig und Krebs), Milchbildung, obwohl Sie nicht schwanger sind (Galaktorrhoe), Eierstockzysten, Hitzewallungen, Ausbleiben der Monatsblutung, sehr starke
Monatsblutungen, Ausfluss aus der Scheide, Trockenheit der Scheide, Unterbauchschmerzen (Becken), auffälliger Gebärmutterhalsabstrich (Papanicolaou- oder Pap-Abstrich), Abnahme des Geschlechtstriebs
• Wassereinlagerung (Flüssigkeitsretention), Antriebsschwäche, übermäßiger Durst, vermehrtes Schwitzen
• Gewichtsabnahme
Seltene Nebenwirkungen (1 bis 10 von 10.000 Anwenderinnen können betroffen sein):
• Asthma
• Beeinträchtigung des Hörvermögens
• Erythema nodosum (sog. Knotenrose mit charakteristischen, schmerzhaften, rötlichen Hautknoten)
• Erythema multiforme (Hautausschlag mit Rötung oder Entzündung, die in konzentrischen Kreisen auftritt)
• gesundheitsschädliche Blutgerinnsel in einer Vene oder Arterie, zum Beispiel: o in einem Bein oder Fuß (d. h. VTE)
o in einer Lunge (d. h. LE) o Herzinfarkt o Schlaganfall
o Mini-Schlaganfall oder vorübergehende, einem Schlaganfall ähnelnde Symptome, die als transitorische ischämische Attacke (TIA) bezeichnet werden o Blutgerinnsel in der Leber, dem Magen/Darm, den Nieren oder dem Auge.
Die Wahrscheinlichkeit für ein Blutgerinnsel kann erhöht sein, wenn Sie an einer anderen Erkrankung leiden, die dieses Risiko erhöht (weitere Informationen zu den Erkrankungen, die das Risiko für ein Blutgerinnsel erhöhen und die Symptome eines Blutgerinnsels siehe Abschnitt 2).
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist aida aufzubewahren?
Arzneimittel für Kinder unzugänglich aufbewahren.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Verfallsdatum
Sie dürfen dieses Arzneimittel nach dem auf der Packung unter "Verwendbar bis” oder ”Verw. bis” angegebenen Verfallsdatum nicht mehr anwenden.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker/Ihre Apothekerin wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Diese Maßnahme hilft die Umwelt zu schützen.
6. Inhalt der Packung und weitere Informationen Was aida enthält
• Die Wirkstoffe sind Ethinylestradiol (als Betadex-Clathrat (1:2)) und Drospirenon.
Eine Filmtablette enthält 0,020 Milligramm Ethinylestradiol (als Betadex-Clathrat (1:2)) und 3,0 Milligramm Drospirenon.
• Die sonstigen Bestandteile sind Lactose-Monohydrat, Maisstärke, Magnesiumstearat (Ph. Eur.), Hypromellose, Talkum, Titandioxid (E171), Eisen(III)-oxid (E172)
Wie aida aussieht und Inhalt der Packung
• Jede Blisterpackung aida enthält 21 hellrosa Filmtabletten.
• aida Tabletten sind Filmtabletten; der Tablettenkern ist mit einem Film überzogen. Die Tabletten sind hellrosa, rund mit gewölbten Oberflächen und einseitiger Prägung mit den Buchstaben "DS" in einem regelmäßigen Sechseck.
• aida ist in Packungen mit 1 Folienstreifen zu 21 Tabletten, mit 3 Folienstreifen zu je 21 Tabletten und mit 6 Folienstreifen zu je 21 Tabletten erhältlich.
Pharmazeutischer Unternehmer
Jenapharm GmbH & Co. KG Otto-Schott-Straße 15 D-07745Jena
Telefon 03641 - 648888 Telefax 03641 - 648889
E-Mail: frauengesundheit@jenapharm.de
Hersteller
Bayer Pharma AG D - 13342 Berlin
und
Bayer Weimar GmbH und Co. KG Döbereinerstr. 20 D - 99427 Weimar
und
Jenapharm GmbH und Co. KG Otto-Schott-Str. 15 D - 07745 Jena
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
• Niederlande: Liofora
• Deutschland: aida
Diese Gebrauchsinformation wurde zuletzt überarbeitet im Dezember 2014
17