Airflusal Forspiro 50 Mikrogramm/500 Mikrogramm/Dosis Einzeldosiertes Pulver Zur Inhalation
FACHINFORMATION
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
Airflusal Forspiro 50 Mikrogramm/500 Mikrogramm/Dosis einzeldosiertes Pulver zur Inhalation
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede abgemessene Dosis von Airflusal Forspiro enthält:
50 Mikrogramm Salmeterol (als Salmeterolxinafoat) und 500 Mikrogramm Fluticason-17-propionat.
Dies entspricht einer abgegebenen Dosis von:
45 Mikrogramm Salmeterol (als Salmeterolxinafoat) und 465 Mikrogramm Fluticason-17-propionat.
Sonstiger Bestandteil mit bekannter Wirkung: 11,93 mg Lactose-Monohydrat pro abgemessener Dosis.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Einzeldosiertes Pulver zur Inhalation Weißes, homogenes Pulver.
Das einzeldosierte Pulver, welches in Blisterpackungen enthalten ist, wird durch einen lilafarbenen Pulverinhalator aus Kunststoff abgegeben.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Asthma bronchiale
Airflusal Forspiro ist indiziert für die regelmäßige Behandlung von Asthma bronchiale, bei der die Anwendung eines Kombinationspräparates (langwirksamer ß2-Agonist und inhalatives Kortikoid) angezeigt ist:
• bei Patienten, die mit inhalativen Kortikoiden und kurzwirksamen ß2-Agonisten zur bedarfsweisen Inhalation nicht ausreichend eingestellt sind
oder
• bei Patienten, die mit inhalativen Kortikoiden und langwirksamen ß2-Agonisten ausreichend eingestellt sind.
Chronisch obstruktive Lungenerkrankung (COPD)
Airflusal Forspiro ist angezeigt für die symptomatische Behandlung von Patienten mit COPD mit einem FEV1 < 60 % des Normwertes (vor Anwendung eines Bronchodilatators) und wiederholt aufgetretenen Exazerbationen, die trotz regelmäßiger bronchienerweiternder Therapie signifikante Symptome aufweisen.
4.2 Dosierung und Art der Anwendung Art der Anwendung
Airflusal Forspiro ist ausschließlich zur Inhalation bestimmt.
Patienten sollten darauf hingewiesen werden, dass es für den Behandlungserfolg erforderlich ist, Airflusal Forspiro täglich anzuwenden, auch wenn sie symptomfrei sind.
Patienten sollten regelmäßig weiterhin vom Arzt untersucht werden, so dass die Dosisstärke von Salmeterol/Fluticason-17-propionat, die sie erhalten, optimal bleibt und nur nach ärztlichem Rat geändert wird.
Die Dosis sollte so angepasst werden, dass eine effektive Kontrolle der Symptome mit der niedrigsten Dosierung erreicht wird. Wird unter 2-mal täglicher Inhalation der niedrigsten Dosisstärke von Salmeterol/Fluticason-17-propionat eine gute Symptomkontrolle erreicht, könnte der nächste Schritt darin bestehen, ein Kortikoid allein zu inhalieren.
Patienten, die einen langwirksamen ß2-Agonisten benötigen, könnten alternativ auf eine 1-mal tägliche Inhalation von Airflusal Forspiro eingestellt werden, wenn nach Ermessen des Arztes eine Kontrolle des Krankheitsbildes gewährleistet ist. Bei der möglichen Einmaldosierung sollten die Patienten, die in der Vorgeschichte nächtliche Symptome aufweisen, spätabends und die Patienten, die in der Vorgeschichte überwiegend tagsüber Symptome aufweisen, morgens inhalieren.
Patienten sollte die Dosisstärke von Salmeterol/Fluticason-17-propionat verordnet werden, die eine für den Schweregrad der Erkrankung geeignete Dosis an Fluticason-17-propionat enthält. Wenn ein Patient Dosierungen außerhalb des empfohlenen Behandlungsschemas benötigt, sollten ausreichende Dosierungen eines ß2-Agonisten und/oder eines Kortikoids verschrieben werden.
Dosierung
Dosierungsempfehlungen Asthma bronchiale
Erwachsene und Jugendliche ab 12 Jahre
2-mal täglich 1 Inhalation mit 50 Mikrogramm Salmeterol und 500 Mikrogramm Fluticason-17-propionat.
Bei Erwachsenen und Jugendlichen mit mittelschwerem Asthma bronchiale (definiert als: Patienten mit täglichen Symptomen, mit täglicher Anwendung von Akutmedikation und mit mittelschwerer bis schwerer Einschränkung des Atemflusses), für die eine schnelle Asthmakontrolle essentiell ist, kann eine Kurzzeitanwendung von Airflusal Forspiro in Form einer Initialbehandlung in Betracht gezogen werden. In diesen Fällen ist die empfohlene Initialdosierung 2-mal täglich 1 Inhalation mit 100 Mikrogramm Fluticason-17-propionat und 50 Mikrogramm Salmeterol (einzeln gegeben oder als fixe Kombination).
Sobald eine Asthmakontrolle erreicht ist, sollte die Behandlung überprüft und erwogen werden, ob auf die Inhalation mit einem Kortikoid allein reduziert werden kann. Während der schrittweisen Verringerung der Dosierung sollte der Patient regelmäßig kontrolliert werden.
Waren ein oder zwei Kriterien des Schweregrads nicht erfüllt, zeigte sich kein klarer Nutzen der Kombinationsbehandlung gegenüber einer Inhalation von Fluticason-17-propionat allein als Initialbehandlung. Im Allgemeinen bleiben inhalative Kortikoide für die meisten Patienten die erste Behandlungsempfehlung. Airflusal Forspiro ist nicht vorgesehen für die Initialbehandlung bei leichtem Asthma bronchiale.
Die Stärke Salmeterol/Fluticason-17-propionat 50 Mikrogramm/100 Mikrogramm ist nicht angemessen für Erwachsene und Kinder mit schwerem Asthma bronchiale; es wird empfohlen, die geeignete Dosierung von einem inhalativen Kortikoid festzulegen, bevor eine fixe Kombination bei Patienten mit schwerem Asthma bronchiale eingesetzt werden kann.
Für Dosierungen, die mit Airflusal Forspiro nicht realisiert werden können, stehen andere Stärken von Salmeterol/Fluticason-17-propionat-haltigen Arzneimitteln zur Verfügung.
COPD
Erwachsene
2-mal täglich 1 Inhalation mit 50 Mikrogramm Salmeterol und 500 Mikrogramm Fluticason-17-propionat.
Spezielle Patientengruppen
Die Dosierung muss bei älteren Patienten oder bei Patienten mit eingeschränkter Nierenfunktion nicht angepasst werden. Für die Anwendung von Airflusal Forspiro bei Patienten mit eingeschränkter Leberfunktion liegen keine Daten vor.
Kinder
Airflusal Forspiro wird für Kinder nicht empfohlen.
Gebrauchsanleitung
Den Patienten sollte gezeigt werden, wie der Forspiro Inhalator anzuwenden ist. Zusätzlich sollte die korrekte Anwendung regelmäßig überprüft werden.
Der Inhalator enthält 60 Dosen des pulverförmigen Arzneimittels in einem aufgewickelten Folienstreifen. Das Gerät ist mit einem Dosiszähler ausgestattet, der von 60 bis 0 zurückzählt und anzeigt, wie viele Dosen noch zur Verfügung stehen. Wenn die letzten 10 Dosen erreicht sind, werden die Zahlen auf rotem Hintergrund angezeigt.
Der Inhalator ist nicht nachfüllbar - nachdem die letzte Dosis aufgebraucht ist, sollte er entsorgt und durch einen Neuen ersetzt werden.
Schutz kappe
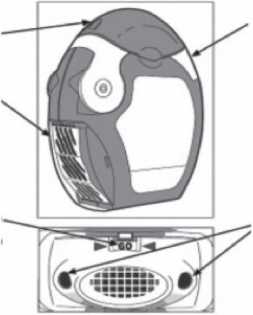
Weißer Hebel:
Diesen Hebel nur dann betätigen, wenn Sie bereit sind, eine Dosis zu inhalieren.
Lufteinlässe:
An beiden Seiten des Mundstücks.
Seitenfach:
Hier sammelt sich der leere Folienstreifen an, der entfernt werden kann.
Dosiszähler; Nach Offnen der Schutzkappe können Sie überprüfen, wie viele Einzeldosen noch übrig sind.
Vor der Anwendung
• Die durchsichtige Abdeckung des Seitenfachs soll geöffnet werden.
• Der Folienstreifen soll wie unten gezeigt vorsichtig an der Perforation abgetrennt werden. An dem Folienstreifen soll nicht gezogen oder gerissen werden.
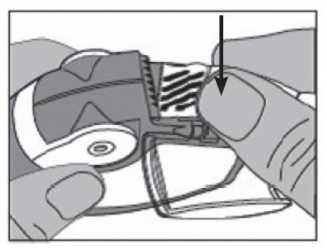
• Die Abdeckung des Seitenfachs soll danach wieder verschlossen werden und der verwendete Folienstreifen soll entsorgt werden.
Wichtig: Während der Anwendung des Inhalators werden sich allmählich leere Folienstreifen in dem Seitenfach ansammeln. Folienstreifen mit schwarzen Streifen enthalten kein Arzneimittel. Anschließend werden die nummerierten Folienstreifen in dem Seitenfach sichtbar. Das Seitenfach sollte nie mehr als 3 Folienstreifen enthalten, da sie zu einer Verstopfung des Inhalators führen können. Die Folienstreifen sollten vorsichtig wie oben gezeigt aus dem Seitenfach entfernt werden.
Anwendung des Inhalators
Der Inhalator soll wie auf den Abbildungen gezeigt in den Händen gehalten werden.
1. Öffnen
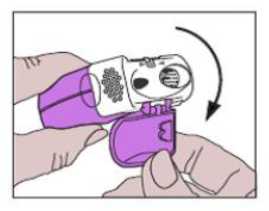
• Die Schutzkappe soll durch Umklappen nach unten geöffnet werden, um das Mundstück freizulegen.
• Der Dosiszähler soll überprüft werden, um zu kontrollieren, wie viele Dosen noch zur Verfügung stehen.
2. Dosis vorbereiten
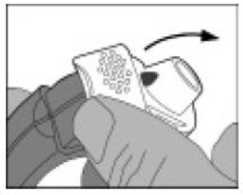
• Das Randstück des weißen Hebels soll nach oben geklappt werden. Das Seitenfach soll geschlossen sein.
Hinweis: Der weiße Hebel soll nur dann betätigt werden, wenn der Patient bereit ist, eine Dosis des Arzneimittels zu inhalieren. Beim unnötigen Betätigen des weißen Hebels werden Dosen verschwendet.
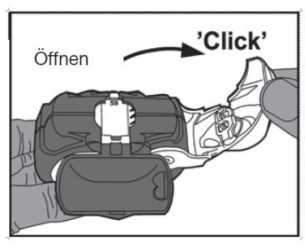
• Öffnen: Der weiße Hebel soll bis zum Anschlag umgelegt werden, bis dieser mit einem klickendem Geräusch einrastet. Hierdurch gelangt eine neue Dosis in die Position, deren Nummer an der Oberseite zu sehen ist.
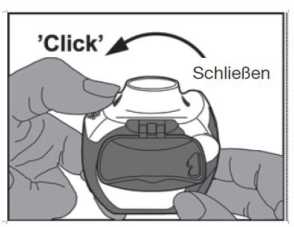
• Schließen: Der weiße Hebel soll anschließend wieder vollständig zurück in seine ursprüngliche Position gebracht werden, bis er mit einem klickendem Geräusch einrastet. Der Inhalator ist nun für die sofortige Anwendung bereit.
3. Dosis inhalieren
• Der Patient soll soweit wie möglich ausatmen, ohne dass es unangenehm wird. Dabei soll das Mundstück vom Mund entfernt sein. Es soll unter keinen Umständen direkt in den Inhalator ausgeatmet werden, da dies die Dosis beeinflussen kann.
• Der Inhalator soll gerade und mit der Schutzkappe nach unten gehalten werden.
• Die Lippen sollen das Mundstück fest umschließen.
• Der Patient soll gleichmäßig und tief durch den Inhalator einatmen - nicht durch die Nase.
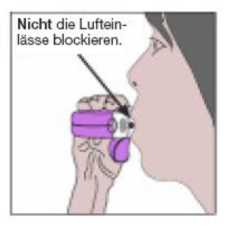
• Der Inhalator soll vom Mund weg gehalten werden und der Atem etwa 5-10 Sekunden lang angehalten werden bzw. so lange, wie es problemlos möglich ist.
• Danach soll der Patient langsam ausatmen, jedoch nicht in den Inhalator.
• Die Schutzkappe soll wieder auf das Mundstück gesetzt werden, um dieses zu schließen.
• Der Mund soll mit Wasser ausgespült werden und dieses ausgespuckt werden. Dies kann das Auftreten von Pilzinfektionen im Mund und Heiserkeit verhindern helfen.
Reinigung
• Das Mundstück soll bei Bedarf von außen mit einem sauberen, trockenen Tuch abgewischt werden.
• Der Inhalator darf zum Reinigen oder für andere Zwecke nicht zerlegt werden!
• Der Inhalator und dessen Teile dürfen nicht mit Wasser oder angefeuchteten Tüchern gereinigt werden, da Feuchtigkeit die Dosis beeinflussen kann!
• Nadel oder andere spitze Gegenstände dürfen niemals in das Mundstück oder in andere Geräteteile gesteckt werden, da dies den Inhalator beschädigen kann!
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Airflusal Forspiro darf nicht für die Behandlung von akuten Asthmasymptomen eingesetzt werden, für die ein schnell- und kurzwirksamer Bronchodilatator benötigt wird. Patienten sollten darauf hingewiesen werden, ihre Inhalationsgeräte für die Behandlung eines akuten Asthmaanfalls jederzeit bei sich zu haben.
Der Therapiebeginn mit Airflusal Forspiro sollte nicht während einer Exazerbation erfolgen oder wenn sich das Asthma signifikant verschlechtert oder akut verschlimmert.
Während der Behandlung mit Airflusal Forspiro können schwere Asthma-assoziierte unerwünschte Ereignisse und Exazerbationen auftreten. Die Patienten sollten aufgefordert werden, die Behandlung fortzusetzen, aber ärztlichen Rat einzuholen, wenn keine Kontrolle der Asthmasymptome zu erreichen ist oder sich diese nach Therapiebeginn mit Airflusal Forspiro verschlimmern.
Eine erhöhte Notwendigkeit zum Gebrauch von Bedarfsmedikation (kurzwirksame Bronchodilatatoren) oder ein abgeschwächte Symptomlinderung nach Anwendung der Bedarfsmedikation sind Anzeichen für eine Verschlechterung der Kontrolle des Asthmas und die Patienten sollten erneut ärztlich untersucht werden.
Sobald eine Kontrolle der Asthmasymptome erreicht ist, kann in Betracht gezogen werden, die Dosis von Airflusal Forspiro stufenweise zu verringern. Während die Dosierung schrittweise reduziert wird, ist eine regelmäßige Überwachung des Patienten wichtig. Es sollte die niedrigste wirksame Dosis von Salmeterol/Fluticason-17-propionat eingesetzt werden (siehe Abschnitt 4.2).
Bei COPD-Patienten mit Exazerbationen ist in der Regel eine Behandlung mit systemischen Kortikosteroiden angezeigt. Daher sollten Patienten angewiesen werden, einen Arzt aufzusuchen, wenn sich die Symptome mit Airflusal Forspiro verschlechtern.
Bei Asthma-Patienten sollte wegen des Risikos einer Exazerbation die Behandlung mit Airflusal Forspiro nicht abrupt abgebrochen werden. Die Behandlung sollte unter ärztlicher Aufsicht schrittweise reduziert werden. Bei COPD-Patienten kann das Absetzen der Therapie auch mit einer Verschlechterung der Symptome verbunden sein, es sollte deshalb von einem Arzt überwacht werden.
Wie alle kortikoidhaltigen Arzneimittel zur Inhalation ist Airflusal Forspiro bei Patienten mit aktiver oder ruhender Lungentuberkulose und Pilzinfektionen, viralen oder anderen Infektionen der Luftwege mit Vorsicht anzuwenden. Eine entsprechende Behandlung sollte, wenn indiziert, umgehend erfolgen.
Airflusal Forspiro kann in seltenen Fällen Herzrhythmusstörungen, z. B. supraventrikuläre Tachykardie, Extrasystolen und Vorhofflimmern, und bei hohen therapeutischen Dosierungen eine geringe vorübergehende Reduktion des
Serumkaliumspiegels verursachen. Airflusal Forspiro ist bei Patienten mit schweren kardiovaskulären Erkrankungen oder Herzrhythmusstörungen und bei Patienten mit Diabetes mellitus, Thyreotoxikose, unkorrigierter Hypokaliämie oder bei Patienten mit einer Prädisposition zu niedrigen Serumkaliumspiegeln mit Vorsicht anzuwenden.
Es ist sehr selten über einen Anstieg der Blutglucosespiegel berichtet worden (siehe Abschnitt 4.8), und dies sollte bei der Verordnung für Patienten mit Diabetes mellitus in der Vorgeschichte berücksichtigt werden.
Wie bei anderer Inhalationsbehandlung können paradoxe Bronchospasmen mit einer sofortigen Zunahme des Giemens und Kurzatmigkeit nach der Anwendung ausgelöst werden. Ein paradoxer Bronchospasmus spricht auf schnell wirksame Bronchodilatatoren an und ist umgehend zu behandeln. Die Anwendung von Airflusal Forspiro sollte dann unverzüglich abgebrochen, der Patient untersucht und, wenn notwendig, eine alternative Behandlung begonnen werden.
Über die pharmakologischen Nebenwirkungen einer ^-Agonisten-Behandlung wie Tremor, Palpitationen und Kopfschmerzen ist berichtet worden. Sie sind aber meist vorübergehend und klingen bei regelmäßiger Behandlung wieder ab.
Systemische Effekte können bei der Behandlung mit jedem inhalativen Kortikoid auftreten, insbesondere unter hohen Dosierungen, die für einen langen Zeitraum verschrieben werden. Diese Effekte sind allerdings viel weniger wahrscheinlich als unter der oralen Gabe von Kortikoiden. Mögliche systemische Effekte schließen Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression,
Verminderung der Knochendichte, Katarakt und Glaukom und seltener eine Reihe von psychischen oder Verhaltensveränderungen einschließlich ungewöhnlicher Aktivitätssteigerung, Schlafstörungen, Angstzustände, Depression oder Aggression (vor allem bei Kindern) ein (siehe den unteren Abschnitt zu Kindern und Jugendlichen zur weiteren Information bezüglich systemischer Effekte von inhalativen Kortikoiden bei Kindern und Jugendlichen). Deshalb ist es wichtig, den Patienten regelmäßig zu kontrollieren und die Dosis des inhalativen Kortikoids auf die niedrigste Dosis zu reduzieren, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann.
Die Inhalation von hohen Dosierungen inhalativer Kortikoide über einen längeren Zeitraum kann zu einer Nebennierenrindensuppression und akuter adrenaler Krise führen. Sehr seltene Fälle von Nebennierenrindensuppression und akuter adrenaler Krise wurden auch bei Fluticason-17-propionat-Dosen zwischen 500 Mikrogramm und weniger als 1.000 Mikrogramm beschrieben. Eine akute adrenale Krise kann möglicherweise durch Umstände wie Verletzung, Operation, Infektion oder jede schnelle Dosisreduktion ausgelöst werden. Die Symptome sind typischerweise unspezifisch wie z. B. Appetitlosigkeit, Bauchschmerzen, Gewichtsverlust, Müdigkeit, Kopfschmerzen, Übelkeit, Erbrechen, Hypotonie, Bewusstseinstrübung, Hypoglykämie und Krampfanfälle. Im Rahmen von Stressperioden oder einer geplanten Operation sollte eine zusätzliche systemische Gabe von Kortikoiden in Betracht gezogen werden.
Die Vorteile einer Inhalationsbehandlung mit Fluticason-17-propionat bestehen darin, dass sie den Bedarf an oralen Kortikoiden vermindern sollten. Allerdings besteht bei der Umstellung von oral kortikoidpflichtigen Patienten für eine beträchtliche Zeit das
Risiko für eine eingeschränkte Nebennierenrindenfunktion. Deshalb sollten diese Patienten mit besonderer Vorsicht behandelt werden und die Nebennierenrindenfunktion ist regelmäßig zu kontrollieren. Patienten, die in der Vergangenheit hohe Notfall-Kortikoid-Dosen erhalten haben, können ebenfalls gefährdet sein. Die Möglichkeit einer bleibenden Einschränkung sollte bei Notfällen oder in bestimmten Situationen, die Stress verursachen könnten, in Betracht gezogen, und die entsprechende Kortikoid-Behandlung überlegt werden. Das Ausmaß der Nebennierenrindenfunktionseinschränkung könnte es erforderlich machen, vor bestimmten Eingriffen einen Facharzt zu konsultieren.
Ritonavir kann die Plasmakonzentration von Fluticason-17-propionat erheblich erhöhen. Deshalb sollte eine gleichzeitige Anwendung vermieden werden, es sei denn, der mögliche Nutzen für den Patienten überwiegt das Risiko systemischer Kortikoid-Nebenwirkungen. Ebenso besteht ein erhöhtes Risiko systemischer Nebenwirkungen bei Kombination von Fluticason-17-propionat mit anderen potenten CYP3A-Inhibitoren (siehe Abschnitt 4.5).
Pneumonie bei COPD-Patienten
Eine Zunahme der Inzidenz von Pneumonien, einschließlich Pneumonien, die eine Krankenhauseinweisung erfordern, wurde bei COPD-Patienten beobachtet, die inhalative Kortikosteroide erhalten. Es gibt einige Hinweise darauf, dass ein erhöhtes Risiko für Pneumonien mit einer erhöhten Steroid-Dosierung einhergeht. Dies konnte jedoch nicht eindeutig in allen Studien gezeigt werden.
Es gibt keinen eindeutigen klinischen Nachweis für Unterschiede im Ausmaß des Pneumonie-Risikos innerhalb der Klasse der inhalativen Kortikosteroide.
Ärzte sollten bei COPD-Patienten auf eine mögliche Entwicklung einer Pneumonie achten, da sich die klinischen Merkmale einer solchen Entzündung mit den Symptomen von COPD-Exazerbationen überschneiden.
Risikofaktoren für eine Pneumonie bei COPD-Patienten umfassen derzeitiges Rauchen, höheres Alter, niedrigen Body-Mass-Index (BMI) und schwere COPDAusprägungen.
Daten aus einer großen klinischen Studie (Salmeterol Multi-Center Asthma Research Trial, SMART) weisen darauf hin, dass afroamerikanische Patienten unter Salmeterol ein höheres Risiko für schwere atemwegsbedingte Ereignisse oder Todesfälle haben als unter Placebo (siehe Abschnitt 5.1). Es ist nicht bekannt, ob dies auf pharmakogenetische oder andere Faktoren zurückzuführen ist. Patienten mit schwarzafrikanischer oder afrokaribischer Abstammung sollten daher aufgefordert werden, die Behandlung fortzusetzen, aber ärztlichen Rat zu suchen, wenn keine Kontrolle der Asthmasymptome zu erreichen ist oder sich diese unter der Anwendung von Airflusal Forspiro verschlechtern.
Die gleichzeitige systemische Anwendung von Ketoconazol erhöht die systemische Verfügbarkeit von Salmeterol in hohem Maße. Dies kann zu einem Anstieg der Inzidenz von systemischen Wirkungen (z. B. Verlängerung des QTc-Intervalls und Palpitationen) führen. Die gleichzeitige Behandlung mit Ketoconazol oder anderen potenten CYP3A4-Inhibitoren sollte deshalb vermieden werden, sofern der Nutzen das potentiell erhöhte Risiko von systemischen Nebenwirkungen der Behandlung mit Salmeterol nicht überwiegt (siehe Abschnitt 4.5).
Kinder und Jugendliche
Kinder und Jugendliche unter 16 Jahren, die hohe Dosen von Fluticason-17-propionat (charakteristischerweise > 1.000 Mikrogramm pro Tag) einnehmen, tragen ein besonderes Risiko. Systemische Effekte können auftreten, besonders, wenn hohe Dosen über lange Zeiträume verschrieben werden. Mögliche systemische Effekte schließen Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, akute adrenale Krise und Wachstumsverzögerung bei Kindern und Jugendlichen ein und, seltener, eine Reihe von psychischen oder Verhaltensänderungen einschließlich ungewöhnlicher Aktivitätssteigerung, Schlafstörungen, Ängstlichkeit, Depression oder Aggression. Es wird angeraten, das Kind oder den Jugendlichen an einen Pädiater mit zusätzlicher Facharztausbildung in der Pneumologie zu überweisen.
Es wird empfohlen, die Körpergröße von Kindern, die unter einer Dauerbehandlung mit einem inhalativen Kortikoid stehen, regelmäßig zu messen. Die Dosis des inhalativen Kortikoids sollte auf die niedrigste Dosis reduziert werden, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann.
Die Anwendung von Airflusal Forspiro kann bei Dopingkontrollen zu positiven Ergebnissen führen. Eine missbräuchliche Anwendung des Arzneimittels Airflusal Forspiro zu Dopingzwecken kann die Gesundheit gefährden.
Airflusal Forspiro enthält 11,93 mg Lactose-Monohydrat pro abgemessener Dosis. Diese Menge verursacht normalerweise keine Probleme bei Lactose-intoleranten Patienten.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
□-Blocker können die Wirkung von Salmeterol schwächen oder entgegen wirken.
Die Anwendung von sowohl nichtselektiven als auch selektiven n-Blockern sollte vermieden werden, solange es nicht zwingende Gründe für ihre Anwendung gibt. Eine potentiell schwere Hypokaliämie kann aus einer ^-Agonisten-Therapie resultieren. Besondere Vorsicht ist bei akutem schweren Asthma angeraten, da diese Wirkung bei gleichzeitiger Behandlung mit Xanthinderivaten, Steroiden und Diuretika verstärkt werden kann.
Die gleichzeitige Anwendung von anderen ß-adrenergen Arzneimitteln kann einen potentiell additiven Effekt haben.
Fluticason-17-propionat
Unter normalen Umständen werden nach inhalativer Anwendung aufgrund eines ausgeprägten First-Pass-Metabolismus und einer hohen systemischen Clearance durch das Cytochrom P450 3A4 in Darm und Leber niedrige Plasmakonzentrationen von Fluticason-17-propionat erreicht. Daher sind durch Fluticason-17-propionat vermittelte, klinisch relevante Wechselwirkungen unwahrscheinlich.
In einer Interaktionsstudie an gesunden Probanden erhöhten 2-mal täglich 100 mg Ritonavir (ein hochpotenter Inhibitor des Cytochrom P450 3A4) die Plasmakonzentrationen von nasal appliziertem Fluticason-17-propionat mehrere 100-mal, mit der Folge deutlich reduzierter Serumkortisolspiegel. Für die inhalative Anwendung von Fluticason-17-propionat liegen entsprechende Informationen nicht vor, jedoch ist ein deutlicher Anstieg der Plasmaspiegel von Fluticason-17-propionat zu erwarten. Es wurde über Fälle von Cushing-Syndrom und adrenaler Suppression berichtet. Die Kombination sollte vermieden werden, sofern der Nutzen das erhöhte Risiko systemischer Kortikoid-Nebenwirkungen nicht überwiegt.
In einer kleinen Studie an gesunden Probanden erhöhte Ketoconazol, ein etwas weniger potenter CYP3A-Inhibitor, die Fluticason-17-propionat-Exposition nach einer einzelnen Inhalation um 150 %. Dies reduzierte, verglichen mit Fluticason-17-propionat alleine, das Kortisol im Plasma stärker. Bei gleichzeitiger Behandlung mit anderen potenten CYP3A-Inhibitoren, wie z. B. Itraconazol, und moderaten CYP3A-Inhibitoren, wie z. B. Erythromycin, ist ebenfalls eine Zunahme der systemischen Fluticason-17-propionat-Exposition und des Risikos systemischer Nebenwirkungen zu erwarten. Deshalb ist Vorsicht geboten, und eine Langzeitbehandlung mit solchen Arzneimitteln sollte, wenn möglich, vermieden werden.
Salmeterol
Potente CYP3A4-Inhibitoren
Die gleichzeitige Anwendung von Ketoconazol (400 mg oral 1-mal täglich) und Salmeterol (50 Mikrogramm inhalativ 2-mal täglich) zeigte bei 15 Probanden über 7 Tage einen deutlichen Anstieg der Plasmaspiegel von Salmeterol (1,4-fache Cmax und 15-fache AUC). Dies kann zu einem Anstieg der Inzidenz von anderen systemischen Wirkungen der Behandlung mit Salmeterol (z. B. Verlängerung des QTc-Intervalls und Palpitationen) führen, verglichen zu einer Behandlung mit Salmeterol oder Ketoconazol allein (siehe Abschnitt 4.4).
Klinisch signifikante Auswirkungen wurden im Hinblick auf den Blutdruck, den Herzschlag sowie den Glucose- und Kaliumspiegel im Blut nicht beobachtet. Die gleichzeitige Anwendung von Ketoconazol erhöhte nicht die Eliminationshalbwertszeit oder die Akkumulation von Salmeterol nach wiederholter Anwendung.
Die gleichzeitige Anwendung von Ketoconazol soll vermieden werden, sofern der Nutzen das potentiell erhöhte Risiko von systemischen Nebenwirkungen der Behandlung mit Salmeterol nicht überwiegt. Ein ähnliches Wechselwirkungsrisiko kann sich möglicherweise mit anderen potenten CYP3A4-Inhibitoren (z. B. Itraconazol, Telithromycin, Ritonavir) ergeben.
Moderate CYP3A4-Inhibitoren
Die gleichzeitige Anwendung von Erythromycin (500 mg oral 3-mal täglich) und Salmeterol (50 Mikrogramm inhalativ 2-mal täglich) zeigte bei 15 Probanden über 6 Tage eine geringe, aber nicht statistisch signifikante Erhöhung der Verfügbarkeit von Salmeterol (1,4-fache Cmax und 1,2-fache AUC). Die gleichzeitige Anwendung von Erythromycin war nicht mit schwerwiegenden unerwünschten Ereignissen verbunden.
Schwangerschaft
Eine geringe Anzahl an Daten von schwangeren Frauen (zwischen 300-1.000 Schwangerschaften) lassen auf keine Missbildungen oder fetal/neonatale Toxizität von Salmeterol und Fluticason-17-propionat schließen. Tierstudien zeigten Reproduktionstoxizität nach der Anwendung von ß2-Adrenozeptoragonisten und Glukokortikosteroiden (siehe Abschnitt 5.3).
Die Anwendung von Airflusal Forspiro bei Schwangeren sollte nur in Betracht gezogen werden, wenn der erwartete Nutzen für die Mutter größer ist als das mögliche Risiko für den Fetus.
Bei der Behandlung von Schwangeren sollte die niedrigste wirksame Dosis an Fluticason-17-propionat eingesetzt werden, die nötig ist, um eine adäquate Kontrolle der Asthmasymptome zu gewährleisten.
Stillzeit
Es ist nicht bekannt, ob Salmeterol und Fluticason-17-propionat bzw. ihre Metaboliten in die Muttermilch übergehen.
Studien haben gezeigt, dass Salmeterol, Fluticason-17-propionat und ihre Metaboliten in die Milch von säugenden Ratten übergehen.
Ein Risiko beim Stillen von Neugeborenen/Säuglingen kann nicht ausgeschlossen werden. Es ist zu entscheiden, entweder abzustillen oder die Anwendung von Airflusal Forspiro zu beenden, wobei der Nutzen des Stillens für das Kind und der Nutzen der Therapie für die Mutter gegeneinander abgewogen werden muss.
Fertilität
Es liegen keine Daten am Menschen vor. In Tierstudien wurden keine Effekte von Salmeterol oder Fluticason-17-propionat auf die Fertilität gezeigt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Airflusal Forspiro hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Da Airflusal Forspiro Salmeterol und Fluticason-17-propionat enthält, können Nebenwirkungen nach Art und Schweregrad erwartet werden, die mit jedem der beiden Wirkstoffe verbunden sind. Es gibt keinen Hinweis darauf, dass zusätzliche Nebenwirkungen nach einer gemeinsamen Anwendung der beiden Wirkstoffe auftreten.
Nebenwirkungen, die bei der Anwendung von Salmeterol oder Fluticason-17-propionat auftraten, sind nachfolgend aufgeführt, geordnet nach Systemorganklassen und Häufigkeit. Die Häufigkeiten sind wie folgt definiert: sehr
häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1.000 bis < 1/100), selten (> 1/10.000 bis < 1/1.000), sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Die Häufigkeiten stammen aus den Daten der klinischen Studien. Das Auftreten in der Placebo-Gruppe wurde nicht berücksichtigt.
|
Systemorganklassen |
Nebenwirkung |
Häufigkeit |
|
Infektionen und |
Candidiasis (Soorbefall) im |
Häufig |
|
parasitäre |
Mund- und Rachenraum | |
|
Erkrankungen |
Pneumonie (bei COPD- |
Häufig135 |
|
Patienten) |
Häufig13 | |
|
Bronchitis ösophageale Candidiasis |
Selten | |
|
Erkrankungen des |
Überempfindlichkeitsreaktionen | |
|
Immunsystems |
mit den folgenden Erscheinungen: | |
|
- Überempfindlichkeitsreaktionen mit Hautbeteiligung |
Gelegentlich | |
|
- Angioödem (überwiegend faziales und oropharyngeales Ödem) |
Selten | |
|
- Atembeschwerden (Dyspnoe) |
Gelegentlich | |
|
- Atembeschwerden (Bronchospasmus) |
Selten | |
|
- anaphylaktische Reaktionen einschließlich anaphylaktischer Schock |
Selten | |
|
Endokrine |
Cushing-Syndrom, cushingoide |
Sehr selten4 |
|
Erkrankungen |
Erscheinungen, adrenale Suppression, Wachstumsverzögerung bei Kindern und Jugendlichen, Verminderung der Knochendichte | |
|
Stoffwechsel- und |
Hypokaliämie |
Häufig3 |
|
Ernährungsstörungen |
Hyperglykämie |
Gelegentlich |
|
Psychiatrische |
Angstzustände |
Gelegentlich |
|
Erkrankungen |
Schlafstörungen |
Gelegentlich |
|
Verhaltensänderungen, einschließlich Hyperaktivität und Reizbarkeit (vor allem bei Kindern) |
Selten | |
|
Depression oder Aggression (vor allem bei Kindern) |
Nicht bekannt | |
|
Erkrankungen des |
Kopfschmerzen |
Sehr häufig1 |
|
Nervensystems |
Tremor |
Gelegentlich |
|
Augenerkrankungen |
Katarakt |
Gelegentlich |
|
Glaukom |
Selten | |
|
Herzerkrankungen |
Palpitationen |
Gelegentlich |
|
Tachykardie |
Gelegentlich |
1 unter Placebo häufig berichtet
|
kardiale Arrhythmien (supraventrikuläre Tachykardie und Extrasystolie) Vorhofflimmern Angina pectroris |
Selten Gelegentlich Gelegentlich | |
|
Erkrankungen der |
Nasopharyngitis |
Sehr häufig2,3 |
|
Atemwege, des |
Irritation der |
Häufig |
|
Brustraums und |
Rachenschleimhaut | |
|
Mediastinums |
Heiserkeit/Dysphonie |
Häufig |
|
Sinusitis |
Häufig13 | |
|
paradoxer Bronchospasmus |
Selten4 | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Blutergüsse |
Häufig13 |
|
Skelettmuskulatur-, |
Muskelkrämpfe |
Häufig |
|
Bindegewebs- und |
traumatische Frakturen |
Häufig13 |
|
Knochenerkrankungen |
Arthralgien |
Häufig |
|
Myalgien |
Häufig |
2 unter Placebo sehr häufig berichtet
3 in einer COPD Studie über 3 Jahre berichtet
4 siehe Abschnitt 4.4
5 siehe Abschnitt 5.1
Erläuterung zu bestimmten Nebenwirkungen
Über die pharmakologischen Nebenwirkungen einer ß2-Agonisten-Behandlung wie Tremor, Palpitationen und Kopfschmerzen ist berichtet worden. Sie sind aber meist vorübergehend und klingen bei regelmäßiger Behandlung wieder ab.
Wie bei anderer Inhalationsbehandlung können paradoxe Bronchospasmen mit einer sofortigen Zunahme des Giemens und von Kurzatmigkeit nach der Anwendung ausgelöst werden. Ein paradoxer Bronchospasmus spricht auf schnell wirksame Bronchodilatatoren an und ist umgehend zu behandeln. Die Anwendung von Airflusal Forspiro sollte dann unverzüglich abgebrochen, der Patient untersucht und, wenn notwendig, eine alternative Behandlung begonnen werden.
Durch den Fluticason-17-propionat-Anteil können bei einigen Patienten Heiserkeit und Candidiasis (Soorbefall) im Mund- und Rachenraum und seltener in der Speiseröhre auftreten. Sowohl Heiserkeit als auch dem Auftreten einer Candidiasis kann vorgebeugt werden, indem nach der Anwendung des Arzneimittels der Mund mit Wasser ausgespült wird und/oder die Zähne geputzt werden. Bei symptomatischer Mund- und Rachen-Candidiasis empfiehlt sich die topische Behandlung mit einem gegen diese Pilzerkrankung wirksamen Arzneimittel, wobei die Anwendung von Salmeterol/Fluticason-17-propionat währenddessen fortgeführt werden sollte.
Pädiatrische Patientengruppe
Mögliche systemische Effekte schließen Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression und Wachstumsverzögerung bei Kindern und Jugendlichen ein (siehe Abschnitt 4.4). Bei Kindern können auch Angstzustände, Schlafstörungen und Verhaltensänderungen einschließlich Hyperaktivität und Reizbarkeit auftreten.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9Überdosierung
Aus klinischen Prüfungen liegen keine Daten zur Überdosierung mit Airflusal Forspiro vor. Im Folgenden sind jedoch Daten zur Überdosierung mit den Einzelwirkstoffen aufgeführt:
Die Anzeichen und Symptome einer Überdosierung mit Salmeterol sind Schwindel, Anstieg des systolischen Blutdrucks, Tremor, Kopfschmerzen und Tachykardie. Wenn die Behandlung mit Airflusal Forspiro aufgrund einer Überdosierung des Beta-Agonisten-Anteils des Arzneimittels abgebrochen werden muss, sollte die Anwendung einer geeigneten Kortikoid-Ersatzbehandlung in Erwägung gezogen werden. Zusätzlich kann eine Hypokaliämie auftreten, und deshalb sollten die Serumkaliumspiegel kontrolliert werden. Eine Kaliumsubstitution sollte in Erwägung gezogen werden.
Akut: Die kurzzeitige Inhalation von höheren als den therapeutisch empfohlenen Dosierungen von Fluticason-17-propionat kann zu einer zeitweiligen Suppression der Nebennierenrindenfunktion führen. Diese erfordert keine Notfallbehandlung, da die Nebennierenrindenfunktion innerhalb weniger Tage wieder hergestellt ist, wie durch Plasma-Kortisol-Messungen belegt wurde.
Chronische Überdosierung von inhaliertem Fluticason-17-propionat:
Siehe Abschnitt 4.4: Risiko einer Nebennierenrindensuppression.
Die Nebennieren-Reserve sollte kontrolliert werden und eine Behandlung mit einem systemischen Kortikoid kann notwendig sein. Wenn eine Stabilisierung eingetreten ist, sollte die Behandlung mit einem inhalativen Kortikoid bei empfohlener Dosierung fortgeführt werden (siehe Abschnitt 4.4).
In den Fällen einer akuten als auch chronischen Überdosierung mit Fluticason-17-propionat sollte die Behandlung mit Airflusal Forspiro in einer geeigneten Dosierung zur Kontrolle der Symptome weiter fortgeführt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Sympathomimetika in Kombination mit Kortikosteroiden oder anderen Mitteln, exkl. Anticholinergika ATC-Code: R03AK06
Wirkmechanismus
Airflusal Forspiro enthält Salmeterol und Fluticason-17-propionat, die verschiedene Wirkungsmechanismen haben. Die beiden Wirkungsmechanismen werden im Folgenden dargestellt:
Salmeterol
Salmeterol ist ein selektiver langwirksamer (12 Stunden) ß2-Adrenozeptoragonist mit einer langen Seitenkette, die an die Exo-Seite des Rezeptors bindet.
Salmeterol bewirkt mit mindestens 12 Stunden eine länger anhaltende Bronchodilatation als herkömmliche kurzwirksame ß2-Agonisten in empfohlenen Dosierungen.
Fluticason-17-propionat
Das Kortikoid Fluticason-17-propionat hat bei inhalativer Anwendung in den empfohlenen Dosierungen eine antientzündliche Wirkung in der Lunge. Hieraus resultiert eine Abnahme der Asthmasymptome und Exazerbationen, mit weniger Nebenwirkungen als bei einer systemischen Kortikoid-Therapie.
Klinische Wirksamkeit und Sicherheit Klinische Asthma-bronchiale-Studien
Eine 12-monatige Studie („Gaining Optimal Asthma Control”, GOAL) an 3.416 erwachsenen und jugendlichen Patienten mit persistierendem Asthma bronchiale verglich die Sicherheit und Wirksamkeit von Salmeterol/Fluticason-17-propionat (FP) mit dem inhalativen Kortikoid (FP) allein, um zu prüfen, ob die Zielkriterien des Asthmamanagements erreichbar sind. Die jeweilige Dosis wurde alle 12 Wochen bis zum Erreichen einer **vollständigen Asthmakontrolle oder der Maximaldosis der Studienmedikation erhöht. Die Ergebnisse von GOAL zeigten, dass unter der Behandlung mit Salmeterol/FP mehr Patienten eine Asthmakontrolle erreichten als Patienten unter dem inhalativen Kortikoid allein, und diese Kontrolle wurde bei einer niedrigeren Kortikoid-Dosis erreicht.
Eine gute Asthmakontrolle wurde mit Salmeterol/FP schneller als mit inhalativem Kortikoid (ICS) allein erreicht. Die Behandlungszeit, bis 50 % der Patienten erstmals eine gute Asthmakontrolle über 1 Woche erreichten, betrug bei den mit Salmeterol/FP behandelten Patienten 16 Tage, im Vergleich zu 37 Tage bei den mit ICS behandelten. In der Subgruppe der steroidnaiven Asthma-Patienten betrug die Behandlungszeit bis zum Erreichen einer guten Asthmakontrolle über 1 Woche bei den mit Salmeterol/FP behandelten Patienten 16 Tage, im Vergleich zu 23 Tagen bei den mit ICS behandelten Patienten.
Die Gesamtstudienergebnisse zeigten Folgendes:
|
Patienten (in Prozent), die über 12 Monate eine *Gute Asthmakontrolle und **Vollständige Asthmakontrolle erreichten | ||||
|
Behandlung vor Studienbeginn |
Salmeterol/FP |
FP | ||
|
Gute Asthmakontrolle |
Vollständige Asthmakontrolle |
Gute Asthmakontrolle |
Vollständige Asthmakontrolle | |
|
Keine ICS (kurzwirksame Beta-2-Agonisten allein) |
78 % |
50 % |
70 % |
40 % |
|
Niedrig dosierte |
75 % |
44 % |
60 % |
28 % |
|
ICS (< 500 Mikrogramm BDP oder entsprechende Dosis eines anderen ICS/Tag) | ||||
|
Mittlere Dosis IcS (> 500-1.000 Mikrogramm BDP oder entsprechende Dosis eines anderen ICS/Tag) |
62 % |
29 % |
47 % |
16 % |
|
Gemittelte Ergebnisse über die 3 Behandlungs stufen |
71 % |
41 % |
59 % |
28 % |
* Gute Asthmakontrolle: weniger als 2 oder bis zu 2 Tagen mit einem Symptom Score von größer als 1 (Symptom Score 1 ist definiert als „Symptome über einen kurzen Zeitraum während des Tages"), Verwendung von SABA an weniger oder bis zu 2 Tagen und weniger oder bis zu 4 Ereignissen pro Woche, mindestens oder mehr als 80 % des zu erwartenden morgendlichen „Peak expiratory flow", kein nächtliches Erwachen, keine Exazerbationen und keine Nebenwirkungen, die eine Änderung der Behandlung erfordern
** Vollständige Asthmakontrolle: keine Symptome, kein Gebrauch von kurzwirksamen Beta-2-Agonisten, morgendliche „Peak expiratory flow" von größer oder gleich 80 % des Sollwertes, kein nächtliches Erwachen, keine Exazerbationen und keine Nebenwirkungen, die eine Änderung der Behandlung erfordern.
Die Ergebnisse dieser Studie zeigen, dass Salmeterol/Fluticason 50/100 Mikrogramm 2-mal täglich als initiale Erhaltungstherapie bei Patienten mit mittelschwerem persistierendem Asthma bronchiale, für die eine schnelle Asthmakontrolle als essentiell erachtet wird, in Betracht gezogen werden kann (siehe Abschnitt 4.2).
In einer doppelblinden, randomisierten, Parallelgruppen-Studie an 318 Patienten mit persistierendem Asthma im Alter von mindestens 18 Jahren wurde die Sicherheit und Verträglichkeit einer Anwendung von 2-mal täglich 2 Inhalationen (doppelte Dosierung) Salmeterol/FP über 2 Wochen untersucht. Die Studie zeigte, dass die Verdoppelung der Inhalationen der jeweiligen Wirkstärke von Salmeterol/FP für bis zu 14 Tage zu einem geringen Anstieg der durch ß-Agonisten verursachten Nebenwirkungen führte (Tremor: 1 Patient [1 %] versus 0; Palpitationen: 6 [3 %] versus 1 [< 1 %]; Muskelkrämpfe: 6 [3 %] versus 1 [< 1 %]) und dass eine ähnliche Inzidenz von Nebenwirkungen beobachtet wurde, die auf die Anwendung von inhalativen Kortikoiden zurückzuführen ist (z. B. orale Candidiasis: 6 [6 %] versus 16 [8 %]; Heiserkeit: 2 [2 %] versus 4 [2 %]), verglichen mit 1 Inhalation 2-mal täglich. Der geringe Anstieg der durch ß-Agonisten verursachten Nebenwirkungen sollte berücksichtigt werden, wenn eine Verdoppelung der Dosierung von Airflusal Forspiro bei erwachsenen Patienten, die eine zusätzliche kurzfristige (bis zu 14-tägig) inhalative Kortikoid-Therapie benötigen, vom Arzt in Betracht gezogen wird.
In der Studie SAM101667 bei 158 Kindern im Alter von 6-16 Jahren mit symptomatischem Asthma ist die Kombination von Salmeterol/Fluticason-17-propionat ebenso wirksam wie die Verdoppelung von Fluticason-17-propionat bezogen auf Symptomkontrolle und Lungenfunktion. Diese Studie war nicht dafür vorgesehen, die Wirkung auf Exazerbationen zu untersuchen.
Klinische COPD-Studien
TORCH war eine 3-Jahres-Studie bei COPD-Patienten zur Beurteilung der Wirksamkeit der Behandlung mit jeweils 2-mal täglicher Anwendung von Salmeterol/FP 50/500 Mikrogramm, Salmeterol 50 Mikrogramm, FP 500 Mikrogramm oder von Placebo hinsichtlich der Gesamtsterblichkeit. COPD-Patienten mit FEV1 < 60 % des Normwertes (vor Anwendung eines Bronchodilatators) als Ausgangswert wurden doppelblind randomisiert. Während der Studie war es den Patienten erlaubt, ihre übliche COPD-Therapie anzuwenden, mit Ausnahme anderer inhalativer Kortikoide, langwirksamer Bronchodilatatoren und systemischer Dauertherapie mit Kortikoiden. Für alle Patienten wurde der Überlebensstatus nach 3 Jahren bestimmt, unabhängig von einem eventuellen Absetzen der Studienmedikation. Der primäre Endpunkt war die Reduktion der Gesamtmortalität nach 3 Jahren unter Salmeterol/FP versus Placebo.
|
Placebo N = 1.524 |
Salmeterol 50 N = 1.521 |
FP 500 N = 1.534 |
Salmeterol/FP 50/500 N = 1.533 | |
|
Gesamtmortalität nach 3 Jahren | ||||
|
Anzahl Todesfälle (%) |
231 (15,2 %) |
205 (13,5 %) |
246 (16,0 %) |
193 (12,6 %) |
|
Hazard Ratio versus Placebo (KI) p-Wert |
N/A |
0,879 (0,73, 1,06) 0,180 |
1,060 (0,89, 1,27) 0,525 |
0,825 (0,68, 1,00) 0,0521 |
|
Hazard Ratio Salmeterol/FP 50/500 versus Einzelwirkstoffe (KI) p-Wert |
N/A |
0,932 (0,77, 1,13) 0,481 |
0,774 (0,64, 0,93) 0,007 |
N/A |
|
1 Nicht signifikanter p-Wert, hinsichtlich des primären |
Endpunktes, nach | |||
Berücksichtigung von 2 Interimsanalysen im log-rank-Test, stratifiziert nach Raucherstatus.
Es bestand ein Trend zu einer höheren Überlebenswahrscheinlichkeit bei Patienten, die über 3 Jahre mit Salmeterol/FP behandelt wurden, im Vergleich zu Placebo, auch wenn das statistische Signifikanzniveau p < 0,05 nicht erreicht wurde.
Der Prozentsatz an Patienten, die innerhalb von 3 Jahren an COPD-bedingten Ursachen verstarben, betrug 6 % unter Placebo, 6,1 % unter Salmeterol, 6,9 % unter FP und 4,7 % unter Salmeterol/FP.
Die durchschnittliche Anzahl mittelschwerer und schwerer Exazerbationen pro Jahr war unter Salmeterol/FP signifikant reduziert, im Vergleich zur Behandlung mit Salmeterol, FP und Placebo (durchschnittliche Rate in der Salmeterol/FP-Gruppe 0,85 im Vergleich zu 0,97 in der Salmeterol-Gruppe, 0,93 in der FP-Gruppe und 1,13 unter Placebo). Dies schlägt sich nieder in einer Reduktion der Rate mittelschwerer und schwerer Exazerbationen um 25 % (95 %-KI: 19-31 %; p < 0,001) im Vergleich zu Placebo, um 12 % im Vergleich zu Salmeterol (95 %-KI: 5-19 %; p = 0,002) und um 9 % im Vergleich zu FP (95 %-KI: 1-16 %; p = 0,024). Salmeterol und FP reduzierten signifikant die Exazerbationsraten um 15 % (95 %-KI: 7-22 %; p < 0,001) und entsprechend um 18 % (95 %-KI: 11-24 %; p < 0,001) im Vergleich zu Placebo.
Die gesundheitsbezogene Lebensqualität, gemessen mit dem St. George's Respiratory Questionnaire (SGRQ), wurde im Vergleich zu Placebo in allen 3 Verum-Behandlungsarmen verbessert. Die durchschnittliche Verbesserung über 3 Jahre unter Salmeterol/Fluticason betrug -3,1 Einheiten (95 %-KI: -4,1 bis -2,1; p < 0,001) im Vergleich zu Placebo, -2,2 Einheiten (p < 0,001) im Vergleich zu Salmeterol und -1,2 Einheiten (p = 0,017) im Vergleich zu FP. Eine Abnahme um 4 Einheiten wird als klinisch relevant angesehen.
Die geschätzte 3-Jahres-Wahrscheinlichkeit einer als unerwünschtes Ereignis berichteten Pneumonie betrug 12,3 % für Placebo, 13,3 % für Salmeterol, 18,3 % für FP und 19,6 % für Salmeterol/FP (Hazard ratio für Salmeterol/FP versus Placebo: 1,64, 95 %-KI: 1,33-2,01; p < 0,001). Es gab keinen Anstieg Pneumonie-assoziierter Todesfälle; Todesfälle, die unter der Behandlung als primär Pneumonie-bedingt gewertet wurden, waren 7 unter Placebo, 9 unter Salmeterol, 13 unter FP und 8 unter Salmeterol/FP. Es gab keinen signifikanten Unterschied in der Wahrscheinlichkeit von Knochenbrüchen (5,1 % unter Placebo, 5,1 % unter Salmeterol, 5,4 % unter FP und 6,3 % unter Salmeterol/FP; Hazard ratio für Salmeterol/FP versus Placebo: 1,22, 95 % Konfidenzintervall: 0,87-1,72; p = 0,248).
Placebokontrollierte klinische Prüfungen über 6 und 12 Monate haben gezeigt, dass die regelmäßige Anwendung von Salmeterol/FP 50/500 Mikrogramm die Lungenfunktion verbessert und Atemnot sowie die Anwendung von Bedarfsmedikation reduziert.
Die Studien SCO40043 und SCO100250 waren randomisierte, doppelt-blinde Parallelgruppen-Studien mit identischem Design zum Vergleich der Wirksamkeit einer Behandlung mit Salmeterol/FP 50/250 Mikrogramm 2-mal täglich (diese Dosierung ist für die Behandlung der COPD in der europäischen Union nicht zugelassen) mit der Anwendung von Salmeterol 50 Mikrogramm 2-mal täglich hinsichtlich der jährlichen Rate mittelschwerer/schwerer Exazerbationen bei COPD-Patienten mit einem FEVrWert von weniger als 50 % des Sollwertes und anamnestisch bekannten Exazerbationen. Mittelschwere/schwere Exazerbationen wurden definiert als sich verschlechternde Symptome, die eine Behandlung mit oralen Kortikoiden und/oder Antibiotika oder Klinikeinweisungen erforderlich machten.
Die Studien starteten mit einer 4-wöchigen Run-in-Phase, in der alle Patienten open label Salmeterol/FP 50/250 erhielten, um die COPD-Pharmakotherapie zu standardisieren und die Erkrankung vor Randomisierung auf eine verblindete Studienmedikation über 52 Wochen zu stabilisieren. Die Patienten wurden 1:1 auf Salmeterol/FP 50/250 (Gesamt ITT n = 776) oder Salmeterol (Gesamt ITT n = 778)
randomisiert. Vor der Run-in-Phase setzten die Patienten die bisherige COPD-Medikation bis auf kurzwirksame Bronchodilatatoren ab. Während des Behandlungszeitraums war die gleichzeitige Anwendung von inhalativen langwirksamen Bronchodilatatoren (ß2-Agonisten und Anticholinergika), von Kombinationsprodukten mit Ipatropium/Salbutamol, oralen ß2-Agonisten und Theophyllin-Präparaten nicht erlaubt. Orale Kortikoide und Antibiotika waren für die akute Behandlung von COPD-Exazerbationen unter Beachtung der speziellen Richtlinien zur Anwendung erlaubt. Die Patienten setzten Salbutamol in den Studien als Bedarfsmedikation ein.
Die Ergebnisse beider Studien zeigten, dass die Behandlung mit Salmeterol/FP 50/250 zu einer deutlich geringeren jährlichen Rate von mittelschweren/schweren COPD-Exazerbationen im Vergleich zu Salmeterol führte (SCO40043: 1,06 und 1,53 pro Patient pro Jahr bzw. relatives Risiko von 0,70, 95 %-KI: 0,58-0,83, p < 0,001; SCO100250: 1,10 bzw. 1,59 pro Patient pro Jahr bzw. relatives Risiko von 0,70,
95 %-KI: 0,58-0,83, p < 0,001). Die Ergebnisse für die sekundären Wirksamkeitsparameter (Zeit bis zur ersten mittelschweren/schweren Exazerbation, die jährliche Rate an Exazerbationen, die eine Behandlung mit oralen Kortikoiden erforderte, und die morgendliche prä-bronchodilatatorische FEV1) fielen deutlich zu Gunsten der Behandlung mit 2-mal täglich Salmeterol/FP 50/250 Mikrogramm gegenüber Salmeterol aus. Die Nebenwirkungsprofile waren annähernd vergleichbar mit Ausnahme einer höheren Inzidenz von Pneumonien und bekannten lokalen Nebenwirkungen (Candidiasis und Heiserkeit) in der mit Salmeterol/FP 50/250 Mikrogramm 2-mal täglich behandelten Gruppe verglichen mit Salmeterol. Ereignisse, die mit einer Pneumonie in Zusammenhang standen, wurden für 55 (7 %) Patienten in der Salmeterol/FP 50/250 Mikrogramm Gruppe mit 2-mal täglicher Behandlung verglichen mit 25 (3 %) in der Salmeterol-Gruppe berichtet.
Die erhöhte Inzidenz von berichteten Pneumonien bei Anwendung von Salmeterol/FP 50/250 Mikrogramm 2-mal täglich erreicht eine ähnliche Größenordnung wie die Pneumonie-Inzidenz in Folge der Behandlung mit Salmeterol/FP 50/500 Mikrogramm 2-mal täglich in der TORCH-Studie.
Salmeterol Multi-Center Asthma Research Trial (SMART)
SMART war eine multizentrische, randomisierte, doppel-blinde, placebokontrollierte Parallelgruppen-Studie in den USA über 28 Wochen, in der randomisiert 13.176 Patienten einer Behandlung mit Salmeterol (50 Mikrogramm 2-mal täglich) und 13.179 Patienten Placebo zugeordnet wurden, jeweils zusätzlich zu ihrer üblichen Asthma-Therapie. In die Studie wurden Patienten mit Asthma eingeschlossen, die 12 Jahre oder älter waren und zu diesem Zeitpunkt Asthma-Arzneimittel (aber keine langwirksamen Beta-2-Sympathomimetika) anwendeten. Eine Basistherapie mit ICS wurde zu Studienbeginn dokumentiert, war aber in der Studie nicht gefordert. Primärer Endpunkt in SMART war die Gesamtanzahl der atemwegsbedingten Todesfälle und atemwegsbedingten lebensbedrohlichen Ereignisse.
Haupt-Ergebnisse SMART: Primärer Endpunkt
|
Patientengruppe |
Anzahl der primären Endpunktereignisse / Patientenzahl |
Relatives Risiko (95 %-Konfidenz-Intervall) | |
|
Salmeterol |
Placebo | ||
|
Alle Patienten |
50 / 13.176 |
36 / 13.179 |
1,40 (0,91; 2,14) |
|
Patienten, die inhalative Steroide anwendeten |
23 / 6.127 |
19 / 6.138 |
1,21 (0,66; 2,23) |
|
Patienten, die keine inhalativen Steroide anwendeten |
27 / 7.049 |
17 / 7.041 |
1,60 (0,87; 2,93) |
|
Afroamerikanische Patienten |
20 / 2.366 |
5 / 2.319 |
4,10 (1,54; 10,90) |
(Die Risiko-Angaben in Fettdruck sind statistisch signifikant bei 95 %-Konfidenz-Intervall.)
Haupt-Ergebnisse von SMART in Abhängigkeit von der Anwendung inhalativer Steroide zu Studienbeginn: Sekundäre Endpunkte__
|
Patientengruppe |
Anzahl der sekundären Endpunktereignisse / Patientenzahl |
Relatives Risiko (95 %-Konfidenz-Intervall) | |
|
Salmeterol |
Placebo | ||
|
Atemwegsbedingte Todesfälle | |||
|
Patienten, die inhalative Steroide anwendeten |
10 / 6.127 |
5 / 6.138 |
2,01 (0,69; 5,86) |
|
Patienten, die keine inhalativen Steroide anwendeten |
14 / 7.049 |
6 / 7.041 |
2,28 (0,88; 5,94) |
|
Gesamtzahl Asthma bedingter Todesfälle und lebensbedrohlicher Ereignisse | |||
|
Patienten, die inhalative Steroide anwendeten |
16 / 6.127 |
13 / 6.138 |
1,24 (0,60; 2,58) |
|
Patienten, die keine inhalativen Steroide anwendeten |
21 / 7.049 |
9 / 7.041 |
2,39 (1,10; 5,22) |
|
Asthma bedingte Todesfälle | |||
|
Patienten, die inhalative Steroide anwendeten |
4 / 6.127 |
3 / 6.138 |
1,35 (0,30; 6,04) |
|
Patienten, die keine inhalativen Steroide anwendeten |
9 / 7.049 |
0 / 7.041 |
* |
* = konnte nicht berechnet werden, da in der Placebo-Gruppe keine
entsprechenden Ereignisse eingetreten waren. Die Risikoangaben in Fettdruck sind statistisch signifikant (95 %-Konfidenz-Intervall). Die sekundären Endpunkte in der obigen Tabelle erreichten statistische Signifikanz in der Gesamt-Population]. Die sekundären Endpunkte der „Gesamtzahl von Todesfällen und lebensbedrohlichen Ereignissen jeglicher Ursache", „Todesfällen jeglicher Ursache" und
„Krankenhauseinweisungen jeglicher Ursache" erreichten keine statistische Signifikanz in der Gesamt-Population.
5.2 Pharmakokinetische Eigenschaften
Bei der Beurteilung der Pharmakokinetik kann jeder einzelne Wirkstoff getrennt betrachtet werden.
Salmeterol
Salmeterol wirkt lokal in der Lunge, deshalb geben Plasmaspiegel keinen Hinweis auf therapeutische Wirkungen. Zu den pharmakokinetischen Eigenschaften von Salmeterol liegen außerdem nur begrenzte Daten vor, da nach inhalativer Anwendung therapeutischer Dosierungen nur geringe Plasmakonzentrationen (ca. 200 Pikogramm/ml oder weniger) erreicht werden, die mit den verfügbaren Messmethoden technisch schwer zu bestimmen sind.
Fluticason-17-propionat
Resorption
Die absolute Bioverfügbarkeit einer Einzeldosis von inhaliertem Fluticason-17-propionat bei Probanden liegt im Bereich von ca. 5-11 % der angegebenen Dosis, abhängig vom verwendeten Inhalator. Bei Patienten mit Asthma bronchiale oder COPD ist ein geringeres Ausmaß der systemischen Exposition von inhaliertem Fluticason-17-propionat beobachtet worden.
Die systemische Aufnahme findet hauptsächlich über die Lungen statt, und zwar anfangs schnell, dann verzögert. Der Rest der inhalierten Dosis kann zwar verschluckt werden, trägt aber aufgrund der geringen Wasserlöslichkeit und des vorsystemischen Metabolismus nur minimal zur systemischen Exposition bei, was eine orale Bioverfügbarkeit von weniger als 1 % zur Folge hat. Es zeigt sich ein linearer Anstieg der systemischen Exposition mit Erhöhung der inhalierten Dosis.
Verteilung
Die Disposition von Fluticason-17-propionat ist charakterisiert durch eine hohe Plasmaclearance (1.150 ml/min), ein großes Verteilungsvolumen im Steady State (ca. 300 l) und eine terminale Halbwertszeit von ca. 8 Stunden.
Die Plasmaproteinbindung beträgt 91 %.
Biotransformation
Fluticason-17-propionat wird sehr schnell aus dem Blutkreislauf entfernt. Hauptsächlich geschieht dies durch Metabolisierung durch das Cytochrom P450 Enzym CYP 3A4 zu einem inaktiven Carboxylsäurederivat. Andere nicht identifizierte Metaboliten werden auch in den Fäzes gefunden.
Elimination
Die renale Clearance von Fluticason-17-propionat ist vernachlässigbar. Weniger als 5 % wird hauptsächlich in Form von Metaboliten im Urin ausgeschieden. Der Großteil der Dosis wird in Form von Metaboliten und unveränderten Wirkstoffen in die Fäzes ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Die einzigen Sicherheitsbedenken für die Anwendung am Menschen, die sich aus tierexperimentellen Untersuchungen mit Salmeterolxinafoat und Fluticason-17-propionat, unabhängig voneinander eingesetzt, ableiten lassen, waren verstärkte pharmakologische Wirkungen.
In tierexperimentellen Reproduktionsstudien zeigte sich, dass Kortikoide Missbildungen hervorrufen können (Gaumenspalten, Skelettfehlbildungen). Diese Ergebnisse aus tierexperimentellen Untersuchungen scheinen jedoch für den Menschen im empfohlenen Dosisbereich nicht von Bedeutung zu sein. Tierexperimentelle Studien mit Salmeterolxinafoat ergaben nur bei hoher Exposition Hinweise auf embryofötale Toxizität. Bei Ratten wurde bei gleichzeitiger Anwendung von Salmeterolxinafoat und Fluticason-17-propionat in Dosierungen, die bekanntlich mit Kortikoid-induzierten Anomalien verbunden sind, ein erhöhtes Auftreten von Transpositionen der Nabelschnurarterien (Arteria umbilicalis) sowie eine unvollständige Ossifikation des Os occipitale festgestellt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre
6.4Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern.
6.5 Art und Inhalt des Behältnisses
Der Kunststoffinhalator enthält eine OPA/Al/PVC-Aluminium-Blisterpackung mit 60 abgemessenen Dosen der Pulvermischung.
Packungsgrößen:
1, 2 oder 3 Pulverinhalator(en) mit jeweils 60 Dosen.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Hexal AG
Industriestr. 25
83607 Holzkirchen
Deutschland
Telefon: 08024/908-0
Telefax: 08024/9058-1290
E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMER
89724.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
(siehe Unterschrift)
10. STAND DER INFORMATION
Juli 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig