Aitaro 12 Sq-Hdm Lyophilisat Zum Einnehmen
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
1. BEZEICHNUNG DES ARZNEIMITTELS
AITARO 12 SQ-HDM Lyophilisat zum Einnehmen.
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Standardisierter Allergenextrakt aus Hausstaubmilben (Dermatophagoides pteronyssinus und Dermatophagoides farinae) 12 SQ-HDM* pro Lyo-Tablette.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
* [SQ-HDM ist die Dosiseinheit für AITARO. SQ ist eine Methode zur Standardisierung in Bezug auf die biologische Gesamtaktivität, den Majorallergengehalt und die Komplexität des Allergenextraktes. HDM ist eine englische Abkürzung für Hausstaubmilben.]
3. DARREICHUNGSFORM
Lyophilisat zum Einnehmen, im Text bezeichnet als Lyo-Tablette.
Weiße bis cremefarbene Lyo-Tablette mit einer Prägung auf einer Seite.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
AITARO ist indiziert bei erwachsenen Patienten (18-65 Jahre), bei denen auf Basis von Anamnese und Nachweis einer Sensibilisierung (Prick-Test und/oder spezifisches IgE) eine Hausstaubmilbenallergie diagnostiziert wurde, wenn mindestens eine der folgenden Bedingungen besteht:
• Hausstaubmilbeninduzierte anhaltende mittelschwere bis schwere allergische Rhinitis trotz Verwendung symptomlindernder Medikamente.
• Hausstaubmilbeninduziertes allergisches Asthma, welches mit inhalativen Kortikosteroiden nicht gut kontrolliert ist und welches mit milder bis schwerer allergischer Rhinitis auf Hausstaubmilben assoziiert ist. Der Asthma-Status des Patienten sollte vor dem Beginn der Behandlung sorgfältig geprüft werden (siehe Abschnitt 4.3).
4.2 Dosierung und Art der Anwendung
Dosierung
Die empfohlene Dosierung bei Erwachsenen beträgt eine Lyo-Tablette (12 SQ-HDM) täglich.
Eine klinische Wirksamkeit kann 8-14 Wochen nach Behandlungsbeginn erwartet werden. Internationale Behandlungsleitlinien empfehlen eine 3-jährige Behandlungsdauer für die Allergie-Immuntherapie (auch spezifische Immuntherapie oder Hyposensibilisierung genannt), um eine nachhaltige Verbesserung zu erreichen. Wirksamkeitsdaten sind für eine 18-monatige Behandlung mit AITARO bei Erwachsenen vorhanden; es sind keine Daten für eine 3-jährige Behandlung verfügbar (siehe Abschnitt 5.1). Wenn im ersten Behandlungsjahr mit AITARO keine Verbesserung der Beschwerden beobachtet wird, gibt es keine Indikation, die Behandlung fortzuführen.
Kinder und Jugendliche
Klinische Erfahrungen zur Allergie-Immuntherapie mit AITARO bei Kindern unter 18 Jahren liegen nicht vor. AITARO ist nicht für die Behandlung von Kindern unter 18 Jahren zugelassen. Aktuell vorhandene Daten bei Kindern sind in Abschnitt 5.1 beschrieben.
Ältere Menschen
Klinische Erfahrungen zur Allergie-Immuntherapie mit AITARO bei Erwachsenen über 65 Jahren liegen nicht vor. AITARO ist nicht für die Behandlung von Erwachsenen über 65 Jahren zugelassen (siehe Abschnitt 5.1).
Art der Anwendung
Die Therapie mit AITARO sollte nur von Ärzten mit Erfahrung in der Therapie allergischer Erkrankungen eingeleitet werden. Die erste Dosis sollte unter ärztlicher Aufsicht eingenommen und der Patient anschließend mindestens 30 Minuten ärztlich überwacht werden, damit eventuell auftretende Nebenwirkungen besprochen und deren etwaige Behandlung festgelegt werden kann.
AITARO ist ein Lyophilisat zum Einnehmen. Die Lyo-Tablette ist unmittelbar vor Gebrauch mit trockenen Fingern vorsichtig aus dem Blister zu entnehmen und unter die Zunge zu legen, wo sie sich auflöst. Schlucken ist für etwa 1 Minute zu vermeiden. Während der folgenden 5 Minuten darf nichts gegessen oder getrunken werden.
Wenn die Behandlung mit AITARO für einen Zeitraum von bis zu 7 Tagen unterbrochen wird, kann die Behandlung durch den Patienten wieder aufgenommen werden. Wenn die Behandlung länger als 7 Tage unterbrochen wurde, wird empfohlen, vor der Wiederaufnahme der Behandlung einen Arzt zu konsultieren.
4.3 Gegenanzeigen
Überempfindlichkeit gegen einen der in Abschnitt 6.1 genannten sonstigen Bestandteile (für eine vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1).
Patienten mit einem FEV1 < 70% des Vorhersagewertes (nach adäquater pharmakologischer Therapie) bei Beginn der Behandlung.
Patienten, die in den letzten 3 Monaten eine schwere Asthma-Exazerbation hatten.
Bei Patienten mit Asthma, die eine akute Infektion des Respirationstraktes haben, soll der Beginn der Behandlung mit AITARO verschoben werden, bis die Infektion abgeklungen ist.
Patienten mit aktiven oder schlecht kontrollierten Autoimmunerkrankungen, Immundefekten, Immunschwäche, Immunsuppression oder bösartigen Tumorerkrankungen mit aktuellem Krankheitswert.
Patienten mit akuter schwerer Entzündung in der Mundhöhle oder Wunden im Mund (siehe Abschnitt 4.4).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Asthma
Asthma ist ein bekannter Risikofaktor für schwere systemische allergische Reaktionen.
Patienten sollen darauf hingewiesen werden, dass AITARO nicht zur Behandlung akuter AsthmaExazerbationen vorgesehen ist. Im Falle einer akuten Asthma-Exazerbation sollte ein kurzwirksamer Bronchodilatator verwendet werden. Wenn Patienten merken, dass die Behandlung mit ihrem kurzwirksamen Bronchodilatator unwirksam ist oder sie mehr Hübe als üblich benötigen, muss ärztliche Hilfe in Anspruch genommen werden.
Patienten müssen über die Notwendigkeit informiert werden, unverzüglich einen Arzt aufzusuchen, wenn sich ihr Asthma plötzlich verschlechtert.
AITARO soll zunächst als Zusatztherapie und nicht als Ersatz von bereits bestehenden AsthmaMedikamenten genutzt werden. Ein plötzliches Absetzen von Asthma-Controller-Medikamenten nach Beginn der Behandlung mit AITARO wird nicht empfohlen. Eine Reduktion der Asthma-Dauermedikation sollte nur schrittweise unter Aufsicht eines Arztes entsprechend der Asthma Behandlungsleitlinien durchgeführt werden.
Schwere systemische allergische Reaktionen
Im Fall von schweren systemischen allergischen Reaktionen, schweren Asthma-Exazerbationen,
Angioödem, Schwierigkeiten beim Schlucken, Schwierigkeiten beim Atmen, Veränderungen der Stimme, Blutdruckabfall oder Engegefühl im Hals soll die Therapie unterbrochen und sofort ein Arzt konsultiert werden. Flushing, Hitzegefühl, Pruritus, allgemeines Unwohlsein und Unruhe/Angst können auf eine beginnende systemische Reaktion hinweisen.
Schwere systemische allergische Reaktionen können mit Adrenalin behandelt werden. Die Wirkung von Adrenalin kann bei Patienten, die mit trizyklischen Antidepressiva, Monoaminooxidasehemmern (MAOHemmern) und/oder COMT-Inhibitoren behandelt werden, verstärkt werden, was möglicherweise lebensbedrohliche Folgen haben kann. Die Wirkung von Adrenalin kann bei Patienten, die mit Betablockern behandelt werden, reduziert sein.
Patienten mit Herzerkrankungen können im Falle von systemischen allergischen Reaktionen möglicherweise ein erhöhtes Risiko haben. Klinische Erfahrungen mit AITARO bei Patienten mit Herzerkrankungen sind begrenzt.
Dies sollte vor Beginn einer Allergie-Immuntherapie in Betracht gezogen werden.
Bei Patienten, die bereits früher eine systemische allergische Reaktion auf eine subkutane Immuntherapie mit Hausstaubmilben entwickelt haben, soll der Beginn einer Behandlung mit AITARO sorgfältig geprüft werden. Außerdem sollen Maßnahmen zur Verfügung stehen, um eventuelle Reaktionen zu behandeln. Diese Empfehlung basiert auf Erfahrungen nach der Markteinführung einer entsprechenden sublingualen Tablette zur Gräserpollen-Immuntherapie. Diese Erfahrungen zeigen, dass das Risiko einer schweren allergischen Reaktion bei Patienten, die zuvor eine systemische allergische Reaktion auf eine subkutane Immuntherapie gegen Gräserpollen hatten, erhöht sein kann.
Entzündungen in der Mundhöhle
Bei Patienten mit schweren Entzündungen in der Mundhöhle (z.B. oraler Lichen planus, Ulzerationen im Mund oder Soor), Wunden im Mund oder nach chirurgischen Eingriffen in der Mundhöhle einschließlich Zahnextraktionen oder nach dem Verlust eines Zahns sollte der Beginn der Behandlung mit AITARO verschoben werden und eine begonnene Behandlung mit AITARO vorübergehend unterbrochen werden, damit die Mundhöhle abheilen kann.
Lokale allergische Reaktionen
Während der Behandlung mit AITARO ist der Patient dem Allergen ausgesetzt, auf das er allergisch ist. Daher sind während der Behandlung lokale allergische Reaktionen zu erwarten. Diese Reaktionen sind normalerweise leicht bis mittelschwer; trotzdem können schwerere oropharyngeale Reaktionen auftreten. Wenn der Patient während der Behandlung erhebliche lokale Nebenwirkungen hat, sollte eine Therapie mit Antiallergika (z.B. Antihistaminika) in Betracht gezogen werden.
Eosinophile Ösophagitis
Im Zusammenhang mit der Behandlung mit AITARO wurden vereinzelt Fälle von eosinophiler Ösophagitis berichtet. Patienten mit schweren und anhaltenden gastroösophagealen Symptomen, wie Schluckstörungen oder Dyspepsie, müssen einen Arzt konsultieren.
Autoimmunerkrankungen in Remission
Es gibt nur begrenzte Daten zur Allergie-Immuntherapie bei Patienten mit Autoimmunerkrankungen in Remission. AITARO sollte daher bei diesen Patienten mit Vorsicht verschrieben werden.
Nahrungsmittelallergie
AITARO kann Spuren von Fischproteinen enthalten. Die verfügbaren Daten weisen nicht auf ein erhöhtes Risiko für allergische Reaktionen bei Patienten mit Fischallergie hin.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zu Wechselwirkungen beim Menschen durchgeführt und es wurden keine möglichen Arzneimittelinteraktionen aus weiteren Quellen identifiziert. Eine gleichzeitige Behandlung mit symptomatisch wirkenden Antiallergika kann die Toleranzschwelle des Patienten erhöhen. Dies sollte beim Absetzen solcher Medikamente beachtet werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es gibt keine Daten zu klinischen Erfahrungen mit der Anwendung von AITARO bei Schwangeren. Tierexperimentelle Studien weisen nicht auf ein erhöhtes Risiko für den Feten hin. Die Therapie mit AITARO sollte nicht während einer Schwangerschaft begonnen werden. Kommt es während der Therapie zu einer Schwangerschaft, kann die Behandlung nach sorgfältiger Beurteilung des Allgemeinzustandes der Patientin (einschließlich der Lungenfunktion) und der Reaktionen auf die vorangegangenen Einnahmen von AITARO fortgesetzt werden. Bei Patientinnen mit vorbestehendem Asthma wird eine engmaschige Überwachung während der Schwangerschaft empfohlen.
Stillzeit
Über die Anwendung von AITARO während der Stillzeit liegen keine klinischen Daten vor. Es sind keine Wirkungen auf den gestillten Säugling zu erwarten.
Fertilität
Es gibt für die Anwendung von AITARO keine klinischen Daten hinsichtlich der Fertilität. In einer Toxizitätsstudie wurden bei wiederholter Gabe in Mäusen keine Effekte auf die Fortpflanzungsorgane beider Geschlechter beobachtet.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Behandlung mit AITARO hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Patienten, die AITARO einnehmen, sollten in erster Linie mit leichten bis mittelschweren lokalen allergischen Reaktionen rechnen, die innerhalb der ersten Tage auftreten und im Laufe der weiteren Behandlung (1-3 Monate) zurückgehen (siehe Abschnitt 4.4). Für die überwiegende Zahl der Ereignisse sollte erwartet werden, dass die Reaktionen jeweils innerhalb von 5 Minuten nach der Einnahme von AITARO beginnen und innerhalb von Minuten bis Stunden wieder abklingen. Schwere oropharyngeale allergische Reaktionen können vorkommen (siehe Abschnitt 4.4).
Es wurden vereinzelt Fälle von schwerer akuter Verschlechterung der Asthmasymptome berichtet. Patienten mit bekannten Risikofaktoren sollten eine Behandlung mit AITARO nicht beginnen (siehe Abschnitt 4.3).
Auflistung der Nebenwirkungen in Tabellenform
Die folgende Tabelle der Nebenwirkungen basiert auf Daten aus placebokontrollierten klinischen Studien mit AITARO, in denen erwachsene Patienten mit Hausstaubmilben-induzierter allergischer Rhinitis und/oder allergischem Asthma untersucht wurden.
Die Nebenwirkungen werden in Gruppen nach der MedDRA-Konvention in Häufigkeiten unterteilt: Sehr häufig (> 1/10), häufig (>1 / 100, < 1/10), gelegentlich (>1 / 1.000 bis < 1/100), selten (> 1 / 10.000 bis < 1/1.000), sehr selten (< 1/10.000).
|
Systemorganklasse |
Häufigkeit |
Nebenwirkung |
|
Infektionen und parasitäre Erkrankungen |
sehr häufig |
Nasopharyngitis |
|
Häufig |
Bronchitis, Laryngitis, Pharyngitis, Rhinitis, Sinusitis | |
|
Erkrankungen des Nervensystems |
gelegentlich |
Schwindel, Dysgeusie |
|
Augenerkrankungen |
Häufig |
Juckreiz der Augen |
|
Erkrankungen des Ohrs und des Labyrinths |
Häufig |
Juckreiz der Ohren |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
sehr häufig |
Rachenirritationen |
|
Häufig |
Dysphonie, Dyspnoe, oropharyngealer Schmerz, Pharynxödem | |
|
Selten |
Kehlkopfödem, Nasenverstopfung, Nasenbeschwerden, Nasenobstruktion, Rhinorrhö, Niesen, Engegefühl im Hals | |
|
Erkrankungen des Gastrointestinaltrakts |
sehr häufig |
Mundödem, Juckreiz im Mund |
|
Häufig |
Bauchschmerzen, Durchfall, trockener Mund, Dysphagie, Dyspepsie, Glossodynie, Lippenödem, Juckreiz der Lippen, Juckreiz der Zunge, Übelkeit, Mundbeschwerden, orale Parästhesie, Stomatitis, Zungenschwellung | |
|
gelegentlich |
Glossitis, Ulzerationen im Mund, Reizung der Speiseröhre, Blasen an der Mundschleimhaut, Rötung der Mundschleimhaut, Erbrechen | |
|
Erkrankungen der Haut des Unterhautzellgewebes |
gelegentlich |
Pruritus |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Häufig |
Beschwerden im Brustraum |
|
gelegentlich |
Müdigkeit, Unwohlsein, Fremdkörpergefühl |
Beschreibung ausgewählter Nebenwirkungen
Wenn es zu bedeutenden unerwünschten Reaktionen durch die Behandlung kommt, ist die Anwendung von Antiallergika zu erwägen.
Für eine entsprechende sublinguale Tablette gegen Gräserpollenallergie wurden Fälle von systemischen allergischen Reaktionen beobachtet, diese werden als Klasseneffekt angesehen. Die medizinische Überwachung bei der ersten Einnahme der Lyo-Tablette ist daher eine wichtig Vorsichtsmaßnahme (siehe Abschnitt 4.2).
Im Fall einer akuten Verschlechterung der Asthma-Symptome oder von schweren systemischen Reaktionen, Angioödem, Schwierigkeiten beim Schlucken, Schwierigkeiten beim Atmen, Veränderungen der Stimme, Blutdruckabfall oder Engegefühl im Hals soll sofort ein Arzt konsultiert werden. In derartigen
Fällen soll die Therapie abgebrochen oder so lange ausgesetzt werden, bis der behandelnde Arzt über die Fortsetzung der Therapie entschieden hat.
Es wurden vereinzelt Fälle von eosinophiler Ösophagitis berichtet (siehe Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 5159, 63225 Langen, Telefon +49 6103 77 0, Telefax +49 6103 77 1234, Website: www.pei.de anzuzeigen.
Kinder und Jugendliche
AITARO ist bei Patienten unter 18 Jahren nicht zugelassen (siehe Abschnitt 4.2). Es sind nur begrenzte Daten für Patienten im Alter von 5-17 Jahren und keine Daten für die Behandlung mit AITARO bei Kindern unter 5 Jahren vorhanden.
4.9 Überdosierung
In Phase I-Studien erhielten erwachsene Patienten mit Hausstaubmilbenallergie Dosen bis zu 32 SQ-HDM.
Wenn höhere Dosen als die empfohlene Tagesdosis eingenommen werden, steigt das Risiko für Nebenwirkungen, einschließlich des Risikos systemischer allergischer Reaktionen oder schwerer lokaler allergischer Reaktionen. Im Fall von schweren Reaktionen wie Angioödem, Schwierigkeiten beim Schlucken, Schwierigkeiten beim Atmen, Veränderungen der Stimme oder Engegefühl im Hals sollte zur Beurteilung sofort ein Arzt konsultiert werden. Diese Reaktionen sollten mit einer entsprechenden symptomatischen Therapie behandelt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Allergenextrakt, Hausstaubmilben ATC Code: V01AA03
Wirkmechanismus
AITARO ist eine Allergie-Immuntherapie. Bei der Allergie-Immuntherapie wird allergischen Personen wiederholt das entsprechende Allergen mit dem Ziel verabreicht, die Immunantwort auf das Allergen zu verändern.
Die pharmakodynamische Wirkung einer Allergie-Immuntherapie zielt auf das Immunsystem, wobei der vollständige und genaue Mechanismus der klinischen Wirkung noch nicht völlig geklärt ist. Für die Behandlung mit AITARO wurde gezeigt, dass das Hausstaubmilben-spezifische IgG4 ansteigt und eine systemische Antikörperantwort induziert wird, die mit IgE um die Bindung von Hausstaubmilbenallergenen konkurriert. Dieser Effekt wird bereits nach 4 Wochen der Behandlung beobachtet.
AITARO wirkt auf die Ursache der allergischen Atemwegserkrankung. Der klinische Effekt wurde während der Behandlung für die oberen und unteren Atemwege nachgewiesen. Der zugrundeliegende Schutz durch AITARO ermöglicht eine bessere Kontrolle der Erkrankung und führt zu einer erhöhten Lebensqualität, nachgewiesen durch Linderung der Symptome, einen reduzierten Bedarf an anderen Medikamenten und ein geringeres Risiko von Exazerbationen.
Klinische Wirksamkeit bei Erwachsenen
Die Wirksamkeit der Behandlung mit AITARO 12 SQ-HDM bei Hausstaubmilben-induzierten allergischen Erkrankungen der Atemwege wurde in zwei doppelblinden, randomisierten, placebokontrollierten Studien mit verschiedenen Endpunkten und bei unterschiedlichen Patientengruppen untersucht. Zwei Drittel der Studienteilnehmer waren auch auf andere Allergene als Hausstaubmilben sensibilisiert. Es hatte keine Auswirkungen auf die Studienergebnisse, ob nur eine Sensibilisierung auf Hausstaubmilben oder auch eine Sensibilisierung auf weitere Allergene vorlag. Unterstützende Daten einer Studie in einer Allergenexpositionskammer sowie einer Studie mit niedrigeren Dosierungen werden ebenfalls vorgestellt.
Allergische Rhinitis
MERIT-Studie (MT-06)
• In die MERIT-Studie wurden 992 Erwachsene eingeschlossen, die trotz symptomatischer Pharmakotherapie eine mittelschwere bis schwere Hausstaubmilben-induzierte allergische Rhinitis hatten. Die Probanden wurden randomisiert und etwa 1 Jahr täglich mit 12 SQ-HDM, 6 SQ-HDM oder Placebo behandelt. Sie hatten freien Zugang zu einer einheitlichen Rhinitis Pharmakotherapie. Die Probanden wurden während der gesamten Studie etwa alle zwei Monate von einem Facharzt untersucht.
• Der primäre Endpunkt war der durchschnittliche tägliche kombinierte Gesamt-Rhinitisscore (Total combined rhinitis score, TCRS), der während der letzten 8 Wochen der Behandlung ermittelt wurde.
o Der TCRS war die Summe des Rhinitis-Symptom- und des Rhinitis-Medikamentenscores. Der Rhinitis-Symptomscore bewertete 4 nasale Symptome (laufende Nase, verstopfte Nase, juckende Nase, Niesen) täglich auf einer Skala von 0-3 (keine, leichte, mittlere, schwere Symptome), entsprechend einer Gesamtskala von 0-12. Der Rhinitis-Medikamentenscore war die Summe der Scores für die nasale Steroid-Einnahme (2 Punkte pro Hub, max. 4 Hübe/Tag.) und die Einnahme eines oralen Antihistaminikums (4 Punkte/Tablette, max. 1 Tablette/Tag), entsprechend einer Gesamtskala von 0- 12. Die TCRS-Gesamtskala ist demzufolge 0-24.
• Zusätzliche vordefinierte sekundäre Schlüsselendpunkte waren der kombinierte Rhinokonjunktivitis-Score (gesamt) und die Rhinokonjunktivitis-Lebensqualität (Rhinoconjunctivitis quality of life questionnaire, RQLQ).
• Weiterhin wurden Post-hoc Analysen der Tage mit Rhinitis-Exazerbationen durchgeführt, um die klinische Relevanz der Ergebnisse zu veranschaulichen.
o Eine Rhinitis-Exazerbation wurde als Tag definiert, an dem der Proband wieder so starke Symptome hatte, wie sie für den Einschluss in die Studie erforderlich waren: einen RhinitisSymptomscore von mindestens 6 oder ein Score von mindestens 5 mit einem Symptom, das als „schwer" bewertet wurde.
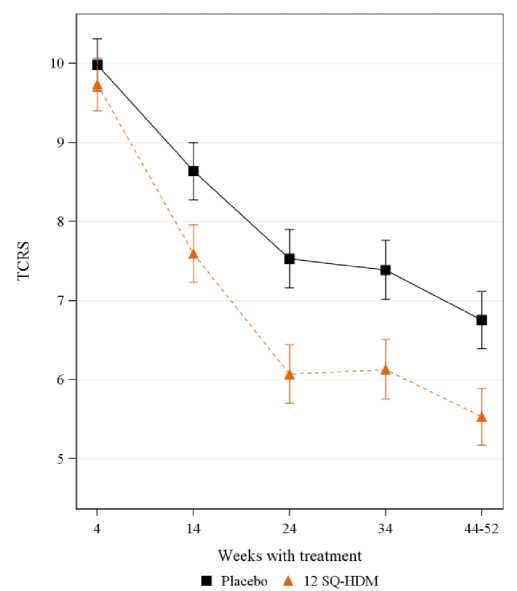
MERIT-Studie: zeitliche Entwicklung des kombinierten Gesamt-Rhinitisscores
TCRS: kombinierter Gesamt-Rhinitisscore (Symptom- und Medikamentenscore).
Der primäre Endpunkt ist der durchschnittliche TCRS während der letzten etwa 8 Wochen der Behandlung (Woche ~44-52).
Der adjustierte Mittelwert des durchschnittlichen TCRS über die Zeit mit Fehlerbalken für den adjustierten Mittelwert. Nicht-überlappende Intervalle zeigen einen statistisch signifikanten Unterschied.
|
MERIT Ergebnisse |
12 SQ-HDM |
Placebo |
Behandlungseffekt | ||||
|
Primärer Endpunkt |
N |
Score |
N |
Score |
absoluter Unterschied |
relativer Unterschied |
p- Wert |
|
kombinierter Rhinitis-Score (gesamt) | |||||||
|
FAS-MI a (adjustierter Mittelwert) |
318 |
5,71 |
338 |
6,81 |
1,09 [0,35;1,84] |
- |
0,004 |
|
FAS b (adjustierter Mittelwert) |
284 |
5,53 |
298 |
6,76 |
1,22 [0,49;1,96] |
18% |
0,001 |
|
FAS b (Median) |
284 |
5,88 |
298 |
7,54 |
1,66 |
22% |
- |
|
vordefinierte sekundäre Schlüsselendpunkte |
N |
Score |
N |
Score |
absoluter Unterschied c |
relativer Unterschied d |
p- Wert |
|
Rhinitis-Symptomscore | |||||||
|
FAS b (adjustierter Mittelwert) |
284 |
2,76 |
298 |
3,30 |
0,54 [0,18;0,89] |
16% |
0,003 |
|
FAS b (Median) |
284 |
2,98 |
298 |
3,98 |
1,00 |
25% |
- |
|
Rhinitis-Medikamentenscore | |||||||
|
FAS b (adjustierter Mittelwert) |
284 |
2,22 |
298 |
2,83 |
0,60 [0,08;1,13] |
21% |
0,024 |
|
FAS b (Median) |
284 |
2,83 |
298 |
4,00 |
1,17 |
29% |
- |
|
kombinierter Rhinokonjunktivits-Score (gesamt) | |||||||
|
FAS b (adjustierter Mittelwert) |
241 |
7,91 |
257 |
9,12 |
1,21 [0,13;2,28] |
13% |
0,029 |
|
FAS b (Median) |
241 |
8,38 |
257 |
10,05 |
1,67 |
20% |
- |
|
MERIT Ergebnisse |
12 SQ-HDM |
Placebo |
Behandlungseffekt | ||||
|
Fragebogen zur Lebensqualität bei Rhinokonjuktivitis (RQ |
LQ(S)) Score | ||||||
|
FAS b (adjustierter Mittelwert) |
229 |
1,38 |
240 |
1,58 |
0,19 e [0,02;0,37] |
12% |
0,031 |
|
FAS b (Median) |
229 |
1,25 |
240 |
1,46 |
0,21 |
14% |
- |
|
Post-hoc Endpunkte |
N |
Anteil |
N |
Anteil |
Chancenverhältnis (Odds ratio) f [95% CL] |
p- Wert | |
|
Wahrscheinlichkeit, einen Tag mit einer Rhinitis-Exazerbation zu haben | |||||||
|
FAS (Schätzung)b |
284 |
5,33% |
298 |
11,14% |
0,45 [0,28;0,72] |
0,001 | |
|
Wahrscheinlichkeit, einen Tag mit einer Rhinitis-Exazerbation trotz der Anwendung von Pharmakotherapie zu haben | |||||||
|
FAS (Schätzung)b |
284 |
3,43% |
298 |
6,50% |
0,51 [0,32;0,81] |
0,005 | |
N: Zahl der Probanden in der Behandlungsgruppe mit auswertbaren Daten für die Analyse. CL: Grenzen des Konfidenzintervalls
a FAS-MI: Full Analysis Set mit multiplen Zuweisungen. Die Analyse behandelt Probanden, die die Studie vor der Wirksamkeitsanalyse abgebrochen haben, als zur Placebogruppe gehörend. Für die Primäranalyse (FAS-MI) war nur der absolute Unterschied vorher spezifiziert.
b FAS: Full Analysis Set. Alle verfügbaren Daten wurden komplett ausgewertet d. h. die Probanden, die ihre Daten während der Wirksamkeitsanalyse zur Verfügung stellten.
c Absoluter Unterschied: Placebo minus 12 SQ-HDM, 95% innerhalb Grenzen des Konfidenzintervalls. d Relativer Unterschied zu Placebo: Placebo minus 12 SQ-HDM geteilt durch Placebo.
e Der Unterschied zwischen 12 SQ HDM und Placebo wurde hauptsächlich bestimmt durch die Unterschiede in den drei Bereichen: Schlafprobleme, praktische Probleme und Nasensymptome.
f Odds Ratio (Chancenverhältnis) für Rhinitis-Exazerbationen: 12 SQ-HDM im Vergleich zu Placebo.
Unterstützende Daten - allergische Rhinitis
Eine randomisierte, doppelblinde placebokontrollierte Phase-II-Studie wurde in einer Allergenexpositionskammer mit 124 Erwachsenen mit Hausstaubmilben-induzierter allergischer Rhinitis durchgeführt. Vor jeder Allergenprovokation wurde die zur Behandlung der Allergie verwendete Pharmakotherapie der Probanden ausgewaschen. Bei der Allergenprovokation nach 24-wöchiger Behandlung mit 12-SQ HDM, 6 SQ-HDM oder Placebo betrug der mittlere Rhinitis Symptomscore der Probanden in der Placebo-Gruppe 7,45 [6,57; 8,33] und in der 12 SQ-HDM-Gruppe 3,83 [2,94; 4,72]; dies entspricht einer absoluten Differenz von 3,62 und einer relativen Differenz von 49% (95%
Konfidenzintervall [35%; 60%], p < 0,001). Der Unterschied zwischen 12 SQ-HDM und Placebo war ebenfalls statistisch signifikant nach 16 Wochen (Mittelwerte von 5,95 und 8,58, Differenz von 2,62, entsprechend 30%, 95% CI [17%; 42%], p < 0,001) und nach 8 Wochen (Mittelwerte von 6,51 und 8,48, Differenz von 1,97, entsprechend 20%, 95% CI [7%, 33%], p = 0,007).
Allergisches Asthma
MITRA-Studie (MT-04)
In die MITRA-Studie wurden 834 Erwachsene mit Hausstaubmilben-induziertem allergischen Asthma eingeschlossen, deren Asthma trotz täglicher Verwendung von inhalativen Kortikosteroiden (ICS) von 400 -1200 Mikrogramm Budesonid nicht gut kontrolliert war. Alle Patienten erhielten 7-12 Monate AITARO zusätzlich zu ICS und kurzwirksamen Beta-Agonisten, bevor die ICS-Dosis reduziert wurde. Vor der
Randomisierung wurde keine Titrationsphase durchgeführt, um die niedrigste Erhaltungsdosis von ICS zu bestimmen. In den letzten 6 Monaten der insgesamt 13 bis 18-monatigen Behandlung wurde die Wirksamkeit anhand der Zeit bis zur ersten mittelschweren oder schweren Asthma-Exazerbation unter der Reduktion von ICS beurteilt.
• Die Definition einer mittelschweren Asthma-Exazerbation wurde erfüllt, wenn der Studienteilnehmer eines oder mehrere der folgenden vier Kriterien erfüllte und dies zu einer Änderung der Behandlung führte:
o Nächtliches Erwachen oder Zunahme der Symptome: nächtliches Erwachen aufgrund von Asthma mit Anwendung von kurzwirksamen Beta-Agonisten (SABA) in zwei aufeinanderfolgenden Nächten oder Anstieg des täglichen Symptomscores von > 0,75 über den Ausgangswert an zwei aufeinanderfolgenden Tagen.
o Erhöhte SABA Verwendung: Anstieg der SABA-Anwendung gegenüber dem Ausgangswert an zwei aufeinanderfolgenden Tagen (Mindesterhöhung: 4 Hübe/Tag).
o Verschlechterung der Lungenfunktion: > 20%ige Abnahme des PEF gegenüber dem Ausgangswert an mindestens zwei aufeinanderfolgenden Morgen/Abenden oder > 20%ige Abnahme des FEV1 gegenüber dem Ausgangswert.
o Arztbesuch: Besuch in der Notaufnahme/im Prüfzentrum zur Asthma-Behandlung, die keine systemischen Kortikosteroide erforderte.
• Eine schwere Asthma Exazerbation war durch das Auftreten mindestens eines der beiden folgenden Kriterien definiert:
o Bedarf an systemischen Kortikosteroiden für > 3 Tage
o Besuch einer Notaufnahme mit Bedarf an systemischen Kortikosteroiden oder Krankenhausaufenthalt für > 12 Stunden.
Kaplan-Meier plot
12 SQ-HDM
Placebo
Z4B
Placebo
12 SQ-HDM
Number of subiects still at risk
214
120
150
180
Time (days durina ICS reduction
MITRA-Studie - Darstellung der primären Wirksamkeitsdaten: zeitliche Entwicklung des Risikos für moderate bis schwere Asthma-Exazerbationen während der Reduktion/des Absetzens von ICS.
Der Zeitpunkt t = 0 in der Grafik ist der Zeitpunkt der ICS Reduktion auf 50%. Nach ungefähr 3 Monaten, d.h. zum Zeitpunkt t =
90 Tage, wurde das ICS bei den Probanden, die keine Exazerbation hatten, vollständig abgesetzt.
|
MITRA Ergebnisse |
12 SQ-HDM |
Placebo |
Wirksamkeit 12 SQ-HDM im Vergleich zu Placebo |
p-Wert | |||
|
N |
n (%) |
N |
n (%) |
RisikoVerhältnis [95% CL] |
Risiko Reduktion | ||
|
Primärer Endpunkt | |||||||
|
Jede Exazerbation, moderat oder schwer (FAS-MI) b |
282 |
59 (21%) |
277 |
83 (30%) |
0,69 [0,50;0,96] |
31% |
0,027 |
|
Jede Exazerbation, moderat oder schwer (FAS)c |
248 |
59 (24%) |
257 |
83 (32%) |
0,66 [0,47;0,93] |
34% |
0,017 |
|
vordefinierte Analyse der Bestandteile des primären Endpunktes | |||||||
|
Nächtliches Erwachen oder Anstieg der Symptome c |
248 |
39 (16%) |
257 |
57 (22%) |
0,64 [0,42;0,96] |
36% |
0,031 |
|
Erhöhte SABA Anwendung c |
248 |
18 (7%) |
257 |
32 (12%) |
0,52 [0,29;0,94] |
48% |
0,029 |
|
Verschlechterung der Lungenfunktion c |
248 |
30 (12%) |
257 |
45 (18%) |
0,58 [0,36;0,93] |
42% |
0,022 |
|
Schwere Exazerbation c |
248 |
10 (4%) |
257 |
18 (7%) |
0,49 [0,23;1,08] |
51% |
0,076 |
N: Zahl der Probanden in der Behandlungsgruppe mit auswertbaren Daten für die Analyse. n (%): Zahl und Prozentangaben der Probanden in der Behandlungsgruppe, die die Kriterien erfüllen.
CL: Grenzen des Konfidenzintervalls a abgeschätzt durch Risiko-Verhältnis
b FAS-MI: Full Analysis Set mit multiplen Zuweisungen. Die Analyse behandelt Probanden, die die Studie vor der Wirksamkeitsanalyse abgebrochen haben, als zur Placebogruppe gehörend.
c FAS: Full Analysis Set. Alle verfügbaren Daten wurden komplett ausgewertet, d.h. die Probanden, die ihre Daten während der Wirksamkeitsanalyse zur Verfügung stellten.
Zusätzlich wurden Post hoc-Analysen der Asthmasymptome und des Gebrauchs von symptomatischen Medikamenten in den letzten 4 Behandlungswochen vor Reduktion der inhalativen Kortikosteroide durchgeführt, um die Wirkung von AITARO zusätzlich zu inhalativen Kortikosteroiden zu untersuchen. Die Analyse untersuchte die Asthma-Symptom-Scores am Tag und in der Nacht, nächtliches Erwachen und die Anwendung von SABA. Die Post hoc-Analysen zeigten konsistente numerische Unterschiede für 12 SQ-HDM im Vergleich zu Placebo für alle untersuchten Parameter. Die Unterschiede waren nur für den AsthmaTages Symptom-Score (p = 0,0450) und die Wahrscheinlichkeit für „kein nächtliches Aufwachen" (p = 0,0409) statistisch signifikant.
Unterstützende Evidenz - allergisches Asthma
In einer doppelblinden, randomisierten, placebokontrollierten Phase II-Studie wurden 604 Probanden (> 14 Jahre alt) mit Hausstaubmilben-induziertem allergischen Asthma, das mit inhalativen Kortikosteroiden (100-800 Mikrogramm) kontrolliert war, und mit einer klinischen Vorgeschichte von Hausstaubmilbeninduzierter allergischer Rhinitis, auf 1, 3 oder 6 SQ-HDM oder Placebo randomisiert und für ca. 1 Jahr behandelt. Während des 4-wöchigen Zeitraums der Wirksamkeitsanalyse am Ende der Studie betrug die mittlere Veränderung der täglichen ICS-Dosis vom Ausgangswert 207,6 Mikrogramm Budesonid in der 6 SQ-HDM-Gruppe und 126,3 Mikrogramm in der Placebo-Gruppe, was einer absoluten Differenz von 81 Mikrogramm Budesonid pro Tag entspricht (95% Konfidenzintervall [27; 136], p = 0,004). Die relative mittlere bzw. mediane ICS Reduktion betrug 42% bzw. 50% für 6 SQ-HDM und 15% bzw. 25% für Placebo. In einer Post-hoc-Analyse einer Subgruppe (N = 108) von Patienten mit schlechterer Asthma-Kontrolle und einer ICS Dosis > 400 Mikrogramm Budesonid pro Tag betrug die durchschnittliche Veränderung der täglichen ICS-Dosis vom Ausgangswert 384,4 Mikrogramm Budesonid in der 6 SQ-HDM-Gruppe und 57,8 Mikrogramm in der Placebo-Gruppe. Dies entspricht einer absoluten Differenz zwischen 6 SQ-HDM und Placebo von 327 Mikrogramm Budesonid pro Tag (95% CI [182; 471], p < 0,0001, Post-hoc-Analyse).
Kinder und Jugendliche
AITARO ist für Patienten unter 18 Jahren nicht zugelassen (siehe Abschnitt 4.2).
Es sind begrenzt Sicherheits- und Verträglichkeitsdaten für pädiatrische Patienten im Alter von 5-17 Jahren verfügbar.
Die Europäische Arzneimittel-Agentur (EMA) hat auf die Verpflichtung verzichtet, Studienergebnisse mit AITARO bei Kindern unter 5 Jahren mit Hausstaubmilben-induzierten allergischen Erkrankungen der Atemwege einzureichen (Behandlung von allergischer Rhinitis, Prävention von Asthma, Behandlung von Asthma).
Die Europäische Arzneimittel-Agentur hat die Verpflichtung zurückgestellt, die Ergebnisse weiterer Studien mit AITARO bei Kindern ab 5 Jahren mit Hausstaubmilben-induzierten allergischen Erkrankungen der Atemwege einzureichen (Behandlung von allergischer Rhinitis, Prävention von Asthma, Behandlung von Asthma).
Ältere Menschen
AITARO ist für Patienten über 65 Jahren nicht zugelassen (siehe Abschnitt 4.2). Es sind begrenzt Daten zur Sicherheit und Verträglichkeit für Patienten über 65 Jahren verfügbar.
Langzeitbehandlung
Internationale Leitlinien empfehlen für die Allergie-Immuntherapie eine Behandlungsdauer von 3 Jahren, um einen krankheitsmodifizierenden Effekt zu erreichen. Für eine Behandlung mit AITARO liegen aus der MITRA-Studie Wirksamkeitsdaten für einen Behandlungszeitraum von 18 Monaten vor. Die Langzeitwirksamkeit wurde nicht untersucht.
5.2 Pharmakokinetische Eigenschaften
Es wurden keine klinischen Studien zur Untersuchung der Pharmakokinetik und des Metabolismus von AITARO durchgeführt. Die Wirkung der Allergie-Immuntherapie wird durch immunologische Mechanismen vermittelt und es stehen nur begrenzt Informationen über die pharmakokinetischen Eigenschaften zur Verfügung.
Die aktiven Moleküle eines Allergenextraktes bestehen hauptsächlich aus Proteinen. Studien für Produkte zur sublingualen Allergie-Immuntherapie haben gezeigt, dass keine passive Absorption des Allergens durch die Mundschleimhaut stattfindet. Die Datenlage deutet darauf hin, dass das Allergen über die Mundschleimhaut durch dendritische Zellen, insbesondere Langerhans-Zellen, aufgenommen wird. Man geht davon aus, dass die nicht auf diese Weise absorbierten Allergene im Lumen des Gastrointestinaltraktes zu Aminosäuren und kleinen Polypeptiden hydrolysiert werden. Es gibt keine Hinweise darauf, dass die in AITARO enthaltenen Allergene nach sublingualer Verabreichung in nennenswertem Umfang in das Gefäßsystem absorbiert werden.
5.3 Präklinische Daten zur Sicherheit
Konventionelle Studien zur allgemeinen Toxizität und Reproduktionstoxizität bei Mäusen ließen keine besonderen Gefahren für den Menschen erkennen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Gelatine (aus Fisch gewonnen)
Mannitol
Natriumhydroxid (zur Einstellung des pH-Wertes)
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Aluminiumblisterstreifen mit entfernbarer Aluminiumfolie in einem Umkarton. Jeder Blisterstreifen enthält 10 Lyo-Tabletten zum Einnehmen.
Packungsgrößen: 30 (3x 10) Lyo-Tabletten 90 (9 x 10) Lyo-Tabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
ALK-Abello A/S B0ge Alle 6-8 DK-2970 H0rsholm
Vertrieb in Deutschland durch:
ALK-Abello Arzneimittel GmbH Griegstraße 75 (Haus 25)
D-22763 Hamburg
8. ZULASSUNGSNUMMER(N)
PELH.11820.0U
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Stand der Information
Oktober 2015
Verkaufsabgrenzung
Verschreibungspflichtig.
Seite 15 von 15
AITARO Fachinformation
Oktober 2015