Alphanine 1000
Gebrauchsinformation: Information für Anwender
AlphaNine® 1000 Trockensubstanz und Lösungsmittel zur Herstellung einer Injektionslösung Wirkstoff: Blutgerinnungsfaktor IX vom Menschen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Symptome haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht:
1. Was ist AlphaNine® und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von AlphaNine® beachten?
3. Wie ist AlphaNine® anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist AlphaNine® aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist AlphaNine® und wofür wird es angewendet?
AlphaNine® ist ein Mittel zur Blutstillung (Antihämorrhagikum).
AlphaNine® wird angewendet zur Behandlung und Prophylaxe von Blutungen bei Patienten mit
Hämophilie B (angeborener Faktor-IX-Mangel).
AlphaNine® 1000 enthält 1000 I.E. Blutgerinnungsfaktor IX von Menschen pro Durchstechflasche.
2. Was sollten Sie vor der Anwendung von AlphaNine® beachten?
AlphaNine® darf nicht angewendet werden,
- wenn Sie allergisch gegen Faktor IX oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind
- bei aktueller oder aus der Anamnese bekannter allergisch bedingter Thrombozytopenie auf Heparin (Heparin-assoziierte Thrombozytopenie Typ II).
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt, Apotheker oder dem medizinischen Fachpersonal, bevor Sie
AlphaNine® anwenden.
Besondere Vorsicht bei der Anwendung von AlphaNine® ist erforderlich,
- wenn Sie Überempfindlichkeitsreaktionen wie Ausschlag, generalisierte Nesselsucht, Engegefühl in der Brust, pfeifendes Atmen und Absinken des Blutdrucks bei sich beobachten.
Dies können Anzeichen für eine anaphylaktische Reaktion gegenüber AlphaNine® sein. Sollten diese Symptome auftreten, müssen Sie die Anwendung des Produktes sofort abbrechen und sich mit Ihrem Arzt in Verbindung setzen.
- wenn sich Ihre Blutung mit AlphaNine® nicht kontrollieren lässt. Setzen Sie sich sofort mit Ihrem Arzt in Verbindung. Sie haben möglicherweise Hemmkörper gegen Faktor IX entwickelt. Es wird empfohlen, in diesen Fällen ein spezialisiertes Hämophilie-Zentrum zu kontaktieren.
Wegen des möglichen Risikos thromboembolischer Komplikationen sollte Faktor IX vom Menschen bei Patienten mit Leberschäden, bei frisch operierten Patienten, bei Neugeborenen oder bei Patienten mit Risiko für thromboembolische Reaktionen oder Verbrauchskoagulopathie unter Vorsicht erfolgen.
Bei der Herstellung von Arzneimitteln aus menschlichem Blut oder Plasma erfolgen bestimmte Maßnahmen, um die Übertragung von Infektionen auf Patienten zu verhindern. Diese beinhalten:
• die sorgfältige Auswahl von Blut- und Plasmaspendern, um sicherzustellen, dass Infektionsträger ausgeschlossen werden,
• die Testung der einzelnen Spende und der Plasmapools auf Anzeichen von Viren/Infektionen,
• die Aufnahme bestimmter Schritte in die Weiterverarbeitung von Blut oder Plasma, die Viren inaktivieren oder entfernen können.
Trotz dieser Maßnahmen kann bei der Anwendung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt werden, die Möglichkeit der Übertragung einer Infektion nicht vollständig ausgeschlossen werden. Dies trifft auch für alle unbekannten oder neu auftauchenden Viren oder andere Infektionstypen zu.
Die durchgeführten Maßnahmen (Solvent-Detergent-Verfahren, Nanofiltration) werden bei umhüllten Viren wie dem Human Immunodeficiency Virus (HIV), dem Hepatitis B-Virus und dem Hepatitis C-Virus als wirksam erachtet. Sie können von begrenzter Wirksamkeit gegen nicht-umhüllte Viren wie Hepatitis A-Virus und Parvovirus B19 sein. Parvovirus B19-Infektionen können schwerwiegende Folgen für schwangere Frauen (Infektion des Ungeborenen) haben und für Patienten, deren Immunsystem geschwächt ist oder die bestimmte Formen der Anämie (z.B. Sichelzellen-Anämie oder hämolytische Anämie) haben.
Möglicherweise empfiehlt Ihnen Ihr Arzt über eine Impfung gegen Hepatitis A oder Hepatitis B nachzudenken, wenn Sie regelmäßig/wiederholt Faktor-IX-Produkte aus menschlichem Plasma erhalten.
Jedes Mal, wenn Sie AlphaNine® erhalten, sollte der Produktname und die Chargenbezeichnung aufgeschrieben werden, um eine Dokumentation der verwendeten Chargen zu erhalten.
Anwendung von AlphaNine® zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/angewendet haben oder beabsichtigen andere Arzneimittel einzunehmen/anzuwenden.
Anwendung von AlphaNine® zusammen mit Nahrungsmitteln und Getränken Nahrungsmittel und Getränke haben keinen Einfluss auf die Anwendung von AlphaNine®.
Schwangerschaft und Stillzeit
Fragen Sie Ihren Arzt oder Apotheker vor der Anwendung von AlphaNine®.
Aufgrund des seltenen Auftretens von Hämophilie B bei Frauen, liegen keine Erfahrungen hinsichtlich der Anwendung von Faktor IX während der Schwangerschaft und Stillzeit vor. Faktor IX sollte deshalb während Schwangerschaft und Stillzeit nur bei eindeutiger Indikation angewendet werden.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Es gibt keine Hinweise, dass Blutgerinnungsfaktor-IX-Konzentrate vom Menschen die Verkehrstüchtigkeit und das Bedienen von Maschinen beeinflusst.
AlphaNine® enthält Natrium
AlphaNine® enthält 1,3 bis 3 mmol Natrium pro 10 ml Lösung. Dies muss bei Patienten, die eine
natriumarme Diät einhalten müssen, berücksichtigt werden.
3. Wie ist AlphaNine® anzuwenden?
Wenden Sie AlphaNine® immer genau nach der Anweisung des Arztes an. Bitte fragen Sie bei
Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
AlphaNine® ist nur intravenös zu verabreichen.
Nicht verwendete Lösung darf nicht zur späteren Anwendung aufbewahrt werden bzw. darf nicht im
Kühlschrank gelagert werden.
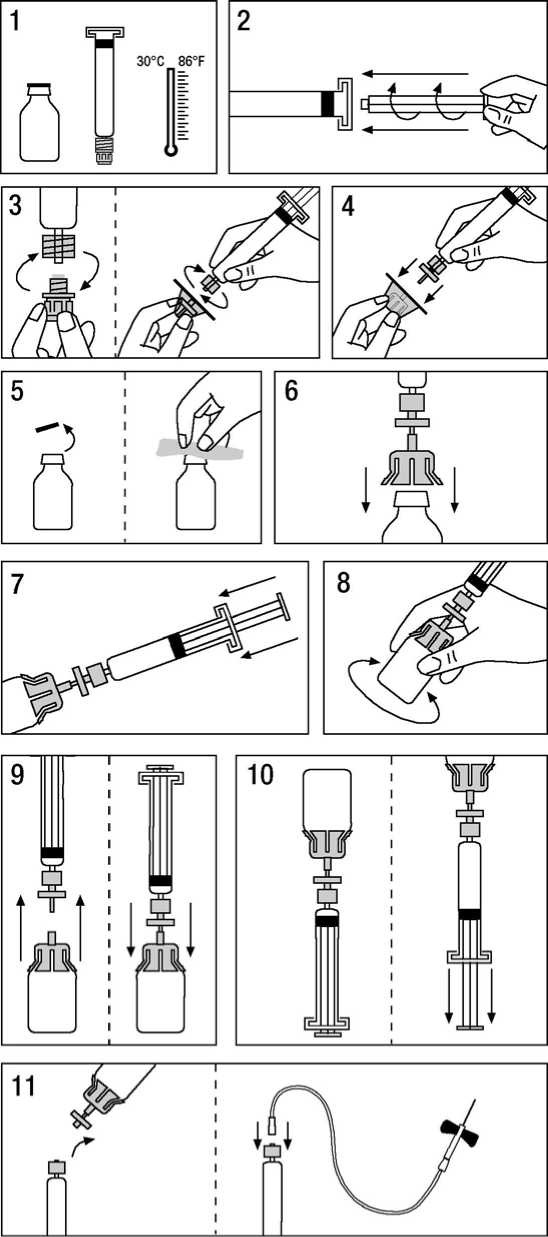
Herstellung der Injektionslösung:
1. Bringen Sie die Produktflasche und Spritze auf Raumtemperatur.
2. Drehen Sie den Plastikkolben in die Spritze mit dem Lösungsmittel ein. Dabei dürfen Sie die Plastikmanschette in diesem Bereich unter keinen Umständen entfernen.
3. Ziehen Sie die Folie von der Filterverpackung ab. Entfernen Sie die Verschlusskappe von der Spritzenspitze und drehen Sie die Spritze auf den Filter.
4. Nehmen Sie den Transferadapter aus der Verpackung und setzen Sie ihn auf die Spritze mit dem Filter.
5. Entfernen Sie den Kunststoffdeckel von der Produktflasche und desinfizieren Sie den Gummistopfen mit dem beigepackten Alkoholtupfer.
6. Halten Sie die Spritze mit Filter und Transferadapter über die Produktflasche und durchstechen Sie den Gummistopfen mit der Kanüle des Transferadapters.
7. Überführen Sie nun durch Drücken des Spritzenkolbens das gesamte Wasser für Injektionszwecke aus der Spritze in die Produktflasche.
8. Schwenken Sie die Spritze mit Produktflasche vorsichtig bis das Lyophilisat vollständig gelöst ist. Wie für jede parenterale Lösung gilt, dass sie nicht verwendet werden darf, wenn das Lyophilisat nicht vollständig aufgelöst ist oder Partikel sichtbar sind.
9. Trennen Sie die Spritze mit Filter kurz von der Produktflasche mit Transferadapter, um das Vakuum zu entfernen.
10. Drehen Sie die Produktflasche mit aufgesetzter Spritze um und ziehen Sie die Lösung durch den Filter auf.
11. Bereiten Sie die Injektionsstelle vor. Trennen Sie die Spritze vom Filter mit Adapter. Setzen Sie die beigepackte Butterfly-Kanüle auf, entlüften Sie die Spritze und injizieren Sie die Lösung intravenös.
Mit einer Infusionsgeschwindigkeit von maximal 10 ml/min. verabreichen.
Nach der Rekonstitution im beigefügten Wasser für Injektionszwecke sollte das Produkt sofort verwendet werden.
Das Infusionsbesteck darf nicht wieder verwendet werden.
Die zu verabreichende Dosis AlphaNine® sowie die Häufigkeit der Anwendung hängt von vielen Faktoren wie z.B. Gewicht, Schwere der Hämophilie, Blutungsort und -ausmaß, Höhe der evtl. vorhandenen Faktor-IX-Hemmkörper sowie dem erforderlichen Faktor-IX-Spiegel ab.
Ihr Arzt wird die Dosierung und Anwendungshäufigkeit von AlphaNine® berechnen, um die notwendige Faktor-IX-Aktivität in Ihrem Blut zu erreichen.
Die erforderliche Dosis lässt sich durch folgende Formel ermitteln:
Erforderliche Einheiten an FIX (I.E.) = Körpergewicht (kg) x erwünschter Anstieg der Faktor IX-Aktivität (%) (I.E./dl) x 0,8
Die zu verabreichende Dosis und Häufigkeit der Anwendung sollten sich stets an der klinischen Wirksamkeit im Einzelfall orientieren. Faktor-IX-Produkte werden selten häufiger als einmal täglich verabreicht.
Die folgende Tabelle dient zur Orientierung für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen:
Bei den aufgeführten Blutungsereignissen sollte die angegebene Faktor-IX-Aktivität im Plasma (in % des Normalwertes oder in I.E./dl) im betreffenden Zeitraum nicht unterschritten werden.
|
Schwere der Blutung / Art des chirurgischen Eingriffs |
Erforderlicher FIX-Plasmaspiegel (%) (I.E./dl) |
Häufigkeit der Dosierung (Stunden) / Behandlungsdauer (Tage) |
|
Blutungen | ||
|
Gelenkblutungen im Frühstadium, Muskelblutungen, Blutungen im Mundbereich |
20 - 40 |
Injektion alle 24 Stunden wiederholen; mindestens 1 Tag, bis die (durch Schmerzen erkennbare) Blutung sis-tiert bzw. Wundheilung erreicht ist. |
|
Ausgeprägte Gelenkblutungen, Muskelblutungen oder Hämatome |
30 - 60 |
Injektion alle 24 Stunden für 3 bis 4 Tage oder länger wiederholen, bis die Schmerzen und Behinderungen beseitigt sind. |
|
Lebensbedrohliche Blutungen |
60 - 100 |
Injektion alle 8 bis 24 Stunden wiederholen, bis die Gefahr für den Patienten vorüber ist. |
|
Chirurgische Eingriffe | ||
|
Kleinere Eingriffe, einschließlich Zahnextraktionen |
30 - 60 |
Injektion alle 24 Stunden; mindestens 1 Tag, bis Wundheilung erreicht ist. |
|
Größere Eingriffe |
80 - 100 (prä- und postoperativ) |
Injektion alle 8 bis 24 Stunden wiederholen, bis ausreichende Wundheilung erreicht ist; dann für mindestens weitere 7 Tage einen Faktor IX-Spiegel von 30 % bis 60 % (I.E./dl) aufrechterhalten. |
Ihr Arzt wird die Dosis und Anwendungshäufigkeit von AlphaNine® immer an die klinische Wirksamkeit im Einzelfall anpassen. Manchmal werden die benötigten Mengen höher sein als die vorher berechneten, insbesondere bei der ersten Dosis.
Wenn Sie AlphaNine® anwenden um Blutungen zu verhindern (Prophylaxe), so wird Ihr Arzt die geeignete Dosierung berechnen. Für die Langzeitprophylaxe liegt die übliche Dosierung bei Patienten mit schwerer Hämophilie B bei 20 bis 40 I.E. Faktor IX pro kg Körpergewicht im Abstand von 3-4 Tagen. In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsintervalle oder höhere Dosen erforderlich sein.
Obwohl die Dosierung mittels der oben aufgeführten Formel berechnet werden kann, ist es empfehlenswert in angemessenen Abständen geeignete Tests im Plasma durchzuführen, um sicherzustellen, dass passende Faktor-IX-Spiegel erreicht und aufrechterhalten werden. Im Falle größerer operativer
Eingriffe ist eine genaue Überwachung der Substitutionstherapie mittels Gerinnungsanalysen unverzichtbar.
Werden die erwarteten Faktor-IX-Spiegel nicht erreicht oder kann die Blutung mit einer offenbar angemessenen Dosis nicht kontrolliert werden, so muss vermutet werden, dass Hemmkörper gegen Faktor IX vorhanden sind. Die Anwesenheit und Menge von Faktor-IX-Hemmkörpern wird von Spezialisten mittels geeigneter Labormethoden bestimmt.
Bitte sprechen Sie mit Ihrem Arzt, wenn Sie den Eindruck haben, dass die Wirkung von AlphaNine® zu stark oder zu schwach ist.
Hemmkörperpatienten
Wenn Ihr Arzt Ihnen mitteilt, dass Sie Hemmkörper gegen Faktor IX entwickelt haben, werden Sie wahrscheinlich größere Mengen AlphaNine® benötigen, um Blutungen zu kontrollieren. Wenn diese Dosierung Ihre Blutung nicht kontrolliert, sollten andere therapeutische Möglichkeiten erwogen werden. Erhöhen Sie nicht die verordnete AlphaNine®-Dosierung um die Blutung zu stillen, ohne Ihren Arzt zu konsultieren. Sollten Sie weitere Informationen benötigen, so fragen Sie Ihren Arzt.
Diese Behandlungen sollten nur von Ärzten, die über Erfahrung in der Therapie der Hämophilie B verfügen, durchgeführt werden.
Siehe auch Abschnitt 2. Was müssen Sie vor der Anwendung von AlphaNine® beachten?
Wenn Sie eine größere Menge AlphaNine® verabreicht haben, als Sie sollten
Symptome von Überdosierung mit Blutgerinnungsfaktor IX vom Menschen wurden nicht berichtet. Sollten Sie mehr AlphaNine® infundiert haben, als notwendig, so setzen Sie sich sofort mit Ihrem Arzt oder Apotheker in Verbindung.
Wenn Sie die Anwendung von AlphaNine® vergessen haben
Applizieren Sie sofort die nächste Anwendung und fahren Sie danach in regelmäßigen Intervallen gemäß den Anweisungen des Arztes fort.
Infundieren Sie nicht die doppelte Dosis, wenn Sie die vorherige Gabe vergessen haben.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
- Überempfindlichkeit oder allergische Reaktionen (wie z.B. Gesichtsschwellung, Brennen und Stechen an der Einstichstelle, Schüttelfrost, Hitzegefühl, generalisierte Nesselsucht, Kopfschmerz, Quaddeln, Absinken des Blutdrucks, Lethargie, Übelkeit, Ruhelosigkeit, Steigerung der Herzfrequenz, Engegefühl in der Brust, Kribbeln, Erbrechen, pfeifendes Atmen) wurden nur bei wenigen Patienten beobachtet, die mit Faktor-IX-Produkten behandelt wurden. In seltenen Fällen trat ein anaphylaktischer Schock auf. Im Fall einer anaphylaktischen oder allergischen Reaktion müssen Sie die Injektion unterbrechen und Ihren Arzt konsultieren.
- Nach versuchter Toleranzinduktion wurde bei Hämophilie-B-Patienten mit Faktor-IXInhibitoren und einer Vorgeschichte allergischer Reaktionen ein nephrotisches Syndrom beobachtet.
- In seltenen Fällen wurde Fieber beobachtet.
Allergische Reaktionen gegen Bestandteile des Produkts können nicht vollständig ausgeschlossen werden. Die Bildung neutralisierender Antikörper gegen Faktor IX (Hemmkörper/Inhibitoren) ist eine bekannte Komplikation bei der Behandlung von Patienten mit Hämophilie B. Treten solche
Hemmkörper auf, so manifestiert sich dies in einer ungenügenden klinischen Wirksamkeit. Sie müssen deshalb sorgfältig anhand geeigneter klinischer Beobachtungen sowie mittels Laboruntersuchungen auf Bildung von Hemmkörpern überwacht werden.
Es besteht ein potenzielles Risiko für thromboembolische Ereignisse nach Verabreichung von Fak-tor-IX-Produkten. Die Anwendung eines hochreinen Faktor-IX-Produkts wie AlphaNine® wird nur selten mit Nebenwirkungen dieser Art in Verbindung gebracht.
Selten werden Heparin-Antikörper-vermittelte schwere Thrombozytopenien (Typ II) mit Thrombozytenwerten deutlich unter 100.000/pl oder einem schnellen Abfall auf weniger als 50% des Ausgangswertes beobachtet. Bei nicht Sensibilisierten beginnt der Thrombozytenabfall in der Regel 6-14 Tage nach Behandlungsbeginn, bei Sensibilisierten unter Umständen innerhalb von Stunden. Die schwere Form der Thrombozytopenie kann verbunden sein mit arteriellen und venösen Thrombosen/Thromboembolien, Verbrauchskoagulopathie (erworbene Gerinnungssteigerung), evtl. Hautnekrosen an der Injektionsstelle, punktförmigen Hautblutungen, verschiedenen exanthe-matösen Hautblutungen und Blutbeimengung im Stuhl. Dabei kann die blutgerinnungshemmende Wirkung des Heparins vermindert sein (Heparintoleranz).
In solchen Fällen ist AlphaNine® sofort abzusetzen. Auch in Zukunft dürfen bei Ihnen keine heparinhaltigen Arzneimittel mehr angewendet werden.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Straße 51-59, 63225 Langen, Tel: +49 6103 77 0, Fax: +49 6103 77 1234, Website: www.pei.de anzeigen.
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist AlphaNine® aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett angegebenen Verfalldatum nicht mehr verwenden.
Aufbewahrungsbedingungen
Im Kühlschrank lagern (2°C - 8°C). Nicht einfrieren. Die Flasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Hinweis auf Haltbarkeit nach Anbruch oder Zubereitung
Sie dürfen das Arzneimittel nicht verwenden, wenn die hergestellte Lösung sichtbare Partikel oder Verfärbung aufweist. Keine Lösungen verwenden, die trüb sind oder einen Bodensatz aufweisen.
Sie dürfen AlphaNine® nur verwenden, wenn die Lösung klar oder leicht opaleszent ist. Das Präparat ist unmittelbar nach dem Auflösen zu verwenden.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Arzt oder Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft die Umwelt zu schützen.
6. Inhalt der Packung und weitere Informationen Was AlphaNine® enthält
Trockensubstanz: Der Wirkstoff ist Blutgerinnungsfaktor IX vom Menschen.
Die sonstigen Bestandteile sind D-Glucose, Heparin, Natriumchlorid und Natriumcitrat.
Lösungsmittel: Wasser für Injektionszwecke.
AlphaNine® 1000 besteht aus einer Trockensubstanz zur Herstellung einer Injektionslösung, die nach Rekonstitution in 10 ml Lösungsmittel (Wasser für Injektionszwecke) 100 I.E./ml Blutgerinnungsfaktor IX vom Menschen enthält.
Wie AlphaNine® aussieht und Inhalt der Packung
Glasflasche mit 1000 I.E. Blutgerinnungsfaktor IX vom Menschen (Trockensubstanz) und Glasspritze mit 10 ml Lösungsmittel (Wasser für Injektionszwecke) zur Herstellung einer Injektionslösung; Microfilter, Butterfly-Kanüle, Transferadapter, 2 Alkoholtupfer.
Pharmazeutischer Unternehmer
Grifols Deutschland GmbH Lyoner Straße 15 60528 Frankfurt Tel.: 069/660 593 100 Fax: 069/660 593 110
Hersteller, der das Fertigarzneimittel für das Inverkehrbringen freigegeben hat Instituto Grifols, S.A.
Can Guasc, 2 - Parets del Valles E-08150 Barcelona
Diese Packungsbeilage wurde zuletzt überarbeitet im August 2014 Herkunftsland des Blutplasmas
Das zur Herstellung von AlphaNine® verwendete Blutplasma stammt aus den USA.
8