Amicette 250 Mikrogramm / 35 Mikrogramm Tabletten
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Amicette 250 Mikrogramm / 35 Mikrogramm Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Amicette sind Tabletten zum Einnehmen.
Jede Tablette enthält 250 Mikrogramm Norgestimat und 35 Mikrogramm Ethinylestradiol.
Sonstiger Bestandteil mit bekannter Wirkung:
Jede unbeschichtete Tablette enthält 89,357 mg Lactose.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette.
Runde, blaue, nicht überzogene Tabletten mit einem Durchmesser von 6,4 mm mit abgeflachten Kanten und der Prägung „146" auf der einen Seite und glatt auf der anderen Seite.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Orale Kontrazeption
Bei der Entscheidung, Amicette zu verschreiben, sollten die aktuellen, individuellen Risikofaktoren der einzelnen Frauen, insbesondere im Hinblick auf venöse Thromboembolien (VTE), berücksichtigt werden. Auch sollte das Risiko für eine VTE bei Anwendung von Amicette mit dem anderer kombinierter hormonaler Kontrazeptiva (KHK) verglichen werden (siehe Abschnitte 4.3 und 4.4).
4.2 Dosierung und Art der Anwendung
Zum Einnehmen.
Dosierung
Kinder und Jugendliche
Amicette darf nicht bei Mädchen vor der Pubertät - vor der Menarche - angewendet werden (siehe Abschnitt 4.3).
Erwachsene
Es wird über einen Zeitraum von 21 Tagen ohne Unterbrechung eine Tablette täglich jeweils zur gleichen Tageszeit (vorzugsweise abends) eingenommen, worauf eine Einnahmepause von 7 Tagen folgt. Mit jeder nachfolgenden Packung wird nach Ablauf der 7 tablettenfreien Tage begonnen. Zusätzliche empfängnisverhütende Maßnahmen sind dann nicht erforderlich. Während der tablettenfreien Phase ist mit einer Blutung zu rechnen, die üblicherweise 2 - 4 Tage nach der letzten Tablette einsetzt.
Ältere Patienten
Dieses Produkt wird nicht bei postmenopausalen Frauen angewendet.
Art der Anwendung Beginn der Behandlung
Mit der Tabletteneinnahme wird an Tag 1 des natürlichen Zyklus der Frau begonnen (d. h. am ersten Tag der Menstruationsblutung).
Umstellung von einem anderen Kontrazeptivum
Umstellung von einem kombinierten hormonellen Kontrazeptivum (kombiniertes orales Kontrazeptivum [KHK], Vaginalring oder transdermales Pflaster)
Die Frau sollte mit der Einnahme von Amicette vorzugsweise am Tag nach der Einnahme der letzten aktiven Tablette (die letzte Tablette, die die Wirkstoffe enthält) ihres vorherigen KHK beginnen, spätestens jedoch am Tag nach der üblichen tablettenfreien bzw. der Placebotabletten-Phase ihres vorherigen KHK. Falls zuvor ein Vaginalring oder transdermales Pflaster angewendet wurde, sollte die Frau vorzugsweise am Tag von dessen Entfernung mit der Einnahme von Amicette beginnen, spätestens jedoch an dem Tag, an dem die nächste Anwendung fällig gewesen wäre.
Umstellung von einer reinen Gestagen-Methode (reine Gestagenpille, Injektion, Implantat) oder von einem Gestagen-freisetzenden Intrauterinsystem (IUS)
Die Frau kann an jedem beliebigen Tag von der reinen Gestagenpille zu Amicette wechseln (die Umstellung von einem Implantat oder IUS erfolgt am Tag von dessen Entfernung, die Umstellung von Injektionen am Tag der nächsten fälligen Injektion). Die Frau sollte aber in allen Fällen angehalten werden, während der ersten 7 Tage der Tabletteneinnahme zusätzlich eine Barrieremethode anzuwenden.
Post-partum-Anwendung
Nach einer Vaginalentbindung kann die Anwendung von oralen Kontrazeptiva bei nicht-stillenden Frauen 21 Tage nach der Entbindung begonnen werden, sofern die Patientin vollständig gehfähig ist und keine puerperalen Komplikationen vorliegen. Es sind keine zusätzlichen Vorkehrungen zur Kontrazeption erforderlich. Falls die Post-partum-Anwendung später als 21 Tage nach der Entbindung beginnt, sind während der ersten 7 Tage der Pilleneinnahme zusätzliche Vorkehrungen zur Kontrazeption zu treffen.
Falls nach der Entbindung Geschlechtsverkehr stattgefunden hat, sollte die Einnahme des oralen Kontrazeptivums auf den ersten Tag der ersten Menstruationsblutung verschoben werden.
Informationen zu stillenden Frauen siehe Abschnitte 4.3, 4.4 und 4.6.
Anwendung nach einem Abort oder einer Fehlgeburt
Nach einem Abort im ersten Trimenon
Die Frau kann sofort mit der Einnahme beginnen und muss in diesem Fall keine zusätzlichen Vorkehrungen zur Kontrazeption treffen.
Nach einer Entbindung oder einem Abort im zweiten Trimenon Die Frau sollte angehalten werden, an Tag 21 bis 28 nach einer Entbindung oder einem Abort im zweiten Trimenon mit der Einnahme zu beginnen. Wenn sie mit der Einnahme später beginnt, sollte sie angehalten werden, während der ersten 7 Tage zusätzlich eine Barrieremethode anzuwenden. Falls bis dahin jedoch bereits Geschlechtsverkehr stattgefunden hat, ist vor dem tatsächlichen Beginn der KHK-Anwendung eine Schwangerschaft auszuschließen oder die erste Menstruationsblutung abzuwarten.
Informationen zu stillenden Frauen siehe Abschnitt 4.6.
Auslassen einer Periode
Um eine Periode auszulassen, wird am Tag nach Beendigung der aktuellen Packung mit einer neuen Packung Amicette begonnen (d. h. die Patientin überspringt die tablettenfreien Tage). Die Tabletteneinnahme sollte in gewohnter Weise fortgeführt werden.
Während der Anwendung der zweiten Packung kann es zu leichten Schmier- oder Durchbruchblutungen kommen, der Empfängnisschutz ist jedoch nicht beeinträchtigt, sofern keine Tabletten ausgelassen wurden.
Mit der nächsten Packung Amicette wird nach den üblichen 7 tablettenfreien Tagen begonnen, unabhängig davon, ob die Periode bereits aufgehört hat oder nicht.
Verminderte Zuverlässigkeit
Wenn Amicette gemäß den Anwendungshinweisen eingenommen wird, ist der Eintritt einer Schwangerschaft höchst unwahrscheinlich. Die Zuverlässigkeit von oralen Kontrazeptiva kann jedoch in den folgenden Situationen eingeschränkt sein:
Wenn Tabletten ausgelassen wurden
Falls die Tabletteneinnahme um weniger als 12 Stunden versäumt wurde, ist der Empfängnisschutz nicht beeinträchtigt. Die Frau sollte die Tabletteneinnahme nachholen, sobald sie das Versäumnis bemerkt, und dann mit der Tabletteneinnahme wie gewohnt fortfahren.
Falls die Tabletteneinnahme um mehr als 12 Stunden versäumt wurde, könnte der
Empfängnisschutz beeinträchtigt sein. Wenn Tabletten ausgelassen wurden, ist nach
den folgenden beiden grundsätzlichen Regeln vorzugehen:
1. Die Tabletteneinnahme darf niemals länger als 7 Tage unterbrochen werden.
2. Für eine ausreichende Suppression der Hypothalamus-Hypophysen-Ovar-
Achse ist eine ununterbrochene Tabletteneinnahme über 7 Tage erforderlich.
Daraus ergeben sich die folgenden Empfehlungen für die tägliche Praxis:
• Tag 1 - 7
Die Anwenderin sollte die letzte ausgelassene Tablette einnehmen, sobald sie das Versäumnis bemerkt, auch wenn sie in diesem Fall zwei Tabletten gleichzeitig einnimmt. Danach fährt sie mit der Tabletteneinnahme zu den gewohnten Zeitpunkten fort.
Zudem sollte während der nächsten 7 Tage eine Barrieremethode angewendet werden, zum Beispiel ein Kondom. Falls in den vorangegangenen 7 Tagen Geschlechtsverkehr stattgefunden hat, ist an die Möglichkeit einer Schwangerschaft zu denken. Je mehr Tabletten ausgelassen wurden und je näher die reguläre tablettenfreie Phase bevorsteht, desto höher ist die Wahrscheinlichkeit einer Schwangerschaft.
• Tag 8 - 14
Die Anwenderin sollte die letzte ausgelassene Tablette einnehmen, sobald sie das Versäumnis bemerkt, auch wenn sie in diesem Fall zwei Tabletten gleichzeitig einnimmt. Danach fährt sie mit der Tabletteneinnahme zu den gewohnten Zeitpunkten fort. Sofern die Frau ihre Tabletten in den 7 Tagen vor der ersten ausgelassenen Tablette korrekt eingenommen hat, sind keine zusätzlichen Vorkehrungen zur Kontrazeption erforderlich. Falls sie jedoch mehr als eine Tablette ausgelassen hat, sollte die Frau angewiesen werden, 7 Tage lang zusätzliche Vorkehrungen zu treffen.
• Tag 15 - 21
Es besteht die Gefahr einer verminderten Zuverlässigkeit, da die tablettenfreie 7-tägige Phase unmittelbar bevorsteht. Jedoch lässt sich eine Verminderung des Empfängnisschutzes durch Anpassung des Tabletteneinnahmeschemas verhindern. Wenn eine der folgenden beiden Optionen eingehalten wird, besteht daher keine Notwendigkeit zusätzlicher kontrazeptiver Maßnahmen, vorausgesetzt, die Frau hat in den 7 Tagen vor der ersten ausgelassenen Tablette alle Tabletten korrekt eingenommen. Wenn dies nicht der Fall ist, sollte die Frau die erste dieser beiden Optionen wählen und außerdem in den folgenden 7 Tagen zusätzliche Vorkehrungen zur Kontrazeption treffen.
1. Die Anwenderin sollte die letzte ausgelassene Tablette einnehmen, sobald sie das Versäumnis bemerkt, auch wenn sie in diesem Fall zwei Tabletten gleichzeitig einnimmt. Danach fährt sie mit der Tabletteneinnahme zu den gewohnten Zeitpunkten fort. Mit der nächsten Blisterpackung muss dann unmittelbar begonnen werden, nachdem die aktuelle Blisterpackung aufgebraucht wurde, d. h. zwischen den Packungen sollte keine Lücke entstehen. Die Anwenderin dürfte wahrscheinlich erst am Ende der Blisterpackung eine Entzugsblutung bekommen, jedoch kann es an den Tagen mit Tabletteneinnahme zu Schmier- oder Durchbruchblutungen kommen.
2. Die Frau kann auch angewiesen werden, die Tabletteneinnahme aus der aktuellen Blisterpackung zu beenden. Sie sollte dann eine tablettenfreie Phase von bis zu 7 Tagen einhalten, einschließlich der Tage mit der ausgelassenen Tabletteneinnahme, und anschließend mit der nächsten Blisterpackung fortfahren.
Falls die Frau Tabletten ausgelassen hat und danach in der ersten tablettenfreien Phase keine Entzugsblutung bekommt, ist an die Möglichkeit einer Schwangerschaft zu denken.
Im Fall von schweren gastrointestinalen Beschwerden (z. B. Erbrechen oder Durchfall) könnte die Resorption unvollständig sein, weshalb zusätzliche Vorkehrungen zur Kontrazeption getroffen werden sollten. Falls es innerhalb von 3 -4 Stunden nach der Tabletteneinnahme zu Erbrechen kommt, sollte so schnell wie möglich eine neue (Ersatz-) Tablette eingenommen werden. Die Einnahme der neuen Tablette sollte dabei möglichst innerhalb von 12 Stunden nach der üblichen Einnahmezeit erfolgen. Falls mehr als 12 Stunden vergangen sind, ist die Vorgehensweise bei ausgelassenen Tabletten wie in Abschnitt 4.2 „Wenn Tabletten ausgelassen wurden" beschrieben einzuhalten. Wenn die Frau ihr übliches Tabletteneinnahmeschema nicht verändern möchte, muss sie die Extratablette(n) aus einer anderen Blisterpackung einnehmen.
4.3 Gegenanzeigen
Kombinierte hormonale Kontrazeptiva (KHK) dürfen unter den folgenden Bedingungen nicht angewendet werden:
• Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• Vorliegen einer oder Risiko für eine venöse Thromboembolie (VTE)
• Venöse Thromboembolie - bestehende VTE (auch unter Therapie mit Antikoagulanzien) oder VTE in der Vorgeschichte (z. B. tiefe Venenthrombose [TVT] oder Lungenembolie [LE])
• Bekannte erbliche oder erworbene Prädisposition für eine venöse Thromboembolie, wie z. B. APC-Resistenz (einschließlich Faktor-V-Leiden), Antithrombin-III-Mangel, Protein-C-Mangel oder Protein-S-Mangel
• Größere Operationen mit längerer Immobilisierung (siehe Abschnitt 4.4)
• Hohes Risiko für eine venöse Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4)
• Vorliegen einer oder Risiko für eine arterielle Thromboembolie (ATE)
• Arterielle Thromboembolie - bestehende ATE, ATE in der Vorgeschichte (z. B. Myokardinfarkt) oder Erkrankung im Prodromalstadium (z. B. Angina pectoris)
• Zerebrovaskuläre Erkrankung - bestehender Schlaganfall, Schlaganfall oder prodromale Erkrankung (z. B. transitorische ischämische Attacke [TIA]) in der Vorgeschichte
• Bekannte erbliche oder erworbene Prädisposition für eine arterielle Thromboembolie, wie z. B. Hyperhomocysteinämie und AntiphospholipidAntikörper (Anticardiolipin-Antikörper, Lupusantikoagulans)
• Migräne mit fokalen neurologischen Symptomen in der Vorgeschichte
• Hohes Risiko für eine arterielle Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4) oder eines schwerwiegenden Risikofaktors wie:
■ Diabetes mellitus mit Gefäßschädigung
■ Schwere Hypertonie
■ Schwere Dyslipoproteinämie
• Stillende Mütter bis zu 6 Wochen nach der Entbindung
• Karzinom des Endometriums oder andere bekannte oder mutmaßliche östrogenabhängige Neoplasien
• Nicht abgeklärte abnorme vaginale Blutungen
• Größere Operation mit längerer Immobilisierung
• Komplizierte Klappen- und kongenitale Herzerkrankungen (z. B. mit pulmonaler Hypertonie, Vorhofflimmern, anamnestisch bekannter subakuter bakterieller Endokarditis)
• Rauchen von 15 oder mehr Zigaretten pro Tag bei Patientinnen ab 35 Jahren
• Akute oder chronische Lebererkrankung, einschließlich Hepatitis (viraler oder nichtviraler Genese) oder schwerer Zirrhose, oder derartige Erkrankungen in der Vorgeschichte, sofern sich die abnormen Leberwerte nicht seit mindestens 3 Monaten normalisiert haben; hepatische Adenome oder Karzinome
• Bekanntes oder vermutetes Mammakarzinom
• Aktuelle oder zurückliegende Pankreatitis, wenn in Verbindung mit schwerer Hypertriglyceridämie
• Amicette darf nicht bei Mädchen vor der Pubertät - vor der Menarche -angewendet werden
Falls es während der Einnahme von Amicette erstmals zu einer der genannten Bedingungen kommt, sollten die Tabletten sofort abgesetzt werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Eignung von Amicette sollte mit der Frau besprochen werden, falls eine der im Folgenden aufgeführten Erkrankungen oder Risikofaktoren vorliegt.
Bei einer Verschlechterung oder dem ersten Auftreten einer dieser Erkrankungen oder Risikofaktoren ist der Anwenderin anzuraten, sich an Ihren Arzt zu wenden, um zu entscheiden, ob die Anwendung von Amicette beendet werden sollte.
Risiko für eine venöse Thromboembolie (VTE)
Die Anwendung eines kombinierten hormonalen Kontrazeptivums (KHK) erhöht das Risiko für eine venöse Thromboembolie (VTE) im Vergleich zur Nichtanwendung. Arzneimittel, die Levonorgestrel, Norgestimat (einschließlich Amicette) oder Norethisteron enthalten, sind mit dem geringsten Risiko für eine VTE verbunden. Die Entscheidung, ein Arzneimittel anzuwenden, das nicht zu denen mit dem geringsten VTE Risiko gehört, sollte nur nach einem Gespräch mit der Frau getroffen werden, bei dem sicherzustellen ist, dass sie Folgendes versteht: das Risiko für eine VTE bei Anwendung von Amicette, wie ihre vorliegenden individuellen Risikofaktoren dieses Risiko beeinflussen, und dass ihr Risiko für VTE in ihrem allerersten Anwendungsjahr am höchsten ist. Es gibt zudem Hinweise, dass das Risiko erhöht ist, wenn die Anwendung eines KHK nach einer Unterbrechung von 4 oder mehr Wochen wieder aufgenommen wird.
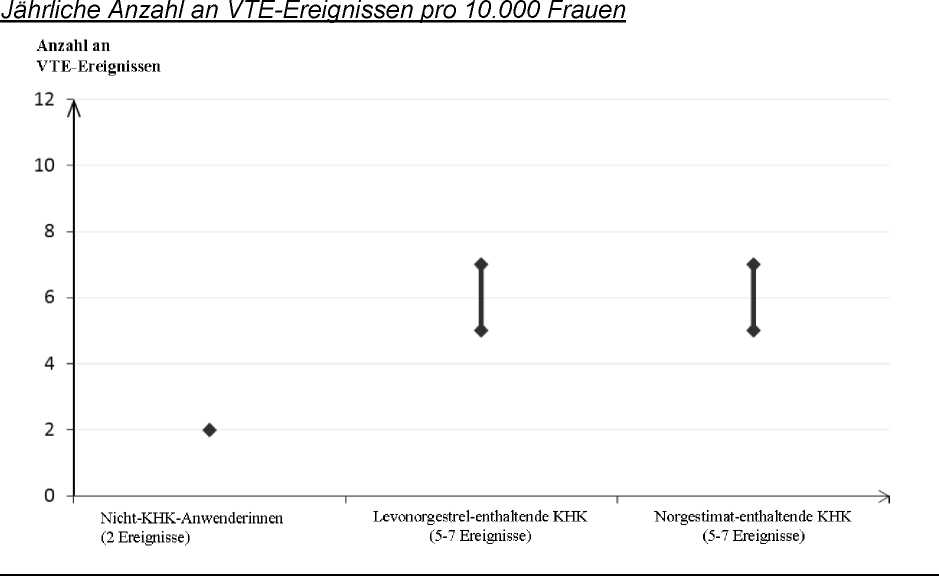
Ungefähr 2 von 10.000 Frauen, die kein KHK anwenden und nicht schwanger sind, erleiden im Verlauf eines Jahres eine VTE. Bei einzelnen Frauen kann das Risiko jedoch in Abhängigkeit von ihren zugrunde liegenden Risikofaktoren bedeutend höher sein (siehe unten).
Es wird geschätzt, dass im Verlauf eines Jahres ungefähr 6' von 10.000 Frauen, die ein Levonorgestrel-haltiges KHK anwenden, eine VTE erleiden.
Die derzeitige Datenlage weist darauf hin, dass das Risiko für eine VTE bei der Anwendung von Norgestimat-haltigen KHK ähnlich hoch wie bei der Anwendung von Levonorgestrel-haltigen KHK ist.
Die Anzahl an VTE pro Jahr ist niedriger als die erwartete Anzahl während der Schwangerschaft oder in der Zeit nach der Geburt.
VTE verlaufen in 1-2 % der Fälle tödlich.
1 Mittelwert der Spannweite 5-7 pro 10.000 Frauenjahre, auf der Grundlage eines relativen Risikos für Levonorgestrel-haltige KHK versus Nichtanwendung von ungefähr 2,3 bis 3,6
Äußerst selten wurde bei Anwenderinnen von KHK über eine Thrombose in anderen Blutgefäßen berichtet, wie z. B. in Venen und Arterien von Leber, Mesenterium, Nieren oder Retina.
Risikofaktoren für VTE
Das Risiko für venöse thromboembolische Komplikationen bei Anwenderinnen von KHK kann deutlich ansteigen, wenn bei der Anwenderin zusätzliche Risikofaktoren bestehen, insbesondere wenn mehrere Risikofaktoren vorliegen (siehe Tabelle). Amicette ist kontraindiziert, wenn bei einer Frau mehrere Risikofaktoren gleichzeitig bestehen, die sie insgesamt einem hohen Risiko für eine Venenthrombose aussetzen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass der Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt - in diesem Fall muss ihr Gesamtrisiko für eine VTE in Betracht gezogen werden. Wenn das Nutzen/Risiko-Verhältnis als ungünstig erachtet wird, darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle: Risikofaktoren für VTE
|
Risikofaktor |
Anmerkung |
|
Adipositas (Body-Mass-Index über 30 kg/m2) |
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig, wenn weitere Risikofaktoren vorliegen. |
|
Längere Immobilisierung, größere Operationen, jede Operation an Beinen oder Hüfte, neurochirurgische Operation oder schweres Trauma |
In diesen Fällen ist es ratsam, die Anwendung des Pflasters/der Tablette/des Rings (bei einer geplanten Operation mindestens vier Wochen vorher) zu unterbrechen und erst zwei Wochen nach der kompletten Mobilisierung wieder aufzunehmen. Es ist eine andere |
|
Hinweis: Eine vorübergehende Immobilisierung einschließlich einer Flugreise von > 4 Stunden Dauer kann ebenfalls einen Risikofaktor für eine VTE darstellen, insbesondere bei Frauen mit weiteren Risikofaktoren. |
Verhütungsmethode anzuwenden, um eine ungewollte Schwangerschaft zu verhindern. Eine antithrombotische Therapie muss erwogen werden, wenn Amicette nicht vorab abgesetzt wurde. |
|
Familiäre Vorbelastung (jede venöse Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, z. B. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird. |
|
Andere Erkrankungen, die mit einer VTE verknüpft sind. |
Krebs, systemischer Lupus erythematodes, hämolytisches urämisches Syndrom, chronisch entzündliche Darmerkrankung (Morbus Crohn oder Colitis ulcerosa) und Sichelzellkrankheit |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
Es besteht kein Konsens über die mögliche Rolle von Varizen und oberflächlicher Thrombophlebitis bezüglich des Beginns oder Fortschreitens einer Venenthrombose. Das erhöhte Risiko einer Thromboembolie in der Schwangerschaft und insbesondere während der 6-wöchigen Dauer des Wochenbetts muss berücksichtigt werden (Informationen zur „Schwangerschaft und Stillzeit" siehe Abschnitt 4.6).
Symptome einer VTE (tiefe Beinvenenthrombose und Lungenembolie)
Beim Auftreten von Symptomen ist den Anwenderinnen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden. Bei einer tiefen Beinvenenthrombose (TVT) können folgende Symptome auftreten:
- unilaterale Schwellung des Beins und/oder Fußes oder entlang einer Beinvene;
- Schmerz oder Druckschmerz im Bein, der möglicherweise nur beim Stehen oder Gehen bemerkt wird,
- Erwärmung des betroffenen Beins; gerötete oder entfärbte Haut am Bein.
Bei einer Lungenembolie (LE) können folgende Symptome auftreten:
- plötzliches Auftreten unerklärlicher Kurzatmigkeit oder schnellen Atmens;
- plötzlich auftretender Husten möglicherweise in Verbindung mit Hämoptyse;
- stechender Brustschmerz;
- starke Benommenheit oder Schwindelgefühl;
- schneller oder unregelmäßiger Herzschlag.
Einige dieser Symptome (z. B. „Kurzatmigkeit", „Husten") sind unspezifisch und können als häufiger vorkommende und weniger schwerwiegende Ereignisse fehlinterpretiert werden (z. B. als Atemwegsinfektionen).
Andere Anzeichen für einen Gefäßverschluss können plötzlicher Schmerz sowie Schwellung und leicht bläuliche Verfärbung einer Extremität sein.
Tritt der Gefäßverschluss im Auge auf, können die Symptome von einem schmerzlosen verschwommenen Sehen bis zu einem Verlust des Sehvermögens reichen. In manchen Fällen tritt der Verlust des Sehvermögens sehr plötzlich auf.
Risiko für eine arterielle Thromboembolie (ATE)
Epidemiologische Studien haben die Anwendung von KHK mit einem erhöhten Risiko für arterielle Thromboembolie (Myokardinfarkt) oder apoplektischen Insult (z.
B. transitorische ischämische Attacke, Schlaganfall) in Verbindung gebracht. Arterielle thromboembolische Ereignisse können tödlich verlaufen.
Risikofaktoren für ATE
Das Risiko für arterielle thromboembolische Komplikationen oder einen apoplektischen Insult bei Anwenderinnen von KHK erhöht sich bei Frauen, die Risikofaktoren aufweisen (siehe Tabelle). Amicette ist kontraindiziert bei Frauen, die einen schwerwiegenden oder mehrere Risikofaktoren für eine ATE haben, die sie einem hohen Risiko für eine Arterienthrombose aussetzen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass der Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt - in diesem Fall muss ihr Gesamtrisiko betrachtet werden. Bei Vorliegen eines ungünstigen Nutzen/Risiko-Verhältnis darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle: Risikofaktoren für ATE
|
Risikofaktor |
Anmerkung |
|
Zunehmendes Alter |
Insbesondere älter als 35 Jahre |
|
Rauchen |
Frauen ist anzuraten, nicht zu rauchen, wenn Sie ein KHK anwenden möchten. Frauen über 35 Jahren, die weiterhin rauchen, ist dringend zu empfehlen, eine andere Verhütungsmethode anzuwenden. |
|
Hypertonie | |
|
Adipositas (Body-Mass-Index über 30 kg/m2) |
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig bei Frauen mit zusätzlichen Risikofaktoren. |
|
Familiäre Vorbelastung (jede arterielle Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, d. h. jünger als 50 Jahre). |
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird. |
|
Migräne |
Ein Anstieg der Häufigkeit oder des Schweregrads der Migräne während der Anwendung von KHK (die einem zerebrovaskulären Ereignis vorausgehen kann) kann ein Grund für ein sofortiges Absetzen sein. |
|
Andere Erkrankungen, die mit unerwünschten Gefäßereignissen verknüpft sind. |
Diabetes mellitus, Hyperhomocysteinämie, Erkrankung der Herzklappen und Vorhofflimmern, Dyslipoproteinämie und systemischer Lupus erythematodes. |
Symptome einer ATE
Beim Auftreten von Symptomen ist den Frauen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden.
Bei einem apoplektischen Insult können folgende Symptome auftreten:
- plötzliche Taubheitsgefühl oder Schwäche in Gesicht, Arm oder Bein, besonders auf einer Köperseite;
- plötzliche Gehschwierigkeiten, Schwindelgefühl, Gleichgewichtsverlust oder Koordinationsstörungen;
- plötzliche Verwirrtheit, Sprech- oder Verständnisschwierigkeiten;
- plötzliche Sehstörungen in einem oder beiden Augen;
- plötzliche, schwere oder länger anhaltende Kopfschmerzen unbekannter Ursache;
- Verlust des Bewusstseins oder Ohnmacht mit oder ohne Krampfanfall. Vorübergehende Symptome deuten auf eine transitorische ischämische Attacke (TIA) hin.
Bei einem Myokardinfarkt (MI) können folgende Symptome auftreten:
- Schmerz, Unbehagen, Druck, Schweregefühl, Enge- oder Völlegefühl in Brust, Arm oder unterhalb des Sternums;
- in den Rücken, Kiefer, Hals, Arm, Magen ausstrahlende Beschwerden;
- Völlegefühl, Indigestion oder Erstickungsgefühl;
- Schwitzen, Übelkeit, Erbrechen oder Schwindelgefühl;
- extreme Schwäche, Angst oder Kurzatmigkeit;
- schnelle oder unregelmäßige Herzschläge.
Tumoren
Einige epidemiologische Studien haben gezeigt, dass die langfristige Anwendung von KHK (> 5 Jahre) mit einem erhöhten Risiko von Gebärmutterhalskrebs verbunden ist. Es ist jedoch nach wie vor umstritten, inwieweit dieser Befund auf beeinflussende Effekte des Sexualverhaltens und weitere Faktoren wie eine Infektion mit dem humanen Papillomvirus (HPV) zurückzuführen ist.
Eine Metaanalyse von 54 epidemiologischen Studien hat ergeben, dass Frauen, die aktuell KHK anwenden, ein geringfügig erhöhtes Risiko einer Brustkrebsdiagnose (RR = 1,24) aufweisen. Dieses erhöhte Risiko geht innerhalb von 10 Jahren nach Absetzen des KHK allmählich zurück. Da Brustkrebs bei Frauen unter 40 Jahren nur selten vorkommt, ist die zusätzliche Anzahl von Brustkrebsdiagnosen bei aktuellen und früheren KHK-Anwenderinnen gegenüber dem allgemeinen Brustkrebsrisiko gering. Diese Studien liefern keinen Hinweis auf einen Kausalzusammenhang. Brustkrebs, der bei Frauen diagnostiziert wird, die schon einmal ein KHK angewendet haben, ist klinisch tendenziell weniger weit fortgeschritten als bei Frauen, die noch nie ein KHK angewendet haben. Das beobachtete Muster eines erhöhten Risikos könnte auf eine frühzeitigere Diagnose des Brustkrebses bei KHK-Anwenderinnen, die biologischen Wirkungen von KHK oder auf eine Kombination beider Faktoren zurückzuführen sein.
In seltenen Fällen wurden bei KHK-Anwenderinnen gutartige Lebertumoren und noch seltener bösartige Lebertumoren beobachtet. In Einzelfällen führten diese Tumoren zu lebensbedrohlichen intraabdominellen Hämorrhagien. Wenn es bei KHK-Anwenderinnen zu starken Oberbauchschmerzen, einer Lebervergrößerung oder Zeichen einer intraabdominellen Hämorrhagie kommt, sollte daher differentialdiagnostisch ein Lebertumor in Betracht gezogen werden.
Bei Anwendung von höher dosierten KHK (50 gg Ethinylestradiol) fällt das Risiko von Endometrium- und Eierstockkrebs geringer aus. Ob dies auch für niedriger dosierte KHK zutrifft, bleibt zu bestätigen.
Andere Erkrankungen
Die kontrazeptive Wirksamkeit kann bei Frauen mit einem Körpergewicht ab 90 kg verringert sein.
Bei Frauen mit Hypertriglyceridämie oder mit Hypertriglyceridämie in der Familiengeschichte kann die Anwendung von kombinierten hormonellen Kontrazeptiva mit einem erhöhten Risiko von Pankreatitis einhergehen.
Obwohl bei vielen Frauen unter hormonellen Kontrazeptiva leichte Anstiege des Blutdrucks berichtet wurden, sind klinisch relevante Erhöhungen selten. Nur in diesen seltenen Fällen ist ein sofortiges Absetzen des KHK gerechtfertigt. Wenn bei Frauen mit vorbestehender Hypertonie, die während der Anwendung kombinierter hormoneller Kontrazeptiva konstant erhöhte Blutdruckwerte oder einen signifikanten Anstieg des Blutdrucks aufweisen, eine antihypertone Behandlung nicht in ausreichendem Maß anschlägt, muss das kombinierte hormonelle Kontrazeptivum abgesetzt werden. Die Anwendung des kombinierten hormonellen Kontrazeptivums kann wiederaufgenommen werden, nachdem unter antihypertoner Therapie wieder normale Blutdruckwerte erzielt wurden.
Es wurde über ein Auftreten bzw. eine Verschlimmerung der folgenden Erkrankungen während einer Schwangerschaft und unter KHK-Anwendung berichtet, wenngleich die Hinweise auf einen Zusammenhang mit der KHK-Anwendung nicht schlüssig sind: cholestatischer Ikterus und/oder Pruritus; Gallensteine; Porphyrie; systemischer Lupus erythematodes; hämolytisch-urämisches Syndrom; Sydenham-Chorea; Herpes gestationis; otosklerosebedingter Gehörverlust.
Bei Frauen mit einem hereditären Angioödem können exogene Estrogene die Symptome eines Angioödems induzieren oder verschlimmern.
Akute oder chronische Störungen der Leberfunktion können ein Absetzen von kombinierten hormonellen Kontrazeptiva erfordern, bis sich die Leberfunktionswerte wieder normalisiert haben. Bei Wiederauftreten von cholestatischem Pruritus, der während einer vorausgehenden Schwangerschaft oder Behandlung mit Sexualsteroiden auftrat, muss die Anwendung von kombinierten hormonellen Kontrazeptiva beendet werden.
Obwohl kombinierte hormonelle Kontrazeptiva die periphere Insulinresistenz und die Glucosetoleranz beeinflussen können, deutet nichts darauf hin, dass das Therapieschema bei Diabetikerinnen unter niedrig dosierten KHK (mit <0,05 mg Ethinylestradiol) verändert werden muss. Diabetikerinnen sollten jedoch, besonders in den frühen Stadien der KHK-Anwendung, engmaschig beobachtet werden.
Unter KHK-Anwendung wurde über eine Verschlechterung endogener Depressionen, von Epilepsie, Morbus Crohn und Colitis ulcerosa berichtet.
Es kann gelegentlich zu einem Chloasma kommen, vor allem bei Anwenderinnen mit Chloasma gravidarum in der Anamnese. Anwenderinnen mit einer Neigung zu Chloasma sollten sich während der KHK-Anwendung nicht der Sonne oder Ultraviolettstrahlung aussetzen. Ein Chloasma ist häufig nicht vollständig reversibel.
Ärztliche Untersuchunq/Beratunq
Vor der Einleitung oder Wiederaufnahme der Behandlung mit Amicette muss eine vollständige Anamnese (inklusive Familienanamnese) erhoben und eine Schwangerschaft ausgeschlossen werden. Der Blutdruck sollte gemessen und eine körperliche Untersuchung durchgeführt werden, die sich an den Gegenanzeigen (siehe Abschnitt 4.3) und Warnhinweisen (siehe Abschnitt 4.4) orientiert. Es ist wichtig, die Frau auf die Informationen zu venösen und arteriellen Thrombosen hinzuweisen, einschließlich des Risikos von Amicette im Vergleich zu anderen KHK, die Symptome einer VTE und ATE, die bekannten Risikofaktoren und darauf, was im Falle einer vermuteten Thrombose zu tun ist.
Die Anwenderin ist zudem anzuweisen, die Packungsbeilage sorgfältig zu lesen und die darin gegebenen Ratschläge zu befolgen. Die Häufigkeit und Art der Untersuchungen sollte den gängigen Untersuchungsleitlinien entsprechen und individuell auf die Frau abgestimmt werden.
Die Anwenderinnen sind darüber aufzuklären, dass hormonale Kontrazeptiva nicht vor HIV-Infektionen (AIDS) und anderen sexuell übertragbaren Krankheiten schützen.
Verminderte Wirksamkeit
Die Wirksamkeit von KHK kann beeinträchtigt sein, zum Beispiel wenn aktive Tabletten ausgelassen wurden (siehe Abschnitt 4.2), bei gastrointestinalen Störungen während der Einnahme der aktiven Tabletten (siehe Abschnitt 4.2) oder durch Begleitmedikationen (siehe Abschnitt 4.5).
Verminderte Zykluskontrolle
Bei allen kombinierten hormonellen Kontrazeptiva kann es, insbesondere in den ersten Anwendungsmonaten, zu unregelmäßigen Blutungen (Schmier- oder Durchbruchblutungen) kommen. Angesichts dessen ist eine medizinische Beurteilung von unregelmäßigen Blutungen erst nach einer Anpassungsperiode von ungefähr drei Zyklen sinnvoll. Wenn die Durchbruchblutungen anhalten oder es unter Anwendung von KHK gemäß dem empfohlenen Behandlungsschema nach zuvor regelmäßigen Zyklen zu Durchbruchblutungen kommt, ist nach einer anderen Ursache als das KHK zu suchen. Es sollten nichthormonelle Ursachen in Erwägung gezogen werden, und bei Bedarf sollten angemessene diagnostische Maßnahmen getroffen werden, um eine organische Erkrankung oder Schwangerschaft auszuschließen. Hierzu kann auch eine Curettage zählen.
Bei manchen Frauen können die Entzugsblutungen in der tablettenfreien Phase ausbleiben. Wenn das KHK gemäß den Anweisungen in Abschnitt 4.2 eingenommen wurde, ist eine Schwangerschaft unwahrscheinlich. Falls das KHK jedoch vor der ersten ausbleibenden Entzugsblutung nicht gemäß diesen Anweisungen angewendet wurde oder wenn zwei Entzugsblutungen ausbleiben, ist vor der weiteren Anwendung von KHK eine Schwangerschaft auszuschließen.
Nach dem Absetzen des hormonellen Kontrazeptivums kann es bei einigen Anwenderinnen zu Amenorrhoe oder Oligomenorrhoe kommen, vor allem wenn solche Zustände aus der Vorgeschichte bekannt sind.
Auf pflanzliche Präparate, die Johanniskraut (Hypericum perforatum) enthalten, sollte während der Einnahme von Norgestimat/Ethinylestradiol verzichtet werden (siehe Abschnitt 4.5).
Sonstige Bestandteile
Die Tabletten enthalten Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Potentielle Verminderung der kontrazeptiven Wirksamkeit in Verbindung mit der gleichzeitigen Anwendung anderer Arzneimittel:
Leberenzyminduktoren
Arzneimittel oder pflanzliche Präparate, die Enzyme induzieren, insbesondere CYP3A4, können zu einer Verminderung der Plasmakonzentration kontrazeptiver Hormone und damit zu einer Beeinträchtigung von deren Wirksamkeit führen und/oder Durchbruchblutungen verstärken. Beispiele sind:
• Barbiturate
• Bosentan
• Carbamazepin
• Felbamat
• Hydantoine
• Primidon
• Griseofulvin
• einige HIV-Proteaseinhibitoren (z. B. Ritonavir)
• Modafinil
• einige nicht-nukleosidische Reverse-Transkriptase-Inhibitoren (z. B. Nevirapin)
• Oxcarbazepin
• Phenytoin
• Rifampicin und Rifabutin
• Johanniskraut
• Topiramat
Antibiotika, die keine Enzyminduktoren sind
Bei gleichzeitiger Einnahme von hormonellen Kontrazeptiva und Antibiotika wurde über Schwangerschaften berichtet, jedoch haben Studien zur klinischen Pharmakokinetik keine konsistenten Effekte von Antibiotika (z. B. Ampicillin und Tetracycline) auf die Plasmakonzentrationen synthetischer Steroide erbracht.
Arzneimittel mit Auswirkungen auf die Resorption
Arzneimittel, die die gastrointestinale Motilität steigern, z. B. Metoclopramid, können die Resorption von Hormonen vermindern.
Die Behandlung mit Aktivkohle beeinträchtigt die Resorption von Steroidhormonen. Management
Bei Frauen unter Langzeitbehandlung mit Arzneimitteln und pflanzlichen Präparaten, die Auswirkungen auf die hormonelle Kontrazeption besitzen, wird eine andere zuverlässige nichthormonelle Kontrazeptionsmethode empfohlen.
Bei Frauen, die über einen kurzen Zeitraum Arzneimittel oder pflanzliche Präparate erhalten, die mit der hormonellen Kontrazeption interagieren und die Plasmakonzentrationen kontrazeptiver Hormone vermindern können, ist eine Verminderung der kontrazeptiven Wirksamkeit nicht auszuschließen. Diesen Frauen sollte geraten werden, wie nachfolgend beschrieben zusätzlich zu Amicette eine Barriere-Kontrazeptionsmethode (z. B. Kondom, Diaphragma) anzuwenden:
• Frauen, die Leberenzym-induzierende Arzneimittel erhalten, sollten vorübergehend, d. h. während der gleichzeitigen Anwendung und über einen Zeitraum von 28 Tagen nach dem Absetzen, zusätzlich zu Amicette eine Barriere-Kontrazeptionsmethode anwenden.
• Im Fall von Modafinil sollte die Barriere-Kontrazeptionsmethode bis zum Ablauf von 56 Tagen nach dem Absetzen angewendet werden.
Falls das Absetzen des gleichzeitig verabreichten Arzneimittels in Woche 3 oder nach Ende der Tabletten in der Blisterpackung erfolgt, sollte ohne Unterbrechung mit dem nächsten Streifen begonnen werden.
Veränderungen der Plasmaspiegel von gleichzeitig verabreichten Arzneimitteln, die klinisch bedeutsam sein können:
Kombinierte hormonelle Kontrazeptiva können auch Einfluss auf die Pharmakokinetik von bestimmten anderen, gleichzeitig angewendeten Arzneimitteln besitzen. Arzneimittel, deren Plasmaspiegel erhöht sein könnten (aufgrund einer CYP-Inhibition).
Beispiele sind:
• Ciclosporin
• Prednisolon
• Theophyllin
Arzneimittel, deren Plasmaspiegel vermindert sein könnten (aufgrund einer Induktion der Glucuronidierung).
Beispiele sind:
• Lamotrigin
Management
Ärzten wird geraten, die Fachinformation der gleichzeitig verabreichten Arzneimittel zu konsultieren, um weitere Informationen über Wechselwirkungen mit hormonellen Kontrazeptiva sowie über die etwaige Notwendigkeit von Dosisanpassungen zu erhalten.
Laboruntersuchungen
Die Anwendung kontrazeptiver Steroide kann die Ergebnisse bestimmter Labortests beeinflussen, darunter die biochemischen Parameter der Leber-, Schilddrüsen-, Nebennieren- und Nierenfunktion, die Plasmakonzentrationen von (Träger-) Proteinen, z. B. des Corticoid-bindenden Globulins und der Lipid-/Lipoprotein-Fraktionen, die Parameter des Kohlenhydratstoffwechsels sowie die Parameter der Koagulation und Fibrinolyse. Diese Veränderungen bewegen sich jedoch generell im Normbereich des Labors.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Das Arzneimittel ist nicht für die Anwendung während der Schwangerschaft bestimmt. Bei nachgewiesener Schwangerschaft ist die Einnahme zu beenden.
Stillzeit
Kontrazeptive Steroide und/oder ihre Metaboliten können in die Muttermilch übergehen.
Die Anwendung von KHK ist bei stillenden Müttern bis zu 6 Wochen nach der Entbindung kontraindiziert (siehe Abschnitt 4.3) und sollte bei stillenden Müttern im Zeitraum zwischen 6 Wochen und 6 Monaten nach der Entbindung medizinisch indiziert sein (siehe Abschnitt 4.4).
Stillenden Müttern sollte von der Anwendung der Kombinationspille abgeraten werden, da sie die Laktation hemmen könnte. Stattdessen kann diesen Frauen die Anwendung einer reinen Gestagenpille empfohlen werden.
Fertilität
Norgestimat, allein oder in Kombination mit Ethinylestradiol, ist eine effektive antiovulatorisch wirkende Substanz. Nach dem Absetzen einer oralen Kontrazeption sollte die Patientin erst nach mindestens einem normalen spontanen Zyklus schwanger werden, damit die Schwangerschaft datiert werden kann. Während dieser Zeit sollte eine alternative Kontrazeptionsmethode angewendet werden.
Die Kombination von Norgestimat und Ethinylestradiol führte bei weiblichen Ratten zu einer dosisabhängigen Verringerung der Fertilität, zu einer verminderten Implantation und Wurfgröße sowie einer erhöhten fötalen Resorption in allen behandelten Gruppen. Sie ist mäßig potent im Progestations-Standardassay in vivo, in dem die Proliferation des Endometriums bei Kaninchen gemessen wird, und sie hemmt wirksam die Ovulation bei Ratten, Hamstern und Kaninchen.
Das erhöhte VTE-Risiko in der Zeit nach der Geburt sollte vor der erneuten Anwendung nach einer Anwendungspause bedacht werden (siehe Abschnitte 4.2 und 4.4).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen
von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
Bestimmte unerwünschte Arzneimittelwirkungen (UAW), die mit oralen Kontrazeptiva in Verbindung gebracht wurden, können eine sofortige ärztliche Behandlung und/oder Beendigung der Anwendung des oralen Kontrazeptivums erfordern. Diese UAW umfassen: Myokardinfarkt, tiefe Venenthrombose, Lungenembolie, zerebrovaskulärer Insult, Retinavenenthrombose, neu einsetzende Migräne-artige Kopfschmerzen, Brustkrebs, Lebertumoren, Adenome, Bluthochdruck, Angioödem, Urtikaria und Überempfindlichkeit.
Während der Durchführung geeigneter diagnostischer und therapeutischer Maßnahmen sollten andere, nichthormonelle Kontrazeptiva angewendet werden.
Auf Grundlage der gepoolten Sicherheitsdaten aus 5 klinischen Studien bestand die am häufigsten gemeldete (> 10%) UAW in Kopfschmerzen (27,9%). Die seit der Marktzulassung am häufigsten (> 10%) beobachtete UAW war Durchfall (11,8%).
Die in klinischen Studien am häufigsten (> 10%) berichteten UAW während des ersten Behandlungszyklus waren: Dysmenorrhoe (40,4%); Übelkeit (29,1%); Metrorrhagie (26,3%); gastrointestinale Beschwerden (berichtet als Übelkeit oder Erbrechen) (24,6%) und abnorme Entzugsblutungen (16,9%). Die Inzidenz dieser UAW war in Zyklus 1 am höchsten und nahm im Zeitverlauf ab, mit Ausnahme von Dysmenorrhoe. Die höchste Inzidenz von Erbrechen wurde in Zyklus 12 festgestellt (11,8%).
Die 5 klinischen Studien (2 randomisierte, aktiv-kontrollierte Studien und 3 unkontrollierte, offene Studien), die für die Beurteilung der Sicherheit von Norgestimat/Ethinylestradiol herangezogen wurden, umfassten 1.891 gesunde gebärfähige Frauen. In 3 Studien wurden die Teilnehmerinnen über bis zu 24 Zyklen beobachtet, in den anderen beiden Studien über bis zu 12 Zyklen. In einer zusätzlichen unkontrollierten Studie (n=8.331) wurden UAW nach Behandlungszyklus über bis zu 24 Zyklen berichtet. Da die Häufigkeit von UAW je nach Behandlungszyklus unterschiedlich ausfällt, wurde für die Zuteilung der UAW zu einer Häufigkeitskategorie die höchste Inzidenz in einem Zyklus herangezogen.
Die nachfolgende Tabelle zeigt alle UAW, die in Verbindung mit der Anwendung von Norgestimat/Ethinylestradiol in klinischen Studien sowie seit der Marktzulassung von Tabletten mit Norgestimat und Ethinylestradiol gemeldet wurden.
Die dargestellten Häufigkeitskategorien beruhen auf der folgenden Konvention: sehr häufig (> 1/10); häufig (> 1/100, < 1/10); gelegentlich (> 1/1.000, < 1/100); selten (> 1/10.000, < 1/1.000); sehr selten (< 1/10.000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Infektionen und parasitäre Erkrankungen | |
|
Häufig |
Harnwegsinfekt, Scheideninfektion |
|
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen) | |
|
Gelegentlich |
Zervikale Dysplasie |
|
Selten |
Brustzyste |
|
Häufigkeit nicht bekannt |
Leberadenome, Brustkrebs, gutartige Neoplasie der Brust, fokal-noduläre |
|
Hyperplasie, Fibroadenom der Brust | |
|
Erkrankungen des Immunsystems | |
|
Häufig |
Überempfindlichkeit |
|
Stoffwechsel- und Ernä |
hrungsstörungen |
|
Häufig |
Flüssigkeitsretention |
|
Gelegentlich |
Zunahme und Verminderung des Appetits, Gewichtsschwankungen |
|
Selten |
Appetitstörung |
|
Häufigkeit nicht bekannt |
Dyslipidämie |
|
Psychiatrische Erkrankungen | |
|
Häufig |
Stimmungsveränderung, Depression, Nervosität, Insomnie |
|
Gelegentlich |
Angst, Libidostörung |
|
Selten |
Libidoverlust |
|
Erkrankungen des Nervensystems | |
|
Sehr häufig |
Kopfschmerzen |
|
Häufig |
Migräne, Schwindel |
|
Gelegentlich |
Synkope, Parästhesie |
|
Häufigkeit nicht bekannt |
Zerebrovaskulärer Insult, Konvulsionen |
|
Augenerkrankungen | |
|
Gelegentlich |
Beeinträchtigung des Sehvermögens, Augentrockenheit |
|
Häufigkeit nicht bekannt |
Unverträglichkeit von Kontaktlinsen, vaskuläre Retinathrombose* |
|
Erkrankungen des Ohrs und des Labyrinths | |
|
Selten |
Vertigo |
|
Herzerkrankungen | |
|
Gelegentlich |
Palpitationen |
|
Selten |
Tachykardie |
|
Häufigkeit nicht bekannt |
Myokardinfarkt |
|
Gefäßerkrankungen | |
|
Gelegentlich |
Hypertonie, Hitzewallungen |
|
Selten |
venöse und arterielle Thrombosen |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
|
Gelegentlich |
Dyspnoe |
|
Erkrankungen des Gastrointestinaltrakts | |
|
Sehr häufig |
Gastrointestinale Störung, Erbrechen, Durchfall, Übelkeit |
|
Häufig |
Gastrointestinale Schmerzen, abdominelle Schmerzen, abdominelle Auftreibung, Obstipation, Flatulenz |
|
Selten |
Pankreatitis |
|
Leber- und Gallenerkrankungen | |
|
Selten Hepatitis | |
|
Erkrankungen der Haut und des Unterhautzellgewebes | |
|
Häufig |
Akne, Hautausschlag |
|
Gelegentlich |
Alopezie, Hirsutismus, Urtikaria, Pruritus, Erythem, Hautverfärbung |
|
Selten |
Hyperhidrose, Lichtempfindlichkeitsreaktion |
|
Häufigkeit nicht bekannt |
Angioödem, Erythema nodosum, nächtliches Schwitzen |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |
|
Häufig |
Muskelspasmen, Schmerzen in den Extremitäten, Rückenschmerzen |
|
Gelegentlich |
Myalgie |
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse | |
|
Sehr häufig |
Dysmenorrhoe, Metrorrhagie, abnorme Entzugsblutungen |
|
Häufig |
Amenorrhoe, genitaler Ausfluss, Brustschmerzen |
|
Gelegentlich |
Ausfluss aus der Brust, Brustvergrößerung, Eierstockzyste, vulvovaginale Trockenheit |
|
Selten |
Vaginaler Ausfluss |
|
Häufigkeit nicht bekannt |
Suppression der Laktation |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
|
Häufig |
Schmerzen im Brustkorb, Ödem, asthenische Zustände |
|
Untersuchungen | |
|
Häufig |
Gewichtszunahme |
|
Gelegentlich |
Gewichtsabnahme |
Beschreibung ausgewählter Nebenwirkungen
Bei Anwenderinnen von KHK wurde ein erhöhtes Risiko für arterielle und venöse thrombotische und thromboembolische Ereignisse einschließlich Myokardinfarkt, Schlaganfall, transitorische ischämische Attacken, Venenthrombose und Lungenembolie beobachtet, die in Abschnitt 4.4 eingehender behandelt werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es liegen keine Berichte über schwerwiegende gesundheitliche Probleme infolge einer Überdosierung vor. Symptome, die auftreten können, sind Übelkeit, Erbrechen und Vaginalblutungen. Es steht kein Antidot zur Verfügung, und es sollte eine symptomatische Behandlung erfolgen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Hormonelle Kontrazeptiva zur systemischen Anwendung. Gestagene und Estrogene, fixe Kombinationen
ATC-Code: G03AA11
Norgestimat/Ethinylestradiol wirkt über den Mechanismus einer Gonadotrophin-Suppression durch die estrogenen und gestagenen Wirkungen von Ethinylestradiol und Norgestimat. Der primäre Wirkmechanismus ist dabei die Hemmung der Ovulation, aber auch Veränderungen des Zervikalschleims, der Motilität der Eileiter und des Endometriums können zur Wirksamkeit des Präparats beitragen.
5.2 Pharmakokinetische Eigenschaften
Resorption
Norgestimat und Ethinylestradiol werden nach oraler Verabreichung rasch resorbiert. Nach einzelner oder mehrfacher (drei Zyklen) Verabreichung von Norgestimat / Ethinylestradiol bleiben die Serumkonzentrationen von Norgestimat unter der Bestimmungsgrenze des Assays (0,1 ng/ml). Metaboliten von Norgestimat, Norelgestromin und Norgestrel, finden sich in messbarer Konzentration im Blutkreislauf und erreichen ungefähr 1,5 h nach der Verabreichung maximale Serumspiegel.
Der Anstieg der Cmax und AUC von Norelgestromin verläuft nach Verabreichung von 0,180 bis 0,250 mg Norgestimat dosisproportional. Serumkonzentrationen von Ethinylestradiol sind innerhalb von 0,5 h nach der Gabe messbar und erreichen etwa
1.2 h nach der Verabreichung Spitzenspiegel.
Verteilung
Norelgestromin und Norgestrel werden stark an Serumproteine gebunden (> 97%). Norelgestromin wird an Albumin, nicht jedoch an SHBG gebunden, wohingegen Norgestrel in erster Linie an SHBG und in weitaus geringerem Maß an Albumin gebunden wird. Ethinylestradiol wird sehr stark an Serumalbumin gebunden.
Studien haben gezeigt, dass die fehlende Bindung von Norelgestromin an SHBG gegenüber anderen Gestagenen in oralen Kontrazeptiva einzigartig ist und eine zentrale Rolle bei der Verstärkung der biologischen Aktivität spielt. Im Gegensatz dazu wird das aus Norgestimat gebildete Norgestrel stark an SHBG gebunden, wodurch dessen biologische Aktivität begrenzt wird.
Biotransformation
Norgestimat wird über First-Pass-Mechanismen (intestinal und/oder hepatisch) rasch zu Norelgestromin (Spitzenkonzentrationen im Serum sind innerhalb von 2 Stunden erreicht) und Norgestrel metabolisiert, wobei es sich bei beiden um pharmakologisch aktive Gestagene handelt. Ethinylestradiol wird zu verschiedenen hydroxylierten Metaboliten und deren Glucuronid- und Sulfatkonjugaten verstoffwechselt.
Elimination
Sowohl Norelgestromin als auch Norgestrel und Ethinylestradiol werden anschließend metabolisiert, und ihre Metaboliten werden renal und über die Fäzes eliminiert. Die Eliminationshalbwertszeit im Steady-State lag bei 10 bis 15 h im Fall von Ethinylestradiol, 24,9 h im Fall von Norelgestromin und 45 h im Fall von Norgestrel. Nach Anwendung von 14C-Norgestimat wurden 47% der verabreichten Radioaktivität im Urin und 37% in den Fäzes ausgeschieden.
Steady-State-Pharmakokinetik
Nach Verabreichung von 0,250 mg Norgestimat / 0,035 mg Ethinylestradiol belief sich die mittlere AUC0-24h im Steady-State auf Grundlage der Serumspiegel der nicht-SHBG-gebundenen Substanzen auf 18,1 h ng/ml (Norelgestromin) und 3,64 h ng/ml (Norgestrel). Die AUC von Norgestrel nach Gabe von 0,250 mg Norgestimat /
0,035 mg Ethinylestradiol entspricht der Exposition nach einer Levonorgestrel-Dosis von etwa 30 Mikrogramm in Kombination mit Ethinylestradiol.
5.3 Präklinische Daten zur Sicherheit
Über die in anderen Abschnitten der Fachinformation bereits genannten Risiken hinaus lassen die präklinischen Studien keine besonderen Gefahren für den Menschen erkennen. Diese umfassten unter anderem Studien mit einer Kombination von Norgestimat und Ethinylestradiol zur Toxizität nach Einmal- und Mehrfachgabe, zur Genotoxizität, Kanzerogenität und zur Reproduktionstoxizität.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose
Lactose-Monohydrat Povidon K25 All-rac-alpha-T ocopherol Mikrokristalline Cellulose Croscarmellose-Natrium Vorverkleisterte Stärke (Mais)
Magnesiumstearat [pflanzlich] (Ph.Eur.)
Indigocarmin, Aluminiumsalz (E 132)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
PVC/PVdC-Aluminium-Blisterpackungen zu 21 Tabletten. Jede Blisterpackung ist in einem trilaminierten Beutel verpackt, der zusätzlich einen Trockenmittelbeutel enthält. Das Trockenmittel (Silicagel) ist nicht zum Verzehr bestimmt.
Packungen mit 21, 63, 126 Tabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht zutreffend.
7. INHABER DER ZULASSUNG
Aristo Pharma GmbH Wallenroder Str. 8 - 10 13435 Berlin
Tel.: +49 30 71094-4200 Fax: +49 30 71094-4250
8. ZULASSUNGSNUMMER
85955.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER
ZULASSUNG
05. März 2013
10. STAND DER INFORMATION
April 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
22