Ampuwa
FACHINFORMATION/ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
Ampuwa®, Lösungsmittel zur Herstellung von Parenteralia
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1000 ml enthalten:
Wasser für Inj ektionszwecke 1000 ml
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Lösungsmittel zur Herstellung von Parenteralia
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Wasser für Injektionszwecke dient als Lösungsmittel zum Auflösen und Verdünnen von Arzneimitteln zur Injektion bzw. Infusion, gemäß den Vorschriften der jeweiligen Gebrauchsinformation.
4.2 Dosierung und Art der Anwendung
Die Lösung dient zum Verdünnen und Verabreichen therapeutischer Arzneimittel. Das jeweilige Volumen sowie die Verabreichungsart werden in der Fachinformation des zugesetzten Arzneimittels festgelegt. Die Verabreichungsrate wird durch das Dosierungsschema des verordneten Arzneimittels bestimmt.
Nur klare und farblose Lösungen verwenden.
4.3 Gegenanzeigen
Gegenanzeigen, die sich aus dem zugesetzten Arzneimittel ergeben, sind unbedingt zu beachten.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Wasser für Injektionszwecke ist hypotonisch und darf aufgrund der fehlenden osmotisch wirksamen Substanzen nicht ohne Zusatz appliziert werden.
Es ist erst dann intravenös zu verabreichen, wenn die Lösung durch Zusetzen eines geeigneten gelösten Stoffs in einen annähernd isotonischen Zustand versetzt wurde.
Wenn es zum Verdünnen von hypertonischen Lösungen verwendet wird, ist die Lösung so zu verdünnen, dass sie in einen annähernd isotonischen Zustand gebracht wird.
Bei Verabreichung großer Volumina ist regelmäßig der Ionenhaushalt zu überprüfen.
Keine bekannt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Die Risiken während der Schwangerschaft und Stillzeit hängen von der Art des zugesetzten Arzneimittels ab.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Ampuwa hat keinen oder einen zu vernachlässigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Wenn Wasser für Injektionszwecke ohne Zusätze intravenös appliziert wird, kann es zu einer Hämolyse kommen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53173 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Nach der Infusion großer Mengen von hypotonischen Lösungen, die mit sterilem Wasser für Injektionszwecke verdünnt wurden, kann es zu einer Hämolyse kommen.
Bei einer versehentlichen Überdosierung ist die Behandlung abzubrechen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lösungs- und Verdünnungsmittel, ATC-Code: V07AB keine
5.2 Pharmakokinetische Eigenschaften
keine
5.3 Präklinische Daten zur Sicherheit
keine
6.1 Liste der sonstigen Bestandteile
keine
6.2 Inkompatibilitäten
Vor dem Zusetzen von Arzneimitteln ist sicherzustellen,
- dass diese wasserlöslich sind und beim pH von Wasser für Injektionszwecke stabil sind.
- dass diese untereinander kompatibel sind.
6.3 Dauer der Haltbarkeit
Glas- und Polyethylenbehältnisse: 3 Jahre
Polyolefinbeutel (freeflex):
100 ml 18 Monate
250 ml, 500 ml, 1000 ml 3 Jahre
Polypropylenflasche: 3 Jahre
Careflex-Beutel: 2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
keine
6.5 Art und Inhalt des Behältnisses
Glasampullen mit 2 ml, 5 ml, 10 ml bzw. 20 ml Polyethylenampullen mit 5 ml, 10 ml bzw. 20 ml Glasinfusionsflaschen mit 100 ml bzw. 250 ml
Glasinjektionsflaschen mit 50 ml, 50 ml mit 40 ml Inhalt, 100 ml bzw. 100 ml mit 50 ml Inhalt
Glasflaschen mit 500 ml bzw. 1000 ml
Polyethylenbehältnisse mit 250 ml, 250 ml mit 200 ml Inhalt, 500 ml, 1000 ml bzw. 3000 ml
Polyolefinbeutel (freeflex) mit Umfolie mit 100 ml, 250 ml, 500 ml, 1000 ml Polypropylenflasche mit 250 ml, 250 ml mit 200 ml Inhalt, 500 ml, 1000 ml Careflex-Beutel mit Stopfenanschluss mit 3000 ml
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Bei der Entnahme von Arzneimitteln aus Kunststoffampullen sind die Prinzipien aseptischen Arbeitens entsprechend der einschlägigen Richtlinien des Robert-Koch-Institutes (RKI) einzuhalten.
1
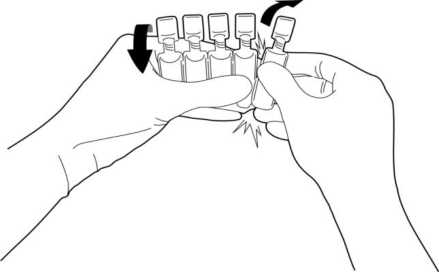
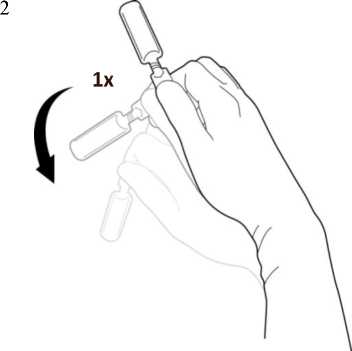
Halten Sie die Ampulle am Verschluss mit einer Hand fest und schütteln Sie sie einmal nach unten, so dass sich kein Tropfen mehr im oberen Bereich der Ampulle befindet. Dadurch wird ein Herausspritzen der Lösung beim Öffnen vermieden.
3
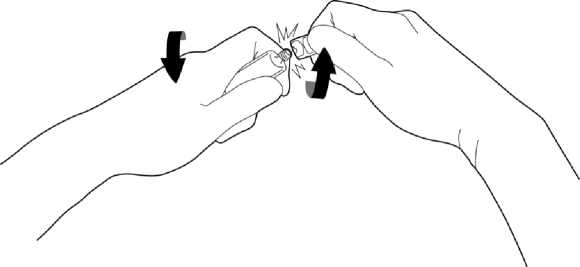
Öffnen Sie die Ampulle, indem Sie den Verschluss mit einer Drehbewegung entfernen.
4
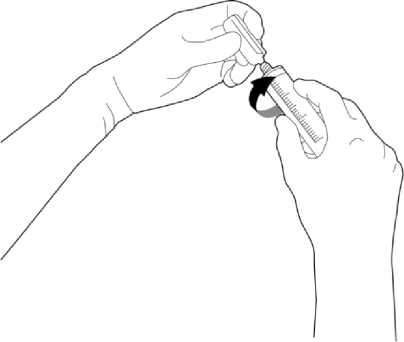
Die geöffnete Ampulle kann auf eine Spritze mit Luer-Anschluss aufgeschraubt werden.
INHABER DER ZULASSUNG
7.
Fresenius Kabi Deutschland GmbH
D - 61346 Bad Homburg
Tel.: +49 6172 686 8200
Fax: +49 6172 686 8239
E-Mail: kundenberatung@fresenius-kabi.de
8. ZULASSUNGSNUMMER
40676.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
15.02.1999 / 13.01.2011
10. STAND DER INFORMATION
Januar 2015
11. VERKAUFSABGRENZUNG
Apothekenpflichtig
Seite 5 von 5