Artiss
Seite 1 von 16
1. BEZEICHNUNG DES ARZNEIMITTELS
ARTISS
Tiefgefrorene Lösungen zur Fibrinklebung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Komponente 1:
Kleberprotein-Lösung
Humanes Fibrinogen (gerinnungsfähiges Protein) 91 mg1 2/ml
Aprotinin (synthetisch) 3000 KIE3/ml
Komponente 2:
Thrombin-Lösung
Humanes Thrombin 4 I.E.4/ml
Kalziumchlorid 40 |umol/ml
1 Doppelkammer-Fertigspritze mit < 1 ml > < 2 ml >< 5 ml > tiefgefrorener Kleberprotein-Lösung (mit Aprotinin) in einer Kammer und < 1 ml > < 2 ml >< 5 ml > tiefgefrorener Thrombin-Lösung (mit Kalziumchlorid) in der anderen Kammer ergibt < 2 ml > < 4 ml >< 10 ml > Gesamtvolumen des gebrauchsfertigen Produktes.
|
Nach dem Mischen |
1 ml |
2 ml |
4 ml |
10 ml |
|
Komponente 1: Kleberprotein-Lösung | ||||
|
Humanes Fibrinogen (als gerinnungsfähiges Protein) Aprotinin (synthetisch) |
45,5 mg 1.500 KIE |
91 mg 3.000 KIE |
182 mg 6.000KIE |
455 mg 15.000KIE |
|
Komponente 2: Thrombin-Lösung | ||||
|
Humanes Thrombin |
2 I.E. |
4 I.E. |
8 I.E. |
20 I.E. |
|
Kalziumchlorid |
20 pmol |
40 prnol |
80 prnol |
200 prnol |
1
2
ARTISS enthält 0,6-5 I.E./ml humanen Faktor XIII, der zusammen mit humanem Fibrinogen herausgereinigt wurde.
Die vollständige Auflistung der sonstigen Bestandteile siehe unter Abschnitt 6.1.
3. DARREICHUNGSFORM
Tiefgefrorene Lösungen zur Fibrinklebung.
Farblose bis leicht gelb und klare bis leicht trübe Lösungen.
Komponente 1; Kleberprotein-Lösung: pH 6.5-8.0 Komponente 2; Thrombin-Lösung: pH 6.0-8.0
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
ARTISS ist angezeigt als Gewebekleber um subkutanes Gewebe in der plastischen, rekonstruktiven und Verbrennungschirurgie zu fixieren/zu verkleben. ARTISS kann Nähte oder Klammern ersetzen (siehe Abschnitt 5.1). Zusätzlich kann ARTISS zur Unterstützung der Blutstillung bei subkutanen Gewebsoberflächen eingesetzt werden.
4.2 Dosierung und Art der Anwendung
ARTISS darf nur im Krankenhaus von erfahrenen Chirurgen angewendet werden, die in der Anwendung von ARTISS geschult wurden.
Dosierung
Die zu verabreichende Menge und die Häufigkeit der Verabreichung von ARTISS richten sich immer nach dem erforderlichen klinischen Bedarf des Patienten.
Die anzuwendende Menge unterliegt verschiedenen Einflussfaktoren und schließt die Art des chirurgischen Eingriffs, die Größe der betroffenen Fläche, die Art der beabsichtigten Applikation und die Anzahl der Verabreichungen ein. Sie ist aber nicht auf diese Faktoren allein beschränkt.
Die Verabreichung des Produktes muss individuell durch den behandelnden Arzt festgelegt werden. Bei klinischen Prüfungen wurden im Normalfall Einzeldosen von 0,2-12 ml verabreicht. Bei einigen Eingriffen (z. B. Versiegelung großer Verbrennungsflächen) werden möglicherweise größere Volumina benötigt. Die zu Beginn der Behandlung verwendete Produktmenge sollte der anatomischen Struktur bzw.
der Größe der zu behandelnden Fläche entsprechen und ausreichen, um den betreffenden Bereich vollständig abzudecken. Die Anwendung kann bei Bedarf bei kleinen Flächen, die nicht vorbehandelt wurden, wiederholt werden. Eine Re-Applikation auf einer vorbestehenden, Schicht sollte vermieden werden, da ARTISS nicht auf einer polymerisierten Schicht haftet.
Es wird empfohlen bei der Erstanwendung die komplette, zum Kleben vorgesehene, Fläche zu bedecken.
Als Richtlinie zur Klebung von Flächen gilt: 1 Packung ARTISS 2 ml (d. h. 1 ml Kleberprotein-Lösung plus 1 ml Thrombin-Lösung) reicht für eine Fläche von mindestens 10 cm2.
Das Hauttransplantat sollte sofort nach dem Auftragen von ARTISS auf das Wundbett gelegt werden. Der Operateur hat vor der Polymerisation 60 Sekunden Zeit für die Manipulation und die Positionierung des Transplantates. Nachdem der Hautlappen oder das Transplantat in Position gebracht wurde, muss es für mindestens 3 Minuten mit sanftem Druck in der gewünschten Lage gehalten werden, um sicherzustellen, dass der Hautlappen oder das Transplantat gut am Gewebsuntergrund haftet.
Es empfiehlt sich, eine möglichst dünne Schicht des Gemisches aus Kleberprotein- und Thrombin-Lösung aufzutragen, um eine übermäßige Bildung von Granulationsgewebe zu vermeiden und eine allmähliche Resorption des verfestigten Fibrinklebers zu erzielen.
ARTISS ist in klinischen Prüfungen nicht an Patienten oberhalb des 65. Lebendsjahres eingesetzt worden. Kinder und Jugendliche
Zurzeit vorliegende Daten sind in Abschnitt 5.1 beschrieben; eine Dosierungsempfehlung kann jedoch nicht gegeben werden.
Art der Anwendung
Zum epiläsionalen (topischen) Gebrauch. Nicht injizieren
Nur für die subkutane Anwendung. ARTISS wird nicht für die Anwendung in der Laparoskopie empfohlen.
Um optimale Sicherheit bei der Anwendung von ARTISS zu gewährleisten, soll beim Aufsprühen ein Druckregelgerät verwendet werden, dessen Maximaldruck höchstens 2,0 bar (28,5 psi) beträgt.
Vor dem Aufbringen von ARTISS muss die Wundoberfläche mittels Standardtechniken (z. B. intermittierende Anwendung von Kompressen, Tupfern, Anwendung von Saugern) getrocknet werden.
ARTISS soll ausschließlich nach den Anweisungen und unter Verwendung der Produkte und Geräte rekonstituiert bzw. verabreicht werden, die für dieses Produkt empfohlen werden (siehe Abschnitt 6.6).
Für die Sprühapplikation siehe Abschnitte 4.4 und 6.6 mit besonderen Empfehlungen zum erforderlichen Druck und Gewebeabstand je nach Art des Eingriffs und zur Länge der Applikationshilfen.
4.3 Gegenanzeigen
ARTISS ist nicht angezeigt zum Ersatz von Hautnähten beim Verschluss chirurgischer Wunden.
Die alleinige Anwendung von ARTISS ist nicht angezeigt für die Behandlung von massiven und starken
arteriellen oder venösen Blutungen.
ARTISS darf niemals intravaskulär angewendet werden.
ARTISS ist kontraindiziert bei Überempfindlichkeit gegen einen der Wirkstoffe oder einen der sonstigen
Bestandteile (siehe auch Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die
Anwendung).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Nur zum epilesionalen Gebrauch. Nicht für die intravaskuläre Anwendung. Eine intravaskuläre
Verabreichung von ARTISS kann zu lebensbedrohlichen, thromboembolischen Komplikationen führen.
Eine Injektion in das Weichteilgewebe birgt das Risiko einer Gewebeschädigung.
Wenn Fibrinkleber mit Hilfe von Druckluft oder Druckgas angewendet werden, ist Vorsicht geboten.
• Jede Anwendung von Druckluft oder Druckgas birgt das lebensbedrohliche oder tödliche Risiko einer möglichen Luft-oder Gasembolie, einer Gewebsruptur, oder von Gaseinschlüssen mit nachfolgender Kompression
• ARTISS soll nur als dünne Schicht aufgetragen werden. Eine zu dicke Schicht kann die Wirksamkeit des Produkts und die Wundheilung negativ beeinflussen.
• Bei der Verwendung von Sprühgeräten mit Druckgasreglern zur Verabreichung von Fibrinklebern sind lebensbedrohliche Luft- oder Gasembolien aufgetreten. Dies scheint auf die Verwendung von Sprühapplikatoren bei einem höheren als dem empfohlenen Druck und/oder in zu geringem Abstand zur Gewebeoberfläche zurückzuführen sein. Das Risiko scheint höher zu sein, wenn Fibrinkleber mit Luft aufgesprüht werden, als beim Sprühen mit CO2 und ist daher bei der Anwendung von ARTISS nicht auszuschließen.
• Wird ARTISS mittels Sprühapplikation aufgetragen, muss sichergestellt werden, dass ein Druck verwendet wird, der im vom Hersteller des Sprühgeräts empfohlenen Druckbereich liegt (siehe Tabelle 6.6 für Drücke und Abstände).
• ARTISS soll nur per Sprühapplikation verabreicht werden, wenn der Sprühabstand exakt beurteilt werden kann. Nicht näher als im empfohlenen Abstand aufsprühen.
• Beim Aufsprühen von ARTISS sollen Änderungen von Blutdruck, Puls, Sauerstoffsättigung und endexspiratorischem CO2 überwacht werden, da die Möglichkeit einer Luft- oder Gasembolie besteht (siehe auch Abschnitt 4.2).
• ARTISS darf nicht mit dem EasySpray/Spray System in umschlossenen Körperbereichen angewendet werden
• Es sollten zur Anwendung von ARTISS nur CE-zertifizierte Medizinprodukte eingesetzt werden.
ARTISS ist nicht angezeigt zur Hämostase und zum Kleben in Situationen, in denen eine schnelle Gerinnung erforderlich ist. Insbesondere bei kardiovaskulären Eingriffen, bei denen das Kleben von Gefäßanastomosen beabsichtigt wird, sollte ARTISS nicht angewendet werden.
ARTISS ist nicht angezeigt für den Einsatz in der Neurochirurgie oder als Nahtunterstützung bei gastrointestinalen oder vaskulären Anastomosen, da keine Daten vorliegen, die diese Indikationen stützen würden.
Vor der Anwendung von ARTISS ist darauf zu achten, dass das Gebiet außerhalb der zu klebenden Fläche ausreichend geschützt/abgedeckt wird, um eine Gewebsadhäsion an nicht-erwünschten Stellen zu vermeiden.
Produkte die oxidierte Zellulose enthalten, können die Wirksamkeit von ARTISS beeinflussen und sollten nicht als Trägermaterialien verwendet werden (siehe Abschnitt 6.2).
Wie bei allen proteinhaltigen Präparaten sind allergische Überempfindlichkeitsreaktionen möglich. Anzeichen von Überempfindlichkeitsreaktionen können Nesselsucht, generalisierte Urtikaria, Engegefühl in der Brust, Stenoseatmung, Hypotonie und Anaphylaxie einschließen. Wenn diese Symptome auftreten, muss die Anwendung sofort abgebrochen werden.
ARTISS enthält Aprotinin. Auch bei strikt lokaler Anwendung besteht das Risiko einer anaphylaktischen Reaktion, die auf das Aprotinin zurückzuführen ist. Das Risiko scheint bei Patienten mit einer vorangegangenen Exposition erhöht zu sein, selbst wenn es damals gut vertragen wurde. Deshalb sollte jede Verwendung von Aprotinin oder aprotininhaltigen Produkten in der Krankenakte vermerkt werden.
Da das synthetische Aprotinin strukturell identisch mit dem bovinen Aprotinin ist, sollte die Anwendung von ARTISS bei Patienten mit einer Allergie gegen Rindereiweiß sorgfältig abgewogen werden.
Bei anaphylaktischen/anaphylaktoiden Reaktionen oder schweren Überempfindlichkeitsreaktionen muss die Anwendung abgebrochen und, sofern möglich, bereits appliziertes, polymerisiertes Produkt von der Operationsstelle entfernt werden. Im Falle einer Unverträglichkeitsreaktion muss unverzüglich die entsprechende medizinische Behandlung und Versorgung eingeleitet werden. Es müssen die derzeit gültigen Standardmaßnahmen für eine Notfallbehandlung angewendet werden. Bei einem Schock muss die geeignete medizinische Schockbehandlung eingeleitet werden.
Standardmaßnahmen zur Vorbeugung von Infektionen, die sich aus der Anwendung von Arzneimitteln ergeben, die aus menschlichem Blut oder Blutplasma hergestellt sind, schließen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie effektive Schritte zur Inaktivierung/Abtrennung von Viren im Herstellungsverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu auftretende Viren oder andere Pathogene.
Die ergriffenen Maßnahmen gelten als wirksam für umhüllte Viren wie Humanes-Immunschwäche-Virus (HIV), Hepatitis B-Virus (HBV) und Hepatitis C-Virus (HCV) sowie für das nicht-umhüllte Hepatits A-Virus (HAV).
Diese Maßnahmen können bei nicht-umhüllten Viren, wie z. B. Parvovirus B19 möglicherweise nur eingeschränkt wirksam sein. Eine Parovirus B19-Infektion kann schwerwiegende Folgen bei Schwangeren (fötale Infektion) sowie bei Personen mit Immundefekt oder einer gesteigerten Erythropoese (z.
B. hämolytische Anämie) haben.
Es wird dringend empfohlen, bei jeder Verabreichung von ARTISS die Bezeichnung des Produktes und die Chargennummer zu notieren, um einen Zusammnhang zwischen dem Patienten und der verwendeten Charge herzustellen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
Wie andere vergleichbare Präparate oder Thrombin-Lösungen wird das Produkt durch den Kontakt mit Lösungen, die Alkohol, Jod oder Schwermetalle enthalten (z. B. antiseptische Lösungen), denaturiert. Solche Substanzen sollten vor der Anwendung des Präparats weitestgehend entfernt werden.
Siehe Abschnitte 4.4 oder 6.2 hinsichtlich der Substanzen, die Wechselwirkungen mit dem Produkt aufweisen können.
4.6 Fertilität, Schwangerschaft und Stillzeit
Die Unbedenklichkeit von Fibrinklebern/Hämostika während der Schwangerschaft und Stillzeit wurde nicht in kontrollierten, klinischen Prüfungen untersucht. Tierversuche wurden ebenfalls nicht vorgenommen.
Daher darf das Präparat während der Schwangerschaft und der Stillzeit nur verwendet werden, wenn es unbedingt erforderlich ist.
Siehe Abschnitt 4.4 zur Information über Parvovirus B19-Infektionen.
Die Wirkungen von ARTISS auf die Fertilität wurden nicht untersucht.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht relevant.
4.8 Nebenwirkungen
Eine intravaskuläre Injektion kann zu thromboembolischen Ereignissen und DIC führen. Es besteht außerdem das Risiko von anaphylaktischen Reaktionen (siehe Abschnit 4.4).
In seltenen Fällen können bei Patienten, die mit Fibrinklebern/Hämostatika behandelt werden, Überempfindlichkeits- oder allergische Reaktionen auftreten (die Angioödeme, Brennen und Stechen an der Verabreichungsstelle, Bradykardie, Bronchospasmus, Schüttelfrost, Atembeschwerden, Flush, generalisierte Urtikaria, Kopfschmerzen, Nesselsucht, Hypotonie, Lethargie, Übelkeit, Juckreiz, Ruhelosigkeit, Tachykardie, Engegefühl in der Brust, Kribbeln, Erbrechen und Stenoseatmung einschließen können).
In Einzelfällen sind diese Reaktionen bis zur schweren Anaphylaxie fortgeschritten. Solche Reaktionen können besonders dann beobachtet werden, wenn das Präparat wiederholt oder bei Patienten angewendet wird, bei denen bereits früher eine Überempfindlichkeit gegenüber Aprotinin (siehe Abschnitt 4.4) oder einen anderen Bestandteil des Präparats aufgetreten ist.
Selbst wenn eine erste Behandlung mit ARTISS gut vertragen wurde, kann eine weitere Anwendung des Präparats oder eine systemische Anwendung von Aprotinin schwere anaphylaktische Reaktionen zur Folge haben.
In seltenen Fällen können sich Antikörper gegen Bestandteile des Fibrinklebers bilden.
Zur Sicherheit vor übertragbaren Erregern siehe Abschnitt 4.4.
Nebenwirkungen, die von klinischen Studien berichtet wurden, sind im Folgenden zusammengefasst. Die bekannten Häufigkeiten dieser Nebenwirkungen basieren auf einer kontrollierten, klinischen Studie an 138 Patienten, bei denen Hauttranplantate mit ARTISS auf chirurgisch behandelten Verbrennungswunden fixiert wurden. Keines dieser Ereignisse wurde als schwerwiegend eingestuft.
Die Nebenwirkungen und ihre Häufigkeiten werden wie folgt zusammengefasst:
Häufig (>1/100 bis <1/10)
Gelegentlich (>1/1000 bis <1/100)
|
Tabelle 1 Nebenwirkungsreaktionen aus Klinischen Prüfungen | ||
|
System-OrganKlassen (SOC) |
Bevorzugter Begriff in der MedDRA |
Häufigkeiten |
|
Erkrankungen der Haut und des Unterhauszellgewebes |
Hautzysten |
gelegentlich |
|
Juckreiz |
häufig | |
|
Verletzungen, Vergiftung und nachfolgende Komplikationen |
Transplantatversagen |
häufig |
Klassenreaktionen
Andere Nebenwirkungsreaktionen, die bei der Produktklasse Fibrinkleber/Hämostakika auftreten, schließen ein: Luft-oder Gasembolien, wenn Medizinprodukte mit Druckluft oder Druckgas verwendet werden. Dies scheint auf die Verwendung von Sprühapplikatoren bei einem höheren als dem empfohlenen Druck und in zu geringem Abstand zur Gewebeoberfläche zurückzuführen sein._Überempfindlichkeits-reaktionen schließen auch Irritationen an der Auftragsstelle, Brustbewschwerden, Schüttelfrost, Kopfschmerzen, Lethargie, Ruhelosigkeit und Erbrechen ein.
Weitere Klassenreaktionen sind: Anaphylaktische Reaktion, Bradykardie, Tachykardie, niedriger Blutdruck, Hämatome, Atemnot, Übelkeit, Nesselsucht, flüchtige Hautrötungen, verzögerte Wundheilung, Ödeme, Fieber und Serome.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Straße 51 - 59, 63225 Langen, Telefon +49 6 10 37 70, Telefax: +49 61 03 77 12 34, Website: www.pei.de anzuzeigen.
4.9 Überdosierung
Es wurden keine Fälle von Überdosierung berichtet.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: lokale Hämostatika, ATC-Code: B02BC; Gewebekleber, ATC-Code: V03A K
ARTISS kann Nähte oder Klammern ersetzen, wenn es zur Befestigung von Hauttransplantaten auf Verbrennungsflächen oder auf anderen Wundflächen verwendet wird. ARTISS kann eingesetzt werden, um Nähte und Klammern für Hautlappen zu unterstützen bei Fällen, wo bei Nähte/Klammern unzureichende Ergebnisse hinsichtlich postoperativer Hämatome oder Serome erwartet werden.
Das Fibrinklebesystem imitiert die letzte Phase der physiologischen Blutgerinnung. Fibrinogen wird durch Aufspaltung in Fibrinmonomere und Fibrinopeptide in Fibrin umgewandelt. Die Fibrinmonomere bilden durch Aggregation ein Fibringerinnsel. Faktor XIIIa, der durch Thrombin aus Faktor XIII gebildet wird, vernetzt das Fibrin. Für die Konversion von Fibrinogen und die Vernetzung sind Kalziumionen erforderlich.
Bei fortschreitender Wundheilung wird durch Plasmin und durch die Entstehung von Fibrinspaltprodukten eine erhöhte fibrinolytische Aktivität initiiert. Dieser proteolytische Abbau von Fibrin wird durch Antifibrinolytika gehemmt. Aprotinin ist als Antifibrinolytikum in ARTISS (gefroren) enthalten, um einen verfrühten Abbau des Gerinnsels zu verhindern.
Zur Wirksamkeitstestung werden in-vivo-Studien an Tiermodellen verwendet, die stark die Situation im Patienten imitieren, Für ARTISS (gefrorene und lyophilisierte Produktform) wurde die Wirksamkeit bei der Fixierung von autologen Hauttransplantaten und bei der Fixierung von Spalthauttransplantaten demonstriert.
Eine prospektive, randomisierte, kontrollierte, klinische Multizenterstudie zum Nachweis der Fixierung von Spalthaut-Transplantaten bei Verbrennungsopfern wurde mit ARTISS (gefroren) durchgeführt. Bei jedem der 138 Patienten wurden zwei vergleichbare Stellen behandelt. An einer Stelle wurde das Hauttransplantat mit ARTISS fixiert, an der anderen Stelle wurde das Transplantat mit Metallklammern (Kontrolle) befestigt. ARTISS erwies sich hinsichtlich der Wirksamkeit und dem vollständigen Wundverschluss am Tag 28 bezogen auf die Differenz des Anteils der erfolgreich behandelten Stellen gegenüber den Metallklammern als nicht unterlegen. Die Berwertung erfolgte verblindet und anhand von Fotoaufnahmen. Dies konnte bei 55 von 127 Patienten (43 %) die mit ARTISS (gefroren) und bei 47 von 127 Patienten (37 %), die mit Klammern behandelt worden waren, erreicht werden.
Hinsichtlich der sekundären Endpunkte zeigte ARTISS am ersten Tag eine signifikant geringere Inzidenz und Größe von Hämatomen/Seromen (p<0,0001 für Inzidenz und Größe). In Bezug auf die Inzidenz und den Bereich des Engraftments am Tag 5 und den Wundverschluss am Tag 14 sowie den Wundverschlussbereich am Tag 28 zeigte sich kein Unterschied. Auch hinsichtlich der Patientenzufriedenheit war ARTISS der Verwendung von Metallklammern überlegen (p<0,0001) und die Patienten hatten bei ARTISS signifikant weniger Angst vor Schmerzen als bei der Verwendung von Metallklammern (p<0,0001). Darüber hinaus war ARTISS auch in der Bewertung des Prüfarztes hinsichtlich der Qualität der Transplantathaftung, die Präferenz für die Fixierungsmethode und die Zufriedenheit mit der Fixierung sowie der Gesamtqualität und der Gesamtrate der Heilung den Metallklammern signifikant überlegen (p<0,0001).
In dieser Studie wurden siebenunddreißig (37) Kinder und Jugendliche im Alter von 1,1 bis 18 Jahren bewertet. Achtzehn (18) dieser Patienten waren 6 Jahre alt oder jünger.
Die Dosierung in den Klinischen Prüfungen war für erwachsene Patienten und Kinder identisch.
5.2 Pharmakokinetische Eigenschaften
ARTISS ist nur zum epilesionalen Gebrauch indiziert. Eine intravaskuläre Verabreichung ist kontraindiziert. Folglich wurden keine pharmakokinetischen Studien zur intravaskulären Anwendung beim Menschen durchgeführt.
Pharmakokinetische Studien an Larbortieren verschiedener Spezies wurden nicht durchgeführt.
Fibrinkleber/Hämostatika werden wie körpereigenes Fibrin mittels Fibrinolyse und Phagozytose metabolisiert.
5.3 Präklinische Daten zur Sicherheit
Es sind keine präklinischen Sicherheitsstudien für ARTISS (enthält 4 I.E. Thrombin/ml) verfügbar. Es wurden Toxizitätsstudien mit Fibrinklebern durchgeführt, die 500 I.E. Thrombin/ml enthalten, und die als repräsentativ für Produkte, die 4 I.E. Thrombin/ml enhalten, angesehen werden. EinzeldosisToxizitätsstudien an Ratten und Kaninchen ergaben keine akute Toxizität von VH S/D-behandelten Fibrinklebern (die 500 I.E. Thrombin/ml enthalten). VH S/D-behandelten Fibrinklebern (mit 500
I.E.Thrombin/ml) zeigten sich auch als gut verträglich bei Wundheilungsmodellen an Ratten und Kaninchen und bei Zellkulturen mit humanen Fibroblasten.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Komponente 1: Kleberprotein-Lösung
Humanalbumin-Lösung
L-Histidin
Niacinamid
Polysorbat 80 (Tween 80)
Natriumzitrat-Dihydrat Wasser für Injektionszwecke
Komponente 2: Thrombin-Lösung
Humanalbumin-Lösung
Natriumchlorid
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Wegen des Fehlens von Kompatibilitätsstudien darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden. Produkte die oxidierte Zellulose enthalten, können die Wirksamkeit von ARTISS beeinflussen und sollten nicht als Trägermaterialien verwendet werden.
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Gefroren lagern und transportieren (bei <-20 °C).
Die Spritze im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ungeöffnete, bei Raumtemperatur aufgetaute Primärverpackungen können bei kontrollierter Raumtemperatur (bis zu maximal +25 °C) bis zu 14 Tage aufbewahrt werden. Nach dem Auftauen nicht wieder einfrieren oder im Kühlschrank lagern.
6.5 Art und Inhalt des Behältnisses
1 ml, 2 ml oder 5 ml Kleberprotein-Lösung und 1ml, 2 ml oder 5 ml Thrombin-Lösung sind in einer Doppelkammer-Einmalspritze (aus Polypropylen) abgefüllt, die eine gemeinsame Verschlusskappe aufweist. Die Doppelkammer-Einmalspritze befindet sich in einem Beutel. Zusätzlich befindet sich in der
Packung ein Set mit Applikationszubehör, bestehend aus einer Doppelkolbenstange, 2 Anschluss-Stücken und 4 Applikationskanülen.
Packungsgröße 1 Stück (1 x 1 ml + 1 ml, 1 x 2 ml + 2 ml, 1 x 5 ml + 5 ml)
Sowohl die Kleberprotein-Lösung als auch die Thrombin-Lösung sind in einer DoppelkammerEinmalspritze aus Polypropylen abgefüllt.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Weiteres Zubehör zur Applikation des Präparats kann über BAXTER bezogen werden.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung Allgemeines
Um zu vermeiden, dass ARTISS an Handschuhen und Instrumenten anhaftet, diese vor dem Kontakt mit Kochsalzlösung befeuchten.
Als Richtlinie zur Klebung von Flächen gilt: 1 Packung ARTISS 2 ml (d. h. 1 ml Kleberprotein-Lösung plus 1 ml Thrombin-Lösung) reicht für eine Fläche von mindestens 10 cm2.
Die erforderliche Menge von ARTISS ist von der Größe der zu bedeckenden Fläche abhängig.
Vorbereitung und Handhabung
Der innere Beutel und sein Inhalt sind bei unbeschädigter, äußerer Verpackung steril.
Es wird empfohlen, die beiden Kleberkomponenten in einem sterilen Wasserbad bei einer Temperatur von 33-37 °C aufzutauen und zu erwärmen. Das Wasserbad darf eine Temperatur von 37 °C nicht überschreiten. (Um den vorgegebenen Temperaturbereich zu überwachen, sollte die Wassertemperatur mit einem Thermometer überwacht und das Wasser gegebenenfalls gewechselt werden. Bei Verwendung eines sterilen Wasserbades zum Auftauen und Erwärmen sollte die Doppelkammer-Fertigspritze aus den aluminium-beschichteten Kunststoffbeuteln entnommen werden.)
Die Verschlusskappe der Spritze sollte erst nach dem vollständigen Auftauen, kurz vor dem Aufstecken desVerbindungsstückes, entfernt werden. ARTISS erst verwenden, wenn es vollständig aufgetaut und erwärmt ist (flüssige Konsistenz).
Die Doppelkammer-Fertigspritzen unter Verwendung eines der folgenden Verfahren auftauen:
1. Auftauen bei Raumtemperatur (bei maximal +25 °C):
Das Präparat kann bei Raumtemperatur aufgetaut werden. In Tabelle 1 sind die erforderlichen Mindestzeiten für das Auftauen bei Raumtemperatur aufgeführt. Das Produkt kann (in beiden aluminiumbeschichteten Kunststoffbeuteln) maximal 14 Tage bei Raumtemperatur aufbewahrt werden.
Wenn das Produkt bei Raumtemperatur aufgetaut wird, muss es kurz vor der Anwendung zusätzlich in einem Inkubator auf 33 °C-37 °C erwärmt werden. Die jeweils erforderliche Erwärmungsdauer im Inkubator ist ebenfalls in Tabelle 1 angegeben.
Tabelle 1: Auftau- und Erwärmungszeiten bei Raumtemperatur (= RT) mit anschließender zusätzlicher Erwärmung vor der Anwendung in einem Inkubator bei 33 °C bis maximal 37 °C
|
Packungsgröße |
Auftauzeiten bei Raumtemperatur (Produkt in aluminium-beschichteten Kunststoffbeuteln) |
Erwärmungszeiten bei 3337 °C im Inkubator nach dem Auftauen bei RT (Produkt in aluminium-beschichteten Kunststoffbeuteln) |
|
2 ml |
60 Minuten |
+ 15 Minuten |
|
4 ml |
110 Minuten |
+ 25 Minuten |
|
10 ml |
160 Minuten |
+ 35 Minuten |
Wenn ARTISS auf 33-37 °C aufgewärmt wurde, kann das Produkt bis zu 4 Stunden aufbewahrt werden. 2. Schnelles Auftauen
Tabelle 2: Auftau- und Erwärmungszeiten in einem sterilen Wasserbad bei 33 °C bis maximal 37 °C
Den Kolben und den inneren Beutel in den sterilen Bereich bringen, die Fertigspritze aus dem inneren Beutel nehmen und direkt in das sterile Wasserbad legen. Sicherstellen, dass der Inhalt der Fertigspritze vollständig in das Wasser eingetaucht ist.
|
Packungsgröße |
Auftau- und Erwärmungszeiten (Produkt außerhalb der aluminium-beschichteten Kunststoffbeutel) |
|
2 ml |
5 Minuten |
|
4 ml |
5 Minuten |
|
10 ml |
12 Minuten |
Eine dritte Alternative besteht darin, das Produkt außerhalb des sterilen Bereichs in einem nicht sterilen Wasserbads aufzutauen.
Hierzu die Fertigspritze in beiden Beuteln belassen und für die entsprechende Dauer (siehe Tabelle 3) in ein Wasserbad außerhalb des sterilen Bereiches legen. Sicherstellen, dass die Beutel während der gesamten Auftaudauer in dem Wasser untergetaucht bleiben. Nach dem Auftauen aus dem Wasserbad entnehmen, den äußeren Beutel abtrocknen und den inneren Beutel mit der Fertigspritze und dem Kolben in den sterilen Bereich bringen.
Tabelle 3: Auftau- und Erwärmungszeiten außerhalb des sterilen Bereichs in einem nicht sterilen Wasserbad bei 33 °C bis maximal 37 °C
|
Packungsgröße |
Auftau- und Erwärmungszeiten (Produkt innerhalb der aluminium-beschichteten Kunststoffbeutel) |
|
2 ml |
30 Minuten |
|
4 ml |
40 Minuten |
|
10 ml |
80 Minuten |
Alternativ können die Kleberkomponenten auch in einem Inkubator bei einer Temperatur zwischen 33 °C und 37 °C aufgetaut und erwärmt werden. Die jeweiligen Auftau- und Erwärmungszeiten im Inkubator sind in Tabelle 4 angegeben. Die Angaben beziehen sich auf das Präparat in den aluminium-beschichteten Kunststoffbeuteln.
Tabelle 4: Auftau- und Erwärmungszeiten in einem Inkubator bei 33 °C bis maximal 37 °C
|
Packungsgröße |
Auftau- und Erwärmungszeiten im Inkubator (Präparat in aluminium-beschichteten Kunststoffbeuteln) |
|
2 ml |
40 Minuten |
|
4 ml |
85 Minuten |
|
10 ml |
105 Minuten |
Hinweis: Von einem Auftauen in der Hand ist abzusehen.
Nicht in der Mikrowelle erwärmen.
Nach dem Auftauen nicht wieder im Kühlschrank lagern oder einfrieren.
Nach dem schnellen Auftauen (d. h. Auftauen bei einer Temperatur von 33-37 °C) kann ARTISS bis zu maximal 4 Stunden bei 33-37 °C aufbewahrt werden.
Um eine optimale Vermischung der beiden Lösungen zu erzielen, müssen die beiden Kleberkomponenten unmittelbar vor der Anwendung auf 33-37 °C erwärmt werden. (Die Temperatur von 37 °C darf jedoch in keinem Fall überschritten werden!)
Die Kleberprotein-Lösung und die Thrombin-Lösung sollten klar bis leicht opaleszierend sein. Lösungen, die trüb sind oder Ablagerungen aufweisen, nicht verwenden. Die aufgetauten Präparate vor der Anwendung visuell auf Partikel und Verfärbungen oder andere Abweichungen von der normalen Erscheinungsform überprüfen. Wird irgendeine Veränderung beobachtet, die Lösung verwerfen.
Die aufgetaute Kleberprotein-Lösung sollte eine leicht viskose Flüssigkeit sein. Wenn die Lösung die Konsistenz eines verfestigten Gels aufweist, ist davon auszugehen, dass sie denaturiert wurde (z. B. aufgrund einer Unterbrechung der Kühlkette oder durch Überhitzen beim Erwärmen). In diesem Fall darf ARTISS nicht verwendet werden.
Ungeöffnete Beutel, die bei Raumtemperatur aufgetaut wurden, können bei kontrollierter Raumtemperatur (bis zu maximal +25 °C) bis zu 14 Tage aufbewahrt werden. Wird das Produkt nicht innerhalb von 14 Tagen nach dem Auftauen verwendet, muss es verworfen werden.
Die Verschlusskappe der Spritze sollte erst nach dem vollständigen Auftauen, kurz vor dem Aufstecken desVerbindungsstückes, entfernt werden. ARTISS erst verwenden, wenn es vollständig aufgetaut und erwärmt ist (flüssige Konsistenz).
Zu weiteren Anweisungen für die Vorbereitung bitte das zuständige Krankenpflegepersonal oder den Arzt befragen.
ANWENDUNG
Zur Anwendung muss die Doppelkammerspritze mit der Kleberprotein-Lösung und der Thrombin-Lösung mit einem Anschluss-Stück und einer Applikationskanüle verbunden werden, die in dem mitgelieferten Set mit Applikationszubehör enthalten sind. Der gemeinsame Kolben der Doppelkammerspritze stellt sicher, dass gleiche Mengen der beiden Kleberkomponenten über das Anschluss-Stück in die Applikationskanüle gelangen, wo sie gemischt und anschließend aufgetragen werden.
Handhabungshinweise
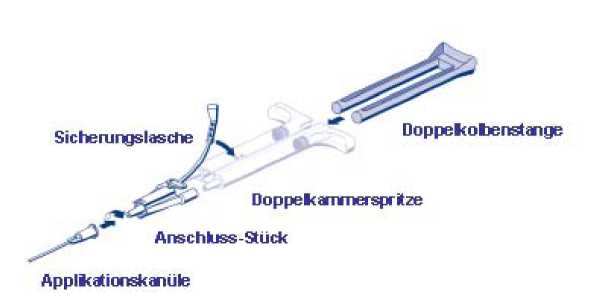
Die Konusse der Doppelkammerspritze mit dem Anschluss-Stück verbinden. Dabei auf festen Halt achten. Das Anschluss-Stück mit der Sicherungslasche an der Doppelkammerspritze fixieren. Sollte die Sicherungslasche abreißen, das Ersatz-Anschluss-Stück verwenden. Sollte keines vorhanden sein, kann das System trotzdem verwendet werden, jedoch ist sorgfältig darauf zu achten, dass die Verbindung fest sitzt und dicht ist.
Eine Applikationskanüle auf das Anschluss-Stück stecken.
Die Luft im Anschluss-Stück und in der Applikationskanüle erst unmittelbar vor der eigentlichen Anwendung herausdrücken, da sonst die Austrittsöffnung der Kanüle verstopfen könnte.
Unmittelbar vor der Anwendung die ersten Tropfen aus der Applikationskanüle herausdrücken und verwerfen, um die Anwendung eines ausreichend gemischten Produktes sicherzustellen.
Das Gemisch aus Kleberprotein- und Thrombin-Lösung auf die zu behandelnde Oberfläche oder auf die Flächen der zu verklebenden Teile auftragen.
Wenn das Auftragen der Fibrinkleberkomponenten unterbrochen wird, kann es zu einer Verstopfung der Kanüle kommen. Die Applikationskanüle in diesem Falle erst unmittelbar vor der Fortsetzung der Applikation gegen eine neue austauschen. Sollten die Austrittsöffnungen des Anschluss-Stücks verstopft sein, das mitgelieferte Ersatz-Anschluss-Stück verwenden.
Die Applikation kann auch mit anderem von BAXTER gelieferten Zubehör erfolgen, das z. B. speziell für die minimal-invasive Chirurgie oder die Applikation auf große oder schwer zugängliche Flächen geeignet ist. Beim Einsatz der Applikationshilfen genau nach Bedienungsanleitung vorgehen.
Nach dem Auftragen der beiden Komponenten die Wundfläche adaptieren und die verklebten Teile ca. 3-5 Minuten unter ständigem leichtem Druck in der gewünschten Position halten, um eine gute Haftung des sich verfestigenden Fibrinklebers am Gewebe zu erzielen.
Sprühapplikation
Wird ARTISS mithilfe eines Sprühgeräts aufgetragen, muss sichergestellt werden, dass der Druck und der Gewebeabstand innerhalb der folgenden, vom Hersteller empfohlenen Bereiche liegen:
Empfohlener Druck, Gewebeabstand und Sprühgeräte für die Applikation von ARTISS
|
Offene Operationswunden am Unterhautzellgewebe |
Zu verwendendes Sprühset |
Zu verwendende Applikationshilfe |
Zu verwendende r Druckregler |
Empfohlener Abstand vom Zielgewebe |
Empfohlener Sprühdruck |
|
Artiss Spray Set |
n. z. |
EasySpray |
10-15 cm |
1,5-2,0 bar (21,5-28,5 psi) | |
|
Artiss Spray Set 10er-Pack |
n. z. |
EasySpray |
Beim Aufsprühen von ARTISS sollen Änderungen von Blutdruck, Puls, Sauerstoffsättigung und endexspiratorischem CO2 überwacht werden, da die Möglichkeit einer Luft- oder Gasembolie besteht (siehe Abschnitte 4.2 und 4.4).
Entsorgung
Nicht verwendetes Produkt oder Abfallmaterial ist entsprechend den lokalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
Baxter Deutschland GmbH Edisonstraße 4 85716 Unterschleißheim Telefon.: 089/31701-0 Fax: 089/31701-177 E-Mail: info_de@baxter.com
8. ZULASSUNGSNUMMER(N) Zul.-Nr.: PEI.H.03593.01.1
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
17. Februar 2009
10. STAND DER INFORMATION
April 2014
11. SONSTIGE HINWEISE
Herkunftsländer der zur Produktion verwendeten Plasmen
Deutschland, Finnland, Norwegen, Österreich, Schweden, Schweiz, Tschechien, und Vereinigte Staaten von Amerika.
12. VERSCHREIBUNGSSTATUS/ APOTHEKENPFLICHT
Verschreibungspflichtig
enthalten in einer Gesamtprotein-Konzentration von 96-125 mg/ml
EPU. (Europäische Pharmakopoe-Einheit) entspricht 1800 KIE (Kallidinogenase-Inaktivator-Einheiten)
Die Berechnung der Thrombinaktivität erfolgt auf der Grundlage des geltenden Internationalen WHO-
Standards für Thrombin.