At Iii Nf 500
Gebrauchsinformation: Information für Anwender
AT III NF 500
Pulver und Lösungsmittel zur Herstellung einer Infusionslösung
Antithrombin vom Menschen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was in dieser Packungsbeilage steht
1. Was ist AT III NF 500 und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von AT III NF 500 beachten?
3. Wie ist AT III NF 500 anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist AT III NF 500 aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist AT III NF 500 und wofür wird es angewendet?
AT III NF 500 ist eine bröckelige bis pulvrige Substanz von blassgelber bis blassgrüner Farbe und wird zur Herstellung einer Infusionslösung in einem Lösungsmittel aufgelöst.
AT III NF 500 gehört zu einer Gruppe von Arzneimitteln, die als Gerinnungshemmer bezeichnet werden.
AT III NF 500 wird zur Behandlung von nachgewiesenem Antithrombin III-Mangel, verbunden mit akuten Makrothrombosen, Mikrothrombosen oder besonderen Thromboembolie-Risiken, speziell in folgenden Fällen eingesetzt:
1. Venöse Thrombosen und Thromboembolien bei Patienten mit pathologisch niedrigem Antithrombin III-Plasmaspiegel, z. B. nach größeren operativen Eingriffen, bei nephrotischem Syndrom oder hereditärem Antithrombin III-Mangel.
2. Gefahr einer Mikrothrombosierung der Endstrombahn durch disseminierte intravaskuläre Gerinnung wie bei septischen Erkrankungen, Polytrauma und anderen Krankheitszuständen, die mit einer akuten Ver-brauchskoagulopathie einhergehen.
3. Fehlende oder ungenügende Heparinwirkung bei nachgewiesenem Antithrombin III-Mangel, da die Wirkung des Heparins von Antithrombin III abhängt.
2. Was sollten Sie vor der Anwendung von AT III NF 500 beachten?
AT III NF 500 darf nicht angewendet werden,
- wenn Sie überempfindlich (allergisch) gegen Antithrombin III oder einen der sonstigen Bestandteile von AT III NF 500 sind.
- wenn Ihre Krankengeschichte eine sogenannte Heparin-induzierte Thrombopenie eine Verringerung der Zahl der Blutplättchen) aufweist.
Warnhinweise und Vorsichtsmaßnahmen
• Wie bei allen intravenös zu verbreichenden Proteinpräparaten können allergische Überempfindlichkeitsreaktionen auftreten (siehe Abschnitt „Nebenwirkungen“). Die Patienten müssen engmaschig überwacht und während der Infusionszeit sorgfältig auf Symptome hin beobachtet werden. Die Patienten sollten über frühe Zeichen von Überempfindlichkeitsreaktionen, wie Ausschlag, generalisierte Urtikaria informiert sein. Beim Auftreten von Schocksymptomen muss die geeignete medizinische Schockbehandlung eingeleitet werden.
• Da Antithrombin III ein Cofaktor von Heparin ist, wird bei einer kombinierten Therapie die Wirkung von Heparin durch Antithrombin III verstärkt. Dies muss bei der Dosierung von Heparin berücksichtigt werden. Um eine übermäßige Hyperkoagulabilität zu vermeiden, und um die Heparindosis anzupassen, sollten die Patienten bei einer Kombinationstherapie mit Heparin daher engmaschig überwacht werden. Es wird eine regelmäßige Kontrolle der PTT (partiellen Thromboplastinzeit) und, wenn angemessen, der Faktor IX-Aktivität empfohlen, besonders in den ersten Minuten und Stunden nach dem Beginn der AT III NF 500-Behandlung. Die Antithrombin III-Spiegel sollten täglich gemessen werden, um die individuelle Dosis festlegen zu können, besonders im Hinblick auf das Risiko eines Antithrombin III-Abfalls im Zusammenhang mit einer länger andauernden Behandlung mit unfraktioniertem Heparin.
• Aufgrund des Heparingehaltes von AT III NF 500 können selten Antikörper-vermittelte
schwereThrombozytopenien (Typ II) mit Thrombozytenwerten deutlich unter 100.000 /pl oder einem schnel-len Abfall auf weniger als 50 % des Ausgangswertes beobachtet werden.
Kontrollen der Thrombozytenzahlen sollen daher
> vor Beginn der Heparingabe
> am 1. Tag nach Beginn der Heparingabe und
> anschließend während der ersten drei Wochen und regelmäßig alle drei bis vier Tage erfolgen.
AT III NF 500 wird aus humanem Plasma hergestellt. Standardmaßnahmen zur Vorbeugung von Infektionen, die sich durch den Einsatz von Arzneimitteln ergeben, die aus Blut oder Blutplasma hergestellt sind, schließen die Auswahl der Spender und das Screening jeder Einzelspende und jedes Plasmapools auf spezifische Infektionsmarker sowie effektive Schritte zur Inaktivierung/Entfernung von Viren im Herstellungsverfahren ein. Trotz dieser Maßnahmen kann die Möglichkeit der Übertragung von Erregern bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln nicht vollständig ausgeschlossen werden. Dies gilt auch für unbekannte Viren und andere Pathogene. Die getroffenen Maßnahmen werden als wirksam erachtet für umhüllte Viren, wie das humane Immunschwächevirus (HIV), das Hepatitis B- und das Hepatitis C-Virus, und für die nicht-umhüllten Viren Hepatitis A-Virus und Parvovirus B19. Für Patienten, die regelmäßig Präparate aus menschlichem Blut oder Plasma erhalten, wird grundsätzlich eine Impfung gegen Hepatitis A und B empfohlen. Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
Dieses Arzneimittel enthält 3,77 mg Natrium pro ml. Das muss bei Patienten, die einer Natriumkontrollierten Diät unterliegen, in Betracht gezogen werden.
Die Sicherheit und Wirksamkeit von AT III NF 500 an Kindern wurde nicht untersucht.
Anwendung von AT III NF 500 zusammen mit anderen Arzneimitteln
Bitte informieren Sie Ihren Arzt, wenn Sie derzeit Heparin-haltige Arzneimittel (z. B. gegen eine Thrombose) anwenden oder vor kurzem angewendet haben. Da Antithrombin III ein Cofaktor von Heparin ist, wird bei einer kombinierten Therapie die Wirkung von Heparin durch AT III NF 500 verstärkt. Dies muss bei der Dosierung von Heparin berücksichtigt werden, um Blutungen zu vermeiden. Bei einer Kombinationstherapie mit Heparin wird daher eine regelmäßige Kontrolle der PTT (partiellen Thromboplastinzeit) bzw. Thrombinzeit und eine entsprechende Anpassung der Heparin-Dosierung empfohlen. Die Halbwertszeit von AT III NF 500 kann bei gleichzeitiger Verabreichung von Heparin durch einen erhöhten Antithrombin III-Umsatz verringert sein.
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen andere Arzneimittel anzuwenden.
Aufgrund des Heparingehaltes von AT III NF 500 kann selten ein allergisch bedingter schneller Abfall der Zahl der Blutplättchen (Thrombozytopenie Typ II) mit Werten deutlich unter 100.000/pl oder auf weniger als 50 % des Ausgangswertes beobachtet werden. Bei Patienten ohne vorbestehende Überempfindlichkeit gegen Heparin beginnt der Abfall der Zahl der Blutplättchen in der Regel 6-14 Tage nach Behandlungsbeginn. Bei Patienten mit Überempfindlichkeit gegen Heparin tritt dieser Abfall unter Umständen innerhalb von Stunden auf.
Diese schwere Form der Verminderung der Blutplättchenzahl kann verbunden sein mit Blutpfropfbildung (arteriellen und venösen Thrombosen/Thrombembolien), Gerinnungssteigerung (Verbrauchskoagulopathie), zum Teil Absterben von Hautgewebe (Hautnekrosen) an der Injektionsstelle, flohstichartigen Blutungen (Petechien) und Teerstuhl (Meläna). Bei Patienten, bei denen die genannten allergischen Reaktionen auftreten, muss AT III 500 NF 500 sofort abgesetzt werden. Bei ihnen darf auch in Zukunft kein Heparinhaltiges Arzneimittel mehr angewendet werden. Wegen der genannten gelegentlich auftretenden ungünstigen Wirkung des Heparins auf die Thrombozyten muss deren Zahl, insbesondere zu Beginn der Behandlung mit diesem Arzneimittel, engmaschig kontrolliert werden.
AT III NF 500 darf nicht mit anderen Arzneimitteln gemischt werden.
Schwangerschaft und Stillzeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen:
AT III NF 500 hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
AT III NF 500 enthält:
Die sonstigen Bestandteile sind: Glukose, Natriumchlorid, Natriumzitrat, Natriummonohydrogen-phosphat, Ammoniumsulfat und Trometamol.
Dieses Arzneimittel enthält ca. 3,77 mg Natrium pro ml. Dies ist bei Patienten, die eine natriumarme Diät einhalten müssen, zu berücksichtigen.
3. Wie ist AT III NF 500 anzuwenden?
AT III NF 500 wird ausschließlich unter ärztlicher Aufsicht angewendet. Die Dosis hängt von Ihrem Körpergewicht und Ihren Erfordernissen ab. Ihr Arzt wird die Dosis ermitteln, die Sie erhalten. AT III NF 500 wird als Infusion in eine Vene verabreicht.
Wenn Sie eine größere Menge von AT III NF 500 angewendet haben, als Sie sollten
Es wurden keine Symptome einer Überdosierung mit Antithrombin berichtet.
Welche Nebenwirkungen sind möglich?
4.
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Häufig wurden Überempfindlichkeits-oder allergische Reaktionen (die Angioödeme, Brennen und Stechen an der Injektionsstelle, Schüttelfrost, flüchtige Hautrötungen, generalisierte Urtikaria, Kopfschmerzen, Nesselsucht, niedriger Blutdruck, Lethargie, Übelkeit, Ruhelosigkeit, Tachykardie, Engegefühl in der Brust, Erbrechen, keuchende Atmung einschließen) beobachtet, die sich in einigen Fällen bis zur schweren Anaphylaxie (einschließlich Schock) entwickelt haben.
In seltenen Fällen wurde Fieber beobachtet.
Aufgrund des Heparingehaltes von AT III NF 500 können selten Antikörper-vermittelte schwere Thrombozytopenien (Typ II) mit Thrombozytenwerten deutlich unter 100.000 /pl oder einem schnellen Abfall auf weniger als 50 % des Ausgangswertes beobachtet werden.
Über die folgenden Nebenwirkungsreaktionen wurden während der Marktbeobachtungsphase berichtet. Sie sind, gemäß den MedDRA-System-Organ-Klassen (SOC), aufgeführt. Die Häufigkeit wurde nach folgenden Kriterien bewertet: Sehr häufig (>1/10); häufig (>1/100 bis <1/10); gelegentlich (>1/1.000 bis <1/100); selten (>1/10.000 bis<1/1.000); sehr selten (<1/10.000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
H |
äufigkeit der Nebenwirkungen (NW) | |
|
MedDRA-System-Organ-Klassen (SOC) |
Nebenwirkung |
Häufigkeit |
|
Erkrankungen des Nervensystems |
Tremor |
nicht bekannt |
|
Gefäßerkrankungen |
Hitzewallung |
nicht bekannt |
Für Hinweise zur Virussicherheit siehe Abschnitt 2.
5. Wie ist AT III NF 500 aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Im Kühlschrank lagern (2-8 °C). Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Sie dürfen AT III NF 500 nach dem auf dem Etikett und dem Umkarton angegebenen Verfalldatum nicht mehr anwenden.
Wenden Sie AT III NF 500 nicht an, wenn die Lösung Trübungen oder Ablagerungen aufweist.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen Was AT III NF 500 enthält
- Der Wirkstoff ist: Antithrombin III vom Menschen
- Die sonstigen Bestandteile sind: Glukose, Natriumchlorid, Natriumzitrat, Natriummonohydrogenphosphat, Ammoniumsulfat und Trometamol
- Dieses Arzneimittel enthält 3,77 mg Natrium pro ml. Dies muss bei Patienten berücksichtigt werden, die eine natriumarme Diät einhalten müssen.
Wie AT III NF 500 aussieht und Inhalt der Packung
AT III NF 500 ist ein Pulver zur Herstellung einer Infusionslösung und enthält je Durchstechflasche nominell 500 I.E aus Humanplasma gewonnenes Antithrombin.
Das Präparat enthält bei Rekonstitution mit 10 ml sterilisiertem Wasser für Injektionszwecke ca. 50 I.E./ml Antithrombin.
AT III NF 500 ist eine bröckelige bis pulvrige Substanz von blassgelber bis blassgrüner Farbe.
Ferner enthält jede Packung:
• 1 Transfernadel (Doppelkanüle)
• 1 Filternadel
Pharmazeutischer Unternehmer und Hersteller
Baxter Deutschland GmbH Edisonstraße 4 85716 Unterschleißheim Tel.: 089/31701-0
E-Mail-Adresse: info_de@baxter.com
Hersteller
Baxter AG, A-1221 Wien, Tel. 00431-20100-0 Herkunftsländer der zur Produktion verwendeten Plasmen
Deutschland, Norwegen, Österreich, Schweden, Schweiz, Tschechien und Vereinigte Staaten von Amerika.
Diese Gebrauchsinformation wurde zuletzt genehmigt im Juni 2012.
<-----------------------------------------------------------------------------------------------------------------------------
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt:
Dosierung und Art der Anwendung
Die Behandlung ist unter der Aufsicht eines mit der Behandlung des Antithrombinmangels vertrauten Arztes einzuleiten.
Dosierung
Durch Verabreichung von AT III NF 500 ist es bei entsprechender Dosierung in kurzer Zeit möglich, einen ausreichenden Antithrombin III-Spiegel im Blut des Patienten zu erreichen. Die notwendige Dosis ist abhängig von Ursache und Ausmaß des Antithrombin III-Mangels bzw. des Antithrombin III-Verbrauchs. Zur genauen Ermittlung der Dosierung ist daher in jedem Falle eine Bestimmung des Antithrombin III-Spiegels notwendig. Anzustreben ist ein Antithrombin III-Spiegel von mindestens 80 % der Norm.
Die biologische Halbwertszeit von Antithrombin III liegt bei angeborenem Antithrombin III-Mangel bei etwa 2‘A Tagen, ist aber bei erworbenem Antithrombin III-Mangel stark verkürzt und beträgt im Extremfall des akuten Verbrauchs (Verbrauchskoagulopathie) nur wenige Stunden.
Soweit nicht anders verordnet, ist in der nachstehend beschriebenen Weise zu verfahren:
1. Vcrbrauchskoagulopathic
Voraussetzung für cinc angcmcsscnc Dosierung ist die Bestimmung des Antithrombin Ill-Plasmaspiegels. Zur Dosisberechnung eignet sich folgende Richtformel:
1 I.E./kg Körpergewicht = Antithrombin III-Plasmaspiegelerhöhung von 1 %
Nachdem ein Antithrombin III-Plasmaspicgcl von mindestens 80 % der Norm erreicht ist, empfehlen sich zu seiner Aufrechterhaltung Applikationen in Abständen von 4-6 Stunden. Dabei sollte der Antithrombin III-Plasmaspicgcl mehrmals am Tage kontrolliert werden.
2. Sonstige Antithrombin III-Mangclzuständc
Als ungefähre Richtlinie kann gelten, dass initial 1500 I.E. und anschließend die Hälfte der Initialdosis in 8-bis 24-stündigen Abständen zu applizieren sind. Zur Ermittlung der exakten Dosis ist jedoch die Kontrolle des Antithrombin III-Plasmaspicgcls unerlässlich.
Im Hinblick auf die Dosisbcrcchnung kann man sich der folgenden Richtformel bedienen:
1 I.E./kg Körpergewicht = Antithrombin III-Plasmaspicgclcrhöhung von etwa 2 %
Kinder und Jugendliche
Es liegen nicht genug Daten vor, um die Anwendung von AT III NF 500 bei Kindern im Alter von unter 6 Jahren empfehlen zu können.
Art der Anwendung
Nach dem Auflösen der Trockensubstanz in dem bcigcpacktcn Wasser für Injcktionszwcckc (Aqua ad injec-tabilia) wird AT III NF 500 intravenös injiziert.
Die Injektionsgeschwindigkeit darf höchstens 5 ml pro Minute betragen.
AT III NF 500 wird in lyophilisiertem Zustand gelagert und soll unmittelbar vor der Applikation aufgelöst werden. Die Lösung muss dann sofort verwendet werden. Angebrochene Flaschen dürfen nicht mehr verwendet werden.
Hinweise zur Anwendung
AT III NF 500 enthält keine Konservierungsmittel. Daher sollte cs erst unmittelbar vor der Anwendung rekonstituiert werden. Es sollte nur das bcigcpacktc Infusions-Set verwendet werden. Der gesamte Rckon-stitutionsprozess sollte unter aseptischen Bedingungen erfolgen und die Lösung sollte dann unmittelbar vcrbraucht werden.
Das rekonstituierte Arzneimittel sollte vor der Verabreichung visuell auf Partikel und Verfärbungen geprüft werden. Die Lösung sollte klar bis leicht opaleszent sein. Keine Lösungen verwenden, die trübe sind oder Ablagerungen aufweisen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Rekonstitution der Trockensubstanz
1. Lösungsmittel in der Flasche erwärmen (auf Raumtemperatur, höchstens auf 37 °C).
2. Schutzkappen von den Flaschen mit Trockensubstanz und Lösungsmittel entfernen (Abb. A) und die Gummistopfen beider Flaschen desinfizieren. In der Mitte der Gummistopfen ist ein kreisförmiger Bezirk abgegrenzt. Dieser Bezirk ist für das Einstcchcn der im Folgenden erwähnten Kanülen bestimmt, wobei diese senkrecht zu halten sind.
3. Die beigepackte Transferkanüle (Doppelkanüle/Transfemadel) ist durch 2 Kunststoffkappen geschützt, welche durch einen "Schweißpunkt" versiegelt sind. Durch Drehen den Schweißpunkt sprengen (Abb. B) und eine Kappe abziehen. Die freigelegte Kanüle in den Gummistopfen der Lösungsmittelflasche einstechen.(Abb. C).
4. Andere Kunststoffkappe der Transferkanüle abziehen. Freies Kanülenende nicht berühren!
5. Lösungsmittelflasche umdrehen und das Ende der aufgesetzten Transferkanüle bis zur halben Kanülenlänge in den Gummistopfen der Trockensubstanzflasche einstechen (Abb. D). Durch das in der Trockensubstanzflasche bestehende Vakuum wird das Lösungsmittel angesaugt.
6. Lösungsmittelflasche samt Kanüle von der Trockensubstanzflasche abziehen (Abb. E). Lösungsvorgang durch Schwenken der Trockensubstanzflasche beschleunigen.
7. Beigepackte Filterkanüle (Filternadel) auf eine Einmalspritze setzen und in den Gummistopfen einstechen (Abb. F).
8. Durch zwischenzeitliches Abziehen der Spritze von der Filterkanüle wird die Trockensubstanzflasche belüftet, wodurch eventuell entstandener Schaum zusammenfällt (Abb. G). Daraufhin die Injektionslösung durch die Filterkanüle in die Spritze aufziehen.
9. Anschließend Spritze von der Filterkanüle abziehen, eine Einmalkanüle auf die Spritze setzen und sofort intravenös injizieren (höchstens 5 ml pro Minute).
Bei der Anwendung einer anderen Auflösungsmethode ist bei der Injektion ein Filter vorzuschalten, um zu verhindern, dass noch ungelöste Partikel (wenn die Lösung in Notfällen rasch zur Verfügung stehen muss) oder aus dem Stopfen gestochene Gummipartikel mit der Arzneimittellösung verabreicht werden (Gefahr von Mikroembolien).

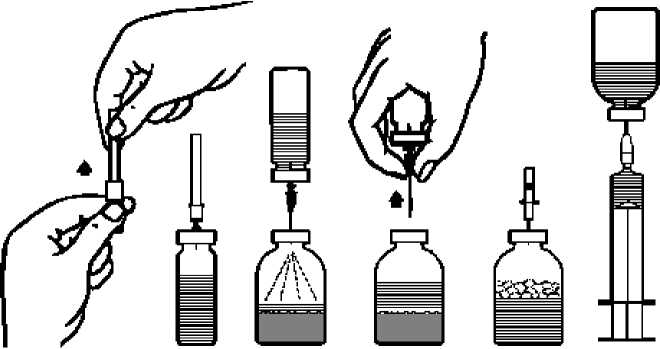
Abb. B Abb. C Abb. D Abb. E
Abb. F Abb. G
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Wie bei allen intravenös zu verabreichenden Proteinpräparaten sind allergische Überempfindlichkeitsreaktionen möglich. Die Patienten müssen engmaschig überwacht werden und während der Infusionszeit sorgfältig auf Symptome hin beobachtet werden. Die Patienten sollten über frühe Zeichen von Überempfindlichkeitsreaktionen, wie Ausschlag, generalisierte Urtikaria, Engegefühl in der Brust, Giemen, Hypotonie und Anaphylaxie informiert werden. Wenn eines dieser Symptome auftritt, sollte der Patient den Arzt informieren.
Bei Auftreten von Schocksymptomen muss die geeignete medizinische Schockbehandlung eingeleitet werden.
8