Atehexal Comp.
F achinformation
1. BEZEICHNUNG DER ARZNEIMITTEL
AteHEXAL® comp mite, 50 mg/12,5 mg Filmtabletten AteHEXAL® comp, 100 mg/25 mg Filmtabletten
Wirkstoffe: Atenolol und Chlortalidon
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
AteHEXAL comp mite
1 Filmtablette enthält: Atenolol 50 mg, Chlortalidon 12,5 mg AteHEXAL comp
1 Filmtablette enthält: Atenolol 100 mg, Chlortalidon 25 mg Sonstiger Bestandteil: Lactose-Monohydrat
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtabletten
Weiße, runde Filmtablette mit einer einseitigen Bruchkerbe.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiet
Hypertonie
AteHEXAL comp/- comp mite ist indiziert bei Patienten, deren Blutdruck mit Atenolol oder Chlortalidon allein nicht ausreichend gesenkt werden konnte.
4.2 Dosierung und Art der Anwendung
Grundsätzlich sollte die Behandlung des Bluthochdrucks mit einem Einzelwirkstoff in niedriger Dosierung (einschleichend) begonnen werden.
Die Gabe der fixen Kombination AteHEXAL comp/- comp mite wird erst nach vorangegangener individueller Dosiseinstellung (Dosistitration) mit den Einzelsubstanzen (d. h. Atenolol und Chlortalidon) empfohlen. Wenn klinisch vertretbar, kann, bei Patienten deren Blutdruck nicht ausreichend unter Kontrolle ist, eine direkte Umstellung von der Monotherapie auf die fixe Kombination in Erwägung gezogen werden.
Erwachsene
AteHEXAL comp mite
Die übliche Dosierung beträgt bei Patienten, für die eine Kombinationsbehandlung angezeigt ist, 1-mal täglich 50 mg Atenolol/12,5 mg Chlortalidon (entsprechend 1 Filmtablette AteHEXAL comp mite).
Bei Patienten die nicht ausreichend auf AteHEXAL comp mite reagieren, kann die Dosis auf eine Tablette AteHEXAL comp erhöht werden.
AteHEXAL comp
Die übliche Dosierung beträgt bei Patienten, für die eine Kombinationsbehandlung angezeigt ist, 1-mal täglich 1 Filmtablette AteHEXAL comp (entsprechend 100 mg Atenolol/25 mg Chlortalidon).
Wenn es notwendig ist, kann zusätzlich ein weiteres blutdrucksenkendes Medikament, z.B. ein Medikament zur Blutgefäßerweiterung, eingenommen werden.
Besondere Patientengruppen
Ältere Patienten:
In dieser Altersgruppe sind die notwendigen Dosierungen in vielen Fällen geringer.
Kinder und Jugendliche (jünger als 18 Jahre):
Es gibt keine Erfahrungen bei der Behandlung von Kindern und Jugendlichen mit AteHEXAL comp/- comp mite.Aus diesem Grunde sollte AteHEXAL comp/- comp mite Kindern und Jugendlichen nicht verabreicht werden.
Patienten mit eingeschränkter Nierenfunktion:
Aufgrund der Eigenschaften des Wirkstoffes Chlortalidon ist die Wirkung von AteHEXAL comp/- comp mite bei Patienten mit Niereninsuffizienz vermindert. Aus diesem Grunde sollte die fixe Kombination bei Patienten mit stark eingeschrä nkter Nierenfunktion nicht verabreicht werden (siehe Abschnitt 4.3).
Patienten mit eingeschränkter Leberfunktion:
Eine Dosisanpassung ist bei Patienten mit eingeschränkter Leberfunktion nicht notwendig, bei schweren Leberfunktionsstörungen ist die Gabe von AteHEXAL comp/- comp mite nicht angezeigt (siehe Abschnitt 4.3).
Art der Anwendung
Das Arzneimittel wird mit ausreichend Flüssigkeit unzerkaut vor der Mahlzeit eingenommen. Dauer der Anwendung
Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Eine Unterbrechung oder Beendigung der Behandlung darf nur auf ärztliche Anordnung erfolgen.
Ein Absetzen der Therapie mit AteHEXAL comp/- comp mite sollte besonders bei Patienten mit Erkrankungen der Herzkranzgefäße nicht abrupt, sondern ausschleichend erfolgen.
4.3 Gegenanzeigen
AteHEXAL comp/- comp mite darf nicht eingenommen werden bei
• Überempfindlichkeit gegen die Wirkstoffe, andere Beta-Rezeptorenblocker andere Thiazide oder Sulfonamide (mögliche Kreuzreaktion beachten) oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• unkontrollierter Herzinsuffizienz
• akutem Herzinfarkt
• kardiogenem Schock
• AV-Block 2. oder 3. Grades
• Sinusknoten-Syndrom (sick sinus syndrome)
• sinuatrialem Block
• Bradykardie (Ruhepuls kleiner als 50 Schläge pro Minute vor Behandlungsbeginn)
• Hypotonie
• metabolischer Azidose
• bronchialer Hyperreagibilität (z. B. bei Asthma bronchiale)
• schweren peripheren arteriellen Durchblutungsstörungen
• gleichzeitiger Gabe von MAO-Hemmstoffen (Ausnahme MAO-B-Hemmstoffe)
• schweren Nierenfunktionsstörungen (Niereninsuffizienz mit Oligurie oder Anurie; Krea-tinin-Clearance kleiner als 30 ml/min und/oder Serum-Kreatinin über 1,8 mg/100 ml)
• unbehandeltem Phäochromozytom
• schweren Leberfunktionsstörungen (einschließlich Coma hepaticum)
• klinisch relevanten Elektrolytstörungen (Hypokaliämie, Hyponatriämie, Hyperkalziämie)
• Gicht
• Kindern (mangels ausreichender Erfahrungen)
• Schwangerschaft
• Stillzeit.
Die intravenöse Applikation von Calciumantagonisten vom Verapamil- und Diltiazem-Typ oder anderen Antiarrhythmika (wie Disopyramid) bei Patienten, die mit AteHEXAL comp/-comp mite behandelt werden, ist kontraindiziert (Ausnahme Intensivmedizin).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei:
• AV-Block 1. Grades, da die Betarezeptorenblocker-Komponente negativen Einflusses auf die Impulse Überleitungszeit haben kann
• Diabetikern mit stark schwankenden Blutzuckerwerten (wegen möglicher schwerer hy-poglykämischer Zustände; die Symptome einer Hypoglykämie wie Tachykardie, Herzklopfen oder Schweißausbrüche können maskiert werden)
• längerem strengen Fasten oder schwerer körperlicher Belastung (wegen möglicher schwerer hypoglykämischer Zustände)
• Patienten mit Phäochromozytom (Nebennierenmarktumor; vorherige Therapie mit AlphaRezeptorenblockern erforderlich), der Blutdruck sollte engmaschig überwacht werden
• Patienten, die gleichzeitig mit Digitalispräparaten, Glukokortikoiden oder Laxantien behandelt werden
• eingeschränkter Leberfunktion
• eingeschränkter Nierenfunktion leichteren Grades
• Psoriasis in der Eigen- oder Familienanamnese
• Prinzmetal-Angina (verstärkte Angina-pectoris-Anfälle).
Die systemische Wirkung oraler Betarezeptorenblocker kann bei gleichzeitiger Anwendung ophthalmischer Betarezeptorenblocker verstärkt werden.
Die Verordnung von Betarezeptorenblockern sollte nur nach sorgfältiger Nutzen-RisikoAbwägung erfolgen bei Patienten mit einer Psoriasis in der Eigen- oder Familienanamnese und bei Patienten mit Prinzmetal-Angina, da, aufgrund ungehinderter Alpha- Rezeptor vermittelter Gefäßverengungen der Herzkranzgefäße, vermehrt z. T. verstärkte Angina-pectoris-Anfälle auftreten können. Atenolol ist ein Beta-1-selektiver Betarezeptorenblocker; folglich kann der Gebrauch von AteHEXAL comp/- comp mite erwogen werden, obwohl äußerste Vorsicht gewahrt werden muss.
Beta-Rezeptorenblocker können die Empfindlichkeit gegenüber Allergenen und die Schwere anaphylaktischer Reaktionen erhöhen. Deshalb ist eine strenge Indikationsstellung bei Patienten mit schweren Überempfindlichkeitsreaktionen in der Vorgeschichte und bei Patienten unter Desensibilisierungstherapie (z.B. gegen Insektengifte) geboten (Vorsicht, überschießende anaphylaktische Reaktionen). Diese Patienten sprechen eventuell auf die üblichen Adrenalindosen zur Behandlung der allergischen Reaktionen nicht an.
Leichtere periphere Durchblutungsstörungen können durch die Anwendung von Betarezepto-renblockem verschlimmert werden.
Betarezeptorenblocker können die Anzeichen einer Thyreotoxikose maskieren.
Die Herzfrequenz wird durch die Anwendung von Betarezeptorenblockern reduziert. In dem seltenen Fall, dass ein Patient klinische Symptome entwickelt, die auf einer langsamen Herzfrequenz beruhen, kann die Dosis reduziert werden.
Betarezeptorenblocker sollten nicht abrupt abgesetzt werden, wenn der Patient an einer ischämischen Herzerkrankung leidet.
Obwohl AteHEXAL comp/- comp mite bei unkontrollierter Herzinsuffizienz kontraindiziert ist (siehe Abschnitt 4.3), kann die Gabe bei Patienten mit kontrollierten Anzeichen von Herzinsuffizienz angezeigt sein. Vorsicht ist bei Patienten mit geringer Herzreserve geboten.
Bei Patienten mit obstruktiven Atemwegserkrankungen kann es auch bei Anwendungen eines kardioselektiven Betarezeptorenblockers wie Atenolol zur Beeinflussung des Atemwegswiderstandes kommen (Atenolol ist ein Beta-1-selektiver Betarezeptorenblocker, wobei die Selektivität nicht absolut ist). Die Anwendung sollte bei Patienten mit obstruktiven Atemwegserkrankungen daher nicht generell erfolgen. Die geringste mögliche Dosis von AteHEXAL comp/-comp mite sollte mit besonderer Vorsicht eingenommen werden. Wenn eine Erhöhung des Atemwegswiderstandes auftritt, sollte AteHEXAL comp/- comp mite abgesetzt werden. Eventuelle Bronchospasmen können - wirksamer als bei nichtselektiven Betarezeptorenblockern -mit den üblichen Bronchodilatatoren wie Salbutamol oder Fenoterol rasch aufgehoben werden. Besondere Vorsicht ist bei der gleichzeitigen Verwendung von Anästhetika und AteHEXAL comp/- comp mite geboten. Der Anästhesist sollte über die Einnahme von AteHEXAL comp/-comp mite informiert werden. Bei der Wahl des Anästhetikums sollte ein Mittel mit so geringer negativer inotroper Aktivität wie möglich gewählt werden. Der Einsatz von Betarezeptorenblockern zusammen mit Anästhetika kann zur Abschwächung der Reflextachykardie führen und das Risiko von Hypotension vergrößern. Anästhetika, die eine Schädigung der Herzmuskelzellen hervorrufen, sollten vermieden werden. Aufgrund der Chlortalidonkomponente sollten in passenden Abständen die Plasmaelektrolyte regelmäßig untersucht werden, um mögliche Elektrolytschwankungen, besonders Hypokaliämie und Hyponatriämie, zu entdecken. Hypoka-liämie und Hyponatriämie können auftreten. Eine Kontrolle des Elektrolytspiegels ist angebracht, insbesondere bei älteren Patienten, bei Patienten, die Digitalis einnehmen, eine kaliumarme Diät einhalten oder unter gastrointestinalen Beschwerden leiden. Eine Hypokaliämie kann bei Patienten, die mit Digitalis behandelt werden, Arrhythmien hervorrufen.
Der Einfluss von Atenolol als ausgeprägt kardioselektivem Betarezeptorenblocker auf den Blutglukosespiegel ist gering. Unter Chlortalidon kann es, wie bei jedem Thiaziddiuretikum, zur Erhöhung des Blutzuckerspiegels kommen. In den bisher vorliegenden Untersuchungen mit AteHEXAL comp/- comp mite wurden keine signifikanten Änderungen des Blutglukosespiegels bei Patienten ohne KH-Stoffwechselstörungen beobachtet. Die Verabreichung von Chlor-talidon an Patienten, die eine bekannte Prädisposition für eine Diabetes-mellitus-Erkrankung haben, muss mit Vorsicht erfolgen. Diabetes-mellitus Patienten müssen mit einem möglichen Anstieg des Blutglukosespiegels rechnen. Eine enge Kontrolle des Blutzuckers ist in der Anfangsphase der Therapie erforderlich. Bei anhaltender Therapie sollte die Glucosurie in regelmäßigen Abständen untersucht werden.
Chlortalidon kann, wie andere Thiaziddiuretika, zu einer Erhöhung der Harnsäurewerte führen. Dieser Effekt ist dosisabhängig und kann durch Anwendung niedriger Chlortalidonmengen, wie sie in AteHEXAL comp/- comp mite enthalten sind, minimal gehalten werden. Die gleichzeitige Gabe eines harnfördernden Medikamentes kehrt die Erhöhung der Harns äurewerte wiederum. Zur Kontrolle sollten gelegentlich Messungen des Harnsäurespiegels durchgeführt werden.
Bei Patienten mit eingeschränkter Leberfunktion oder progressiver Lebererkrankung können kleine Änderungen im Flüssigkeits- und Elektrolythaushalt ein hepatisches Koma hervorrufen.
Die Anwendung von AteHEXAL comp/- comp mite kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Eine missbräuchliche Anwendung des Arzneimittels AteHEXAL comp/- comp mite zu Dopingzwecken kann die Gesundheit gefährden.
Diese Arzneimittel enthalten Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten AteHEXAL comp/-comp mite nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen sind beschrieben worden:
Beeinflussung der Wirkung nachfolgend genannter Arzneistoffe bzw. Präparategruppen:
• orale Antidiabetika (z. B. Sulfonylharnstoffe/Biguanide), Insulin: Verstärkung des blutzuckersenkenden Effektes, Warnzeichen einer Hypoglykämie - insbesondere Tachykardie und Tremor - sind verschleiert oder abgemildert.
• harnsäuresenkende Arzneimittel: Deren Wirkung kann abgeschwächt sein.
• Digitalisglykoside: Verlängerung der AV-Überleitungszeit; Wirkungen und Nebenwirkungen von Digitalisglykosiden können bei Hypokaliämie und Hypomagnesiämie verstärkt werden.
• hochdosiertes Salicylat: Verstärkung der toxischen Wirkung auf das zentrale Nervensystem.
• Muskelrelaxanzien vom Curaretyp: Verstärkung und Verl ängerung der muskelrelaxieren-den Wirkung (Information des Anästhesisten über die Therapie mit AteHEXAL comp/-comp mite).
• Lithium: Erhöhung der Serumlithiumkonzentration (regelmäßige Kontrolle!), somit Verstärkung der kardio- und neurotoxischen Wirkung von Lithium.
• kaliuretische Arzneimittel (z. B. Furosemid), Glukokortikoide, ACTH, Carbenoxolon, Amphotericin B oder Abführmittel: erhöhte Kaliumverluste und/oder Magnesiumverluste.
• Vitamin D, Kalziumsalze: Anstieg des Serumkalziums.
• Zytostatika (z. B. Cyclophosphamid, Fluoruracil, Methotrexat): verstärkte Knochenmarkstoxizität (insbesondere Granulozytopenie).
Verstärkung der antihypertensiven Wirkung bzw. Erhöhung des Nebenwirkungsrisikos:
• andere Antihypertensiva, Diuretika, Vasodilatatoren, Barbiturate, Phenothiazine, trizyklische Antidepressiva, Alkohol.
• ACE-Hemmer (z. B. Captopril, Enalapril): zu Behandlungsbeginn Risiko eines massiven Blutdruckabfalls.
• Calciumantagonisten vom Nifedipintyp: verstärkte Blutdrucksenkung, in Einzelfällen Ausbildung einer Herzinsuffizienz.
• Calciumantagonisten mit negativ inotroper Wirkung vom Verapamil- oder Diltiazemtyp: schwere Hypotonie, Bradykardie, Herzrhythmusstörungen und Herzversagen. Diese Calciumantagonisten dü rfen frühestens 48 Stunden nach dem Absetzen von AteHEXAL comp/-comp mite verabreicht werden (siehe auch Abschnitt 4.3).
• Klasse-I-Antiarrhythmika (z. B. Disopyramid) und Amiodaron: die Wirkung auf die atrioventrikuläre Überleitungszeit kann potenziert und eine negativ inotrope Wirkung kann induziert werden.
• Reserpin, Alpha-Methyldopa, Guanfacin oder Clonidin: neben Verstärkung der antihypertensiven Wirkung auch Bradykardie.
• Baclofen: die Verstärkung der antihypertensiven Wirkung kann eine Dosisanpassung notwendig machen.
• Narkotika, Anästhetika: verstärkter Blutdruckabfall, Verstärkung der negativ inotropen Wirkung. (Information des Anästhesisten über die Therapie mit AteHEXAL comp/- comp mite: Das Anästhetikum der Wahl sollte so wenig negativ inotrop wie möglich sein. Die gleichzeitige Anwendung von Betarezeptorenblockern und Anästhetika kann die reflektorische Tachykardie abschwächen und das Risiko der Hypotonie erhöhen. Anästhetika mit einer depressiven Wirkung auf das Herz sollten vermieden werden.)
Abschwächung der antihypertensiven Wirkung:
• Analgetika, nichtsteroidale Antiphlogistika (z. B. Salicylsäurederivate, Indometacin, Ibuprofen): Abschwächung der blutdrucksenkenden Wirkung, in Einzelfällen Verschlechterung der Nierenfunktion.
• Sympathomimetika (z. B. Adrenalin) können dem Effekt von Betarezeptorenblockern entgegenwirken.
• Cholestyramin oder Colestipol: verminderte Resorption von AteHEXAL comp/- comp mite.
• Norepinephrin, Epinephrin: beträchtlicher Blutdruckanstieg möglich.
• Monoaminooxidase (MAO)-Hemmer (Ausnahme: MAO-B-Hemmer): überschießender Bluthochdruck.
• Clonidin: überschießender Blutdruckanstieg (hypertensive Krise) beim Absetzen von Clonidin, wenn nicht zuvor AteHEXAL comp/- comp mite abgesetzt wurde. Behandlung mit AteHEXAL comp/- comp mite erst mehrere Tage nach dem Absetzen von Clonidin beginnen.
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
AteHEXAL comp/- comp mite darf in der Schwangerschaft nicht angewendet werden (siehe Abschnitt 5.3.).
Stillzeit
In der Stillzeit ist AteHEXAL comp/- comp mite kontraindiziert, da beide Wirkstoffe in erheblichen Mengen in die Muttermilch übergehen und mit pharmakologischen Wirkungen beim Säugling zu rechnen ist.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Behandlung des Bluthochdrucks mit diesem Arzneimittel bedarf der regelmäßigen ärztlichen Kontrolle. Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen soweit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird (gelegentlich können Schwindel und Erschöpfung auftreten). Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.00 bis < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Blutes und des Lymphsystems Selten • Anämie
Thrombozytopenie
• Leukopenie (durch Chlortalidon)
• Purpura
Sehr selten
• Agranulozytose
Psychiatrische Erkrankungen
Gelegentlich
• Schlafstörungen der Art, wie sie auch bei anderen Betarezeptorenblockern beobachtet werden
• Alpträume
• verstärkte Traumaktivität
• depressive Verstimmungen
• Verwirrtheit
• Psychosen
• Halluzinationen
Selten
• Stimmungsschwankungen
Erkrankungen des Nervensysteme
Gelegentlich
• Schwindel
• Kopfschmerzen
• Parästhesien
• Schwitzen
• Benommenheit
Augenerkrankungen
Selten:
• Trockene Augen (dies ist beim Tragen von Kontaktlinsen zu beachten)
• Sehstörungen (z.B. verschwommenes Sehen)
• Konjunktivitis
Nicht bekannt:
• Eine bestehende Kurzsichtigkeit kann sich verschlimmern.
Herzerkrankungen
Häufig:
• Bradykardie
Gelegentlich:
• atrioventrikuläre Überleitungsstörungen
• Verstärkung einer Herzinsuffizienz
• Herzklopfen
• Herzblock
Sehr selten:
• bei Patienten mit Angina pectoris ist eine Verstärkung der Anfälle nicht auszuschließen
Gefäßerkrankungen
Häufig:
Gelegentlich:
• Hypotonie
• Synkopen
• orthostatische Regulationsstörungen
Selten:
• Verstärkung einer bereits vorhandenen Claudicatio intermittens ist möglich,
• Raynaud-Syndrom bei anfälligen Patienten,
• Vaskulitis
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Selten:
• Bronchospasmen können auftreten bei Patienten mit Bronchialasthma oder asthmatischen Beschwerden in der Vorgeschichte
Sehr selten:
• Plötzlich auftretendes Lungenödem durch Idiosynkrasie
Erkrankungen des Gastrointestinaltrakts
Häufig:
• Magen-Darm-Beschwerden (Erbrechen, Schmerzen und Krämpfe im Bauchraum, Obstipation, Diarrhoe, Übelkeit durch Chlortalidon)
Gelegentlich:
• Mundtrockenheit
Nicht bekannt:
• Obstipation
Leber- und Gallenerkrankungen
Selten:
• Lebertoxizität inklusive intrahepatische Cholestase in der Leber
• cholestatischer Ikterus (Gelbsucht)
• Pankreatitis durch Chlortalidon
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich:
• allergische Hautreaktionen wie Erythem, Pruritus, photoallergisches Exanthem, Purpura, Urticaria und Arzneimittelfieber
Selten:
• Alopezie
• psoriasisforme Exantheme
• Verschlechterung der Symptome einer Psoriasis
• Hautausschläge
Sehr selten:
• Auslösen einer Psoriasis
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich:
• Muskelschwäche
Muskelkrämpfe
Erkrankungen der Nieren und Harnwege
Selten:
• akute interstitielle Nephritis
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Selten:
• Potenzstörungen
Sehr selten:
• Störungen der Libido
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig:
• Müdigkeit
Gelegentlich:
• Durst
• Schwächegefühl
Untersuchungen
Häufig:
• Störungen im Flüssigkeits- und Elektrolythaushalt bei langfristiger kontinuierlicher Anwendung von AteHEXAL comp/- comp, insbesondere Hypokaliämie und Hyponatriämie, ferner Hypomagnesiämie und Hypochlorämie sowie Hyperkalzämie
• Hyperurikämie (dies kann bei prädisponierten Patienten zu Gichtanfällen führen)
• verminderte Glucosetoleranz
• Hyperglykämie und Glukosurie bei Stoffwechselgesunden, bei Patienten mit latentem oder manifestem Diabetes mellitus
• Bei Patienten mit manifestem Diabetes mellitus kann es zu einer Verschlechterung der Stoffwechsellage kommen.Ein latenter Diabetes mellitus kann in Erscheinung treten.
Gelegentlich:
• Erhöhte Transaminasespiegel
• Hypermagnesiurie (sie äußert sich nicht immer als Hypomagnesiämie, weil Magnesium aus dem Knochen mobilisiert wird)
• Reversibler Anstieg der harnpflichtigen Substanzen (Kreatinin, Harnstoff) im Serum
Selten:
• Erhöhte Amylasewerte im Blut
Sehr selten:
• Anstieg der antinukleären Antikörper, die klinische Bedeutung ist jedoch unklar
Besondere Hinweise
Begleiterscheinungen wie Mundtrockenheit und Durst, Schwäche - und Schwindelgefühl, Herzklopfen, Hypotonie und orthostatische Beschwerden sind auf eine verstärkte Diurese zurückzuführen.
Betarezeptorenblocker können die Empfindlichkeit gegenüber Allergenen und die Schwere anaphylaktischer Reaktionen erhöhen. Bei Patienten mit schweren Überempfindlichkeitsreaktionen in der Vorgeschichte und bei Patienten unter Desensibilisierungstherapie kann es daher zu überschießenden anaphylaktischen Reaktionen kommen.
Eine Verstärkung der Beschwerden bei Patienten mit peripheren Durchblutungsstörungen (einschließlich Patienten mit Raynaud-Syndrom) wurde beobachtet.
Infolge einer möglichen Erhöhung des Atemwegswiderstandes kann es bei Patienten mit Neigung zu bronchospastischen Reaktionen (insbesondere bei obstruktiven Atemwegserkrankungen) zu Atemnot kommen.
Nach längerem strengen Fasten oder schwerer körperlicher Belastung kann es bei gleichzeitiger Therapie mit AteHEXAL comp/- comp mite zu hypoglykämischen Zuständen kommen. Warnzeichen einer Hypoglykämie (insbesondere Tachykardie und Tremor) können verschleiert werden.
Es kann unter der Therapie mit AteHEXAL comp/- comp mite zu Störungen im Fettstoffwechsel kommen. Ein Anstieg der Serumlipide (Cholesterin, Triglyzeride) kann auftreten.
Bei Patienten mit Hyperthyreose können unter der Therapie mit AteHEXAL comp/- comp mite die klinischen Zeichen einer Thyreotoxikose (z.B. Tachykardie, Tremor) verschleiert werden.
Infolge einer Hypokaliämie können Müdigkeit, Schläfrigkeit, Muskelschwäche, Parästhesien, Paresen, Apathie oder Herzrhythmusstörungen auftreten. Schwere Kaliumverluste können zu einem Subileus bis hin zu einem paralytischen Ileus oder zu Bewusstseinsstörungen bis hin zum Koma führen, EKG-Veränderungen und gesteigerte Glykosidempfindlichkeit können auftreten.
Als Folge der Elektrolyt- und Flüssigkeitsverluste kann sich eine metabolische Alkalose entwickeln bzw. eine bereits bestehende metabolische Alkalose verschlechtern.
Wegen des Auftretens schwerer Leberschäden sollten unter der Therapie mit AteHEXAL comp/- comp mite in regelmäßigen Abständen die Leberwerte überprüft werden.
Während der Behandlung mit AteHEXAL comp/- comp mite sollten die Patienten auf eine ausreichende Flüssigkeitsaufnahme achten und wegen des Kaliumverlustes kaliumreiche Nahrungsmittel zu sich nehmen (Bananen, Gemüse, Nüsse).
Während der Therapie mit AteHEXAL comp/- comp mite sollten die Serumelektrolyte (insbesondere Kalium-, Natrium-, Kalziumionen), Kreatinin und Harnstoff, die Serumlipide (Cholesterin und Triglyzeride), Harnsäure sowie der Blutzucker regelmäßig kontrolliert werden.
Das Absetzen von Atenolol/Chlortalidon sollte in Betracht gezogen werden, falls nach klinischer Beurteilung das Wohlbefinden des Patienten durch eine der o. g. Reaktionen nachteilig beeinflusst wird.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem BfArM anzuzeigen:
Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn Website: www.bfarm.de
Symptome einer Überdosierung
Atenolol
Das klinische Bild ist in Abhängigkeit vom Ausmaß der Intoxikation im Wesentlichen von kardiovaskulären und zentralnervösen Symptomen geprägt. Überdosierung kann zu schwerer Hypotonie, Bradykardie bis zum Herzstillstand, Herzinsuffizienz und kardiogenem Schock führen. Zusätzlich können Atembeschwerden, Bronchospasmen, Erbrechen, Bewusstseinsstörungen, gelegentlich auch generalisierte Krampfanfälle auftreten.
Chlortalidon
Die Intoxikation mit einem Thiaziddiuretikum ist abhängig vom Ausmaß des Flüssigkeits- und Elektrolytverlustes. Bei ausgeprägten Flüssigkeits- und Natriumverlusten können Schwäche-und Schwindelgefühl, Muskelkrämpfe, Tachykardie, Hypotonie und orthostatische Regulationsstörungen auftreten. Dehydratation und Hypovolämie können zu Hämokonzentration, zu Konvulsionen, Verwirrtheitszuständen, Kreislaufkollaps und zu einem akuten Nierenversagen führen. Infolge einer Hypokaliämie kann es zu Herzrhythmusstörungen kommen. Schwere Kaliumverluste können zu einem paralytischen Ileus oder zu Bewusstseinsstörungen bis zum hypokaliämischen Koma führen.
Therapiemaßnahmen bei Überdosierung
Bei Anzeichen einer Überdosierung muss die Behandlung mit AteHEXAL comp/-comp mite umgehend abgebrochen werden.
Neben allgemeinen Maßnahmen der primären Giftelimination müssen unter intensivmedizinischen Bedingungen die vitalen Parameter überwacht und gegebenenfalls korrigiert werden.
Therapeutische Maßnahmen bei Überdosierung des Beta-Rezeptorenblockers:
Bei bedrohlichem Abfall von Blutdruck und Puls:
Atropin: 0,5-2,0 mg i.v. als Bolus
Glukagon: initial 1-10 mg i.v. anschließend 2-2,5 mg/ Std. als Dauerinfusion
Sympathomimetika in Abhängigkeit von Körpergewicht und Effekt:
Dopamin, Dobutamin, Isoprenalin, Orciprenalin und Epinephrin.
Bei therapierefraktärer Bradykardie sollte eine temporäre Schrittmachertherapie durchgeführt werden.
Bei Bronchospasmus können Beta-2-Sympathomimetika als Aerosol (bei ungenügender Wirkung auch intravenös) oder Aminophyllin i.v. gegeben werden.
Bei generalisierten Krampfanfällen empfiehlt sich die langsame intravenöse Gabe von Diazepam.
Atenolol ist dialysierbar.
Therapeutische Maßnahmen bei Überdosierung des Thiaziddiuretikums bei
• Hypovolämie: Volumensubstitution
• Hypokaliämie: Kaliumsubstitution
• Kreislaufkollaps: Schocklagerung, gegebenenfalls Schocktherapie.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Betarezeptorenblocker und Diuretikum
ATC-Code: C07BB03
AteHEXAL comp/- comp mite ist ein Kombinationspräparat mit Atenolol und Chlortalidon als wirksame Bestandteile.
Atenolol
Atenolol ist ein hydrophiler Beta-Rezeptorenblocker mit relativer ß1-Selektivität („Kardiose-lektivität“), ohne intrinsische sympathomimetische Aktivität (ISA) und ohne membranstabilisierende Wirkung.
Die Substanz senkt in Abhängigkeit von der Höhe des Sympathikotonus die Frequenz und die Kontraktionskraft des Herzens, die AV-Überleitungsgeschwindigkeit und die Plasma-Renin-Aktivität. Atenolol kann durch Hemmung von ß2-Rezeptoren eine Erhöhung des Tonus der glatten Muskulatur bewirken.
Chlortalidon
Chlortalidon ist ein Benzothiadiazin-Derivat mit langanhaltender Wirksamkeit.
Thiazide wirken direkt an den Nieren, indem sie die Natriumchlorid- und die damit verbundene Wasserausscheidung vermehren. Ihr klinisch relevanter Hauptangriffsort ist der frühdistale Tubulus. Dort hemmen sie den elektroneutralen Na-Cl-Cotransport in der luminalen Zellmembran. Kalium und Magnesium werden vermehrt ausgeschieden, Kalzium wird vermindert ausgeschieden.
Durch hohe Chlortalidon-Dosen kann Bikarbonat infolge einer Hemmung der Karboanhydrata-se vermehrt ausgeschieden werden, so dass der Urin alkalisiert wird.
Durch Azidose oder Alkalose wird die saluretische bzw. diuretische Wirkung des Chlor-talidons nicht wesentlich beeinflusst.
Während der Langzeittherapie mit Chlortalidon wird die Kalziumausscheidung über die Niere reduziert, so dass eine Hyperkalzämie resultieren kann.
Als Mechanismen der antihypertensiven Wirkung von Chlortalidon werden ein veränderter Natriumhaushalt, eine Reduktion des extrazellulären Wasser- und Plasmavolumens, eine Änderung des renalen Gefäßwiderstandes sowie eine reduzierte Ansprechbarkeit auf Norepinephrin und Angiotensin II diskutiert.
Bei chronisch niereninsuffizienten Patienten (Kreatinin-Clearance unter 30 ml/min und/oder Serum-Kreatin über 1,8 mg/100 ml) ist Chlortalidon unwirksam.
5.2 Pharmakokinetische Eigenschaften
Atenolol
Nach oraler Applikation wird Atenolol zu ca. 50 % aus dem Gastrointestinaltrakt resorbiert.
Da Atenolol keinem First-Pass-Metabolismus unterliegt, beträgt die systemische Verfügbarkeit ebenfalls ca. 50 %. Maximale Plasmaspiegel werden nach 2-4 Stunden erreicht. Die Plasmaproteinbindung liegt bei ca. 3 %; das relative Verteilungsvolumen beträgt 0,7 l/kg.
Atenolol wird in sehr geringem Maße metabolisiert. Es entstehen keine aktiven Metaboliten mit klinischer Relevanz.
Etwa 90 % des systemisch verfügbaren Atenolols werden innerhalb von 48 Stunden unverändert über die Nieren eliminiert. Die Eliminationshalbwertszeit von Atenolol beträgt bei normaler Nierenfunktion 6-10 Stunden. Bei terminaler Niereninsuffizienz kann die Eliminationshalbwertszeit auf bis zu 140 Stunden ansteigen.
Chlortalidon
Chlortalidon wird relativ langsam aus dem Gastrointestinaltrakt resorbiert (t50 der Resorption ca. 2,6 h). Die systemische Verfügbarkeit beträgt ca. 64 ± 10 % nach oraler Aufnahme. Die Plasmaeiweißbindung liegt bei 75 %, das Verteilungsvolumen bei 4 l/kg.
Chlortalidon wird hauptsächlich renal als vorwiegend unveränderte Substanz eliminiert. Die Eliminationshalbwertszeit beträgt ca. 50 Stunden.
Die relative Bioverfügbarkeit von Atenolol liegt bei oraler Gabe bei ca. 50 % und ändert sich auch durch eine gleichzeitige Verabreichung von Chlortalidon - wie in AteHEXAL comp/-comp mite - nicht. Für Chlortalidon wird die relative Bioverfü gbarkeit mit 60 - 70 % angegeben, in fixer Kombination mit Atenolol wird eine etwas höhere biologische Verfügbarkeit erreicht als bei Gabe von Chlortalidon allein.
5.3 Präklinische Daten zur Sicherheit
Akute und chronische Toxizität siehe auch Abschnitt 4.9
Tierexperimentelle Untersuchungen zur chronischen Toxizität mit der Kombination Atenolol und Chlortalidon liegen nicht vor.
Mutagenes und tumorerzeugendes Potenzial
Chlortalidon induziert in Säugerzellen in vitro Chromosomenmutationen. In vivo Experimente an Mäusen erbrachten keine derartigen Hinweise im Knochenmark und in Hepatozyten. Die Bedeutung der positiven in vitro Befunde ist nicht ausreichend geklärt. Langzeituntersuchungen am Tier auf ein tumorerzeugendes Potential von Chlortalidon liegen nicht vor.
Atenolol wurde keiner ausführlichen Mutagenitätsprüfung unterzogen. Bisherige Tests verliefen negativ. In Langzeituntersuchungen an Ratten und Mäusen ergaben sich keine Hinweise auf ein tumorerzeugendes Potenzial von Atenolol.
Reproduktionstoxizität
Beide Wirkstoffe passieren die Plazenta. Atenolol erreicht im fetalen Blut ähnliche Konzentrationen wie im maternalen.
Für Chlortalidon liegen unzureichende Erfahrungen am Menschen vor. Eine Studie mit 20 in der Frühschwangerschaft Chlortalidon-exponierten Frauen hat Anhaltspunkte für ein erhöhtes Fehlbildungsrisiko gegeben.
Für Atenolol liegen unzureichende Erfahrungen mit einer Exposition in der Frühschwangerschaft vor. Neugeborene von Frauen, die während der Schwangerschaft mit Atenolol behandelt wurden, zeigten in mehreren Studien ein deutlich niedrigeres Geburtsgewicht als Neugeborene unbehandelter Mütter bzw. als Neugeborene, deren Mütter mit anderen Beta-Blockern behandelt wurden, wobei möglicherweise auch die Schwere der mütterlichen Erkrankung ein ursächlicher Faktor war. Auch wurde eine Erniedrigung der Herzfrequenz bei exponierten Feten, respektive Neugeborenen, beobachtet. Ein Fall von Beta-Blockade bei einem Neugeborenen wurde beschrieben.
Beide Wirkstoffe gehen in die Muttermilch über, Atenolol reichert sich in der Milch an. Aufgrund der hohen Konzentrationen beider Wirkstoffe ist beim gestillten Säugling eine pharmakologische Wirkung zu erwarten.
Ergebnisse aus Tierversuchen
Reproduktionstoxikologische Untersuchungen an Ratten und Kaninchen haben keine Hinweise auf ein teratogenes Potenzial der Kombination von Atenolol und Chlortalidon ergeben. Ab einer Dosis von 8 mg/kg/Tag Atenolol plus 2 mg/kg/Tag Chlortalidon wurden beim Kaninchen embryoletale Wirkungen beobachtet.
Nach Verabreichung von Atenolol allein kam es bei der Ratte zu einem Anstieg der Embryoletalität bereits unterhalb einer maternal toxischen Dosis.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
• Carboxymethylstärke-Natrium (Typ A) (Ph.Eur.)
• Hyprolose
• Hypromellose
• Lactose-Monohydrat
• Macrogol 4000
• schweres basisches Magnesiumcarbonat
• Magnesiumstearat (Ph.Eur.)
• Maisstärke
• Natriumdodecylsulfat
• Titandioxid (E 171)
Hinweis für Diabetiker 1 Filmtablette enthält weniger als 0,01 BE.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für diese Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt der Behältnisse Packungen mit 30, 50 und 100 Filmtabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNGEN
Hexal AG Industriestr. 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMERN
AteHEXAL comp mite
AteHEXAL comp 23826.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN / VERLÄNGERUNG DER ZULASSUNGEN
Datum der Erteilung der Zulassung: 13. Juli 1993
Datum der letzten Verlängerung der Zulassung: 30. Januar 2004
10. STAND DER INFORMATION
Februar 2014
11. VERKAUFSABGRENZUNG Verschreibungspflichtig
BIOVERFÜGBARKEIT
AteHEXAL® comp
Eine im Jahr 1992 durchgeführte Bioverfügbarkeitsuntersuchung an 24 Probanden ergab im Vergleich zum Referenzpräparat:
für Atenolol
|
Testpräparat |
Referenzpräparat | |
|
Cmax [ng/ml] maximale Plasmakonzentration |
563,30 ± 164,94 |
519,50 ± 193,30 |
|
tmax [h] Zeitpunkt der maximalen Plasmakonzentration |
3,15 ± 0,98 |
3,02 ± 1,22 |
|
AUQu48 h) [ng/ml*h] Fläche unter der KonzentrationsZeit-Kurve |
5512,24 ± 1137,40 |
4964,92 ± 1448,2 |
|
AUC(0-¥) [ng/ml*h] Fläche unter der Konzentrations-ZeitKurve |
6150,19 ± 1057,91 |
5477,43 ± 1408,3 |
Angabe der Werte als Mittelwerte und Streubreite (Standardabweichung) für Chlortalidon
|
Testpräparat |
Referenzpräparat | |
|
Cmax [mg/ml] maximale Plasmakonzentration |
1,85 ± 0,36 |
1,75 ± 0,37 |
|
tmax [h] Zeitpunkt der maximalen Plasmakonzentration |
11,62 ± 3,26 |
10,17 ± 2,71 |
|
AUC(0-240 h) [mg/ml*h] Fläche unter der KonzentrationsZeit-Kurve |
159,41 ± 33,56 |
152,11 ± 25,36 |
|
AUC(0-¥) [mg/ml*h] Fläche unter der KonzentrationsZeit-Kurve |
169,00 ± 37,44 |
161,23 ± 28,63 |
Angabe der Werte als Mittelwerte und Streubreite (Standardabweichung)
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrati-ons-Zeit-Diagramm:
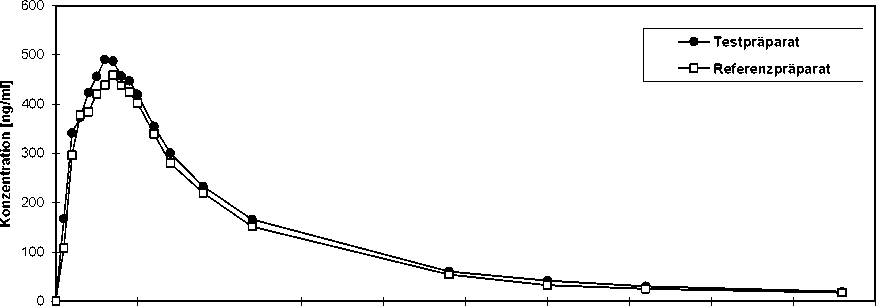
0 5 10 15 20 25 30 35 40 45 50
Zeit [h]
für Chlortalidon
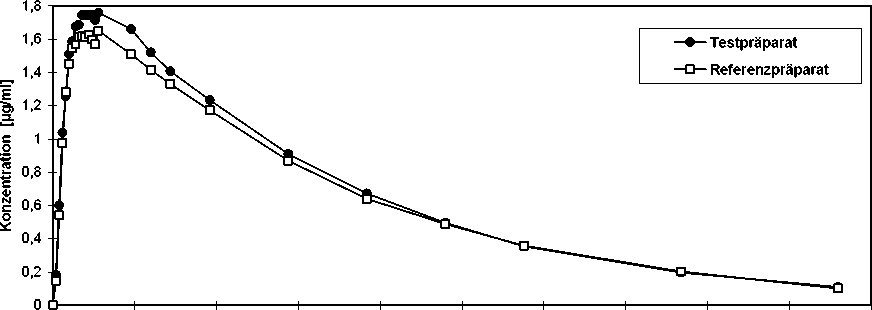
0 25 50 75 100 125 150 175 200 225 250
Zeit [h]