Atosil Filmtabletten 25 Mg
FACHINFORMATION
1. BEZEICHNUNG DER ARZNEIMITTEL
Atosil Filmtabletten 25 mg
Atosil Tropfen, 22,6 mg/ml, Tropfen zum Einnehmen, Lösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Promethazinhydrochlorid Atosil Filmtabletten 25 mg:
1 Filmtablette enthält 25 mg Promethazinhydrochlorid (entsprechend 22,1 mg Promethazin). Atosil Tropfen:
1 ml Lösung (= 20 Tropfen) enthält 22,6 mg Promethazinhydrochlorid (entsprechend 20 mg Promethazin).
Sonstiger Bestandteil mit bekannter Wirkung: 180 mg Sucrose Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORMEN
Atosil Filmtabletten 25 mg: Filmtablette
Orangefarbene, runde, leicht gewölbte Filmtablette mit der Prägung „AT 25“ auf einer Seite Atosil Tropfen: Tropfen zum Einnehmen, Lösung
Klare, bräunliche Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Unruhe- und Erregungszustände im Rahmen psychiatrischer Grunderkrankungen
Atosil Filmtabletten 25 mg oder Atosil Tropfen können indiziert sein, wenn therapeutische Alternativen nicht durchführbar sind oder nicht erfolgreich waren, bei:
- Übelkeit und Erbrechen
- Schlafstörungen bei Erwachsenen
4.2 Dosierung und Art der Anwendung
Die Dosierung, Darreichungsform und Dauer der Anwendung müssen an die individuelle Reaktionslage, die Indikation und die Schwere der Krankheit angepasst werden. Hierbei gilt der Grundsatz, die Dosis so gering und die Behandlungsdauer so kurz wie möglich zu halten.
Nach längerer Anwendung sollte Promethazin nicht abrupt, sondern ausschleichend abgesetzt werden.
Dosierung
Ältere oder geschwächte Patienten sowie Patienten mit hirnorganischen Veränderungen, Kreislaufund Atemschwäche sowie gestörter Leber- oder Nierenfunktion erhalten in der Regel die Hälfte der angegebenen Tagesdosierung.
Atosil Filmtabletten 25 mg:
Bei Unruhe- und Erregungszuständen im Rahmen _psychiatrischer Grunderkrankunsen:
Bei Unruhe- und Erregungszuständen sollte die Anwendung von Atosil auf einzelne Gaben oder wenige Tage beschränkt werden. Für die Therapie im unteren Dosisbereich stehen auch Darreichungsformen mit niedrigerem Wirkstoffgehalt zur Verfügung.
Bei Erwachsenen wird die Behandlung im Allgemeinen mit 1 Atosil Filmtablette 25 mg (entsprechend 25 mg Promethazinhydrochlorid) zur Nacht begonnen.
Wenn bei dieser Dosierung die gewünschten Wirkungen nicht erzielt werden können, kann die Dosis unter Berücksichtigung der erforderlichen Vorsichtsmaßnahmen auf 2 Atosil Filmtabletten 25 mg pro Tag (entsprechend 50 mg Promethazinhydrochlorid/Tag) oder bis maximal 4mal 1 Atosil Filmtablette 25 mg pro Tag (entsprechend 100 mg Promethazinhydrochlorid/Tag) gesteigert werden.
Höhere Dosierungen sind nur in seltenen Fällen notwendig und erfolgen in der Regel im Krankenhaus.
Bei schweren Unruhe- und Erregungszuständen kann die Dosis kurzfristig auf maximal 3-4mal 2 Atosil Filmtabletten 25 mg pro Tag (entsprechend 200 mg Promethazinhydrochlorid/Tag) gesteigert werden.
Kinder und Jugendliche
Zur Behandlung von Kindern und Jugendlichen unter 18 Jahren stehen geeignete Darreichungsformen (Tropfen) zur Verfügung.
Kinder unter 2 Jahren dürfen nicht mit Atosil behandelt werden
Bei Erbrechen, wenn therapeutische Alternativen nicht durchführbar sind oder nicht erfolgreich waren:
Erwachsene erhalten anfangs im Allgemeinen 1 Atosil Filmtablette 25 mg (entsprechend 25 mg Promethazinhydrochlorid). Die Behandlung wird in der Regel mit bis zu 2mal täglich 1 Atosil Filmtablette 25 mg (entsprechend 25 bis 50 mg Promethazinhydrochlorid/Tag) fortgeführt.
Kinder und Jugendliche
Zur Behandlung von Kindern und Jugendlichen stehen geeignete Darreichungsformen (Tropfen) zur Verfügung
Bei Schlafstörungen, wenn therapeutische Alternativen nicht durchführbar sind oder nicht erfolgreich waren:
Erwachsene erhalten 20 -50 mg Promethazinhydrochlorid zur Nacht. Die maximale Dosis sollte 1 mg Promethazinhydrochlorid/kg Körpergewicht nicht überschreiten.
Kinder und Jugendliche
Kinder und Jugendliche unter 18 Jahren sollen bei Schlafstörungen nicht mit Atosil behandelt werden. Atosil Tropfen:
Atosil Tropfen stehen als Tropfflasche zu 30 bzw. 50 ml (1 ml = 20 Tropfen; 1 Tropfen = 1 mg Promethazin) und als 100 ml-Pipettenflasche mit 0,5 ml Maßeinteilung zur Verfügung. Die ml-Angaben im Folgenden beziehen sich auf die Pipettenflasche, bei Dosierungen unter 0,5 ml bzw.
10 mg Promethazin ist auf die Tropfflasche auszuweichen.
Bei Verwendung der Pipettenflasche muss zur Dosierung das Volumen allein mit der Pipette in ml abgemessen werden während aus der Tropfflasche die Dosis in Tropfen abgemessen wird.
Bei Unruhe- und Erregungszuständen im Rahmen _psychiatrischer Grunderkrankungen:
Bei Unruhe- und Erregungszuständen sollte die Anwendung von Atosil Tropfen auf einzelne Gaben oder wenige Tage beschränkt werden. Für die Therapie im oberen Dosisbereich stehen auch Darreichungsformen mit höherem Wirkstoffgehalt zur Verfügung.
Bei Erwachsenen wird die Behandlung im Allgemeinen mit 20 bis 30 Tropfen bzw. 1 - 1,5 ml Atosil Tropfen (entsprechend 20 - 30 mg Promethazin) zur Nacht begonnen.
Wenn bei dieser Dosierung die gewünschten Wirkungen nicht erzielt werden können, kann die Dosis unter Berücksichtigung der erforderlichen Vorsichtsmaßnahmen auf morgens und mittags 10 Tropfen bzw. 0,5 ml und abends 10 bis 20 Tropfen bzw. 0,5 - 1 ml Atosil Tropfen (entsprechend 30-40 mg Promethazin/Tag) bis maximal 5mal 20 Tropfen bzw. 1 ml Atosil Tropfen pro Tag (entsprechend 100 mg Promethazin/Tag) gesteigert werden.
Höhere Dosierungen sind nur in seltenen Fällen notwendig und erfolgen in der Regel im Krankenhaus.
Bei schweren Unruhe- und Erregungszuständen kann die Dosis kurzfristig auf maximal 3 - 5mal 40 Tropfen bzw. 2 ml Atosil Tropfen pro Tag (entsprechend bis zu 200 mg Promethazin/Tag) gesteigert werden.
Kinder und Jugendliche
Kinder und Jugendliche unter 18 Jahren erhalten initial 10 Tropfen bzw. 0,5 ml Atosil Tropfen (entsprechend 10 mg Promethazin) zur Nacht.
Die Behandlung wird im Allgemeinen mit 3mal 10 Tropfen bzw. 0,5 ml Atosil Tropfen pro Tag (entsprechend 30 mg Promethazin/Tag) fortgeführt. Eine Tagesgesamtdosis von 0,5 mg Promethazin/kg Körpergewicht sollte in keinem Fall überschritten werden.
Kinder unter 2 Jahren dürfen nicht mit Atosil Tropfen behandelt werden.
Bei Erbrechen, wenn therapeutische Alternativen nicht durchführbar sind oder nicht erfolgreich waren:
Erwachsene erhalten anfangs im Allgemeinen 20 bis 30 Tropfen bzw. 1 - 1,5 ml Atosil Tropfen (entsprechend 20-30 mg Promethazin). Die Behandlung wird in der Regel mit 3mal täglich 10 bis 20 Tropfen bzw. 0,5 - 1 ml Atosil Tropfen (entsprechend 30 - 60 mg Promethazin/Tag) fortgeführt.
Kinder und Jugendliche
Kinder und Jugendliche unter 18 Jahren erhalten initial 10 Tropfen bzw. 0,5 ml Atosil Tropfen (entsprechend 10 mg Promethazin). Die Behandlung wird im Allgemeinen mit 3mal 10 Tropfen bzw. 0,5 ml Atosil Tropfen (entsprechend 30 mg Promethazin) fortgeführt. Eine Tagesgesamtdosis von 0,5 mg Promethazin/kg Körpergewicht sollte in keinem Fall überschritten werden.
Kinder unter 2 Jahren dürfen nicht mit Atosil Tropfen behandelt werden.
Bei Schlafstörungen, wenn therapeutische Alternativen nicht durchführbar sind oder nicht erfolgreich waren:
Erwachseneerhalten 20 bis 50 Tropfen bzw. 1 - 2,5 ml Atosil Tropfen (entsprechend 20 - 50 mg Promethazin) zur Nacht. Die maximale Dosis sollte 1 mg Promethazin/kg Körpergewicht nicht überschreiten.
Kinder und Jugendliche
Kinder und Jugendliche unter 18 Jahren sollen bei Schlafstörungen nicht mit Atosil Tropfen behandelt werden.
Art der Anwendung
Die Tropfen werden mit ausreichend Flüssigkeit eingenommen.Die Filmtabletten sollten unzerkaut mit ausreichend Flüssigkeit eingenommen werden.
Bei der Behandlung von Unruhe- und Erregungszuständen sollten Atosil Filmtabletten ebenso wie Atosil Tropfen hauptsächlich abends eingenommen werden, und zwar ca. % Stunde vor dem Schlafengehen und nicht auf vollen Magen, da sonst mit verzögertem Wirkungseintritt und - abhängig von der Schlafdauer - mit verstärkten Nachwirkungen (z.B. Müdigkeit, Konzentrationsstörungen) am nächsten Morgen gerechnet werden muss.
4.3 Gegenanzeigen
Atosil darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff, andere Phenothiazine oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- akuter Intoxikation mit zentraldämpfenden Arzneimitteln (z.B. Opiaten, Hypnotika, Antidepressiva, Neuroleptika, Tranquilizern) oder Alkohol
- schwerer Blutzell- oder Knochenmarksschädigung
- Kreislaufschock oder Koma
- anamnestisch bekanntem malignen Neuroleptika-Syndrom nach Promethazin
Kinder unter 2 Jahren dürfen nicht mit Promethazin behandelt werden, da eine erhöhte Gefährdung durch den so genannten plötzlichen Kindstod ("Sudden infant death sydrome") nicht ausgeschlossen ist.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Atosil darf nur unter besonderer Vorsicht angewendet werden bei:
- Leukopenie und anderen Erkrankungen des hämatopoetischen Systems
- Leber- und Nierenfunktionsstörungen
- Pylorusstenose
- Prostatahyperplasie, Harnretention
- Hypotonie, Hypertonie, orthostatischer Dysregulation, Bradykardie, Hypokaliämie, angeborenem langem QT-Syndrom oder anderen klinisch signifikanten kardialen Störungen (insbesondere koronare Herzkrankheit, Erregungsleitungsstörungen, Arrhythmien)
- gleichzeitiger Behandlung mit Arzneimitteln, die ebenfalls das QT-Intervall im EKG verlängern oder eine Hypokaliämie hervorrufen können (siehe Abschnitt 4.5 "Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen ")
- hirnorganischen Erkrankungen und epileptischen Anfällen in der Anamnese,
- Parkinson-Syndrom
- neurologisch erkennbaren subkortikalen Hirnschäden oder Verdacht darauf,
- chronischen Atembeschwerden und Asthma bronchiale
- Photosensibilität bzw. phototoxischen Reaktionen in der Anamnese
- Engwinkel- und Winkelblockglaukom und entsprechender Disposition
Kinder über 2 Jahre und Jugendliche unter 18 Jahren sollten nur bei zwingender Indikation mit Promethazin behandelt werden.
Hinweis
Bei Behandlung über einen längeren Zeitraum sollten Herzfunktion und Blutbild sorgfältig überwacht werden.
Sehr selten kann es bei der Behandlung mit Neuroleptika zu einem lebensbedrohlichen malignen Neuroleptika-Syndrom mit Fieber über 40°C und Muskelstarre (Anstieg des Myoglobin und der Creatininkinase-Aktivität im Blut) kommen.
Die Behandlung dieses Syndroms ist schwierig, folgende Maßnahmen werden empfohlen:
- sofortiges Absetzen des Medikaments
- Behandlung der Hyperthermie durch Kühlen, da Antipyretika bei hohem Fieber möglicherweise nicht wirksam sind.
- Behandlung von Störungen des Elektrolyt- und Wasserhaushaltes, der kardiovaskulären Manifestationen, Infektionen, der respiratorischen und renalen Komplikationen.
- Therapieversuch mit Dantrolen-Infusionen (3 bis 10 mg/kg Körpergewicht und Tag) in Kombination mit Bromocriptin (7,5 bis 30 mg/Tag oral).
Erhöhte Mortalität bei älteren Menschen mit Demenz-Erkrankungen:
Die Daten zweier großer Anwendungsstudien zeigten, dass ältere Menschen mit DemenzErkrankungen, die mit konventionellen (typischen) Antipsychotika behandelt wurden, einem leicht erhöhten Mortalitätsrisiko im Vergleich zu nicht mit Antipsychotika Behandelten ausgesetzt sind. Anhand der vorliegenden Studiendaten kann eine genaue Höhe dieses Risikos nicht angegeben werden und die Ursache für die Risikoerhöhung ist nicht bekannt.
Atosil ist nicht zur Behandlung von Verhaltensstörungen, die mit Demenz-Erkrankungen zusammenhängen, zugelassen.
Erhöhtes Risiko für das Auftreten von unerwünschten cerebrovaskulären Ereignissen:
In randomisierten, placebokontrollierten klinischen Studien mit an Demenz erkrankten Patienten, die mit einigen atypischen Antipsychotika behandelt wurden, wurde ein etwa um das dreifache erhöhtes Risiko für unerwünschte cerebrovaskuläre Ereignisse beobachtet. Der Mechanismus, der zu dieser Risikoerhöhung führt, ist unbekannt. Es kann nicht ausgeschlossen werden, dass diese Wirkung auch bei der Anwendung anderer Antipsychotika oder bei anderen Patientengruppen auftritt. Atosil sollte daher bei Patienten, die ein erhöhtes Schlaganfallrisiko haben, mit Vorsicht angewendet werden.
Thromboembolie-Risiko:
Im Zusammenhang mit der Anwendung von Antipsychotika sind Fälle von venösen Thromboembolien (VTE) berichtet worden. Da Patienten, die mit Antipsychotika behandelt werden, häufig erworbene Risikofaktoren für VTE aufweisen, sollten alle möglichen Risikofaktoren für VTE vor und während der Behandlung mit Atosil identifiziert und Präventivmaßnahmen ergriffen werden.
Information zu sonstigen BestandteilenPatienten mit der seltenen hereditären Fructose-Intoleranz, Glucose-Galactose-Malabsorption oder Saccharase-Isomaltase-Mangel sollten Atosil Tropfen nicht einnehmen. Atosil Tropfen kann schädlich für die Zähne sein (Karies).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei gleichzeitiger Anwendung mit anderen zentraldämpfenden Arzneimitteln (Hypnotika/Sedativa, Analgetika, anderen Psychopharmaka, Antihistaminika) oder Alkohol kann es zu einer wechselseitigen Verstärkung der Wirkungen und Nebenwirkungen (insbesondere von Sedierung und Blutdrucksenkung) kommen.
Bei Kombination von Promethazin mit anderen anticholinerg wirkenden Arzneistoffen, wie z.B. Antidepressiva oder Atropin, können die anticholinergen Effekte additiv verstärkt werden und vermehrt pharmakogene delirante Syndrome auftreten.
Die Plasmakonzentration von trizyklischen Antidepressiva und ihrer Metabolite wird durch gleichzeitige Gabe von Promethazin oder anderen Phenothiazinen stark erhöht, sodass mit einer erhöhten Toxizität beider Wirkstoffe (anticholinerge Wirkung, Absenken der Krampfschwelle, vor allem aber mit kardialen Effekten [QT-Intervall-Verlängerung]) gerechnet werden muss. Aus diesem Grunde wird von dieser Kombination abgeraten.
Aufgrund von Hinweisen auf Hypertension und Verstärkung extrapyramidalmotorischer Nebenwirkungen in Verbindung mit MAO-Hemmstoffen wird von einer Kombination von Promethazin mit MAO-Hemmstoffen abgeraten.
Promethazin sollte aufgrund eines möglichen paradoxen Blutdruckabfalls ("Adrenalinumkehr") nicht mit Epinephrin kombiniert werden.
Die Wirkung von Antihypertonika kann beeinflusst werden; in der Regel ist eine verstärkte blutdrucksenkende Wirkung (z.B. orthostatische Kreislaufdysregulation) von klinischer Relevanz.
Bei gleichzeitiger Einnahme von Antikonvulsiva kommt es zu einem gesteigerten Abbau der Phenothiazine.
Die gleichzeitige Anwendung von Arzneimitteln, die ebenfalls das QT-Intervall verlängern (z.B. Antiarrhythmika Klasse IA oder III, Makrolid-Antibiotika, Malaria-Mittel, Antihistaminika, Antidepressiva), zu einer Hypokaliämie führen (z.B. bestimmte Diuretika) oder den hepatischen Abbau von Promethazin hemmen können, ist zu vermeiden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Aus den bisher dokumentierten Erfahrungen mit der Anwendung in der Schwangerschaft für ca. 800 Mutter-Kind-Paare, ca. 170 davon im ersten Trimester, liegen keine eindeutigen Hinweise auf ein erhöhtes Fehlbildungsrisiko vor. Promethazin durchdringt die Plazenta und ist noch vier Stunden nach der Geburt im Blut des Neugeborenen nachweisbar. Die Möglichkeit einer Atemdepression sowie von vorübergehenden EEG- und Verhaltensänderungen beim Neugeborenen ist nicht auszuschließen. Promethazin kann die Thrombozyten-Aggregation bei Mutter und Kind beeinträchtigen. Bisher sind jedoch keine Fälle von erhöhter Blutungsneigung nach Gabe des Wirkstoffes unter der Geburt beschrieben worden. Es liegen keine hinreichenden tierexperimentellen Studien in bezug auf die Reproduktionstoxizität von Promethazin vor (siehe Abschnitt 5.3.“ Präklinische Daten zur Sicherheit“).
Obwohl es bisher keine Hinweise auf ein erhöhtes Fehlbildungsrisiko durch Promethazin gibt, sollte das Präparat in der Frühschwangerschaft nur bei zwingender Notwendigkeit angewendet werden.
Stillzeit
Wegen der Möglichkeit einer Atemdepression sowie von vorübergehenden EEG- und Verhaltensänderungen beim Neugeborenen sollte das Präparat zum Ende der Schwangerschaft und während der Stillzeit mit besonderer Vorsicht eingesetzt werden. Es liegen keine Untersuchungen zum Übergang von Promethazin in die Muttermilch vor.
Neugeborene, die während des dritten Trimenons der Schwangerschaft gegenüber Antipsychotika (einschließlich Promethazin) exponiert sind, sind durch Nebenwirkungen einschließlich extrapyramidaler Symptome und/oder Entzugserscheinungen gefährdet, deren Schwere und Dauer nach der Entbindung variieren können.
Es gab Berichte über Agitiertheit, erhöhten oder erniedrigten Muskeltonus, Tremor, Somnolenz, Atemnot oder Störungen bei der Nahrungsaufnahme. Dementsprechend sollten Neugeborene sorgfältig überwacht werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann auch am Folgetage das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
Daher sollten das Führen von Fahrzeugen, das Bedienen von Maschinen oder sonstige gefahrvolle Tätigkeiten - zumindest während der ersten Phase der Behandlung - ganz unterbleiben. Die Entscheidung trifft in jedem Einzelfall der behandelnde Arzt unter Berücksichtigung der individuellen Reaktion und der jeweiligen Dosierung.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Sehr selten kann es bei der Behandlung mit Neuroleptika zu einem lebensbedrohlichen malignen Neuroleptika-Syndrom mit Fieber über 40°C und Muskelstarre (Anstieg des Myoglobin und der Creatininkinase-Aktivität im Blut) kommen (siehe Abschnitt 4.4).
Erkrankungen des Blutes und des Lymphsystems
Es kann Leukopenie auftreten, über Agranulozytose wurde berichtet
Stoffwechsel und Ernährungsstörungen
Vor allem unter höheren Dosen kann Gewichtszunahme auftreten.
Psychiatrische Erkrankungen
Es wurde über Schlafstörungen, Verwirrtheitszustände und allgemeine Unruhe berichtet.
Besonders bei Kindern und älteren Patienten kann es zu paradoxen ZNS-Stimulationen mit Tremor, Irritabilität, Schlaflosigkeit und Affektstörungen kommen. Prädisponierend wirken fieberhafte Erkrankungen und Dehydratation.
Erkrankungen des Nervensystems
Sehr häufig kann es zur Sedierung kommen. Es wurde über das Auftreten von Krampfanfällen berichtet.
Neuroleptika können, insbesondere nach hoch dosierter und längerer Behandlung, extrapyramidalmotorische Nebenwirkungen hervorrufen.
Grundsätzlich kann es zu Frühdyskinesien (krampfartiges Herausstrecken der Zunge, Verkrampfung der Schlundmuskulatur, Blickkrämpfe, Schiefhals, Versteifung der Rückenmuskulatur, KiefermuskelKrämpfe) oder zu einem pharmakogenem Parkinson-Syndrom (Zittern, Steifigkeit, Bewegungsarmut) kommen. Bei Auftreten von Frühdyskinesien oder Parkinson-Symptomen ist eine Dosisreduktion oder Behandlung mit anticholinergen Antiparkinsonmitteln erforderlich.
Nach längerfristiger Anwendung können (insbesondere bei älteren Patienten und beim weiblichen Geschlecht) Spätdyskinesien vor allem im Mundbereich auftreten, die noch nach der Beendigung der Behandlung anhalten können und manchmal irreversibel sind. Bei langdauernder PromethazinMonotherapie in individuell abgestimmter und möglichst niedriger Dosierung sind Spätdyskinesien bisher nicht beobachtet worden bzw. in ihrem kausalen Zusammenhang zu Promethazin fraglich. Grundsätzlich können Spätdyskinesien unter der Neuroleptika-Therapie maskiert werden und dann erst nach Beendigung der Behandlung in Erscheinung treten.
Augenerkrankungen
Vor allem unter höheren Dosen können Erhöhung des Augeninnendrucks und Akkommodationsstörungen auftreten.
Bei Langzeitbehandlung mit hohen Dosen sind Einlagerungen bzw. Pigmentierungen in Hornhaut und Linse des Auges möglich.
Herzerkrankungen
Insbesondere zu Beginn der Behandlung können Blutdruckveränderungen (Hypotonie bzw. orthostatische Dysregulation) und eine reflektorische Beschleunigung der Herzfrequenz auftreten. Promethazin kann das QT-Intervall im EKG verlängern sowie zu Erregungsleitungsstörungen führen; sehr selten sind Torsades de Pointes aufgetreten. In diesen Fällen ist die Behandlung mit Atosil abzubrechen.
Gefäßerkrankungen
Es wurde über Ausbildung einer Thrombose berichtet.
Nicht bekannt: Fälle von Thromboembolien (einschließlich Fällen von Lungenembolie und Fällen von tiefer Venenthrombose)
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Vor allem unter höheren Dosen kann das Gefühl einer verstopften Nase auftreten.
Über respiratorische Störungen wurde berichtet. Bei Patienten mit neurologischen Defiziten, vorbestehenden Atemstörungen, bei Kindern oder bei Kombination mit anderen atemdepressiv wirkenden Arzneimitteln kann dosisabhängig eine Atemdepression auftreten.
Erkrankungen des Gastrointestinaltraktes
Sehr häufig kann es zu Mundtrockenheit und Eindickung von Schleim mit Störungen der Speichelsekretion kommen.
Es kann außerdem zu Obstipation kommen.
Leber- und Gallenerkrankungen Cholestase kann auftreten.
Erkrankungen der Haut und des Unterhautzellgewebes Vor allem unter höheren Dosen kann Schwitzen auftreten.
Es wurde über phototoxische Reaktionen berichtet, cutane Photosensibilisierungen und allergische Hauterscheinungen können auftreten.
Erkrankungen der Nieren und Harnwege Es kann zu Miktionsstörungen kommen.
Schwangerschaft, Wochenbett und perinatale Erkrankungen
Nicht bekannt: Arzneimittelentzugssyndrom des Neugeborenen (siehe Abschnitt 4.6)
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Es kann zu Auswirkungen auf die sexuellen Funktionen (z.B. Beeinträchtigung der sexuellen Reaktionsfähigkeit, sexuellen Appetenz, Störungen der Erektion und Ejakulation) kommen. Über Galaktorrhoe wurde berichtet.
Kongenitale, familiäre und genetische Erkrankungen Über Porphyrie wurde berichtet.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Vor allem unter höheren Dosen kann vermehrtes Durstgefühl auftreten.
Untersuchungen
Es können Temperaturerhöhungen beobachtet werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Phenothiazine zeichnen sich durch eine erhebliche akute Toxizität aus; Kinder bzw. Kleinkinder sind besonders gefährdet.
Symptome einer Überdosierung
Überdosierungen mit Promethazin sind in erster Linie - abhängig von der aufgenommenen Menge -gekennzeichnet durch die unterschiedlichen Stadien einer ZNS-Beeinträchtigung (Somnolenz bis Koma, Atemdepression bis Atemstillstand, Angstzustände, Halluzinationen, Erregungszustände bis zu Krampfanfällen) sowie Herz-Kreislauf-Symptome (Blutdruckabfall, Tachykardie, Herzrhythmusstörungen wie QT-Intervall-Verlängerung, wobei Torsades de pointes nicht ausgeschlossen werden können). Außerdem treten anticholinerge Symptome (Fieber, trockene Schleimhäute, Mydriasis, Obstipation, Harnretention) und eine metabolische Azidose auf.
Insbesondere bei Kindern können die erregenden ZNS-Effekte im Vordergrund stehen.
Maßnahmen bei Überdosierung
So rasch wie möglich ist eine intensivmedizinische Behandlung einzuleiten.
Eine Magenspülung kann aussichtsreich sein, wenn sie frühzeitig (am besten innerhalb 1 Stunde) durchgeführt wird, gefolgt von der wiederholten Gabe von Aktivkohle. Die Provokation von Erbrechen erscheint in Anbetracht der antiemetischen Wirkung von Promethazin und der geringen Effizienz dieser Maßnahme nicht mehr sinnvoll.
Die weitere Therapie erfolgt symptomatisch: Zum Einsatz können Volumensubstitution, Antikonvulsiva, gefäßverengende Medikamente (Norepinephrin, kein Epinephrin!), und bei kardialen Komplikationen ggf. Antiarrhythmika und/oder Natriumhydrogencarbonat bzw.
-lactat kommen; bei extrapyramidalen Symptomen können Anticholinergika (Biperiden) sinnvoll sein. EKG und Vitalfunktionen sind zu überwachen, bis das EKG normalisiert ist. Analeptika sind kontraindiziert, da infolge der Senkung der Krampfschwelle durch Promethazin eine Neigung zu zerebralen Krampfanfällen besteht. Auch Betablocker sollten vermieden werden, weil sie die Vasodilatation erhöhen.
Bei schweren Vergiftungen bzw. bei Auftreten eines anticholinergen Syndroms steht zur Anwendung unter intensivmedizinischen Bedingungen (EKG-Kontrolle!) als Antidot Physostigminsalicylat zur Verfügung.
Auf Grund des großen Verteilungsvolumens und der starken Plasma-Eiweiß-Bindung sind forcierte Diurese oder Hämodialyse bei reinen Promethazin-Vergiftungen wenig hilfreich.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Phenothiazin , ATC-Code: R06AD02
Promethazin, ein Phenothiazin-Derivat mit verzweigter aliphatischer Seitenkette, ist ein potentes H1-Antihistaminikum mit stark sedierender Wirkung, das nur geringe antipsychotischen Eigenschaften besitzt. Es wirkt antihistaminerg, anticholinerg, antiserotonerg und membranstabilisierend. Ferner blockiert es Alpha-Rezeptoren. Im Tierexperiment wirkt es nicht antagonistisch auf Dopaminrezeptoren und weist in vitro eine extrem geringe Affinität zu (3H)-Haloperidol-markierten Dopaminrezeptoren auf. Infolgedessen wird die Prolaktinsekretion nicht erhöht, die Apomorphin- und Amphetamin-bedingte Hyperaktivität nicht gemindert, und es tritt keine Katalepsie und keine Hemmung des bedingten Fluchtreflexes ein. Promethazin wirkt antiemetisch.
Klinisch wird Promethazin heute vor allem als Sedativum bei Unruhe- und Erregungszuständen eingesetzt; unter bestimmten Bedingungen auch auf Grund seiner antiemetischen und hypnotischen Eigenschaften. Nach aktuellem medizinischen Kenntnisstand wird für die Verwendung als Antihistaminikum nur noch bei parenteraler Gabe ein positives Nutzen-Risiko-Verhältnis gesehen (siehe Abschnitt 4.1).
5.2 Pharmakokinetische Eigenschaften
Resorption
Promethazin wird nach oraler Gabe nahezu vollständig resorbiert. Aufgrund eines ausgeprägten FirstPass-Effektes ist die systemische Bioverfügbarkeit niedrig (ca. 25%).
Verteilung
Die Plasmakonzentrationen unterliegen starken interindividuellen Schwankungen. Maximale Plasmakonzentrationen wurden nach 1,5 bis 3 h mit 2-18 ng/ml (nach 25 mg Einzeldosis per os) und mit 8-39 ng/ml (nach 50 mg Einzeldosis per os) bestimmt. Nach intramuskulärer Injektion von 25 mg wurden maximale Plasmakonzentrationen nach 4 h mit 22,4 + 5,9 ng/ml gemessen, die nach 12 h auf 3 ng/ml abgesunken waren.
Promethazin verteilt sich über alle Organe, wobei in Lunge, Leber und Nieren die höchsten Konzentrationen auftreten. Die Substanz überwindet die Blut-Hirn-Schranke, ist plazentagängig und tritt rasch auf den Feten über. Die fetalen Plasmakonzentrationen entsprechen denen der Mutter. Zum Übergang in die Muttermilch existieren keine Daten.
Die Plasmaproteinbindung beträgt bis zu 90%. Das Verteilungsvolumen ist groß; die Werte in der Literatur reichen von 171 bis 1346 Litern.
Biotransformation
Die Metabolisierung erfolgt vornehmlich in der Leber, im Wesentlichen durch S-Oxidation, in kleinerem Umfang durch N-Demethylierung und Ring-Hydroxylierung. Der Hauptmetabolit ist das pharmakologisch inaktive Promethazinsulfoxid. Promethazin induziert die mikrosomalen Enzyme.
Elimination
Die Ausscheidung erfolgt überwiegend renal, davon zu 10% als Sulfoxid, und in geringerem Umfang biliär. Promethazin wird nur zu sehr geringem Anteil unverändert ausgeschieden (0,2%). Die totale Clearance liegt bei 1,1 l/min und ist praktisch ausschließlich hepatisch bedingt.
Bioverfügbarkeit
Eine im Jahr 1993 mit Atosil Filmtabletten 25 mg durchgeführte Bioverfügbarkeitsunter- suchung an 12 Probanden ergab im Vergleich zum Referenzpräparat:
|
Testpräparat 1 Atosil Filmtablette 25 mg (25 mg Promethazinhydrochlorid) |
Referenzpräparat Orale Lösung, 1ml, entspricht in der Zusammensetzung Atosil Injektionslösung (28,2 mg Promethazinhydrochlorid) | |
|
maximale Plasmakonzentration (Cmax [hg/l]): |
5,59 (1,59) |
9,74 (1,40) |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax [h]): |
3,30 (1,15) |
2,0 (1,55) |
|
Fläche unter der Konzentrations-ZeitKurve (AUC [^g*h/l]): |
64,29 (1,81) |
101,35 (1,61) |
Promethazin-Konzentrationen; Angabe der Werte als geometrische Mittelwerte und Streubreite
Mittlere Plasmaspiegelverläufe (Promethazin-Konzentrationen als geometrische Mittel) im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
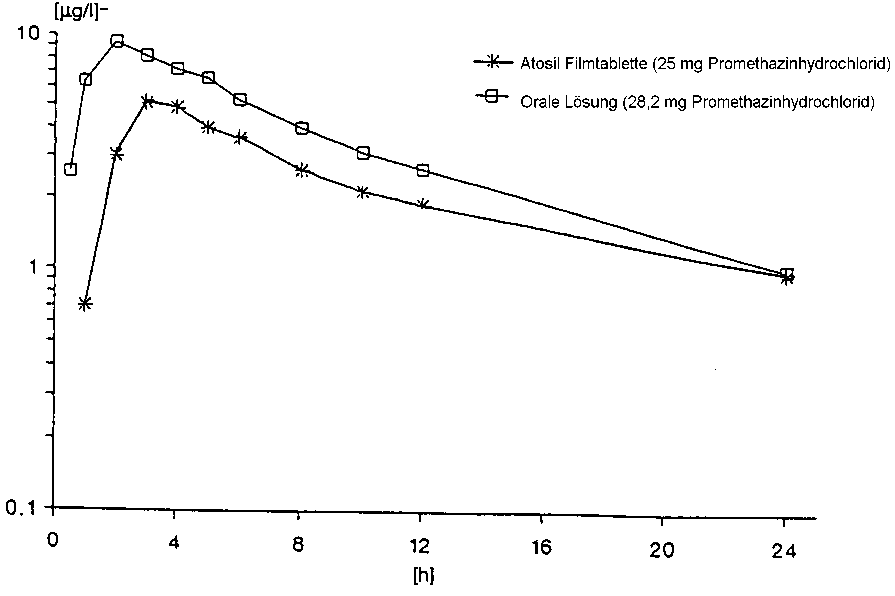
5.3 Präklinische Daten zur Sicherheit
Die wiederholte orale Applikation von Promethazin über einen Zeitraum von 13 Wochen führte bei Ratten tendenziell zu erhöhtem Lebergewicht, in einer Langzeitstudie (2 Jahre) wurden bei männlichen Tieren Fetteinlagerungen in der Leber beschrieben.
In-vivo- und In-vitro-Untersuchungen zum Nachweis von Gen- und Chromosomenmutationen sowie DNS-Reparatur verliefen mit Promethazin negativ.
Langzeituntersuchungen an Ratte und Maus ergaben keine Hinweise auf ein tumorerzeugendes Potential.
Orale Dosen bis zu 250 mg/kg/Tag hatten keine nachteiligen Wirkungen auf die Implantation und die Embryonalentwicklung bei Ratten.
In vitro blockiert Promethazin exprimierte HERG-Kanäle in mikromolaren Konzentrationen, die im oberen Bereich therapeutischer Plasmakonzentrationen liegen. Diese Kanäle sind für die Repolarisation im Herz verantwortlich. Daher hat Promethazin das Potential, bestimmte Formen von Kammerherzrhythmusstörungen (Torsades de Pointes) auszulösen.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Atosil Filmtabletten 25 mg:
Mikrokristalline Cellulose, Hypromellose, Macrogol 4000, Magnesiumstearat (Ph.Eur.), Croscarmellose-Natrium, Titandioxid (E 171), Eisen(III)-oxid (E 172), Eisen(III)-hydroxid-oxid (E 172).
Atosil Tropfen:
Ascorbinsäure, Citronensäure, 3-Ethoxy-4-hydroxybenzaldehyd, Sucrose, gereinigtes Wasser, Zuckercouleur (E 150).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Atosil Filmtabletten 25 mg: 3 Jahre
Atosil Tropfen (Tropflasche): 3,5 Jahre
Atosil Tropfen (Pipettenflasche): 2,5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Atosil Filmtabletten 25 mg:
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Atosil Tropfen:
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Atosil Tropfen sollten nach Anbruch im Kühlschrank (bei 2 - 8°C, nicht einfrieren) aufbewahrt werden und sind unter diesen Bedingungen 12 Wochen haltbar. Wird das Präparat nach Anbruch bei Raumtemperatur (nicht über 25°C) aufbewahrt, sind Atosil Tropfen 6 Wochen haltbar.
6.5 Art und Inhalt der Behältnisse
Atosil Filmtabletten 25 mg:
Blister aus Polypropylen und Aluminiumfolie 20 Filmtabletten 50 Filmtabletten 100 Filmtabletten
Klinikpackung mit 300 Filmtabletten
Atosil Tropfen:
Braunglasflasche mit Tropfeinsatz aus Polyethylen und Schraubdeckel aus Polypropylen
Braunglasflasche mit Glaspipette und Saugbalg aus Gummi sowie Schraubdeckel aus Polypropylen
Tropfflasche mit 30 ml Lösung
Tropfflasche mit 50 ml Lösung
Pipettenflasche mit 100 ml Lösung
Klinikpackungen:
30 ml und 300 ml Lösung in Tropfflasche 50 ml und 500 ml Lösung in Tropfflasche 100 ml und 1000 ml Lösung in Pipettenflasche
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
DESITIN ARZNEIMITTEL GMBH Weg beim Jäger 214, 22335 Hamburg
Telefon: (040) 5 91 01 525 Telefax: (040) 5 91 01 377
8. ZULASSUNGSNUMMERN
Atosil Filmtabletten 25 mg: 6245842.00.00
Atosil Tropfen: 6245291.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN/VERLÄNGERUNG DER ZULASSUNGEN
Atosil Filmtabletten 25 mg
Datum der Erteilung der Zulassung 15. September 2004 Atosil Tropfen
Datum der Erteilung der Zulassung 16. September 2004
10. STAND DER INFORMATION
{MM.JJJJ}
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig