Aurodes-Ee 30 0,150 Mg/0,030 Mg Filmtabletten
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
Aurodes-EE 30 0,150 mg/0,030 mg Filmtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede Filmtablette enthält 0,150 mg Desogestrel und 0,030 mg Ethinylestradiol. Sonstige Bestandteile mit bekannter Wirkung: 55 mg Lactose-Monohydrat, max. 0,026 mg Sojabohnenöl.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtablette
Wirkstoffhaltige Tabletten: Weiße, runde Filmtabletten mit einem Durchmesser von
5,00 mm. Sie haben die Prägung „C" auf der einen und „7" auf der anderen Seite.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Hormonale Kontrazeption
Bei der Entscheidung, Aurodes-EE 30 zu verschreiben, sollten die aktuellen, individuellen Risikofaktoren der einzelnen Frauen, insbesondere im Hinblick auf venöse Thromboembolien (VTE), berücksichtigt werden. Auch sollte das Risiko für eine VTE bei Anwendung von Aurodes-EE 30 mit dem anderer kombinierter hormonaler Kontrazeptiva (KHK) verglichen werden (siehe Abschnitte 4.3 und 4.4).
4.2 Dosierung und Art der Anwendung
Art der Anwendung: Zum Einnehmen.
Wie Aurodes-EE 30 einzunehmen ist
Die Tabletten müssen jeden Tag etwa zur gleichen Zeit, falls erforderlich mit etwas Flüssigkeit, in der auf der Blisterpackung angegebenen Reihenfolge eingenommen werden. Die Tabletteneinnahme erfolgt durchgehend. Täglich muss 1 Tablette über 21 aufeinander folgende Tage eingenommen werden. Mit der jeweils nächsten Packung wird nach einer 7-tägigen Einnahmepause begonnen, in der es üblicherweise zu einer Abbruchblutung kommt. Diese beginnt in der Regel 2 - 3 Tage nach Einnahme der
letzten Tablette und kann noch andauern, wenn mit der Einnahme aus der nächsten Packung begonnen wird.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Desogestrel und Ethinylestradiol bei Jugendlichen unter 18 Jahren ist bisher noch nicht nachgewiesen. Es stehen keine Daten zur Verfügung.
Beginn der Einnahme von Aurodes-EE 30
• Keine vorangegangene Einnahme von hormonalen Kontrazeptiva (im letzten Monat)
Mit der Tabletteneinnahme ist am 1. Tag des natürlichen Zyklus (d.h. am 1. Tag der Menstruationsblutung) zu beginnen. Ein Beginn ist auch vom 2. bis 5. Tag an möglich, wobei während der ersten 7 Tage der Tabletteneinnahme im 1. Zyklus die zusätzliche Anwendung eines mechanischen Verhütungsmittels empfohlen wird.
• Wechsel von einem kombinierten hormonalen Kontrazeptivum (kombiniertes orales Kontrazeptivum [KOK], Vaginalring oder transdermales Pflaster)
Mit der Einnahme von Aurodes-EE 30 sollte vorzugsweise am Tag nach Einnahme der letzten wirkstoffhaltigen Tablette (die letzte Tablette, die Wirkstoffe enthält) des zuvor eingenommenen KOKs begonnen werden, spätestens aber am Tag nach dem üblichen einnahmefreien oder Placebotabletten-Intervall des zuvor eingenommenen KOKs. Für den Fall, dass ein Vaginalring oder ein transdermales Pflaster angewendet wurde, sollte die Einnahme von Aurodes-EE 30 vorzugsweise am Tag der Entfernung begonnen werden, spätestens aber, wenn die nächste Applikation fällig wäre.
• Wechsel von einem Gestagenmonopräparat (Minipille, Injektionspräparat, Implantat) oder einem gestagenfreisetzenden Intrauterinpessar (IUP)
Bei vorheriger Einnahme der Minipille kann an jedem beliebigen Tag gewechselt werden (die Umstellung von einem Implantat oder IUP muss am Tag der Entfernung erfolgen, die Umstellung von einem Injektionspräparat zu dem Zeitpunkt, an dem die nächste Injektion fällig wäre). In jedem Fall ist während der ersten 7 Tage der Tabletteneinnahme zusätzlich die Anwendung einer nicht hormonalen Verhütungsmethode (Barrieremethode) erforderlich.
• Nach einem Abort im 1. Trimenon
Es kann sofort mit der Einnahme von Aurodes-EE 30 begonnen werden. In diesem Fall sind keine zusätzlichen empfängnisverhütenden Maßnahmen erforderlich.
• Nach einer Geburt oder einem Abort im 2. Trimenon
Den Anwenderinnen sollte empfohlen werden, an den Tagen 21 bis 28 nach einer Geburt oder nach einem Abort im zweiten Trimenon mit der Einnahme zu beginnen.
Bei einem späteren Einnahmebeginn sollte während der ersten 7 Tage zusätzlich eine Barrieremethode angewendet werden. Wenn jedoch bereits Geschlechtsverkehr stattgefunden hat, muss vor Beginn der KOK-Einnahme eine Schwangerschaft ausgeschlossen oder die erste Menstruationsblutung abgewartet werden.
Zur Anwendung bei stillenden Frauen siehe Abschnitt 4.6.
Vorgehen bei vergessener Tabletteneinnahme
Wird innerhalb von 12 Stunden nach dem üblichen Einnahmezeitpunkt bemerkt, dass die Einnahme einer Filmtablette vergessen wurde, muss die Filmtablette sofort eingenommen werden. Alle darauf folgenden Filmtabletten sind dann wieder zur gewohnten Zeit einzunehmen. Der kontrazeptive Schutz ist dann nicht eingeschränkt.
Wenn die Einnahmezeit um mehr als 12 Stunden überschritten wurde, ist der Konzeptionsschutz nicht mehr voll gewährleistet.
Für das Vorgehen bei vergessener Einnahme gelten die folgenden zwei Grundregeln:
1. Die Tabletteneinnahme darf nie länger als 7 Tage unterbrochen werden.
2. Eine regelmäßige Einnahme der Tabletten über mindestens 7 Tage ist erforderlich, um wirkungsvoll die Hypothalamus-Hypophysen-Ovar-Achse zu unterdrücken.
Entsprechend können für die tägliche Praxis folgende Empfehlungen gegeben werden:
1. Einnahmewoche
Die Einnahme der letzten vergessenen Tablette sollte so schnell wie möglich nachgeholt werden, auch wenn dies bedeutet, dass zwei Tabletten zur gleichen Zeit eingenommen werden. Die weitere Tabletteneinnahme erfolgt dann zur gewohnten Zeit. Während der nächsten 7 Tage sollte jedoch zusätzlich eine Barrieremethode, z.
B. ein Kondom, angewendet werden. Wenn in den vergangenen 7 Tagen Geschlechtsverkehr stattgefunden hat, sollte die Möglichkeit einer Schwangerschaft in Betracht gezogen werden. Das Risiko einer Schwangerschaft ist umso höher, je mehr Tabletten vergessen wurden und je näher dies zeitlich am regulären einnahmefreien Intervall liegt.
2. Einnahmewoche
Die Einnahme der letzten vergessenen Tablette sollte so schnell wie möglich nachgeholt werden, auch wenn dies bedeutet, dass zwei Tabletten zur gleichen Zeit eingenommen werden. Die weitere Einnahme der Tabletten erfolgt dann zur üblichen Zeit. Vorausgesetzt, dass die Einnahme der Tabletten an den 7 Tagen vor der ersten vergessenen Tablette korrekt erfolgt ist, besteht keine Notwendigkeit, zusätzliche kontrazeptive Schutzmaßnahmen anzuwenden. Wurde jedoch mehr als 1 Tablette vergessen, sollte die Anwendung zusätzlicher Schutzmaßnahmen über 7 Tage empfohlen werden.
3. Einnahmewoche
Aufgrund des bevorstehenden 7-tägigen einnahmefreien Intervalls kann ein voller Konzeptionsschutz nicht mehr gewährleistet werden. Durch eine Anpassung des Einnahmeschemas lässt sich eine Herabsetzung der empfängnisverhütenden Wirkung dennoch verhindern. Bei Einhalten einer der beiden folgenden Vorgehensweisen besteht daher keine Notwendigkeit zusätzlicher kontrazeptiver Maßnahmen, vorausgesetzt, die Tabletteneinnahme an den 7 Tagen vor der ersten vergessenen Tablette erfolgte korrekt. Wenn dies nicht der Fall ist, sollte die Anwenderin wie unter Punkt 1 beschrieben vorgehen und außerdem in den nächsten 7 Tagen zusätzliche Schutzmaßnahmen anwenden.
1. Die Anwenderin sollte die Einnahme der letzten vergessenen Tablette so schnell wie möglich nachholen, auch wenn dies bedeutet, dass zwei Tabletten zur gleichen Zeit eingenommen werden. Die Einnahme der Tabletten erfolgt dann wieder zur üblichen Zeit bis die wirkstoffhaltigen Tabletten aufgebraucht sind. Mit der Einnahme aus der nächsten Blisterpackung wird direkt nach Aufbrauchen der aktuellen Blisterpackung begonnen, d. h. zwischen den beiden Packungen soll kein einnahmefreies Intervall liegen. Es ist unwahrscheinlich, dass es bei der Anwenderin vor Aufbrauchen der wirkstoffhaltigen Tabletten aus der zweiten Packung zu einer Abbruchblutung kommt, allerdings können noch während der Einnahme Schmier- oder Durchbruchblutungen auftreten.
2. Es kann auch ein Abbruch der Einnahme aus der aktuellen Blisterpackung empfohlen werden an den sich ein einnahmefreies Intervall von bis zu 7 Tagen, die Tage der vergessenen Tabletteneinnahme eingerechnet, anschließen sollte. Danach wird mit der Tabletteneinnahme aus der neuen Packung begonnen.
Bei vergessener Tabletteneinnahme und anschließendem Ausbleiben einer Abbruchblutung im nächsten regulären einnahmefreien Intervall sollte die Möglichkeit einer Schwangerschaft in Betracht gezogen werden.
Verhalten bei gastrointestinalen Störungen
Bei schweren gastrointestinalen Störungen (z. B. Erbrechen oder Durchfall) werden die Wirkstoffe möglicherweise nicht vollständig aufgenommen und zusätzliche kontrazeptive Maßnahmen sind erforderlich.
Bei Erbrechen in den ersten 3 - 4 Stunden nach der Einnahme einer wirkstoffhaltigen Tablette sollte so schnell wie möglich eine weitere (Ersatz-)Tablette eingenommen werden. Die Einnahme der neuen Tablette sollte, wenn möglich, innerhalb von 12 Stunden nach der normalen Einnahmezeit erfolgen. Wenn mehr als 12 Stunden vergangen sind, empfiehlt sich die im Abschnitt 4.2 unter „Vorgehen bei vergessener Tabletteneinnahme“ genannte Vorgehensweise für vergessene Tabletten. Wenn die Anwenderin nicht von ihrem normalen Einnahmerhythmus abweichen möchte, muss sie die Ersatztablette(n) aus einer anderen Blisterpackung einnehmen.
Verschiebung der Entzugsblutung
Um die Entzugsblutung hinauszuschieben, soll direkt ohne einnahmefreies Intervall mit der Einnahme aus der nächsten Blisterpackung Aurodes-EE 30 begonnen werden. Die Einnahme kann so lange fortgesetzt werden wie gewünscht, maximal bis die wirkstoffhaltigen Tabletten der zweiten Packung aufgebraucht sind. Während der Einnahme aus der zweiten Packung kann es zu Durchbruch- oder Schmierblutungen kommen. Nach der darauf folgenden regulären 7-tägigen Einnahmepause kann die Einnahme von Aurodes-EE 30 wie üblich fortgesetzt werden.
Zur Verschiebung der Entzugsblutung auf einen anderen Wochentag als nach dem bisherigen Einnahmeschema üblich, kann das bevorstehende einnahmefreie Intervall um die gewünschte Zahl von Tagen verkürzt werden. Je kürzer einnahmefreie Intervall, desto unwahrscheinlicher kommt es zu einer Entzugsblutung bzw. desto höher ist die Wahrscheinlichkeit einer ausbleibenden Entzugsblutung und während der Einnahme aus der folgenden Packung einsetzender Durchbruch- bzw. Schmierblutungen (wie beim Verschieben der Entzugsblutung).
4.3 Gegenanzeigen
Kombinierte hormonale Kontrazeptiva (KHK) dürfen unter den folgenden Bedingungen nicht angewendet werden.
• Vorliegen einer oder Risiko für eine venöse Thromboembolie (VTE)
- Venöse Thromboembolie - bestehende VTE (auch unter Therapie mit
Antikoagulanzien) oder VTE in der Vorgeschichte (z. B. tiefe Venenthrombose [TVT] oder Lungenembolie [LE])
- Bekannte erbliche oder erworbene Prädisposition für eine venöse Thromboembolie, wie z. B. APC-Resistenz (einschließlich Faktor-V-Leiden), Antithrombin-III-Mangel, Protein-C-Mangel oder Protein-S-Mangel
- Größere Operationen mit längerer Immobilisierung (siehe Abschnitt 4.4)
- Hohes Risiko für eine venöse Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4)
• Vorliegen einer oder Risiko für eine arterielle Thromboembolie (ATE)
- Arterielle Thromboembolie - bestehende ATE, ATE in der Vorgeschichte (z. B. Myokardinfarkt) oder Erkrankung im Prodromalstadium (z. B. Angina pectoris)
- Zerebrovaskuläre Erkrankung - bestehender Schlaganfall, Schlaganfall oder prodromale Erkrankung (z. B. transitorische ischämische Attacke [TIA]) in der Vorgeschichte
- Bekannte erbliche oder erworbene Prädisposition für eine arterielle Thromboembolie, wie z. B. Hyperhomocysteinämie und AntiphospholipidAntikörper (Anticardiolipin-Antikörper, Lupusantikoagulans)
- Migräne mit fokalen neurologischen Symptomen in der Vorgeschichte
- Hohes Risiko für eine arterielle Thromboembolie aufgrund mehrerer Risikofaktoren (siehe Abschnitt 4.4) oder eines schwerwiegenden Risikofaktors wie:
• Diabetes mellitus mit Gefäßschädigung
• Schwere Hypertonie
• Schwere Dyslipoproteinämie
• bestehende oder vorausgegangene Pankreatitis, falls verbunden mit schwerer Hypertriglyceridämie
• bestehende oder vorausgegangene schwere Lebererkrankung, solange sich die Leberfunktionswerte nicht normalisiert haben
• bestehende oder vorausgegangene benigne oder maligne Lebertumoren
• bekannte oder vermutete sexualhormonabhängige maligne Tumoren (z. B. der Gentitalorgane oder der Brust)
• Endometriumhyperplasie
• Diagnostisch nicht geklärte vaginale Blutungen
• Überempfindlichkeit gegen einen der Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• Überempfindlichkeit gegen Erdnuss oder Soja.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Warnhinweise
Die Eignung von Aurodes-EE 30 sollte mit der Frau besprochen werden, falls eine der im Folgenden aufgeführten Erkrankungen oder Risikofaktoren vorliegt.. Bei einer Verschlechterung oder dem erstmaligem Auftreten einer dieser Erkrankungen oder Risikofaktoren ist der Anwenderin anzuraten, sich an Ihren Arzt zu wenden, um zu entscheiden, ob die Anwendung von Aurodes-EE 30 beendet werden sollte.
Bei Verdacht auf oder bestätigter VTE oder ATE sollte die Einnahme des KHK abgebrochen werden. Wenn eine antikoagulatorische Therapie begonnen wird, sollten wegen der Teratogenität der antikoagulatorischen Therapie (Cumarine) angemessene alternative Verhütungsmethoden angewendet werden.
Risiko für eine venöse Thromboembolie (VTE)
Die Anwendung jedes kombinierten hormonalen Kontrazeptivums (KHK) erhöht das Risiko für eine venöse Thromboembolie (VTE) im Vergleich zur Nichtanwendung. Arzneimittel, die Levonorgestrel, Norgestimat oder Norethisteron enthalten, sind
mit dem geringsten Risiko für eine VTE verbunden. Andere Arzneimittel, wie Aurodes-EE 30, können ein bis zu doppelt so hohes Risiko aufweisen. Die Entscheidung, ein Arzneimittel anzuwenden, das nicht zu denen mit dem geringsten VTE-Risiko gehört, sollte nur nach einem Gespräch mit der Frau getroffen werden, bei dem sicherzustellen ist, dass sie Folgendes versteht: das Risiko für eine VTE bei Anwendung von Aurodes-EE 30, wie ihre vorliegenden individuellen Risikofaktoren dieses Risiko beeinflussen, und dass ihr Risiko für VTE in ihrem allerersten Anwendungsjahr am höchsten ist. Es gibt zudem Hinweise, dass das Risiko erhöht ist, wenn die Anwendung eines KHK nach einer Unterbrechung von 4 oder mehr Wochen wieder aufgenommen wird.
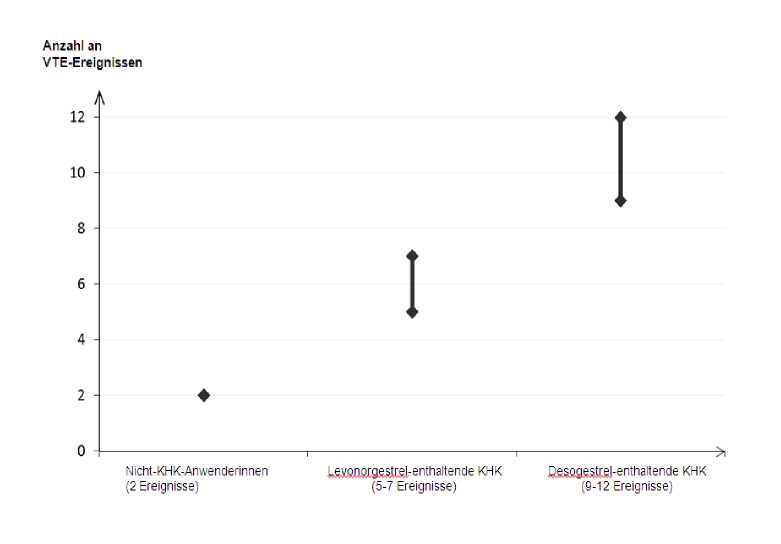
Ungefähr 2 von 10.000 Frauen, die kein KHK anwenden und nicht schwanger sind, erleiden im Verlauf eines Jahres eine VTE. Bei einer einzelnen Frau kann das Risiko jedoch in Abhängigkeit von ihren zugrunde liegenden Risikofaktoren bedeutend höher sein (siehe unten).
Es wird geschätzt1, dass im Verlauf eines Jahres 9 bis 12 von 10.000 Frauen, die ein Desogestrel-haltiges KHK anwenden, eine VTE erleiden; im Vergleich hierzu kommt es pro Jahr bei ungefähr 62 von 10.000 Frauen, die ein Levonorgestrel-haltiges KHK anwenden, zu einer VTE.
In beiden Fällen ist die Anzahl an VTE pro Jahr geringer als die erwartete Anzahl während der Schwangerschaft oder in der Zeit nach der Geburt.
VTE verlaufen in 1-2 % der Fälle tödlich.
Jährliche Anzahl an VTE-Ereignissen pro 10.000 Frauen
Äußerst selten wurde bei Anwenderinnen von KHK über eine Thrombose in anderen Blutgefäßen berichtet, wie z. B. in Venen und Arterien von Leber, Mesenterium, Nieren oder Retina.
Risikofaktoren für VTE
Das Risiko für venöse thromboembolische Komplikationen bei Anwenderinnen von KHK kann deutlich ansteigen, wenn bei der Anwenderin zusätzliche Risikofaktoren bestehen, insbesondere wenn mehrere Risikofaktoren vorliegen (siehe Tabelle).
Aurodes-EE 30 ist kontraindiziert, wenn bei einer Frau mehrere Risikofaktoren gleichzeitig bestehen, die insgesamt zu einem hohen Risiko für eine Venenthrombose führen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass des Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt- in diesem Fall muss ihr Gesamtrisiko für eine VTE in Betracht gezogen werden. Wenn das Nutzen/Risiko-Verhältnis als ungünstig erachtet wird, darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle: Risikofaktoren für VTE
Risikofaktor
Adipositas (Body-Mass-Index über 30 kg/m2)
Längere Immobilisierung, größere Operationen, jede Operation an Beinen oder Hüfte, neurochirurgische Operation oder schweres Trauma
Hinweis: Eine vorübergehende Immobilisierung einschließlich einer Flugreise von > 4 Stunden Dauer kann ebenfalls einen Risikofaktor für eine VTE darstellen, insbesondere bei Frauen mit weiteren Risikofaktoren.
Familiäre Vorbelastung (jede venöse Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, z. B. jünger als 50 Jahre). Andere Erkrankungen, die mit einer VTE verknüpft sind.
Zunehmendes Alter
Anmerkung
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig, wenn weitere Risikofaktoren vorliegen.
In diesen Fällen ist es ratsam, die Anwendung des Pflasters/der Tablette/des Rings (bei einer geplanten Operation mindestens vier Wochen vorher) zu unterbrechen und erst zwei Wochen nach der kompletten Mobilisierung wieder aufzunehmen. Es ist eine andere Verhütungsmethode anzuwenden, um eine ungewollte Schwangerschaft zu verhindern.
Eine antithrombotische Therapie muss erwogen werden, wenn Aurodes-EE 30 nicht vorab abgesetzt wurde.
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird.
Krebs, systemischer Lupus erythematodes, hämolytisches urämisches Syndrom, chronisch entzündliche Darmerkrankung (Morbus Crohn oder Colitis ulcerosa) und Sichelzellkrankheit Insbesondere älter als 35 Jahre
Es besteht kein Konsens über die mögliche Rolle von Varizen und oberflächlicher Thrombophlebitis bezüglich des Beginns oder Fortschreitens einer Venenthrombose.
Das erhöhte Risiko einer Thromboembolie in der Schwangerschaft und insbesondere während der 6-wöchigen Dauer des Wochenbetts muss berücksichtigt werden (Informationen zur „Schwangerschaft und Stillzeit" siehe Abschnitt 4.6).
Symptome einer VTE (tiefe Beinvenenthrombose und Lungenembolie)
Beim Auftreten von Symptomen ist den Anwenderinnen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden. Bei einer tiefen Beinvenenthrombose (TVT) können folgende Symptome auftreten:
- unilaterale Schwellung des Beins und/oder Fußes oder entlang einer Beinvene;
- Schmerz oder Druckschmerz im Bein, der möglicherweise nur beim Stehen oder Gehen bemerkt wird,
- Erwärmung des betroffenen Beins; gerötete oder entfärbte Haut am Bein.
Bei einer Lungenembolie (LE) können folgende Symptome auftreten:
- plötzliches Auftreten unerklärlicher Kurzatmigkeit oder schnellen Atmens;
- plötzlich auftretender Husten möglicherweise in Verbindung mit Hämoptyse;
- stechender Brustschmerz;
- starke Benommenheit oder Schwindelgefühl;
- schneller oder unregelmäßiger Herzschlag.
Einige dieser Symptome (z. B. „Kurzatmigkeit“, „Husten") sind unspezifisch und können als häufiger vorkommende und weniger schwerwiegende Ereignisse fehlinterpretiert werden (z. B. als Atemwegsinfektionen).
Andere Anzeichen für einen Gefäßverschluss können plötzlicher Schmerz sowie Schwellung und leicht bläuliche Verfärbung einer Extremität sein.
Tritt der Gefäßverschluss im Auge auf, können die Symptome von einem schmerzlosen verschwommenen Sehen bis zu einem Verlust des Sehvermögens reichen. In manchen Fällen tritt der Verlust des Sehvermögens sehr plötzlich auf.
Risiko für eine arterielle Thromboembolie (ATE)
Epidemiologische Studien haben die Anwendung von KHK mit einem erhöhten Risiko für arterielle Thromboembolie (Myokardinfarkt) oder apoplektischen Insult (z. B. transitorische ischämische Attacke, Schlaganfall) in Verbindung gebracht. Arterielle thromboembolische Ereignisse können tödlich verlaufen.
Risikofaktoren für ATE
Das Risiko für arterielle thromboembolische Komplikationen oder einen apoplektischen Insult bei Anwenderinnen von KHK erhöht sich bei Frauen, die Risikofaktoren aufweisen (siehe Tabelle). Aurodes-EE 30 ist kontraindiziert bei Frauen, die einen schwerwiegenden oder mehrere Risikofaktoren für eine ATE haben, die sie einem hohen Risiko für eine Arterienthrombose aussetzen (siehe Abschnitt 4.3). Weist eine Frau mehr als einen Risikofaktor auf, ist es möglich, dass der Anstieg des Risikos das Risiko der Summe der einzelnen Faktoren übersteigt- in diesem Fall muss ihr Gesamtrisiko betrachtet werden. Bei Vorliegen eines ungünstigen Nutzen/Risiko-Verhältnis darf ein KHK nicht verschrieben werden (siehe Abschnitt 4.3).
Tabelle: Risikofaktoren für ATE Risikofaktor Anmerkung
Zunehmendes Alter Insbesondere älter als 35 Jahre
Rauchen Frauen ist anzuraten, nicht zu rauchen, wenn Sie
ein KHK anwenden möchten. Frauen über 35 Jahren, die weiterhin rauchen, ist dringend zu empfehlen, eine andere Verhütungsmethode anzuwenden.
Hypertonie
Das Risiko nimmt mit steigendem BMI deutlich zu. Besonders wichtig bei Frauen mit zusätzlichen Risikofaktoren.
Adipositas (Body-Mass-Index über 30 kg/m2)
Familiäre Vorbelastung (jede arterielle Thromboembolie bei einem Geschwister oder Elternteil, insbesondere in relativ jungen Jahren, d. h. jünger als 50 Jahre). Migräne
Andere Erkrankungen, die mit unerwünschten Gefäßereignissen verknüpft sind.
Bei Verdacht auf eine genetische Prädisposition ist die Frau zur Beratung an einen Spezialisten zu überweisen, bevor eine Entscheidung über die Anwendung eines KHKs getroffen wird.
Ein Anstieg der Häufigkeit oder des Schweregrads der Migräne während der Anwendung von KHK (die einem zerebrovaskulären Ereignis vorausgehen kann) kann ein Grund für ein sofortiges Absetzen sein.
Diabetes mellitus, Hyperhomocysteinämie, Erkrankung der Herzklappen und Vorhofflimmern, Dyslipoproteinämie und systemischer Lupus erythematodes.
Symptome einer ATE
Beim Auftreten von Symptomen ist den Frauen anzuraten, unverzüglich ärztliche Hilfe in Anspruch zu nehmen und das medizinische Fachpersonal darüber zu informieren, dass sie ein KHK anwenden.
Bei einem apoplektischen Insult können folgende Symptome auftreten:
- plötzliche Taubheitsgefühl oder Schwäche in Gesicht, Arm oder Bein, besonders auf einer Köperseite;
- plötzliche Gehschwierigkeiten, Schwindelgefühl, Gleichgewichtsverlust oder Koordinationsstörungen;
- plötzliche Verwirrtheit, Sprech- oder Verständnisschwierigkeiten;
- plötzliche Sehstörungen in einem oder beiden Augen;
- plötzliche, schwere oder länger anhaltende Kopfschmerzen unbekannter Ursache;
- Verlust des Bewusstseins oder Ohnmacht mit oder ohne Krampfanfall. Vorübergehende Symptome deuten auf eine transitorische ischämische Attacke (TIA) handeln.
Bei einem Myokardinfarkt (MI) können folgende Symptome auftreten:
- Schmerz, Unbehagen, Druck, Schweregefühl, Enge- oder Völlegefühl in Brust, Arm oder unterhalb des Sternums;
- in den Rücken, Kiefer, Hals, Arm, Magen ausstrahlende Beschwerden;
- Völlegefühl, Indigestion oder Erstickungsgefühl;
- Schwitzen, Übelkeit, Erbrechen oder Schwindelgefühl;
- extreme Schwäche, Angst oder Kurzatmigkeit;
- schnelle oder unregelmäßige Herzschläge.
Tumorerkrankungen
• In einigen epidemiologischen Untersuchungen wurde über ein erhöhtes Zervixkarzinom-Risiko bei Langzeitanwendung von KOK (> 5 Jahre) berichtet. Kontrovers diskutiert wird nach wie vor, in welchem Ausmaß dieses Ergebnis durch das Sexualverhalten und andere Faktoren, wie eine Infektion mit dem humanen Papillomavirus (HPV), beeinflusst wird.
• Eine Metaanalyse von 54 epidemiologischen Studien hat ein leicht erhöhtes Brustkrebsrisiko (RR = 1,24) bei Frauen ergeben, die aktuell KOK einnehmen. Das
erhöhte Risiko geht innerhalb von 10 Jahren nach dem Absetzen von KOK allmählich wieder zurück. Da Brustkrebs bei Frauen unter 40 Jahren selten auftritt, ist die Anzahl zusätzlicher Brustkrebserkrankungen bei Anwenderinnen von KOK oder solchen, die früher KOK eingenommen haben, gering im Vergleich zum Gesamtrisiko an Brustkrebs zu erkranken. Ein Kausalzusammenhang wurde mit diesen Studien nicht bewiesen. Das beobachtete erhöhte Risiko kann an einer früheren Diagnose des Brustkrebses bei KOK-Anwenderinnen, den biologischen Wirkungen von KOK oder einer Kombination beider Faktoren liegen. Brustkrebs, der bei Frauen diagnostiziert wird, die irgendwann einmal ein KOK angewendet haben, scheint klinisch weniger weit fortgeschritten zu sein als Krebs bei Frauen, die noch nie ein KOK angewendet haben.
• In seltenen Fällen sind bei Anwenderinnen von KOK gutartige und noch seltener bösartige Lebertumoren beobachtet worden. In Einzelfällen führten diese Tumoren zu lebensbedrohlichen intraabdominellen Blutungen. Wenn starke Oberbauchbeschwerden, eine Lebervergrößerung oder Anzeichen einer intraabdominellen Blutung bei Frauen auftreten, die KOK einnehmen, sollte ein Lebertumor in die differentialdiagnostischen Überlegungen einbezogen werden.
• Mit der Einnahme höher dosierter KOK (50 pg Ethinylestradiol) verringert sich das Risiko eines Endometrium- und Ovarialkarzinoms. Ob dies auch für niedriger dosierte KOK gilt, muss noch nachgewiesen werden.
Sonstige Erkrankungen
• Frauen mit einer Hypertriglyzeridämie oder einer diesbezüglich positiven Familienanamnese können ein erhöhtes Risiko für die Entwicklung einer Pankreatitis haben, wenn sie KOK einnehmen.
• Obwohl bei vielen Frauen, die KOK einnehmen, ein geringer Blutdruckanstieg berichtet wurde, sind klinisch relevante Blutdruckerhöhungen selten. Nur in diesen seltenen Fällen ist eine sofortige Unterbrechung der Einnahme des KOKs gerechtfertigt. Wenn es bei einer bereits existierenden Hypertonie und der gleichzeitigen Einnahme eines KOKs zu ständig erhöhten Blutdruckwerten oder einer signifikanten Erhöhung des Blutdrucks kommt, und in diesen Fällen eine antihypertensive Therapie keine Wirkung zeigt, muss das KOK abgesetzt werden. Wenn es angemessen erscheint, kann die Einnahme des KOKs wieder begonnen werden, sobald sich die Blutdruckwerte unter der antihypertensiven Therapie normalisiert haben
• Die folgenden Erkrankungen sollen Berichten zufolge sowohl in der Schwangerschaft als auch unter Einnahme eines KOKs auftreten bzw. sich verschlechtern. Jedoch konnte ein Zusammenhang mit der Einnahme von KOK nicht bewiesen werden: cholestatischer Ikterus und/oder Pruritus im Zusammenhang mit Cholestase; Cholelithiasis; Porphyrie; systemischer Lupus erythematodes; hämolytisch-urämisches Syndrom; Sydenham-Chorea; Herpes gestationis; Otosklerosebedingte Schwerhörigkeit; (hereditäres) Angioödem.
• Akute oder chronische Leberfunktionsstörungen können eine Unterbrechung der Einnahme des KOKs erforderlich machen, bis sich die Leberfunktionswerte wieder normalisiert haben. Auch ein Rezidiv eines in einer vorausgegangenen Schwangerschaft oder während einer früheren Einnahme von steroidalen Geschlechtshormonen aufgetretenen cholestatischen Ikterus und/oder eines cholestasebedingten Pruritus macht das Absetzen des KOKs erforderlich.
• Obwohl KOK einen Einfluss auf die periphere Insulinresistenz und Glucosetoleranz haben können, liegen keine Hinweise auf die Notwendigkeit einer Änderung des Therapieregimes bei Diabetikerinnen vor, die niedrig dosierte KOK einnehmen (mit < 0,05 mg Ethinylestradiol). Diabetikerinnen müssen jedoch sorgfältig überwacht werden, insbesondere in der ersten Zeit der Anwendung eines KOKs.
• Bei Einnahme von KOK wurde über eine Verschlechterung endogener Depressionen, Epilepsie, Morbus Crohn und Colitis ulcerosa berichtet.
• Chloasmen können gelegentlich auftreten, insbesondere bei Frauen mit Chloasma gravidarum in der Anamnese. Frauen mit dieser Veranlagung sollten sich daher während der Einnahme von KOK nicht direkt der Sonne oder ultraviolettem Licht aussetzen.
• Aurodes-EE 30 enthält 55 mg Lactose pro Filmtablette. Anwenderinnen mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Aurodes-EE 30 nicht einnehmen.
Alle oben aufgeführten Informationen müssen bei der Abwägung und Auswahl einer geeigneten kontrazeptiven Methode Berücksichtigung finden.
Ärztliche Untersuchung/Beratung
Vor der Einleitung oder Wiederaufnahme der Behandlung mit von Aurodes-EE 30 muss eine vollständige Anamnese (mit Erhebung der Familienanamnese) erfolgen und eine Schwangerschaft ausgeschlossen werden. Der Blutdruck sollte gemessen und eine körperliche Untersuchung durchgeführt werden, die sich an den Gegenanzeigen (siehe Abschnitt 4.3) und Warnhinweise (siehe Abschnitt 4.4) orientiert. Es ist wichtig, die Frau auf die Informationen zu venösen und arteriellen Thrombosen hinzuweisen, einschließlich des Risikos von Aurodes-EE 30 im Vergleich zu anderen KHK, die Symptome einer VTE und ATE, die bekannten Risikofaktoren und darauf, was im Falle einer vermuteten Thrombose zu tun ist.
Die Anwenderin ist zudem anzuweisen, die Packungsbeilage sorgfältig zu lesen und die darin gegebenen Ratschläge zu befolgen. Die Häufigkeit und Art der Untersuchungen sollte den geltenden Untersuchungsleitlinien entsprechen und individuell auf die Frau abgestimmt werden.
Die Anwenderinnen sind darüber aufzuklären, dass hormonale Kontrazeptiva nicht vor HIV-Infektionen (AIDS) und anderen sexuell übertragbaren Krankheiten schützen.
Verminderte Wirksamkeit
Die Wirksamkeit von KOK kann beeinträchtigt sein, wenn z. B. wirkstoffhaltige Tabletten vergessen wurden (siehe Abschnitt 4.2.3), bei gastrointestinalen Beschwerden während der Einnahme wirkstoffhaltiger Tabletten (siehe Abschnitt 4.2.4) oder wenn gleichzeitig bestimmte andere Arzneimittel eingenommen werden (siehe Abschnitt 4.5.1).
Pflanzliche Arzneimittel, die Johanniskraut (Hypericum perforatum) enthalten, sollten nicht gleichzeitig mit Aurodes-EE 30 angewendet werden, da das Risiko besteht, dass die Plasmakonzentrationen erniedrigt werden und die Wirksamkeit von Aurodes-EE 30 eingeschränkt wird (siehe Abschnitt 4.5).
Beeinträchtigung der Zykluskontrolle
Bei allen KOK kann es, insbesondere in den ersten Monaten der Einnahme, zu unregelmäßigen Blutungen (Schmier- oder Durchbruchblutungen) kommen. Eine diagnostische Abklärung dieser Zwischenblutungen ist deshalb erst nach einer Anpassungsphase von ungefähr drei Zyklen sinnvoll.
Bei anhaltenden, unregelmäßigen Blutungen oder beim Auftreten von Blutungsunregelmäßigkeiten bei bislang regelmäßigen Zyklen sollten nichthormonale Ursachen in Betracht gezogen und entsprechende diagnostische Maßnahmen ergriffen werden, um eine maligne Erkrankung oder eine Schwangerschaft auszuschließen. Dies kann auch eine Kürettage beinhalten.
Es ist möglich, dass es bei einigen Anwenderinnen im einnahmefreien Intervall zu keiner Entzugsblutung kommt. Wenn das KOK wie unter Abschnitt 4.2 beschrieben eingenommen wurde, ist eine Schwangerschaft unwahrscheinlich. Wenn die Einnahme des KOK jedoch vor der ersten ausgebliebenen Entzugsblutung nicht vorschriftsmäßig erfolgt ist oder bereits zum zweiten Mal die Entzugsblutung ausgeblieben ist, muss eine Schwangerschaft ausgeschlossen werden, bevor die Anwendung des KOK fortgesetzt wird.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Hinweis: Die Fachinformationen gleichzeitig verordneter Arzneimittel sollten auf mögliche Wechselwirkungen überprüft werden.
Einfluss anderer Arzneimittel auf Aurodes-EE 30
Wechselwirkungen von oralen Kontrazeptiva mit anderen Arzneimitteln können zu Durchbruchblutungen und/oder Versagen des oralen Kontrazeptivums führen. Die folgenden Wechselwirkungen sind in der Literatur beschrieben:
Leberstoffwechsel
Wechselwirkungen können mit Arzneimitteln auftreten, die Leberenzyme induzieren; dies kann eine erhöhte Clearance von Sexualhormonen zur Folge haben (z. B. Hydantoine, Barbiturate, Primidon, Bosentan, Carbamazepin, Rifampicin, Rifabutin und möglicherweise auch Oxcarbazepin, Modafinil, Topiramat, Felbamat, Ritonavir, Griseofulvin sowie Produkte, die Johanniskraut enthalten). Zudem können HIV-Proteaseinhibitoren mit induzierendem Potenzial (z. B. Ritonavir und Nelfinavir) sowie nichtnukleosidische Reverse-Transkriptase Inhibitoren (z. B. Nevirapin und Efavirenz) den Leberstoffwechsel beeinflussen. Die Enzyminduktion erreicht zwar im Allgemeinen erst nach 2-3 Wochen ihr Maximum, kann aber nach Absetzen des Arzneimittels noch 4 Wochen oder länger anhalten.
Wechselwirkungen mit dem enterohepatischen Kreislauf:
Ein Versagen oraler Kontrazeptiva wurde auch unter der Gabe von Antibiotika wie Penicillinen und Tetrazyklinen berichtet. Der Mechanismus dieser Wechselwirkung ist bislang nicht geklärt.
Vorgehensweis
Frauen, die kurzzeitig mit Arzneimitteln irgendeiner der genannten Substanzklassen oder mit einzelnen Wirkstoffen (Leberenzym-induzierende Arzneimittel) mit Ausnahme von Rifampicin behandelt werden, sollten während dieser Zeit neben dem KOK zusätzlich eine Barrieremethode anwenden, d. h. während der Einnahme der Begleitmedikation und noch 7 Tage darüber hinaus.
Mit Rifampicin behandelte Frauen sollten zusätzlich zu dem KOK eine Barrieremethode für die Dauer der Rifampicinbehandlung und weitere 28 Tage darüber hinaus anwenden.
Bei Frauen, die längerfristig mit Leberenzym-induzierenden Wirkstoffen behandelt werden, wird die Anwendung einer anderen zuverlässigen, nichthormonalen Verhütungsmethode empfohlen.
Falls die Begleitmedikation auch nach Einnahmeende der wirkstoffhaltigen Tabletten der aktuellen Blisterpackung des KOK fortgesetzt werden muss, dann sollte direkt, ohne das übliche einnahmefreie Intervall, mit der Einnahme aus der nächsten Packung des KOKs begonnen werden.
Einfluss von Aurodes-EE 30 auf andere Arzneimittel
Orale Kontrazeptiva können den Stoffwechsel bestimmter anderer Wirkstoffe beeinflussen. Entsprechend können Plasma- und Gewebekonzentrationen entweder erhöht (z. B. Ciclosporin) oder erniedrigt (z. B. Lamotrigin) werden.
Labortests
Die Einnahme von steroidalen Kontrazeptiva kann die Ergebnisse bestimmter Labortests beeinflussen, u. a. die biochemischen Parameter der Leber-, Schilddrüsen-, Nebennieren- und Nierenfunktion sowie die Plasmaspiegel von (Träger-)Proteinen, z. B. des kortikosteroidbindenden Globulins und der Lipid-/Lipoprotein-Fraktionen, die Parameter des Kohlenhydratstoffwechsels sowie die Gerinnungs- und Fibrinolyseparameter. Im Allgemeinen bleiben diese Veränderungen jedoch innerhalb des Normbereichs.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Aurodes-EE 30 ist während der Schwangerschaft nicht angezeigt. Falls unter der Einnahme von Aurodes-EE 30 eine Schwangerschaft eintritt, ist das Arzneimittel sofort abzusetzen. In umfangreichen epidemiologischen Untersuchungen fand sich weder ein erhöhtes Risiko für Missbildungen bei Kindern, deren Mütter vor der Schwangerschaft KOK eingenommen hatten, noch eine teratogene Wirkung bei versehentlicher Einnahme von KOK in der Schwangerschaft
Das erhöhte VTE-Risiko in der Zeit nach der Geburt sollte vor der erneuten Anwendung nach einer Anwendungspause bedacht werden (siehe Abschnitte 4.2 und 4.4).
Stillzeit
KOK können die Laktation beeinflussen, da sie die Menge der Muttermilch vermindern und ihre Zusammensetzung verändern können. Daher wird die Einnahme von KOK generell nicht empfohlen, solange eine Mutter ihr Kind nicht vollständig abgestillt hat. Geringe Mengen der kontrazeptiven Steroide und/oder ihrer Metaboliten können während der KOK- Einnahme in die Muttermilch ausgeschieden werden. Diese Mengen könnten das Kind beeinträchtigen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Es wurden keine Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen bei Anwenderinnen von KOK beobachtet.
Für schwerwiegende Nebenwirkungen bei KOK-Anwenderinnen siehe Abschnitt 4.4.
Bei der Einnahme von Aurodes-EE 30 wurde über folgende Nebenwirkungen des Arzneimittels berichtet:
|
Systemorganklasse |
Sehr häufig (> 1/10) |
Häufig/Gelegentlich (> 1/1.000, < 1/10) |
Selten (< 1/1.000) |
|
Infektionen und parasitäre Erkrankungen |
vaginale Candidose | ||
|
Erkrankungen des Immunsystems |
Überempfindlichkeit | ||
|
Stoffwechsel- und Ernährungsstörungen |
Flüssigkeitsretention | ||
|
Psychiatrische Erkrankungen |
depressive Verstimmung Stimmungsschwankungen verminderte Libido |
gesteigerte Libido | |
|
Erkrankungen des Nervensystems |
Kopfschmerzen Schwindel Nervosität | ||
|
Augenerkrankungen |
Beschwerden beim T ragen von Kontaktlinsen | ||
|
Erkrankungen des Ohrs und des Labyrinths |
Otosklerose | ||
|
Gefäßerkrankungen |
Migräne Hypertonie |
Venöse Thromboembolie Arterielle Thromboembolie | |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit abdominale Schmerzen Erbrechen | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Akne Hautausschlag, Urtikaria |
Erythema nodosum, Erythema multiform Pruritus Alopezie | |
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Unregelmäßige Blutungen |
Amenorrhoe Spannungsgefühl in den Brüsten Brustschmerzen Brustvergrößerung Metrorrhagie |
vaginaler Ausfluss Brustdrüsensekretion |
|
Untersuchungen |
Gewichts zunahme |
Beschreibung ausgewählter Nebenwirkungen
Bei Anwenderinnen von KOK wurde über die folgenden schweren unerwünschten Ereignisse berichtet, die in Abschnitt 4.4 „Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung" erläutert werden:
- Bei Anwenderinnen von KHK wurde ein erhöhtes Risiko für arterielle und venöse thrombotische und thromboembolische Ereignisse einschließlich Myokardinfarkt, Schlaganfall, transitorische ischämische Attacken, Venenthrombose und Lungenembolie beobachtet, die in Abschnitt 4.4 eingehender behandelt werden.
- Hypertonie
- hormonabhängige Tumoren (z. B. Lebertumoren, Brustkrebs)
- Auftreten oder Verschlechterung von Erkrankungen, für die ein Zusammenhang mit der Einnahme von KOK nicht eindeutig nachgewiesen ist: Morbus Crohn, Colitis ulcerosa, Epilepsie, Migräne, Endometriose, Uterusmyom, Porphyrie, systemischer Lupus erythematodes, Herpes gestationis, Sydenham-Chorea, hämolytischurämisches Syndrom, cholestatischer Ikterus;
- Chloasma
- Akute oder chronische Leberfunktionsstörungen können die Unterbrechung des KOK erforderlich machen, bis sich die Leberfunktionswerte wieder normalisiert haben
- Bei Frauen mit hereditärem Angioödem können exogen zugeführte Estrogene die Symptome eines Angioödems auslösen oder verschlimmern.
Die Diagnosehäufigkeit von Brustkrebs unter Anwenderinnen von KOK ist geringfügig erhöht. Da bei Frauen unter 40 Jahren Brustkrebs selten auftritt, ist das zusätzliche Risiko im Verhältnis zum Gesamtrisiko, an Brustkrebs zu erkranken, gering. Die Kausalität mit der Einnahme von KOK ist nicht bekannt. Für weitere Informationen siehe Abschnitte 4.3 und 4.4.
Sojaöl kann sehr selten allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Für Aurodes-EE 30 liegen bislang keine Erfahrungen zur Überdosierung vor. Ausgehend von den mit kombinierten oralen Kontrazeptiva gesammelten allgemeinen Erfahrungen können möglicherweise folgende Symptome auftreten: Übelkeit, Erbrechen und bei jungen Mädchen leichte vaginale Blutungen. Es gibt kein Antidot und die weitere Behandlung erfolgt symptomatisch.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1
Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Gestagene und Estrogene, fixe Kombinationen ATC-Code: G03AA09
Die empfängnisverhütende Wirkung von kombinierten oralen Kontrazeptiva auf dem Zusammenspiel verschiedener Faktoren, wobei die Ovulationshemmung und Endometriumveränderungen als die wichtigsten Faktoren anzusehen sind.
Aurodes-EE 30 ist ein KOK mit Ethinylestradiol und dem Gestagen Desogestrel. Ethinylestradiol ist ein bekanntes synthetisches Östrogen.
Desogestrel ist ein synthetisches Gestagen. Nach oraler Gabe es hat eine starke ovulationshemmende Wirkung.
In der größten multizentrischen Studie (n = 23 258 Zyklen) wird der unkorrigierte PearlIndex auf 0,1 (95% Konfidenzintervall 0,0-0,3) geschätzt. Darüber hinaus berichten 4,5% der Frauen ein Ausbleiben der Entzugsblutungen und 9,2% ein Auftreten von unregelmäßigen Blutungen nach 6 Behandlungszyklen.
Kinder und Jugendliche
Es liegen keine klinischen Daten zur Wirksamkeit und Sicherheit bei Jugendlichen unter 18 Jahren vor.
5.2 Pharmakokinetische Eigenschaften Desogestrel
Resorption
Desogestrel wird nach oraler Verabreichung von Aurodes-EE 30 rasch und vollständig resorbiert und in Etonogestrel umgewandelt. Maximale Blutspiegel von 2 ng/ml werden ca. 1,5 Stunden nach Verabreichung einer Einzeldosis erreicht. Die Bioverfügbarkeit von Etonogestrel beträgt 62-81 %.
Verteilung
Etonogestrel wird sowohl an Albumin als auch an Sexualhormon-bindendes Globulin (SHBG) gebunden. Die Ethinylestradiol-bedingte Zunahme der SHBG-Konzentration beeinflusst sowohl die Bindung von Etonogestrel an Serumproteine als auch die Verteilung im Plasma. Als Folge steigt die Konzentration von Etonogestrel während der Behandlung langsam an, bis innerhalb von 3-13 Tagen ein Steady State erreicht wird.
Metabolismus
Der Phase-I-Metabolismus von Desogestrel besteht aus einer Cytochrom P-450-katalysierten Hydroxylierung und anschließender Dehydrierung an C3. Der aktive Metabolit von Etonogestrel wird weiter abgebaut, die Abbauprodukte sind zu Sulfaten und Glucuroniden konjugiert. Tierstudien zeigen, dass der enterohepatische Kreislauf keine Relevanz für die gestagene Wirksamkeit von Desogestrel hat.
Elimination
Etonogestrel wird mit einer Halbwertszeit von ca. 31 (24-38) Stunden ausgeschieden, die Plasma-Clearance liegt zwischen 5,0-9,5 l/Stunde. Desogestrel und seine Metaboliten werden entweder als freie Steroide oder Konjugate mit dem Harn und den Fäces in einem Verhältnis von ca. 1,5:1 ausgeschieden.
Steady state Bedingungen
Unter Steady-State-Bedingungen sind die Serumspiegel von Etonogestrel um etwa das Zwei- bis Dreifache erhöht.
Ethinylestradiol
Resorption
Oral angewendetes Ethinylestradiol wird schnell und vollständig resorbiert. Nach Einmalgabe werden maximale Blutspiegel von 80 pg/ml nach 1,5 Stunden erreicht. Infolge der präsystemischen Konjugation und des First-Pass-Metabolismus liegt die absolute Bioverfügbarkeit bei ca. 60 %. Die Fläche unter der Kurve und Cmax können im Laufe der Zeit leicht an steigen.
Verteilung
Ethinylestradiol ist zu 98,8 % an Serumproteine gebunden, fast ausschließlich an Albumin.
Metabolismus
Ethinylestradiol unterliegt der präsystemischen Konjugation sowohl in der Mukosa des Dünndarms als auch in der Leber. Die Hydrolyse der direkten Konjugate von Ethinylestradiol mit Hilfe der Darmflora ergibt Ethinylestradiol, das wieder aufgenommen werden kann, und hiermit ein enterohepatischer Kreislauf einsetzt. Der primäre Weg des Metabolismus von Ethinylestradiol ist eine Cytochrom P-450-vermittelte Hydroxylierung zu den primären Metaboliten 2-OH-EE und 2-Methoxy-EE. 2-OH-EE wird weiter zu chemisch reaktiven Metaboliten verstoffwechselt.
Elimination
Der Ethinylestradiol-Serumspiegel nimmt mit einer Halbwertszeit von ca. 29 (26-33) Stunden ab, die Plasma-Clearance liegt zwischen 10-30 l/Stunde. Die Konjugate von Ethinylestradiol und die Metaboliten werden mit dem Harn und den Fäces (Verhältnis 1:1) ausgeschieden.
Steady state-Bedingungen
Der Steady state wird nach 3-4 Tagen erreicht, wobei die Serumkonzentration um 3040 % höher als nach Verabreichung einer Einzeldosis ist.
5.3 Präklinische Daten zur Sicherheit
In toxikologische Studien beschränkten sich die Effekte von Aurodes-EE 30 auf diejenigen, die mit den bekannten pharmakologischen Wirkungen der enthaltenen Hormone in Verbindung gebracht werden.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
- Tablettenkern: Lactose-Monohydrat Maisstärke Povidon K30 All-rac-alpha-T ocopherol
Raffiniertes Sojaöl (Ph.Eur.) hochdisperses Siliciumdioxid hochdisperses Siliciumdioxid, wasserfrei Stearinsäure (Ph.Eur.) [pflanzlich]
- Filmüberzug:
Hypromellose Triacetin Polysorbat 80 Titandioxid (E171)
6.2 Inkompatibilitäten
Nicht bekannt.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30°C lagern. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
Blisterpackung aus einer Aluminium-Durchdrückfolie und einer klaren bis leicht opaken PVC / PVDC-Folie. Die Packungen enthalten außerdem ein Pillenetui.
Packungsgrößen:
1 x 21 Filmtabletten 3 x 21 Filmtabletten 6 x 21 Filmtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Actavis Group PTC ehf. Reykjavikurvegur 76 - 78 220 Hafnarfjördur Island
Mitvertrieb:
Actavis Deutschland GmbH & Co. KG Willy-Brandt-Allee 2 81829 München
Telefon: 089/558909 - 0 Telefax: 089/558909 - 240
8. ZULASSUNGSNUMMER
88579.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 25. November 2013
10. STAND DER INFORMATION
März 2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Diese Inzidenzen wurden aus der Gesamtheit der epidemiologischen Studiendaten abgeleitet, wobei relative Risiken der verschiedenen Arzneimittel im Vergleich zu Levonorgestrel-haltigen KHK verwendet wurden.
Mittelwert der Spannweite 5-7 pro 10.000 Frauenjahre, auf der Grundlage eines relativen Risikos für Levonorgestrel-haltige KHK versus Nichtanwendung von ungefähr 2,3 bis 3,6