Azzalure
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Azzalure 10 Speywood-Einheiten/0,05 ml Pulver zur Herstellung einer Injektionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Clostridium botulinum Toxin Typ A* 10 Speywood-Einheiten**/0,05 ml rekonstituierte Lösung Durchstechflasche mit 125 Einheiten
*Clostridium botulinum Toxin Typ A-Hämagglutinin-Komplex
**Eine Speywood-Einheit (U) ist definiert als mediane letale peritoneale Dosis bei Mäusen (LD50).
Die Speywood-Einheiten von Azzalure sind für das Arzneimittel spezifisch und nicht auf andere Botulinumtoxin-Präparate übertragbar.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver zur Herstellung einer Injektionslösung.
Das Pulver ist weiß.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Azzalure wird angewendet zur vorübergehenden Verbesserung des Erscheinungsbildes von mittelstarken bis starken Glabellafalten (vertikale Falten zwischen den Augenbrauen) beim Stirnrunzeln bei erwachsenen Patienten unter 65 Jahren, wenn das Ausmaß dieser Falten eine erhebliche psychische Belastung für den Patienten darstellt.
4.2 Dosierung und Art der Anwendung
Dosierung
Botulinumtoxin-Einheiten sind je nach Arzneimittel verschieden. Die Speywood-Einheiten von Azzalure sind für das Arzneimittel spezifisch und nicht auf andere Botulinumtoxin-Präparate übertragbar.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Azzalure bei Personen unter 18 Jahren wurde nicht nachgewiesen.
Art der Anwendung (siehe Abschnitt 6.6)
Azzalure darf nur von Ärzten mit geeigneter Qualifikation angewendet werden, die die entsprechende Erfahrung mit dieser Behandlung haben und über die erforderliche Ausstattung verfügen.
Azzalure darf nach Rekonstitution nur für eine Behandlung bei einem Patienten verwendet werden.
Vor der Injektion muss das Arzneimittel rekonstituiert werden; die entsprechenden Anweisungen hierzu finden sich in Abschnitt 6.6.
Jedes Make-up ist zu entfernen, und die Haut ist mit einem Lokalantiseptikum zu desinfizieren.
Die intramuskulären Injektionen sollten im rechten Winkel zur Haut mit einer sterilen 29-30
Gauge-Nadel vorgenommen werden.
Hinweise für die Anwendung
Die empfohlene Dosis beträgt 50 Speywood-Einheiten (0,25 ml rekonstituierte Lösung) Azzalure, aufgeteilt auf 5 Injektionsstellen, d. h. es werden 10 Speywood-Einheiten (0,05 ml der rekonstituierten Lösung) intramuskulär an jeder der 5 Injektionsstellen angewendet: Zwei Injektionen in jeden M. corrugator und eine Injektion in den M. procerus in der Nähe des Nasofrontalwinkels, wie unten dargestellt:
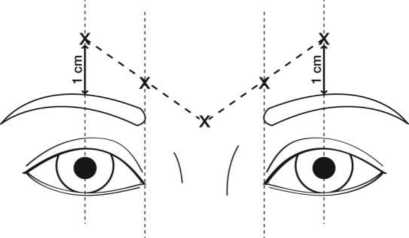
Die anatomischen Orientierungspunkte können schneller ermittelt werden, wenn sie bei maximalem Stirnrunzeln beobachtet und palpiert werden. Vor der Injektion Daumen oder Zeigefinger fest unter den Augenhöhlenrand drücken, um eine Extravasation unter den Augenhöhlenrand zu verhindern. Die Nadel sollte während der Injektion nach superior und medial ausgerichtet sein. Um das Risiko einer Ptosis zu reduzieren, Injektionen in der Nähe des M. levator palpebrae superioris vermeiden, insbesondere bei Patienten mit größeren Brauendepressorkomplexen (M. depressor supercilii). Injektionen in den M. corrugator dürfen nur im Mittelteil des Muskels mindestens 1 cm über dem Augenhöhlenrand erfolgen.
Das Therapieintervall ist von dem festgestellten individuellen Ansprechen des jeweiligen Patienten abhängig. In klinischen Studien wurde die optimale Wirkung für bis zu 4 Monate nach Injektion nachgewiesen. Einige Patienten sprachen auch noch nach 5 Monaten auf die Therapie an (siehe Abschnitt 5.1). Das Therapieintervall sollte nicht häufiger als alle 3 Monate sein.
Wenn die Behandlung fehlschlägt oder die Wirkung bei Wiederholungsinjektionen nachlässt, sollten alternative Behandlungsmethoden angewendet werden. Bei Fehlschlagen der Behandlung nach der ersten Anwendung können folgende Maßnahmen in Erwägung gezogen werden:
o Analyse der Gründe für das Therapieversagen, z. B. falsche Muskeln, in die injiziert wurde, Injektionstechnik und Bildung Toxin-neutralisierender Antikörper
o Erneute Überprüfung der Relevanz der Behandlung mit Clostridium botulinum Toxin Typ A
4.3 Gegenanzeigen
o Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
o Infektionen an den vorgesehenen Injektionsstellen.
o Myasthenia gravis, Eaton-Lambert-Syndrom oder amyotropher Lateralsklerose.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Azzalure ist bei Patienten mit einem Risiko für oder mit klinisch nachgewiesener gestörter neuromuskulärer Reizleitung mit Vorsicht anzuwenden. Solche Patienten haben möglicherweise eine erhöhte Empfindlichkeit gegen Arzneimittel wie Azzalure. Dies kann zu übermäßiger
Muskelschwäche führen.
Nebenwirkungen, die möglicherweise mit der Ausbreitung der Wirkung des Toxins an vom Applikationsort entfernte Stellen in Zusammenhang stehen, wurden bei Botulinumtoxin sehr selten berichtet. Bei Patienten, die mit therapeutischen Dosen behandelt wurden, kann eine übersteigerte Muskelschwäche auftreten.
Die Injektion von Azzalure ist bei Patienten mit einer Vorgeschichte von Dysphagie und Aspiration nicht zu empfehlen.
Patienten oder pflegende Personen sollten darauf hingewiesen werden, dass sofort ein Arzt zu verständigen ist, wenn Schluck-, Sprech- oder Atemstörungen auftreten.
Die empfohlenen Dosierungen und die Häufigkeit der Anwendung von Azzalure dürfen nicht überschritten werden.
Es ist unbedingt erforderlich, dass sich der Arzt vor der Anwendung von Azzalure mit der Anatomie des Gesichts des Patienten vertraut macht. Gesichtsasymmetrien, Ptosis, übermäßige Dermatochalasis, Vernarbungen und irgendwelche aufgrund früherer chirurgischer Eingriffe entstandene anatomische Veränderungen sollten berücksichtigt werden.
Azzalure sollte nur mit Vorsicht angewendet werden bei Entzündung der vorgesehenen Injektionsstelle(n) oder bei ausgeprägter Schwäche oder Atrophie des zu injizierenden Muskels.
Wie bei allen intramuskulären Injektionen wird eine Behandlung mit Azzalure bei Patienten mit verlängerter Blutgerinnungszeit nicht empfohlen.
Injektionen in kürzeren Abständen oder mit zu hohen Dosierungen können das Risiko einer Antikörperbildung gegen Botulinumtoxin erhöhen. Klinisch kann die Bildung neutralisierender Antikörper die Wirksamkeit der nachfolgenden Behandlung verringern.
Die Wirkung der Anwendung verschiedener Botulinum-Neurotoxine während der Behandlung mit Azzalure ist nicht bekannt und muss daher vermieden werden.
Azzalure darf nur zur Behandlung eines einzelnen Patienten bei einer Sitzung verwendet werden. Übrig gebliebenes, nicht verwendetes Arzneimittel muss, wie in Abschnitt 6.6 näher beschrieben, entsorgt werden. Besondere Vorsicht ist bei der Zubereitung und Anwendung des Produkts sowie bei der Inaktivierung und Entsorgung der restlichen, nicht verwendeten Lösung erforderlich (siehe Abschnitt 6.6).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Behandlung mit Azzalure und Aminoglykosiden oder anderen Arzneimitteln, die auf die neuromuskuläre Reizleitung wirken (z. B. Curare-ähnliche Wirkstoffe), sollte nur mit Vorsicht erfolgen, da die Wirkung von Clostridium botulinum Toxin Typ A potenziert werden kann.
Es wurden keine Wechselwirkungsstudien durchgeführt. Es wurden keine anderen Wechselwirkungen mit klinischer Relevanz berichtet.
4.6 Schwangerschaft und Stillzeit Schwangerschaft
Azzalure darf nicht in der Schwangerschaft angewendet werden, es sei denn, dies ist eindeutig erforderlich. Es liegen keine hinreichenden Daten über die Anwendung von Clostridium botulinum Toxin Typ A bei schwangeren Frauen vor. In Studien an Tieren wurde bei hohen Dosierungen eine reproduktionstoxische Wirkung nachgewiesen (siehe Abschnitt 5.3). Das potenzielle Risiko für den Menschen ist nicht bekannt.
Stillzeit
Es ist nicht bekannt, ob Azzalure in die Muttermilch übergeht. Die Anwendung von Azzalure während der Stillzeit kann nicht empfohlen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es besteht ein potenzielles Risiko für eine lokalisierte Muskelschwäche oder Sehstörungen im Zusammenhang mit der Anwendung dieses Arzneimittels, die die Fähigkeit zum Führen eines Fahrzeugs oder zum Bedienen von Maschinen vorübergehend beeinträchtigen können.
4.8 Nebenwirkungen
Mehr als 1.900 Patienten erhielten in den verschiedenen klinischen Studien Azzalure.
In zulassungsrelevanten klinischen Studien wurden über 1.500 Patienten mit mittelstarken bis starken Glabellafalten mit der empfohlenen Dosis von 50 Einheiten im Rahmen von doppelblinden, placebokontrollierten Studien und offenen Langzeitstudien behandelt.
In zulassungsrelevanten doppelblinden, placebokontrollierten Einzeldosisstudien trat bei 22,3 % der Patienten, die mit der empfohlenen Dosierung von Azzalure (50 Einheiten) behandelt wurden und bei 16,6 % der Patienten, die Placebo erhielten, eine Reaktion auf, die entweder mit der Behandlung, der Injektionstechnik oder mit beidem zusammenhing. In einer offenen Phase-III-Langzeitdosisstudie, in der die Patienten mehrere Injektionszyklen erhielten, trat bei 26 % der Patienten nach der ersten Injektion mindestens eine Reaktion auf, die mit der Behandlung bzw. der Injektionstechnik zusammenhing. Die Inzidenz der Reaktionen, die mit der Behandlung bzw. mit der Injektionstechnik zusammenhingen, verringerte sich während der Wiederholungszyklen.
Die am häufigsten auftretenden, mit der Behandlung bzw. der Injektionstechnik zusammenhängenden Reaktionen sind Kopfschmerzen und Reaktionen an der Injektionsstelle. Im Allgemeinen treten mit der Behandlung bzw. mit der Injektionstechnik zusammenhängende Reaktionen innerhalb der ersten Woche nach der Injektion auf und sind vorübergehend. Die Mehrzahl dieser berichteten Reaktionen war leicht oder mittelschwer ausgeprägt und reversibel.
Die Häufigkeit von Nebenwirkungen wird wie folgt eingeteilt:
Sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1.000 bis < 1/100), selten (> 1/10.000 bis < 1/1.000), sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Erkrankungen des Nervensystems |
Sehr Häufig Kopfschmerzen Häufig Fazialisparese (überwiegend wird Lidheberparese beschrieben) Gelegentlich Schwindel |
|
Augenerkrankungen |
Häufig Asthenopie, Ptosis, Lidödeme, vermehrter Tränenfluss, trockenes Auge, Muskelzucken (Zucken der Muskeln in der Umgebung der Augen) Gelegentlich Sehstörungen, Verschwommensehen, Diplopie, Störung der Augenbewegungen |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Gelegentlich Juckreiz, Hautausschlag Selten Urticaria |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Sehr häufig Reaktionen an der Einstichstelle (z. B. Hautrötung, Ödem, Reizung, Hautausschlag (Rash), Juckreiz, Parästhesien, Schmerzen, Beschwerden, Stechen und Bluterguss) |
|
Erkrankungen des Immunsystems |
Gelegentlich Überempfindlichkeit |
Uber Nebenwirkungen, für die eine sich von der Injektionsstelle ausbreitende Toxinwirkung verantwortlich gemacht wird (übermäßige Schwächung der Muskulatur, Dysphagie, Aspirationspneumonie, in einigen Fällen mit tödlichem Ausgang), wurde nach Anwendung mit Botulinumtoxin sehr selten berichtet (siehe Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit.
Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt.
Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Während der klinischen Studien traten keine Fälle einer Überdosierung auf.
Es ist davon auszugehen, dass übermäßig hohe Dosen von Botulinumtoxin eine neuromuskuläre Schwäche mit einer Vielzahl von Symptomen hervorrufen. Bei Patienten, bei denen übermäßig hohe Dosen zu einer Lähmung der Atemmuskulatur führen, kann eine Beatmung erforderlich sein. Im Falle einer Überdosierung muss der Patient ärztlich auf Symptome einer übermäßigen Muskelschwäche oder einer Muskellähmung überwacht werden. Falls erforderlich, ist eine symptomorientierte Behandlung einzuleiten.
Es kann sein, dass Symptome einer Überdosierung nicht unmittelbar nach einer Injektion auftreten.
Eine Einweisung in ein Krankenhaus sollte bei Patienten erwogen werden, bei denen Symptome einer Vergiftung mit Clostridium botulinum Toxin Typ A festgestellt werden (z. B. eine Kombination aus Muskelschwäche, Ptosis, Diplopie, Schluck- und Sprechstörungen oder Lähmung der Atemmuskulatur).
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere Muskelrelaxanzien, peripher wirkende Mittel ATC-Code: M03AX01
Die wichtigste pharmakodynamische Wirkung von Clostridium botulinum Toxin Typ A ist auf die chemische Denervierung des behandelten Muskels zurückzuführen, die zu einer messbaren Verringerung des Muskelsummenpotenzials führt, welche eine örtlich begrenzte Verringerung oder eine Lähmung der Muskelaktivität bewirkt.
Während der klinischen Entwicklung von Azzalure wurden mehr als 2.600 Patienten in die verschiedenen klinischen Studien einbezogen.
In klinischen Studien wurden 1.907 Patienten mit mittelstarken bis starken Glabellafalten mit der empfohlenen Dosis von 50 Speywood-Einheiten behandelt. Von diesen Patienten wurden 305 mit 50 Einheiten in zwei zulassungsrelevanten, doppelblinden, placebokontrollierten Phase-III-Studien und 1.200 mit 50 Einheiten in einer offenen Phase-III-Langzeitstudie mit wiederholter Anwendung behandelt. Die übrigen Patienten wurden in supportiven Studien und Dosisfindungsstudien behandelt.
Die mediane Zeit bis zum Eintreten der Reaktion betrug 2 bis 3 Tage nach der Behandlung, wobei die maximale Wirkung am Tag 30 beobachtet wurde. In beiden zulassungsrelevanten, placebokontrollierten Phase-III-Studien verringerten die Azzalure-Injektionen signifikant den Schweregrad der Glabellafalten für bis zu 4 Monate. Die Wirkung war in einer der beiden zulassungsrelevanten Studien nach 5 Monaten noch signifikant.
30 Tage nach der Injektion hatten nach der Beurteilung der Prüfärzte 90 % (273/305) der Patienten auf die Behandlung angesprochen (d. h. sie wiesen keine oder nur leichte Glabellafalten bei maximalem Stirnrunzeln auf), dagegen nur 3 % (4/153) der mit Placebo behandelten Patienten.
5 Monate nach Injektion sprachen in der betroffenen Studie immer noch 17 % (32/190) der mit Azzalure behandelten Patienten auf die Therapie an, dagegen nur 1 % (1/92) der mit Placebo behandelten Patienten. Die Beurteilung der Patienten selbst nach 30 Tagen ergab bei maximalem Stirnrunzeln eine Ansprechrate von 82 % (251/305) bei den mit Azzalure behandelten Patienten und von 6 % (9/153) bei den mit Placebo behandelten Patienten. Der Anteil der Patienten, die nach der Beurteilung der Prüfärzte bei maximalem Stirnrunzeln eine Verbesserung um zwei Schweregrade zeigte, betrug 77 % (79/103) in der einen zulassungsrelevanten Phase-III-Studie, in der diese Beurteilung vorgenommen wurde.
Eine Untergruppe von 177 Patienten hatte vor der Behandlung mittelstarke oder starke Glabellafalten im Ruhezustand. 30 Tage nach der Behandlung hatten nach der Beurteilung der Prüfärzte in diesem Kollektiv 71 % (125/177) der mit Azzalure behandelten Patienten auf die Behandlung angesprochen, verglichen mit 10 % (8/78) der mit Placebo behandelten Patienten.
Die offene Phase-III-Langzeitstudie mit wiederholter Anwendung ergab, dass die mediane Zeit von 3 Tagen bis zum Ansprechen über die Zyklen mit wiederholter Anwendung hinweg aufrechterhalten blieb. Die Ansprechrate bei maximalem Stirnrunzeln, die von den Prüfärzten nach 30 Tagen ermittelt wurde, wurde über die Zyklen mit wiederholter Anwendung hinweg aufrechterhalten und lag während der 5 Zyklen im Bereich von 80 % bis 91 %. Die Ansprechrate im Ruhezustand während der Zyklen mit wiederholter Anwendung war auch in den Einzeldosisstudien gleich bleibend. Diese betrug bei den mit Azzalure behandelten Patienten nach der Beurteilung der Prüfärzte 30 Tage nach der Behandlung 56 % bis 74 %.
Keiner der klinischen Endpunkte beinhaltete eine objektive Bewertung der psychischen Folgen.
5.2 Pharmakokinetische Eigenschaften
Es ist nicht zu erwarten, dass Azzalure nach i.m.-Injektion in der empfohlenen Dosierung im peripheren Blut in messbarer Menge vorhanden ist. Daher wurden mit Azzalure keine pharmakokinetischen Studien durchgeführt.
5.3 Präklinische Daten zur Sicherheit
In Reproduktionsstudien an Ratten und Kaninchen wurde bei hohen Dosierungen eine schwere maternale Toxizität mit Einnistungs(Nidations-)verlusten beobachtet. In Dosierungen, die dem 60- bis 100-fachen der empfohlenen Dosis beim Menschen (50 Einheiten) entsprechen, wurde bei Kaninchen bzw. Ratten keine embryofetale Toxizität beobachtet. Bei diesen Tierarten wurden keine teratogenen Effekte beobachtet. Bei Ratten wurde die Fruchtbarkeit von Männchen und Weibchen aufgrund der verminderten Paarungen, bedingt durch Muskellähmung unter hohen Dosierungen, verringert.
In einer an Ratten durchgeführten Langzeit-Toxizitätsstudie fanden sich keine Hinweise für eine systemische Toxizität in Dosierungen, die der 75-fachen bei Menschen empfohlenen Dosierung (50
Seite 6 von 9
Einheiten), bei gleichmäßiger Verteilung auf den rechten und linken M. glutaeus, entsprachen.
Studien zur akuten Toxizität, Langzeit-Toxizität und lokalen Verträglichkeit an der Injektionsstelle ergaben bei klinisch relevanten Dosierungen keine ungewöhnlichen lokalen oder systemischen Nebenwirkungen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Albumin vom Menschen 20 % (200 g/l)
Lactose-Monohydrat
6.2 Inkompatibilitäten
Das Arzneimittel darf, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
2 Jahre
Rekonstituierte Lösung:
Aus mikrobiologischer Sicht sollte die rekonstituierte Lösung sofort verwendet werden. Die chemische und physikalische Stabilität der rekonstituierten Lösung wurde jedoch für 4 Stunden bei 2°C bis 8°C nachgewiesen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2°C - 8°C).
Nicht einfrieren.
Lagerungsbedingungen des rekonstituierten Arzneimittels siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Pulver (125 Speywood-Einheiten) in einer Durchstechflasche (Glas Typ I) mit einem Gummistopfen (Halobutyl) und Aluminiumverschluss.
Packungen mit einer oder zwei Durchstechflasche(n).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Die Anweisungen zur Anwendung, Handhabung und Entsorgung müssen strikt eingehalten werden.
Die Rekonstitution ist in Übereinstimmung mit den Regeln der guten Herstellungspraxis, insbesondere im Hinblick auf die Asepsis, durchzuführen.
Azzalure ist mit der Natriumchlorid 9 mg/ml (0,9 %)-Injektionslösung zu rekonstituieren.
Die erforderliche Menge an Natriumchlorid 9 mg/ml (0,9 %)-Injektionslösung muss gemäß nachfolgender Verdünnungstabelle in die Spritze aufgezogen werden, um eine klare rekonstituierte Lösung mit einer Konzentration von 10 Einheiten/0,05 ml zu erhalten.
|
Zugegebene Menge Lösungsmittel (Natriumchlorid 9 mg/ml (0,9 %)) in die Durchstechflasche mit 125 Einheiten |
Erhaltene Dosis (Einheiten/0,05 ml) |
|
0,63 ml |
10 Einheiten |
Die genaue Abmessung von 0,63 ml kann mit 1 ml-Spritzen, die in Stufen von 0,1 ml und 0,01 ml unterteilt sind, erreicht werden.
EMPFEHLUNGEN FÜR DIE ENTSORGUNG VON KONTAMINIERTEN MATERIALIEN
Unmittelbar nach der Anwendung und vor der Entsorgung muss unbenutztes rekonstituiertes Azzalure (in der Durchstechflasche oder in der Spritze) mit 2 ml verdünnter Natriumhypochloritlösung (0,55 oder 1 %ig) (Bleichmittel) inaktiviert werden.
Gebrauchte Durchstechflaschen, Spritzen oder Materialien dürfen nicht entleert werden, sondern müssen in entsprechende Behälter geworfen und entsprechend den lokalen Vorschriften entsorgt werden.
EMPFEHLUNGEN BEI UNFÄLLEN WÄHREND DES UMGANGS MIT BOTULINUMTOXIN
o Jegliches verschüttetes Arzneimittel muss aufgewischt werden: Entweder - im Fall des Pulvers - mit einem saugfähigen Material, das mit einer Natriumhypochloritlösung (Bleichmittel) getränkt wurde oder - im Fall der rekonstituierten Lösung - mit einem trockenen saugfähigen Material.
o Kontaminierte Oberflächen müssen mit einem saugfähigen Material gereinigt werden, das mit einer Natriumhypochloritlösung (Bleichmittel) getränkt wurde.
Anschließend trocknen lassen.
o Wenn eine Durchstechflasche zerbricht, wie oben beschrieben vorgehen: Glassplitter
vorsichtig aufsammeln und das Arzneimittel aufwischen, dabei Schnittverletzungen der Haut vermeiden.
o Wenn das Arzneimittel in Kontakt mit der Haut gelangt, den betroffenen Bezirk mit einer Natriumhypochloritlösung (Bleichmittel) waschen und anschließend gründlich mit reichlich Wasser abspülen.
o Wenn das Arzneimittel in Kontakt mit den Augen gelangt, die Augen gründlich mit reichlich Wasser oder einer Augenspüllösung ausspülen.
o Wenn das Arzneimittel in Kontakt mit einer Wunde, Schnittverletzung oder nicht-intakter Haut gelangt, gründlich mit reichlich Wasser spülen und die entsprechenden medizinischen Maßnahmen entsprechend der injizierten Dosis ergreifen.
Diese Anweisungen zur Anwendung, Handhabung und Entsorgung müssen strikt eingehalten
werden.
7. INHABER DER ZULASSUNG
Max Pharma GmbH
Am Gewerbegebiet 5
95185 Gattendorf
8. ZULASSUNGSNUMMER
81972.00.00
9. Datum der Erteilung der Zulassung
21.09.2010
März 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 9 von 9