Baymycard Rr 20 Mg Retardtabletten
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Baymycard® RR 10 mg Retardtabletten Baymycard® RR 20 mg Retardtabletten Baymycard® RR 30 mg Retardtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Baymycard RR 10 mg Retardtabletten 1 Tablette enthält 10 mg Nisoldipin.
Baymycard RR 20 mg Retardtabletten 1 Tablette enthält 20 mg Nisoldipin.
Baymycard RR 30 mg Retardtabletten 1 Tablette enthält 30 mg Nisoldipin.
Sonstiger Bestandteil mit bekannter Wirkung
Jede Tablette Baymycard RR 10 mg enthält 122 mg, Baymycard RR 20 mg 111 mg bzw. Baymycard RR 30 mg 102 mg Lactose-Monohydrat, siehe Abschnitt 4.4.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Retardtabletten
Die Retardtabletten bestehen aus einer Hülle, die den Wirkstoff langsam freigibt, und einem Kern, der den Wirkstoff rasch freisetzt.
Baymycard RR 10 mg Retardtabletten
Hellgelbe, runde Tabletten, die auf einer Seite mit „"NIS 10“ und auf der anderen Seite mit dem „Bayerkreuz“ gekennzeichnet sind.
Baymycard RR 20 mg Retardtabletten:
Grau-gelbe, runde Tabletten, die auf einer Seite mit „NIS 20“ und auf der anderen Seite mit dem „Bayerkreuz“ gekennzeichnet sind.
Baymycard RR 30 mg Retardtabletten:
Braun-gelbe, runde Tabletten, die auf einer Seite mit „NIS 30“ und auf der anderen Seite mit dem „Bayerkreuz“ gekennzeichnet sind.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Behandlung der essentiellen Hypertonie.
Dosierung
Die Behandlung soll möglichst individuell nach dem Schweregrad der Erkrankung und dem Ansprechen des Patienten auf die Behandlung durchgeführt werden.
Es gelten folgende Dosierungsrichtlinien:
1 x täglich 10 mg Nisoldipin (1 x täglich 1 Tablette Baymycard RR 10 mg Retardtabletten).
Bei Bedarf kann die Dosis stufenweise (üblicherweise in wöchentlichen Intervallen) auf maximal 1 x täglich 40 mg Nisoldipin erhöht werden.
Zur individuellen Dosierungsanpassung stehen Baymycard RR 10 mg Retardtabletten (10 mg Nisoldipin), Baymycard RR 20 mg Retardtabletten (20 mg Nisoldipin) und Baymycard RR 30 mg Retardtabletten (30 mg Nisoldipin) zur Verfügung.
Patienten, die von einer schnell freisetzenden Nisoldipin-Darreichungsform auf Baymycard RR Retardtabletten umgestellt werden, sollten zunächst die empfohlene Anfangsdosis von 10 mg Nisoldipin pro Tag erhalten. Danach kann die Dosis, falls klinisch erforderlich, stufenweise erhöht werden.
Bei der gleichzeitigen Gabe von Arzneimitteln, die das Cytochrom P450 3A4-System hemmen oder induzieren, kann es erforderlich sein, die Nisoldipin-Dosis anzupassen oder ggf. ganz auf die Anwendung von Nisoldipin zu verzichten (siehe Abschnitt 4.5).
Leberfunktionsstörung (siehe auch Abschnitte 4.3, 4.4 und 5.2)
Nisoldipin wird in der Leber metabolisiert. Patienten mit eingeschränkter Leberfunktion sollten daher die Behandlung mit der niedrigsten Tagesdosis von 10 mg beginnen, wobei die Patienten sorgfältig auf klinische Reaktionen zu überwachen sind, da die Arzneimittelwirkung verstärkt oder verlängert sein kann.
Nierenfunktionsstörung (siehe auch Abschnitt 5.2)
Für Patienten mit eingeschränkter Nierenfunktion ist keine Anpassung der Dosis erforderlich.
Ältere Patienten (siehe auch Abschnitt 5.2)
Bei älteren Patienten können erhöhte Plasmakonzentrationen auftreten. Die Behandlung sollte deshalb mit der niedrigsten empfohlenen Dosis von 10 mg pro Tag begonnen werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Baymycard RR bei Kindern ist nicht erwiesen.
Art der Anwendung
Die Baymycard RR-Retardtabletten sollten unzerkaut mit etwas Flüssigkeit auf nüchternen Magen eingenommen werden.
Die Retardtabletten sollen in einem 24-stündigen Abstand eingenommen werden, d. h. immer zu derselben Tageszeit - vorzugsweise morgens vor dem Frühstück (siehe Abschnitt 4.5).
Um erhöhte maximale Plasmakonzentrationen zu vermeiden und die Wirksamkeit über 24 Stunden zu gewährleisten, sind die Retardtabletten unbedingt ungeteilt, unzerbissen und unzerkaut einzunehmen (siehe Abschnitt 4.4).
Baymycard RR darf nicht zusammen mit Grapefruit/ -Saft eingenommen werden, da dies eine verstärkte und verlängerte Wirkung von Nisoldipin (Anstieg der Cmax und AUC) zur Folge haben kann. Der Konsum von Grapefruit/ -Saft sollte spätestens 4 Tage vor Beginn der Therapie mit Baymycard RR eingestellt werden (siehe Abschnitt 4.5).
Das Absetzen von Baymycard RR sollte schrittweise erfolgen.
Die Behandlung mit diesen Arzneimitteln bedarf der regelmäßigen ärztlichen Kontrolle. Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
4.3 Gegenanzeigen
Baymycard RR darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff Nisoldipin oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- Herz-Kreislauf-Schock
- instabiler Angina pectoris
- akutem Myokardinfarkt (innerhalb der ersten 12 Tage)
- höhergradiger Aortenstenose
- schweren Leberfunktionsstörungen (Leberzirrhose) (siehe Abschnitt 5.2)
- Schwangerschaft und Stillzeit (siehe Abschnitt 4.6).
Nisoldipin wird über das Cytochrom P450 3A4-System metabolisiert. Daher können Arzneimittel, die dieses Enzymsystem stark inhibieren oder induzieren, den First-Pass-Metabolismus oder die Ausscheidung von Nisoldipin verändern (siehe Abschnitte 4.5 und 4.4). Deshalb darf Baymycard RR nicht verabreicht werden, wenn die Patienten folgende andere Arzneimittel anwenden:
- Dauertherapie mit enzyminduzierenden Arzneimitteln, z. B. Rifampicin, Phenytoin, Carbamazepin oder Phenobarbital
- bestimmte Makrolid-Antibiotika (z. B. Erythromycin)
- Anti-HIV-Arzneimittel, Proteaseinhibitoren (z. B. Ritonavir)
- Antimykotika vom Azol-Typ (z. B. Ketoconazol)
- das Antidepressivum Nefazodon
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Baymycard RR-Retardtabletten sind unbedingt ungeteilt, unzerbissen und unzerkaut einzunehmen (siehe Abschnitt 4.2).
Gelegentlich kann es, insbesondere zu Beginn der Behandlung, zum Auftreten von Angina pectoris-Anfällen bzw. bei Patienten mit bestehender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen. Vereinzelt ist das Auftreten eines Herzinfarktes beschrieben worden.
Vorsicht ist geboten bei dekompensierter Herzinsuffizienz oder eingeschränkter Herzkammerfunktion, insbesondere bei gleichzeitiger Einnahme von Beta-Rezeptorenblockern.
Bei Patienten mit eingeschränkter Leberfunktion kann die Wirkung von Baymycard RR verstärkt oder verlängert sein. Daher sollten diese Patienten sorgfältig überwacht werden; ggf. kann eine Dosisreduktion notwendig sein (siehe Abschnitt 5.2).
Nisoldipin wird über das Cytochrom P450 3A4-System metabolisiert. Daher können Arzneimittel, die dieses Enzymsystem inhibieren oder induzieren, den First-Pass-Metabolismus oder die Ausscheidung von Nisoldipin verändern (siehe Abschnitte 4.5 und 4.3).
Die Plasmaspiegel von Nisoldipin können z. B. durch folgende Arzneimittel, die als schwache oder mittelmäßige Inhibitoren des Cytochrom P450 3A4-Systems bekannt sind, erhöht werden:
- Quinupristin/Dalfopristin
- Fluoxetin
- Valproinsäure
- Cimetidin
Wenn Baymycard RR zusammen mit einem dieser Arzneimittel angewendet wird, sollte der Blutdruck überwacht werden und, falls erforderlich, eine Verringerung der Nisoldipin-Dosis in Betracht gezogen werden.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Baymycard RR nicht einnehmen.
Kinder
Wegen fehlender Erfahrungen sollen Kinder nicht mit Baymycard RR behandelt werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Arzneimittel, die Nisoldipin beeinflussen
Nisoldipin wird über das Cytochrom P450 3A4-System metabolisiert, das sowohl in der Darmschleimhaut als auch in der Leber vorkommt. Daher kann die gleichzeitige Anwendung von Arzneimitteln, die dieses System induzieren oder hemmen, grundsätzlich zu Wechselwirkungen dieser Arzneimittel mit Nisoldipin führen (siehe Abschnitte 4.3 und 4.4).
Sowohl das Ausmaß wie auch die Dauer der Interaktionen sollten in Betracht gezogen werden, wenn Baymycard RR zusammen mit den nachfolgend aufgeführten Arzneimitteln verabreicht werden soll.
Arzneimittel, die das Cytochrom P450 3A4-System induzieren, wie z. B.:
Phenytoin
Bei gleichzeitiger Einnahme von Phenytoin über einen längeren Zeitraum wird die Bioverfügbarkeit von Nisoldipin verringert. Daher darf Nisoldipin nicht gleichzeitig mit Phenytoin eingenommen werden (siehe Abschnitt 4.3).
Phenobarbital, Carbamazepin
Studien zur Interaktion zwischen Nisoldipin und Carbamazepin oder Phenobarbital liegen nicht vor.
Da von dem strukturell verwandten Calciumkanalblocker Nimodipin bekannt ist, dass die Plasmakonzentration aufgrund der Enzyminduktion verringert wird, kann eine ebensolche Wirkung bei Nisoldipin und damit eine verringerte Wirksamkeit nicht ausgeschlossen werden (siehe Abschnitt 4.3).
Rifampicin
Aufgrund von Erfahrungen mit dem strukturell ähnlichen Calciumantagonisten Nifedipin ist zu erwarten, dass Rifampicin wegen seiner enzyminduzierenden Wirkung die Metabolisierung von Nisoldipin beschleunigt. Da hierdurch die Wirksamkeit von Nisoldipin abgeschwächt werden kann, darf Nisoldipin nicht gleichzeitig mit Rifampicin angewendet werden (siehe Abschnitt 4.3).
Arzneimittel mit stark inhibierender Wirkung auf das Cytochrom P450 3A4-System:
Antimykotika vom Azol-Typ (z. B. Ketoconazol)
Bei gleichzeitiger Einnahme von 200 mg Ketoconazol wird die Bioverfügbarkeit von Nisoldipin um mehr als das 20fache erhöht. Wegen des Ausmaßes dieser Interaktion kann eine Dosisreduktion von Nisoldipin nicht empfohlen werden. Die gleichzeitige Anwendung von Nisoldipin mit einem Wirkstoff dieser Arzneimittelgruppe ist somit kontraindiziert (siehe Abschnitt 4.3).
Makrolid-Antibiotika (z. B. Erythromycin)
Es wurden keine Interaktionsstudien mit Nisoldipin und Makrolid-Antibiotika durchgeführt. Da aber bekannt ist, dass bestimmte Makrolid-Antibiotika das Cytochrom P450 3A4-System hemmen, kann ein Anstieg der Plasmakonzentration von Nisoldipin nicht ausgeschlossen werden. Die gleichzeitige Anwendung von Nisoldipin mit Makrolid-Antibiotika ist daher kontraindiziert (siehe Abschnitt 4.3). Azithromycin (obwohl strukturell verwandt mit den Makrolid-Antibiotika) zeigt keine enzyminhibierende Wirkung und ist daher nicht kontraindiziert.
Anti-HIV-Arzneimittel, Protease-Inhibitoren (z. B. Ritonavir)
Formale Interaktionsstudien mit Nisoldipin und bestimmten Anti-HIV-Protease-Inhibitoren wurden nicht durchgeführt. Da aber bekannt ist, dass diese Arzneimittel das Cytochrom P450 3A4-System stark hemmen, kann ein ausgeprägter, klinisch relevanter Anstieg der Plasmakonzentration von Nisoldipin nicht ausgeschlossen werden. Die gleichzeitige Anwendung von Nisoldipin mit einem dieser Protease-Inhibitoren ist daher kontraindiziert (siehe Abschnitt 4.3).
Nefazodon
Formale Studien zur möglichen Interaktion mit Nefazodon wurden nicht durchgeführt. Aufgrund der bekannten starken Hemmwirkung dieses Antidepressivums auf das Cytochrom P450 3A4-System, kann bei gleichzeitiger Anwendung ein klinisch relevanter Anstieg der NisoldipinPlasmakonzentration nicht ausgeschlossen werden (siehe Abschnitt 4.3).
Arzneimittel mit schwach- oder mäßig-inhibierender Wirkung auf das Cytochrom P450 3A4-System: Bei gleichzeitiger Anwendung von Nisoldipin und den nachfolgend aufgeführten Wirkstoffen sollte der Blutdruck überwacht und ggf. die Nisoldipin-Dosis angepasst werden (siehe Abschnitt 4.2):
Fluoxetin
Erfahrungen mit dem strukturähnlichen Calciumantagonisten Nimodipin haben gezeigt, dass die gleichzeitige Verabreichung von Nimodipin und dem Antidepressivum Fluoxetin zu ca. 50% höheren Nimodipin-Plasmakonzentrationen führt. Der Fluoxetin-Plasmaspiegel wurde deutlich erniedrigt, während der aktive Metabolit, Norfluoxetin, davon nicht betroffen war. Ein klinisch relevanter Anstieg der Nisoldipin-Plasmakonzentration kann daher nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Quinupristin/Dalfopristin
Aufgrund der Erfahrungen mit dem strukturähnlichen Calciumantagonisten Nifedipin können die Plasmakonzentrationen von Nisoldipin erhöht werden (siehe Abschnitt 4.4).
Valproinsäure
Aus Ergebnissen mit dem strukturähnlichen Calciumantagonisten Nimodipin wird erwartet, dass auch der Metabolismus von Nisoldipin durch Valproinsäure inhibiert wird. Mit erhöhten Plasmakonzentrationen und somit auch einer Zunahme der Nisoldipin-Wirkungen muss gerechnet werden (siehe Abschnitt 4.4).
Cimetidin
Bei gleichzeitiger Anwendung von Nisoldipin und Cimetidin kann es zu einer verstärkten Wirkung von Nisoldipin kommen. Bei gleichzeitiger 2mal täglicher Gabe von 400 mg Cimetidin wurden AUC und Cmax von Nisoldipin um 30 - 45% erhöht (siehe Abschnitt 4.4).
Chinidin
(AUC) von Baymycard RR in dieses Effekts möglicherweise Baymycard RR erhöht werden
Durch Chinidin kann die Fläche unter der Konzentrations-Zeit-Kurve geringem Ausmaß verringert werden. Obwohl die klinische Relevanz gering ist, sollte in Betracht gezogen werden, dass evtl. die Dosis von muss, um den gewünschten klinischen Effekt zu erzielen.
Blutdrucksenkende Arzneimittel:
Verstärkung des blutdrucksenkenden Effekts von Nisoldipin.
Wirkungen von Nisoldipin auf andere Arzneimittel
Blutdrucksenkende Arzneimittel
Nisoldipin kann den blutdrucksenkenden Effekt von gleichzeitig verabreichten Antihypertensiva verstärken, wie z. B.:
- Diuretika
- Beta-Rezeptorenblocker
- ACE-Inhibitoren
- AT1-Rezeptorantagonisten
- andere Calciumantagonisten
- Alpha-Rezeptorenblocker
- PDE-5-Inhibitoren
- Alpha-Methyldopa
Beta-Rezeptorenblocker
Bei gleichzeitiger Anwendung von Nisoldipin und Beta-Rezeptorenblockern ist eine sorgfältige Überwachung der Patienten angezeigt, da in Einzelfällen Zeichen einer Herzinsuffizienz auftreten können.
Interaktionen mit Nahrungsmitteln und Getränken
Grapefruit/ -Saft
Grapefruit/ -Saft hemmt das Cytochrom P450 3A4-System. Aufgrund eines verringerten First-PassMetabolismus und einer verlangsamten Ausscheidung führt die Einnahme von Nisoldipin mit Grapefruit/ -Saft zu höheren Plasmakonzentrationen von Nisoldipin und zu einer verlängerten Wirkungsdauer.
Als Folge kann eine verstärkte blutdrucksenkende Wirkung auftreten. Dieser Effekt kann über mindestens 4 Tage nach der letzten Einnahme von Grapefruit/ -Saft anhalten.
In zeitlichem Zusammenhang mit der Nisoldipin-Behandlung ist deshalb der Genuss von Grapefruit/ -Saft zu vermeiden (siehe Abschnitt 4.2).
Andere Nahrungsmittel
Gleichzeitige Nahrungsaufnahme kann zu einer 2-3fachen Erhöhung der maximalen Plasmaspiegel führen. Die Bioverfügbarkeit kann bei gleichzeitiger Nahrungsaufnahme um ca. 20% vermindert sein. Es wird daher empfohlen, Baymycard RR im Nüchternzustand, z. B. vor dem Frühstück, einzunehmen (siehe Abschnitt 4.2).
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft (siehe Abschnitt 4.3)
Baymycard RR darf in der gesamten Schwangerschaft nicht angewendet werden. Die Sicherheit von Baymycard RR für die Anwendung während der Schwangerschaft ist nicht nachgewiesen. Tierexperimentelle Studien mit maternal-toxischen Dosen gaben Hinweise auf Fruchtschädigungen (Missbildungen).
Stillzeit (siehe Abschnitt 4.3)
In der Stillzeit darf Baymycard RR nicht angewendet werden, da Nisoldipin möglicherweise in die Muttermilch übergeht.
Fertilität
In Einzelfällen von in-vitro-Fertilisation wurde der vergleichbare Calciumantagonist Nifedipin mit reversiblen biochemischen Veränderungen in der Kopfregion von Spermatozoen in Verbindung gebracht, die zu einer Beeinträchtigung der Spermienfünktion führen könnten. In Fällen, bei denen wiederholte in-vitro-Fertilisationen erfolglos blieben und bei denen keine andere Erklärung dafür gefunden werden kann, sollte eine Nisoldipin-Behandlung des Mannes als mögliche Ursache in Betracht gezogen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Durch individuell auftretende unterschiedliche Reaktionen auf diese Arzneimittel (wie z. B. einen verstärkten Blutdruckabfall) kann das Reaktionsvermögen so weit verändert sein, dass die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren
Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Unerwünschte Begleiterscheinungen treten vorzugsweise zu Therapiebeginn, bei Dosiserhöhung oder bei hoher Dosierung auf. Die meisten unter Behandlung von Nisoldipin beobachteten Nebenwirkungen ergeben sich aus seinen vasodilatatorischen Eigenschaften. Sie sind meist leichter und vorübergehender Natur.
Folgende Nebenwirkungen wurden nach Gabe von Nisoldipin berichtet:
|
Systemorganklassen gemäß MedDRA |
Sehr häufig (> 1/10) |
Häufig (> 1/100, < 1/10) |
Gelegentlich (> 1/1.000, < 1/100) |
Selten (> 1/10.000, < 1/1.000) |
Sehr selten (< 1/10.000) |
|
Erkrankungen des Blutes und des Lymphsystems |
Leukopenie Petechien | ||||
|
Erkrankungen des Immunsystems |
Allergische Reaktionen |
Anaphylak tischer Schock/Angio- ödem/Lungen- ödem | |||
|
Stoffwechsel- und Ernährungsstörungen |
Hyperglykämie | ||||
|
Erkrankungen des Nervensystems und psychiatrische Erkrankungen |
Kopfschmerzen |
Benommenheit |
Nervosität Parästhesien Hypästhesien Schläfrigkeit Schlafstörungen Schwindel Tremor |
Agitiertheit Alpträume | |
|
Augenerkrankungen |
Sehstörungen Amblyopie |
Augenschmerzen Diplopie | |||
|
Herz- und Gefäßerkrankungen |
Ödeme, besonders in Händen und Füßen |
Gesichtsrötung (Flush) Wärmegefühl Erweiterung der Blutgefäße Palpitationen Tachykardie Schmerzen im Brustkorb Angina pectoris- Anfälle* |
Hypotone Kreislaufreaktion en (evtl. mit Synkope) Migräne EKG- Veränderungen |
Herzrhythmus störungen Bradykardie Supraventrikuläre Tachykardie Ventrikuläre Extrasystolen |
Herzinfarkt |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Dyspnoe |
Epistaxis | |||
|
Erkrankungen des Gastrointestinaltrakts |
Nausea Völlegefühl |
Erbrechen Mundtrockenheit Verstopfung Diarrhoe Abdominale Schmerzen Dyspepsie Flatulenz |
Gingiva Hyperplasie | ||
|
Leber- und Gallenerkrankungen |
Leberfunktionsstörungen (Anstieg der Leberenzyme) |
GGTP Anstieg |
|
Systemorganklassen gemäß MedDRA |
Sehr häufig (> 1/10) |
Häufig (> 1/100, < 1/10) |
Gelegentlich (> 1/1.000, < 1/100) |
Selten (> 1/10.000, < 1/1.000) |
Sehr selten (< 1/10.000) |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Allergische Hautreaktionen (z. B. Exanthem, Pruritus, Urtikaria) Gesichtsödem Schwitzen |
Exfoliative Dermatitis Makulopapulöser Hautausschlag Vesikulobullöser Hautausschlag | |||
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Myalgie Wadenkrämpfe Myasthenie Arthralgie | ||||
|
Erkrankungen der Nieren und Harnwege |
Vermehrter Harndrang |
Nierenfunktions störungen Dysurie Nykturie Polyurie | |||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Gynäkomastie | ||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Schwächegefühl Müdigkeit |
Unwohlsein Schmerzen (Arme, Beine) |
* Bei Patienten mit bestehender Angina pectoris kann es zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen.
Meldungen des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome
Aufgrund der vasodilatatorischen Eigenschaften von Nisoldipin und der möglichen Einwirkung auf die Herzfunktion ist mit folgenden Symptomen zu rechnen:
- Blutdruckabfall
- Kardiogener Schock
- Herzrhythmusstörungen (Tachykardie, Bradykardie).
Behandlung
Therapeutisch stehen die Wirkstoffelimination (ausgiebige Magenspülung mit Zusatz medizinischer Kohle) und die Wiederherstellung stabiler Herz-Kreislaufverhältnisse (Sauerstoffgabe, evtl. Beatmung, Volumensubstitution) im Vordergrund.
Bradykarde Herzrhythmusstörungen werden symptomatisch mit Atropin und/oder Betasympathomimetika behandelt. Bei bedrohlichen bradykarden Herzrhythmusstörungen ist eine temporäre Schrittmachertherapie erforderlich.
Die Hypotonie als Folge von kardiogenem Schock und arterieller Vasodilatation wird mit Calcium (10 - 20 ml einer 10%igen Calciumgluconat-Lösung als langsame intravenöse Injektion) behandelt; falls erforderlich kann die Calcium-Injektion wiederholt werden. Der Serum-Calciumspiegel sollte hochnormal bis leicht erhöht gehalten werden. Bei Nichtansprechen dieser Maßnahme können
vasokonstriktive Sympathomimetika wie z. B. Dopamin oder Noradrenalin zusätzlich verabreicht werden. Die Dosierung dieser Arzneimittel orientiert sich an der erzielten Wirkung.
Eine Hämodialyse ist wegen der fehlenden Dialysierbarkeit von Nisoldipin (Eiweißbindung > 99%) nicht sinnvoll; eine extrakorporale Entgiftung mittels Hämoperfusion oder Plasmapherese erscheint nicht Erfolg versprechend (hohes Verteilungsvolumen von ca. 300 Litern bei einem Körpergewicht von 70 kg).
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Dihydropyridin-Derivat, Calciumkanalblocker,
ATC-Code: C08C A07
Baymycard RR enthält als Wirkstoff den Calciumantagonisten Nisoldipin, der spezifisch den langsamen, spannungsabhängigen Calciumkanal blockiert. Durch hohe Gefäßselektivität, starke peripher vasodilatatorische und damit nachlastsenkende Wirkungen von Nisoldipin sowie durch seine initialen natriuretischen Eigenschaften wird die antihypertensive Wirksamkeit bedingt.
In therapeutischen Dosen hat Nisoldipin keine negativ inotrope Wirkung und beeinflusst nicht die Erregungsbildung und -leitung.
Die blutdrucksenkende Wirkung von Nisoldipin beruht auf der Dilatation peripherer Gefäße und der hieraus resultierenden Verringerung des peripheren Gefäßwiderstandes.
Eine Toleranzentwicklung in der Langzeittherapie mit Nisoldipin wurde nicht beobachtet.
5.2 Pharmakokinetische Eigenschaften
Die Resorption des oral verabreichten Wirkstoffes erfolgt praktisch vollständig über die Schleimhäute des Gastrointestinaltraktes. Nisoldipin unterliegt einem ausgeprägten First-pass-Metabolismus in der Leber und dem Gastrointestinaltrakt, so dass die systemische Verfügbarkeit von oral verabreichtem Nisoldipin bei 4 - 8% liegt. Bereits 15 - 30 Minuten nach Verabreichung einer oralen Lösung kann der unveränderte Wirkstoff im Plasma nachgewiesen werden. Maximale Plasmakonzentrationen werden nach 0,5 -2 Stunden erreicht. Die Metaboliten werden zu 70 - 80% renal ausgeschieden. Die Eliminationskinetik ist im empfohlenen Dosierungsbereich linear. Die Halbwertszeiten für Nisoldipin betragen ca. 2 Stunden (ß-Phase) und 10 - 12 Stunden (y-Phase). Nisoldipin wird zu über 99% an Plasmaproteine gebunden.
Nach Gabe von Baymycard RR bei älteren Patienten ist ein Anstieg der AUC- und Cmax-Werte um das Doppelte zu verzeichnen (siehe Abschnitt 4.2).
Ein Vergleich der pharmakokinetischen Daten von gesunden Personen und Patienten mit Nierenfunktionsstörungen (inkl. anurischen Patienten unter Dialyse-Therapie) zeigte keine Unterschiede im Hinblick auf Cmax und AUC. Eine Dosisanpassung von Baymycard RR bei diesen Patienten ist daher nicht erforderlich. Renale Funktionsstörungen beeinflussen die Eiweißbindung von Nisoldipin nicht (siehe Abschnitt 4.2).
Bei Patienten mit Leberzirrhose können die AUC- und Cmax-Werte um das 3 - 4fache erhöht sein (siehe Abschnitte 4.2, 4.3 und 4.4).
Bioverfügbarkeit
Baymycard RR-Retardtabletten erlauben eine einmal tägliche Gabe. Die Retardtabletten bestehen aus einer Hülle, die den Wirkstoff langsam freigibt und einem Kern, der den Wirkstoff rasch freisetzt.
Die Pharmakokinetik von Baymycard RR (Retardtablette) im Vergleich zu der schnell freisetzenden Nisoldipin-Tablette ist gekennzeichnet durch geringere maximale Plasmaspiegel und eine verminderte
peak-trough-Fluktuation. Die 24h-Plasmaprofile im steady-state zeigen ein Plateau, wodurch eine einmal tägliche Applikation ermöglicht wird.
Die absolute Bioverfügbarkeit der Baymycard RR-Retardtablette beträgt 5,5%.
In der folgenden Tabelle sind die pharmakokinetischen Parameter (arithmetische Mittelwerte ± SD) nach Einmalgabe von Nisoldipin-haltigen Retardtabletten (10, 20, 30 und 40 mg Nisoldipin) zusammengestellt [Cmax: maximaler Plasmaspiegel; tmax: Zeit bis zum Erreichen von Cmax; AUC (0 - 48): Fläche unter der Plasmaspiegel-Kurve über 48 Stunden]:
|
Dosis |
n |
AUC (0-48) |
Cmax |
tmax |
|
(mg Nisoldipin) |
[pg x h/l] |
[pg/l] |
[h] | |
|
1 x 10 |
24 |
15,2 |
0,90 |
8,6 |
|
± 5,0 |
± 0,39 |
± 3,8 | ||
|
1 x 20 |
24 |
27,1 |
1,45 |
8,3 |
|
± 10,1 |
± 0,57 |
± 3,7 | ||
|
1 x 30 |
14 |
39,9 |
2,27 |
8,1 |
|
± 16,8 |
± 1,37 |
± 6,8 | ||
|
1 x 40 |
14 |
64,0 |
3,14 |
8,6 |
|
± 32,5 |
± 1,91 |
± 6,8 |
Die apparente Halbwertszeit von Nisoldipin nach Gabe der Baymycard RR-Retardtablette beträgt 6,8 - 22,7 h. Im Dosisbereich von 10 - 40 mg Nisoldipin kann ein dosis-proportionaler Anstieg der Nisoldipin-Plasmakonzentrationen gesehen werden.
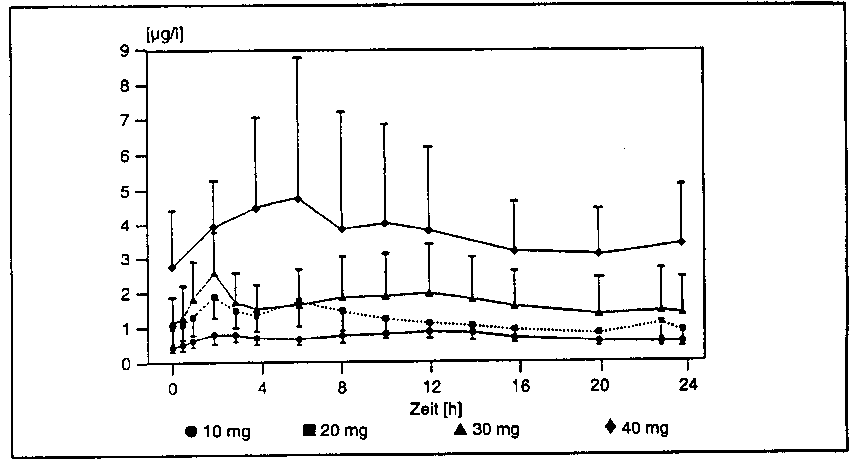
Abb.: Plasmakonzentrationen (im steady-state) von Nisoldipin nach Gabe von Nisoldipin-haltigen Retardtabletten (10, 20, 30 und 40 mg Nisoldipin) (arithmetische Mittelwerte ± SD).
5.3 Präklinische Daten zur Sicherheit
Nach akuter oraler Verabreichung von Nisoldipin ist der Wirkstoff nur gering toxisch.
Bei der Ratte wurde in subakuten und subchronischen Versuchen Nisoldipin in Dosen bis
100 mg/kg p. o. schädigungslos vertragen. Nach chronischer Verabreichung an Mäuse (21 Monate)
und an Ratten (2 Jahre) zeigten sich keine Hinweise auf kanzerogene Effekte.
Nisoldipin-Dosen bis zu 3 mg/kg p. o. - über ein Jahr verabreicht - wurden beim Hund ohne Schädigung vertragen.
In Studien zu Fertilität, Embryotoxizität und peri-/postnataler Entwicklung an Ratten wurden Dosen bis 10 mg/kg p. o. schädigungslos vertragen.
Untersuchungen am Kaninchen ließen nach Dosen bis 10 mg/kg p. o. weder allgemein embryotoxische noch spezifische teratogene Effekte erkennen.
Ergebnisse einer Embryotoxizitätsstudie an Affen zeigten, dass die deutlich maternal-toxische Dosis von 100 mg/kg p. o. Defekte im Bereich der Phalangen hervorrief.
Nisoldipin zeigte in breit angelegten Tests in vitro und in vivo keine mutagenen Eigenschaften.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Alle 3 Wirkstärken der Baymycard RR Retardtabletten enthalten die folgenden sonstigen Bestandteile: Maisstärke, mikrokristalline Cellulose, Lactose-Monohydrat, Povidon K25, Natriumdodecylsulfat, Magnesiumstearat, Hypromellose, Hyprolose, Crospovidon, Macrogol 4000, Titandioxid (E 171), Eisenoxid gelb (E 172).
Baymycard RR 30 mg Retardtabletten zusätzlich: Eisenoxid rot (E 172).
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
4 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Blister im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
Polypropylen/Aluminiumfolie-Blister in Faltschachteln
Baymycard RR 10 mg Retardtabletten Packung mit 100 Retardtabletten
Baymycard RR 20 mg Retardtabletten Packungen mit 50 und 100 Retardtabletten
Baymycard RR 30 mg Retardtabletten Packung mit 100 Retardtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Bayer Vital GmbH
51368 Leverkusen
Tel. 0214 30-51348
Fax 0214 30-51603
bayer-vital@bayerhealthcare.com
8. ZULASSUNGSNUMMERN
Baymycard RR 10 mg Retardtabletten 10143.00.01
Baymycard RR 20 mg Retardtabletten
10143.01.01
Baymycard RR 30 mg Retardtabletten
10143.02.01
9. DATUM DER ERTEILUNG DER ZULASSUNGEN/VERLÄNGERUNG DER ZULASSUNGEN
Baymycard RR 10 mg Retardtabletten
Datum der Erteilung der Zulassung: 03. April 1996
Datum der letzten Verlängerung der Zulassung: 26. Juni 2001
Baymycard RR 20 mg Retardtabletten
Datum der Erteilung der Zulassung: 03. April 1996
Datum der letzten Verlängerung der Zulassung: 26. Juni 2001
Baymycard RR 30 mg Retardtabletten
Datum der Erteilung der Zulassung: 03. April 1996
Datum der letzten Verlängerung der Zulassung: 26. Juni 2001
10. STAND DER INFORMATION
August 2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
12