Bayotensin Akut
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Bayotensin® akut, 5 mg/1 ml, Lösung zum Einnehmen
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml Lösung (1 Phiole) enthält 5 mg Nitrendipin.
Sonstiger Bestandteil mit bekannter Wirkung:
1 ml Lösung enthält 250 mg Ethanol 96 % (entspricht 29,7 Vol.-% Alkohol). Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Lösung zum Einnehmen
Bayotensin akut ist eine klare, gelbe Lösung mit Pfefferminzgeruch.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Behandlung des hypertensiven Notfalls.
4.2 Dosierung und Art der Anwendung
Dosierung
Soweit nicht anders verordnet, gelten folgende Dosierungsrichtlinien:
Richt-/Einzeldosis für Erwachsene 1 ml Lösung Bayotensin akut (1 Phiole)
Sollte die Blutdrucksenkung unzureichend sein, kann nach 30 - 60 Minuten der Inhalt einer weiteren Phiole (1 ml Lösung) verabreicht werden.
Bei kürzerem Abstand oder höherer Dosierung sind gefährdende Hypotonien nicht auszuschließen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Bayotensin akut bei Kindern und Jugendlichen unter 18 Jahren ist nicht erwiesen.
Art der Anwendung
Der Inhalt einer Phiole Bayotensin akut wird in den Mund hinein ausgedrückt und sofort hinuntergeschluckt.
Bayotensin akut darf nicht mit Grapefruitsaft eingenommen werden (siehe Abschnitt 4.5).
Durch Anwendung anderer Arzneimittel, die das Cytochrom P450 3A4 (CYP 3A4)-System inhibieren oder induzieren, kann es erforderlich sein, die Nitrendipin-Dosis anzupassen oder ggf. ganz auf die Einnahme von Nitrendipin zu verzichten (siehe Abschnitt 4.5).
Nitrendipin, der Wirkstoff von Bayotensin akut, ist in hohem Maße lichtempfindlich. Obgleich er durch die Phiole geschützt ist, sollte die Phiole erst unmittelbar vor der Anwendung der Blisterpackung entnommen werden (siehe Abschnitt 6.4).
4.3 Gegenanzeigen
Bayotensin akut darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff, Pfefferminzöl oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
- Herz-Kreislauf-Schock,
- instabiler Angina pectoris,
- akutem Myokardinfarkt (innerhalb der ersten 4 Wochen),
- dekompensierter Herzinsuffizienz,
- höhergradiger Aortenstenose (pathophysiologisch ist das Auftreten eines hypertensiven Notfalls bei Patienten mit höhergradiger Aortenstenose nicht zu erwarten)
sowie während der Schwangerschaft und Stillzeit (siehe Abschnitt 4.6).
Aufgrund von Erfahrungen mit dem strukturell ähnlichen Calciumantagonisten Nifedipin ist damit zu rechnen, dass Rifampicin den Metabolismus von Nitrendipin in Folge einer Enzyminduktion beschleunigt und dass somit keine wirksamen Nitrendipin-Plasmaspiegel erreicht werden. Daher ist die gleichzeitige Anwendung von Rifampicin kontraindiziert (siehe Abschnitt 4.5).
Bayotensin akut darf wegen seines Gehaltes an Pfefferminzöl nicht bei Säuglingen und Kindern bis zu 2 Jahren angewendet werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Hypertensiver Notfall
Die Behandlung des hypertensiven Notfalls mit Bayotensin akut bedarf der ärztlichen Kontrolle. Leberfunktionsstörungen
Bei Patienten mit schwerer Leberfunktionsstörung kann die Wirkung von Nitrendipin verstärkt oder verlängert sein. In diesen Fällen muss der Behandlungsverlauf sorgfältig überwacht werden (siehe Abschnitt 5.2).
Angina pectoris
Gelegentlich kann es, insbesondere zu Beginn der Behandlung, zum Auftreten von Angina pectoris-Anfällen bzw. bei Patienten mit bestehender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen. Vereinzelt ist das Auftreten eines Herzinfarktes beschrieben worden (siehe Abschnitt 4.8).
CYP 3A4-System
Nitrendipin wird über das CYP 3A4-System metabolisiert. Daher können Arzneimittel, die dieses Enzymsystem inhibieren oder induzieren, den First-Pass-Metabolismus oder die Ausscheidung von Nitrendipin verändern (siehe Abschnitt 4.5).
Die Plasmaspiegel von Nitrendipin können z. B. durch folgende Arzneimittel, die als Inhibitoren des CYP 3A4-Enzymsystems bekannt sind, erhöht werden:
- Makrolid-Antibiotika (z. B. Erythromycin),
- Anti-HIV-Proteaseinhibitoren (z. B. Ritonavir),
- Antimykotika vom Azol-Typ (z. B. Ketoconazol),
- die Antidepressiva Nefazodon und Fluoxetin,
- Quinupristin/Dalfopristin,
- Valproinsäure,
- Cimetidin und Ranitidin.
Wenn Bayotensin akut mit einem dieser Arzneimittel angewendet wird, sollte der Blutdruck überwacht werden und, falls erforderlich, eine Verringerung der Nitrendipin-Dosis in Betracht gezogen werden (siehe Abschnitt 4.5).
Bayotensin akut enthält Alkohol
Dieses Arzneimittel enthält 29,7 Vol.-% Alkohol.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Arzneimittel, die Nitrendipin beeinflussen
Nitrendipin wird über das CYP 3A4-System metabolisiert, das sowohl in der Darmschleimhaut als auch in der Leber vorkommt. Daher kann die gleichzeitige Anwendung von Arzneimitteln, die dieses System induzieren oder hemmen, den First-Pass-Metabolismus oder die Ausscheidung von Nitrendipin beeinflussen.
Sowohl das Ausmaß wie auch die Dauer der Interaktionen sollten in Betracht gezogen werden, wenn Nitrendipin zusammen mit den nachfolgend aufgeführten Arzneimitteln verabreicht werden soll.
Rifampicin
Aufgrund von Erfahrungen mit dem strukturell ähnlichen Calciumantagonisten Nifedipin ist zu erwarten, dass Rifampicin wegen seiner enzyminduzierenden Wirkung die Metabolisierung von Nitrendipin beschleunigt. Da hierdurch die Wirksamkeit von Nitrendipin abgeschwächt werden kann, darf Nitrendipin nicht gleichzeitig mit Rifampicin angewendet werden (siehe Abschnitt 4.3).
Arzneimittel, die das CYP 3A4-System inhibieren
Bei gleichzeitiger Anwendung mit einem der nachfolgend aufgeführten Inhibitoren des CYP 3A4-Systems sollte der Blutdruck überwacht und ggf. die Nitrendipin-Dosis verringert werden (siehe Abschnitt 4.2):
Makrolid-Antibiotika (z. B. Erythromycin)
Es wurden keine Interaktionsstudien mit Nitrendipin und Makrolid-Antibiotika durchgeführt. Da aber bekannt ist, dass bestimmte Makrolid-Antibiotika das CYP 3A4-System hemmen, kann ein Anstieg der Plasmakonzentration von Nitrendipin bei gleichzeitiger Anwendung nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Azithromycin (obwohl strukturell verwandt mit den Makrolid-Antibiotika) zeigt keine enzyminhibierende Wirkung.
Anti-HIV-Protease-Inhibitoren (z. B. Ritonavir)
Formale Studien mit Nitrendipin und bestimmten Anti-HIV-Protease-Inhibitoren wurden nicht durchgeführt. Wegen der starken Hemmung des CYP 3A4-Systems durch diese Wirkstoffe, kann ein Anstieg der Plasmakonzentration von Nitrendipin bei gleichzeitiger Anwendung nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Antimykotika vom Azol-Typ (z. B. Ketoconazol)
Eine formale Interaktionsstudie mit bestimmten Antimykotika vom Azol-Typ wurde nicht durchgeführt. Da aber bekannt ist, dass Wirkstoffe dieser Substanzklasse das CYP 3A4-System hemmen und verschiedene Berichte über Interaktionen mit anderen Dihydropyridin-Calciumantagonisten vorliegen, kann nicht ausgeschlossen werden, dass diese Stoffe bei oraler Gabe zusammen mit Nitrendipin die systemische Bioverfügbarkeit von Nitrendipin aufgrund des verringerten First-Pass-Metabolismus deutlich erhöhen (siehe Abschnitt 4.4).
Nefazodon
Formale Studien zur möglichen Interaktion mit Nefazodon wurden nicht durchgeführt. Wegen der bekannten starken Hemmwirkung dieses Antidepressivums auf das CYP 3A4-System, kann bei gleichzeitiger Anwendung die Nitrendipin-Plasmakonzentration erhöht sein (siehe Abschnitt 4.4).
Fluoxetin
Erfahrungen mit dem strukturähnlichen Calciumantagonisten Nimodipin haben gezeigt, dass die gleichzeitige Verabreichung von Nimodipin und dem Antidepressivum Fluoxetin zu ca. 50 % höheren Nimodipin-Plasmakonzentrationen führt. Gleichzeitig wurde der Fluoxetin-Plasmaspiegel deutlich erniedrigt, während der aktive Metabolit, Norfluoxetin, davon nicht betroffen war. Ein klinisch relevanter Anstieg der Nitrendipin-Plasmakonzentrationen kann daher bei gleichzeitiger Anwendung von Fluoxetin nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Quinupristin/Dalfopristin
Aufgrund der Erfahrungen mit dem strukturähnlichen Calciumantagonisten Nifedipin können die Plasmakonzentrationen von Nitrendipin bei gleichzeitiger Anwendung von Quinupristin/Dalfopristin erhöht werden (siehe Abschnitt 4.4).
Valproinsäure
Formale Studien zur Untersuchung möglicher Interaktionen zwischen Nitrendipin und Valproinsäure wurden nicht durchgeführt. Aufgrund von Ergebnissen mit dem strukturähnlichen Calciumantagonisten Nimodipin können jedoch auch bei Nitrendipin erhöhte Plasmakonzentrationen und somit auch eine Zunahme der Nitrendipin-Wirkungen nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Cimetidin, Ranitidin
Durch Cimetidin - und in geringerem Ausmaß auch durch Ranitidin - kann es zu höheren NitrendipinPlasmaspiegeln und folglich zu einer verstärkten Wirkung von Nitrendipin kommen (siehe Abschnitt 4.4).
Antiepileptika, die das CYP 3A4-System induzieren, wie z. B.
Phenytoin, Phenobarbital und Carbamazepin
Studien zur Interaktion zwischen Nitrendipin und diesen Antikonvulsiva liegen nicht vor. Jedoch ist bekannt, dass Phenytoin, Phenobarbital und Carbamazepin das CYP 3A4-System induzieren und somit eine klinisch relevante Verringerung der Bioverfügbarkeit von Nitrendipin zur Folge haben können. Mit einer verringerten Wirksamkeit von Nitrendipin muss daher gerechnet werden. Falls wegen der gleichzeitigen Anwendung von Phenytoin, Phenobarbital oder Carbamazepin eine erhöhte Nitrendipin-Dosis eingenommen wird, sollte bei Absetzen der Antikonvulsiva die Nitrendipin-Dosis verringert werden.
Wirkungen von Nitrendipin auf andere Arzneimittel
Blutdrucksenkende Arzneimittel
Nitrendipin kann den blutdrucksenkenden Effekt von gleichzeitig verabreichten Antihypertensiva verstärken, wie z. B.:
- Diuretika,
- Beta-Rezeptorenblocker,
- ACE-Inhibitoren,
- Angiotensin-1 -(AT -1 -)Rezeptorantagonisten,
- andere Calciumantagonisten,
- Alpha-Rezeptorenblocker,
- PDE-5-Inhibitoren,
- Alpha-Methyldopa.
Digoxin
Nitrendipin kann eine Erhöhung des Digoxin-Plasmaspiegels bewirken. Die Patienten sollen auf Symptome einer Digoxin-Überdosierung überwacht und der Plasmaspiegel kontrolliert werden. Ggf. ist die Digoxin-Dosis zu verringern.
Muskelrelaxanzien
Die Wirkung von Muskelrelaxanzien wie z. B. Pankuronium kann unter gleichzeitiger Therapie mit Nitrendipin verlängert und verstärkt werden.
Interaktionen mit Nahrungsmitteln und Getränken
Grapefruitsaft
Grapefruitsaft hemmt das CYP 3A4-System. Aufgrund eines verringerten First-Pass-Metabolismus und einer verlangsamten Ausscheidung kann der Blutspiegel von Nitrendipin erhöht und die Wirkungsdauer verlängert sein.
Als Folge kann eine verstärkte blutdrucksenkende Wirkung auftreten. Erfahrungen mit dem strukturell ähnlichen Calciumantagonisten Nisoldipin haben gezeigt, dass dieser Effekt über mindestens 3 Tage nach der letzten Einnahme von Grapefruitsaft anhalten kann.
In zeitlichem Zusammenhang mit der Nitrendipin-Behandlung ist deshalb der Genuss von Grapefruit bzw. Grapefruitsaft zu vermeiden (siehe Abschnitt 4.2).
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Bayotensin akut ist während der Schwangerschaft kontraindiziert (siehe Abschnitt 4.3). Es liegen keine hinreichenden Daten für die Verwendung von Bayotensin akut bei Schwangeren vor. Tierexperimentelle Studien haben Reproduktionstoxizität gezeigt und Studien mit maternaltoxischen Dosierungen haben Hinweise auf Fruchtschädigungen ergeben (siehe Abschnitt 5.3).
Stillzeit
Bayotensin akut ist während der Stillzeit kontraindiziert (siehe Abschnitt 4.3).
Nitrendipin geht in geringen Mengen in die Muttermilch über. Die Wirkung von Nitrendipin auf Neugeborene/Säuglinge während der Stillzeit ist nicht bekannt.
Fertilität
In Einzelfällen von in-vitro Fertilisation wurden Calciumantagonisten mit reversiblen biochemischen Veränderungen in der Kopfregion von Spermatozoen in Verbindung gebracht, die zu einer Beeinträchtigung der Spermienfunktion führen könnten. In Fällen, bei denen Männer bei der Zeugung eines Kindes durch in-vitro Fertilisation wiederholt erfolglos blieben und wo keine andere Erklärung dafür gefunden werden kann, sollten Calciumantagonisten als mögliche Ursache in Betracht gezogen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Durch individuell auftretende unterschiedliche Reaktionen kann die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt werden. Dies gilt in verstärktem Maße bei Behandlungsbeginn und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Die Sicherheit von Nitrendipin ist im folgenden Abschnitt aufgeführt. Nebenwirkungen und die Häufigkeit des Auftretens wurden aus klinischen Studien und aus Berichten nach der Markteinführung ermittelt.
Die am häufigsten vorkommenden Nebenwirkungen sind Kopfschmerzen, Palpitationen, Vasodilatation, Ödeme, Flatulenz, Schwächegefühl und Angstzustände. Im Allgemeinen sind diese Nebenwirkungen als nicht schwerwiegend zu betrachten. Mit Ausnahme von Schwächegefühl und
Angstzuständen sind die Nebenwirkungen auf den Wirkmechanismus von Nitrendipin zurückzuführen.
Zu den schwerwiegendsten Nebenwirkungen (aber nur gelegentlich auftretend) zählen arterielle Hypotonie, Angina-pectoris-Anfälle (Schmerzen im Brustkorb) und allergische Reaktionen einschließlich Angioödem. Diese Nebenwirkungen können in Abhängigkeit vom Verlauf eine sofortige therapeutische Intervention erfordern.
Die in der Tabelle aufgeführten häufigen Nebenwirkungen liegen im Vorkommen, mit Ausnahme von Ödemen (6,2 %), Kopfschmerzen (4,7 %) und Vasodilatation (3,0 %), unter 3 %.
Die Häufigkeit der Nebenwirkungen basiert auf Daten aus placebo-kontrollierten klinischen Studien mit Nitrendipin und sind gemäß CIOMS III Definition geordnet (Datenbank klinische Studien: Nitrendipin n = 824; Placebo n = 563).
Aufgrund von Spontanberichten über Gingiva-Hyperplasie wurde die Häufigkeitsangabe mit < 1/400 (beruhend auf der 3/x Regel) geschätzt.
Tabellarische Auflistung der Nebenwirkungen
Innerhalb der Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
|
Systemorganklassen (MedDRA) |
Häufig (> 1/100, < 1/10) |
Gelegentlich (> 1/1.000, < 1/100) |
|
Erkrankungen des Immunsystems |
allergische Reaktionen einschließlich Hautreaktionen und allergisches Ödem/Angioödem | |
|
Psychiatrische Erkrankungen |
Angstzustände |
Schlafstörungen |
|
Erkrankungen des Nervensystems |
Kopfschmerzen |
Schwindel Migräne Benommenheit Müdigkeit Hypästhesien |
|
Augenerkrankungen |
Änderung der optischen Wahrnehmung | |
|
Erkrankungen des Ohrs und des Labyrinths |
Tinnitus | |
|
Herzerkrankungen |
Palpitationen |
Angina pectoris* Schmerzen im Brustkorb Tachykardie |
|
Gefäßerkrankungen |
Ödeme Vasodilatation (z. B. Flush mit Erythem) |
arterielle Hypotonie |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Dyspnoe Nasenbluten |
|
Systemorganklassen (MedDRA) |
Häufig (> 1/100, < 1/10) |
Gelegentlich (> 1/1.000, < 1/100) |
|
Erkrankungen des Gastrointestinaltrakts |
Flatulenz |
Gastrointestinale und abdominale Schmerzen Durchfall Völlegefühl Übelkeit Erbrechen Mundtrockenheit Dyspepsie Verstopfung Gastroenteritis Gingiva-Hyperplasie |
|
Leber- und Gallenerkrankungen |
Leberenzymerhöhungen (alkalische Phosphatase und/oder AST, ALT) | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Myalgie | |
|
Erkrankungen der Nieren und Harnwege |
Polyurie | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Unwohlsein |
unspezifischer Schmerz |
‘Gelegentlich kann es, insbesondere zu Beginn der Behandlung, zum Auftreten von Angina pectoris-Anfällen bzw. bei Patienten mit bestehender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen. Vereinzelt ist das Auftreten eines Herzinfarktes beschrieben worden.
Bei entsprechend sensibilisierten Patienten können durch Pfefferminzöl Überempfindlichkeitsreaktionen (einschließlich Atemnot) ausgelöst werden.
Pfefferminzöl kann bei Säuglingen und Kindern bis zu 2 Jahren einen Laryngospasmus hervorrufen (siehe Abschnitt 4.3).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome
Bei einer akuten Überdosierung/Vergiftung muss mit verstärktem Auftreten von Flush, Kopfschmerzen, Blutdruckabfall (mit Kreislaufkollaps), Herzfrequenzänderung (Tachykardie, Bradykardie) gerechnet werden.
Behandlung
Als erste Therapiemaßnahme kommt eine Magenspülung mit anschließender Instillation von Aktivkohle in Betracht. Die Vitalfunktionen sollten überwacht werden. Bei extremer Blutdrucksenkung ist Dopamin oder Noradrenalin indiziert, auf mögliche Nebenwirkungen (insbesondere Herzrhythmusstörungen) durch Katecholamine ist zu achten. Falls - wie bei Überdosierungen/Intoxikationen mit anderen Calciumantagonisten beobachtet - Bradykardien auftreten, ist Atropin bzw. Orciprenalin indiziert.
Nach Erfahrungen bei Intoxikationen mit anderen Calciumantagonisten führt die wiederholte intravenöse Gabe von 10 ml Calciumgluconat oder -chlorid 10 %, die anschließend als Dauerinfusion weitergeführt wird (cave: Hyperkalzämie), meist zu einer raschen Besserung der Symptomatik; Katecholamine waren hier mitunter nur in hoher Dosierung wirksam.
Darüber hinaus richtet sich die Therapie nach den im Vordergrund stehenden Symptomen.
Eine extrakorporale Detoxikation ist nicht Erfolg versprechend (siehe Abschnitt 5.2). Zudem liegen mit einer solchen Behandlung keine Erfahrungen vor.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Selektiver Calciumkanalblocker mit vorwiegender Gefäßwirkung (C08C), Dihydropyridin-Derivat Nitrendipin, ATC-Code: C08CA08.
Wirkmechanismus
Nitrendipin ist ein Calciumantagonist aus der 1,4-Dihydropyridin-Gruppe, das als Antihypertonikum wirkt.
Als Calciumantagonist hemmt Nitrendipin den transmembranären Calciumioneneinstrom in die glatten Gefäßmuskelzellen.
Daraus resultieren folgende Wirkungen:
- Schutz vor gesteigertem Calciumioneneinstrom in die Zelle
- Hemmung der myogenen, calciumabhängigen Gefäßmuskelkontraktion
- Herabsetzung des peripheren Gefäßwiderstandes
- Senkung des pathologisch erhöhten arteriellen Blutdrucks
- Leichter natriuretischer Effekt, vor allem zu Beginn der Behandlung.
5.2 Pharmakokinetische Eigenschaften
Resorption und Bioverfügbarkeit
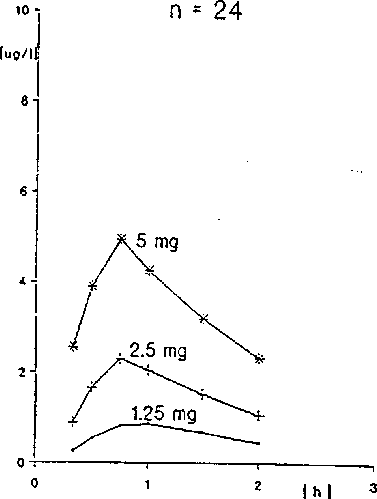
Der Wirkstoff Nitrendipin wird nach oraler Gabe von Bayotensin akut rasch und nahezu vollständig resorbiert; die Resorptionsquote beträgt mehr als 77 %. Die maximalen Plasmaspiegel werden bereits 30 - 45 Minuten nach Gabe erreicht. Bei 24 Probanden, die 1 ml der Bayotensin akut-Lösung (entsprechend 5 mg Nitrendipin) erhalten hatten, wurden im Mittel maximale Plasmaspiegel von 5,5 pg/l erzielt. Nach 2 x 1 ml Lösung (= 10 mg Nitrendipin) fanden sich mittlere maximale Plasmaspiegel in Höhe von ca. 11,6 pg/l.
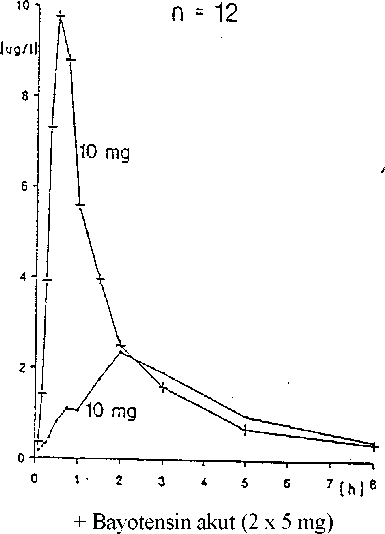
Bei 12 Probanden wurde die relative Bioverfügbarkeit der Bayotensin akut-Lösung im Vergleich zur Tablettenform nach oraler Gabe bestimmt. Die Dosis betrug jeweils 10 mg. Der Verlauf der Plasmaspiegel ist der Abbildung zu entnehmen. Für die Lösung ergeben sich im Vergleich zu der Tablette deutlich höhere mittlere maximale Plasmaspiegel (11,6 bzw. 3,6 pg/l) zu früheren Zeiten nach der Gabe (32 Minuten bzw. ca. 2 Stunden). Die Fläche unter der Kurve (AUC) ist bei der Lösung im Vergleich zu der Tablette um durchschnittlich 40 % größer (21,9 bzw. 15,3 h x pg/l). Der größere AUC-Wert ist vor allem auf die schnellere Resorption der Lösung und einen deshalb verringerten First-Pass-Effekt zurückzuführen.
Abb. 1a:
Mittlerer Plasmaspiegel von Nitrendipin bei
Abb. 1b:
Bayotensin akut (+) vs. Tablette zu 10 mg (•)
24 Probanden nach einmaliger oraler Gabe von 1,25 mg, 2,5 mg bzw. 5 mg Bayotensin akut
Mittlere Plasmaspiegel bei 12 Probanden
Nitrendipin-Plasmaspiegel
(kig/1)
Nitrendipin-Plasmaspiegel
(hg/1)
• Tablette (10 mg)
Verteilung
Nitrendipin wird zu ca. 96 - 98 % an Plasmaeiweiß (Albumin) gebunden und ist deshalb nicht dialysierbar. Das Verteilungsvolumen im Steady-State beträgt 5 - 9 l/kg Körpergewicht, so dass Hämoperfusion oder Plasmapherese nicht Erfolg versprechend sind.
Biotransformation und Elimination
Der Wirkstoff Nitrendipin wird nahezu vollständig über oxidative Prozesse in der Leber metabolisiert. Dabei unterliegt Nitrendipin bei oraler Gabe einem ausgeprägten First-Pass-Effekt. Weniger als 0,1 % einer oralen Dosis wird als unverändertes Nitrendipin mit dem Urin ausgeschieden. Die Metabolite zeigen keine pharmakodynamische Aktivität. Nitrendipin wird in Form seiner Metabolite vorwiegend renal ausgeschieden (etwa 77 % einer oralen Dosis); der nicht renal zur Ausscheidung gelangende Teil wird mit den Fäzes ausgeschieden.
Die mittlere Eliminationshalbwertszeit von 10 mg Nitrendipin als Lösung (= 2 x 1 ml Lösung zum Einnehmen) beträgt 10,4 Stunden. Die entsprechende Eliminationshalbwertszeit nach Verabreichung von 5 mg (= 1 Phiole Bayotensin akut) ist wegen zu niedriger Plasmakonzentrationen in der terminalen Eliminationsphase nicht mehr sicher bestimmbar.
Da Nitrendipin vorwiegend in der Leber metabolisiert wird, ist bei Patienten mit chronischen Lebererkrankungen mit erhöhten Plasmaspiegeln zu rechnen. Dagegen ist bei Patienten mit eingeschränkter Nierenfunktion keine besondere Dosisanpassung notwendig.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität nach Einmalgabe, Toxizität bei wiederholter Gabe, Reproduktions- und Entwicklungstoxizität, Genotoxizität und zum kanzerogenen Potenzial lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
In Studien zur Reproduktionstoxizität, die an Ratten und Kaninchen durchgeführt wurden, zeigten sich weder embryotoxische noch teratogene Effekte. Bei Affen wurden bei maternaltoxischen Dosen von 100 mg/kg Körpergewicht Skelettveränderungen beobachtet, jedoch nicht bei einer Dosis von 30 mg/kg Körpergewicht.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Ethanol 96 %, Palmitoylascorbinsäure (Ph. Eur.), Pfefferminzöl, Polysorbat 20, Propylenglykol, gereinigtes Wasser, all-rac-a-Tocopherol.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
Nach Entnahme der Phiole aus der Folie beträgt die Haltbarkeit der Lösung in der Phiole maximal 2 Stunden bei Tageslicht.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Phiolen im Umkarton aufbewahren und erst unmittelbar vor Gebrauch dem Blister entnehmen, um den Inhalt vor Licht zu schützen.
Um die lichtempfindliche Wirkstofflösung von Bayotensin akut zu schützen, ist der Blister (= Folienverpackung) erst unmittelbar vor Gebrauch der Phiole aus dem Umkarton zu entnehmen. Nach Entnahme der Phiole aus der Folie beträgt die Haltbarkeit der Lösung (in der Phiole) maximal 2 Stunden bei Tageslicht.
6.5 Art und Inhalt des Behältnisses
Kunststoffphiole mit Schraubkappe in Polypropylen- (rot opak)/Aluminiumfolie-Blister in Faltschachteln
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Bayer Vital GmbH 51368 Leverkusen Tel.: 0214 30-51348 Fax: 0214 30-51603
E-Mail: bayer-vital@bayerhealthcare.com
8. ZULASSUNGSNUMMER(N) 5562.00.01
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung 13. August 1993 Datum der letzten Verlängerung der Zulassung 26. April 2007
10. STAND DER INFORMATION
November 2014
11. VERKAUFSABGRENZUNG V erschreibungspflichtig
12