Bcg-Medac
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
BCG-medac®
Pulver und Lösungsmittel zur Herstellung einer Suspension zur intravesikalen Anwendung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Nach Rekonstitution enthält eine Durchstechflasche:
BCG (Bacillus Calmette-Guerin) Bakterien Stamm RIVM abgeleitet von Stamm 1173-P2 2 x 108 bis 3 x IO9 lebensfähige Einheiten Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Suspension zur intravesikalen Anwendung Weißes Pulver und farblos klare Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Behandlung nicht-invasiver urothelialer Harnblasenkarzinome:
• kurative Behandlung eines Carcinoma in situ
• prophylaktische Behandlung zur Vermeidung eines erneuten Auftretens von:
- urothelialen Karzinomen beschränkt auf die Schleimhaut:
- Ta G1-G2 bei einem multifokalen Tumor und/oder Tumorrezidiv
- Ta G3
- urothelialen Karzinomen in der Lamina propia aber nicht im Muskelgewebe der Blase (T1)
- Carcinoma in situ
4.2 Dosierung, Art und Dauer der Anwendung
Dosierung
Der Inhalt einer Durchstechflasche wird für eine Blaseninstillation benötigt. Hinweise für die Rekonstitution sind unter 6.6 angegeben.
Dauer der Anwendung Carcinoma in situ
Ein üblicher Behandlungsplan für eine initiale Therapie besteht aus einer intravesikalen Instillation von BCG-medac pro Woche für 6 aufeinanderfolgende Wochen. Die Behandlung mit BCG darf erst 2 - 3 Wochen nach einer transurethralen Resektion (TUR) begonnen werden. Nach einem behandlungsfreien Intervall von 4 Wochen sollte die intravesikale Behandlung mit einer mindestens einjährigen Erhaltungstherapie fortgesetztwerden. Behandlungsschemata für die Erhaltungstherapie sind unten beschrieben.
Initiale Therapie (Prophylaktische Behandlung zur Vermeidung eines Wiederauftretens)
Die BCG-Therapie sollte etwa 2 - 3 Wochen nach einer TUR oder Blasenbiopsie und ohne eine traumatische Katheterisierung beginnen und im wöchentlichen Abstand 6 Wochen lang wiederholt werden. Bei Tumoren mit mittlerem oder hohem Risiko sollte eine Erhaltungstherapie angeschlossen werden.
Erhaltungstherapie
Ein Therapieschema besteht aus einer 12-monatigen Erhaltungstherapie mit Behandlungen in monatlichem Abstand. Ein anderes Schema besteht aus 3 Instillationen in wöchentlichem Abstand in den Monaten 3, 6, 12, 18, 24, 30 und 36. In diesem Schema werden insgesamt 27 Instillationen über einen Zeitraum von 3 Jahren verabreicht.
Die aufgeführten Behandlungsschemata verschiedener BCG-Stämme wurden in klinischen Studien an einer großen Anzahl von Patienten erprobt. Zum gegenwärtigen Zeitpunkt lässt sich nicht festlegen, ob ein Therapieregime dem anderen überlegen ist.
Art der Anwendung
BCG-medac sollte unter den gleichen Kautelen wie für eine intravesikale Endoskopie verabreicht werden.
Der Patient sollte über einen Zeitraum von 4 Stunden vor bis 2 Stunden nach der Instillation keine Flüssigkeit zu sich nehmen. Die Harnblase muss vor der BCG-Instillation entleert sein. BCG-medac wird in die Blase mit Hilfe eines Einmal-Katheters und mit geringem Druck eingeführt. Die instillierte Suspension sollte für etwa 2 Stunden in der Blase verbleiben. Während dieser Zeit sollte die Suspension einen ausreichenden Kontakt mit der gesamten Schleimhautoberfläche haben. Es sollte daher darauf geachtet werden, dass der Patient so weit wie möglich mobil bleibt. Nachdem die Suspension 2 Stunden in der Harnblase geblieben ist, entleert der Patient sitzend die Blase. Sofern keine besondere medizinische Gegenanzeige besteht, wird eine Hyperhydratation des Patienten für 48 Stunden nach jeder Instillation empfohlen.
BCG-medac sollte nicht bei Kindern angewendet werden, da Sicherheit und Wirksamkeit bisher nicht gezeigt wurden. Es gibt keine speziellen Hinweise für die Anwendung bei älteren Patienten.
4.3 Gegenanzeigen
Überempfindlichkeit gegenüber dem arzneilich wirksamen Bestandteil oder einem der Hilfsstoffe.
BCG-medac darf nicht bei immunsupprimierten Patienten oder Personen mit einer angeborenen oder erworbenen Immunschwäche angewandt werden. Dabei ist unerheblich, ob diese Beeinträchtigung durch eine gleichzeitige Erkrankung (z. B. positive HIV-Serologie, Leukämie, Lymphom), Krebstherapie (z. B. Zytostatika, Bestrahlung) oder eine immunosuppressive Therapie (z. B. Kortikosteroide) erworben wurde.
Patienten mit einer aktiven Tuberkulose darf BCG-medac nicht verabreicht werden. Das Risiko einer aktiven Tuberkulose muss durch eine entsprechende Anamnese und, falls erforderlich, durch diagnostische Untersuchungen gemäß nationalen Anforderungen ausgeschlossen werden.
Eine Radiotherapie der Blase in der Vorgeschichte.
Die Behandlung mit BCG-medac während der Stillzeit ist kontraindiziert (siehe Abschnitt 4.6).
Mit der Instillation von BCG darf erst 2 - 3 Wochen nach einer transurethralen Resektion (TUR), einer Blasenbiopsie oder einer traumatischen Katheterisierung begonnen werden.
Blasenperforation (siehe Abschnitt 4.4.)
Akute Infektion des Harntraktes (siehe Abschnitt 4.4)
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
BCG-medac darf nicht subkutan, intradermal, intramuskulär, intravenös oder zur Impfung gegen Tuberkulose verabreicht werden.
Symptome, Symptomenkomplexe und deren Behandlung siehe Abschnitt 4.8.
Anzahl der BCG-Instillationen
Nebenwirkungen einer Behandlung mit BCG-medac sind häufig, aber im Allgemeinen leicht und vorübergehend. Sie nehmen mit der Anzahl der Instillationen zu.
Schwere systemische BCG-Infektion/-Reaktion
Über systemische BCG-Infektionen/-Reaktionen wurde selten berichtet. Sie werden charakterisiert durch Fieber über 39,5 °C über mindestens 12 Stunden, Fieber über
38,5 °C über mindestens 48 Stunden, miliare Pneumonie, granulomatöse Hepatitis, Abweichungen im Leberfunktionstest, organische Dysfunktion (außer im Urogenitaltrakt) mit Granulomen in der Biopsie, Reiter-Syndrom.
Die Möglichkeit einer schweren BCG-Infektion sollte vor Beginn der Therapie bedacht werden.
Eine traumatische Instillation kann BCG-bedingte, septische Ereignisse mit möglichem septischem Schock und potenziell fatalen Folgen fördern.
Eine Infektion des Harntraktes sollte vor jeder Blaseninstillation von BCG-medac ausgeschlossen werden. Eine Entzündung der Blasenschleimhaut kann das Risiko einer hämatologischen Dissemination erhöhen.
Wenn eine Infektion des Harntraktes während einer BCG-Therapie diagnostiziert wird, sollte die Therapie unterbrochen werden, bis sich der Urinbefund normalisiert hat und eine antibiotische Behandlung abgeschlossen wurde.
Eine Infektion von Implantaten und Organersatz wurde bei Patienten mit z. B. Aneurysma oder Prothesen beobachtet.
Persistenz von BCG
Es wurde über Einzelfälle berichtet, bei denen die BCG-Bakterien länger als 16 Monate in den Harnwegen verblieben sind.
Fieber oder Makrohämaturie
Im Falle eines begleitenden Fiebers oder einer Makrohämaturie sollte die Behandlung bis zum Abklingen der Symptome verschoben werden.
Niedrige Blasenkapazität
Das Risiko einer Schrumpfblase kann bei Patienten mit einer niedrigen Blasenkapazität erhöht sein.
HLA-B27
Bei Patienten mit positivem HLA-B27 kann vermehrt eine reaktive Arthritis oder ein Reiter-Syndrom auftreten.
Vorsichtsmaßnahmen für die Anwendung
Der Umgang mit BCG-medac sollte weder im selben Raum noch durch dasselbe Personal erfolgen, das Zytostatika zur intravenösen Anwendung vorbereitet. Das Präparat sollte nicht durch Personen mit einer bekannten Immunschwäche zubereitet werden. Der Kontakt von BCG-medac mit der Haut und den Schleimhäuten ist zu vermeiden. Eine Kontaminierung kann zu einer allergischen Reaktion oder einer Infektion der betroffenen Stelle führen.
Patienten mit Immunschwäche
Patienten mit einer bekannten Immunschwäche müssen den Kontakt mit Patienten vermeiden, die mit BCG-medac behandelt werden.
Hauttest auf Tuberkulin
Die intravesikale Behandlung mit BCG-medac kann eine Empfindlichkeit gegenüber Tuberkulin bewirken und dadurch die nachfolgende Interpretation eines Hauttests auf Tuberkulin im Rahmen der Diagnose einer mycobakteriellen Infektion erschweren. Daher kann ein Test auf Tuberkulin vor einer Anwendung von BCG-medac erfolgen.
Schwangerschaft
Eine Behandlung mit BCG-medac während der Schwangerschaft wird nicht empfohlen (siehe Abschnitt 4.6).
Sexuelle Übertragung
Über eine sexuelle Übertragung von BCG-Bakterien wurde bisher nicht berichtet, es wird aber empfohlen, während des Geschlechtsverkehrs für eine Woche nach der BCG-Instillation ein Kondom zu benutzen.
Allgemeine Hygiene
Es wird empfohlen, nach dem Wasserlassen Hände und Genitalbereich zu waschen. Dies betrifft vor allem die ersten Male nach eine BCG-Instillation. Sind verletzte Hautpartien kontaminiert, wird die Anwendung eines geeigneten Desinfektionsmittels empfohlen.
Verschütten von BCG-medac
Verschüttete BCG-Suspension muss mit einem Desinfektionsmittel beseitigt werden, das nachweislich gegen Mykobakterien wirkt. Eine Kontamination der Haut ist mit einem geeigneten Desinfektionsmittel zu behandeln.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
BCG-Bakterien sind empfindlich gegenüber Tuberkulostatika (z. B. Ethambutol, Streptomycin, p-Aminosalicylsäure (PAS), Isoniazid (INH) und Rifampicin), Antibiotika, Antiseptika und Gleitmitteln. Eine Resistenz gegen Pyrazinamid und Cycloserin ist beschrieben worden.
Während einer intravesikalen BCG-Instillationstherapie sollte die gleichzeitige Anwendung von Tuberkulostatika und Antibiotika wie Fluorochinolonen, Doxycyclin oder Gentamicin wegen der Empfindlichkeit der Bakterien gegenüber diesen Wirkstoffen vermieden werden.
4.6 Schwangerschaft und Stillzeit
Schwangerschaft (siehe Abschnitt 4.4):
Ausreichende Erfahrungen über die Anwendung von BCG-medac bei Schwangeren liegen nicht vor. Reproduktionsstudien an Tieren wurden nicht durchgeführt. Eine Behandlung mit BCG-medac während der Schwangerschaft wird daher nicht empfohlen.
Stillzeit:
Ausreichende Daten über den Übergang der Bakterien in die Muttermilch liegen nicht vor. Die Anwendung bei Stillenden ist daher kontraindiziert (siehe Abschnitt 4.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Lokale oder systemische Symptome während der Therapie mit BCG-medac können die Verkehrstüchtigkeit und das Bedienen von Maschinen beeinflussen.
4.8 Nebenwirkungen
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Tabelle 1
|
Systemorganklasse |
Häufigkeit und Nebenwirkung |
|
Infektionen und parasitäre Erkrankungen |
Sehr häufig (> 1/10): Zystitis und entzündliche Reaktionen (Granulomata) der Blase Gelegentlich (> 1/1.000 bis < 1/100): Harnwegsinfektion, Orchitis, schwere systemische BCG-Reaktion/-Infektion, BCG-Sepsis, miliare Pneumonie, Hautabszesse, Reiter-Syndrom (Konjunktivitis, asymmetrische Oligoarthritis und Zystitis) Selten (> 1/10.000 bis < 1/1.000): Gefäßinfektionen (z. B. infiziertes Aneurysma), Nierenabszess Sehr selten (< 1/10.000): BCG-Infektion von Implantaten und dem umgebenden Gewebe (z. B. Aortentransplantat, Defibrillator, Hüft- oder Knieprothese), zervikale Lymphadenitis, regionale Lymphknoteninfektion, Osteomyelitis, Knochenmarkinfektion, Psoas-Abszess, Infektion der Glans Penis, gegenüber Tuberkulostatika resistente Orchitis oder Epididymitis |
|
Erkrankungen des Blutes und des |
Gelegentlich (> 1/1.000 bis < 1/100): |
|
Lymphsystems |
Zytopenie, Anämie |
|
Erkrankungen des Immunsystems |
Sehr häufig (> 1/10): Vorübergehende systemische BCG-Reaktion (Fieber < 38,5 °C, grippeähnliche Symptome wie Unwohlsein, Fieber, Schüttelfrost, allgemeines Unwohlsein) Sehr selten (< 1/10.000): Hypersensitivitätsreaktionen (z. B. Augenlidödeme, Husten) |
|
Augenerkrankungen |
Sehr selten (< 1/10.000): Chorioretinitis, Konjunctivitis, Uveitis |
|
Gefäßerkrankungen |
Sehr selten (< 1/10.000): Gefäßfisteln |
|
Erkrankungen der Atemwege, des |
Gelegentlich (> 1/1.000 bis < 1/100): |
|
Brustraums und Mediastinums |
Lungengranulomatose |
|
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig (> 1/10): Übelkeit Sehr selten (< 1/10.000): Erbrechen, intestinale Fisteln, Peritonitis |
|
Leber- und Gallenerkrankungen |
Gelegentlich (> 1/1.000 bis < 1/100): Hepatitis |
|
Erkrankungen der Haut und des Unter- |
Gelegentlich (> 1/1.000 bis < 1/100): |
|
hautzellgewebes |
Exanthem |
|
Skelettmuskulatur-, Bindegewebs- und |
Gelegentlich (> 1/1.000 bis < 1/100): |
|
Knochenerkrankungen |
Arthritis, Arthralgie |
|
Erkrankungen der Nieren und Harnwege |
Sehr häufig (> 1/10): Erhöhte Miktionsfrequenz mit Schmerzen und Unwohlsein Gelegentlich (> 1/1.000 bis < 1/100): Makrohämaturie, Einschränkung der Blasenkapazität, Harnstauung, Schrumpfblase |
|
Erkrankungen der Geschlechtsorgane |
Sehr häufig (> 1/10): |
|
und der Brustdrüse |
Asymptomatische granulomatöse Prostatitis Gelegentlich (> 1/1.000 bis < 1/100): Epididymitis, symptomatische granulomatöse Prostatitis Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar): Beschwerden im Genitalbereich (z. B. Schmerzen in der Vagina, Dyspareunie) |
|
Allgemeine Erkrankungen und Beschwer- |
Häufig (> 1/100 bis < 1/10): |
|
den am Verabreichungsort |
Fieber > 38,5 °C Gelegentlich (> 1/1.000 bis < 1/100): Hypotonie |
Mit unerwünschten Wirkungen ist häufig zu rechnen. In der Regel sind die beobachteten Symptome mild und vorübergehend. Die unerwünschten Wirkungen können üblicherweise im Verlauf der Therapie zunehmen.
Gelegentlich können Arthritis/Arthralgien und Exantheme auftreten. In den meisten Fällen sind diese Symptome Zeichen einer Hypersensibilität gegenüber BCG. In einigen Fällen kann eine Unterbrechung oder ein Abbruch der BCG-Behandlung erforderlich sein.
Lokale unerwünschte Wirkungen:
Bei bis zu 90 % der Patienten kommt es zu Schmerzen und Unwohlsein bei der Miktion sowie zu verstärktem Harndrang. Zystitis und entzündliche Reaktionen (Granulome) der Blase sind ein Bestandteil der antineoplastischen Aktivität. Weitere lokale unerwünschte Wirkungen werden gelegentlich beobachtet: Makrohämaturie, Harnwegsinfektion, Einschränkung der Blasenkapazität, Harnstauung, Schrumpfblase, symptomatische granulomatöse Prostatitis, Orchitis, Epididymitis. Darüber hinaus können Beschwerden im Genitalbereich (z. B. Schmerzen in der Vagina, Dyspareunie) mit unbekannter Häufigkeit auftreten.
Vorübergehende systemische BCG-Reaktion:
Niedriges Fieber, grippeähnliche Symptome und allgemeines Unwohlsein können auftreten. Diese Symptome bilden sich in der Regel innerhalb von 24 - 48 Stunden zurück und sollten mit symptomatischen Maßnahmen behandelt werden. Sie sind als Zeichen der gewünschten beginnenden immunologischen Reaktion zu werten. Alle Patienten, die eine BCG-Behandlung erhalten, sollten sorgfältig überwacht und angewiesen werden, Fieber und Reaktionen außerhalb des Harntrakts dem Arzt mitzuteilen.
Schwere systemische Nebenwirkungen/Infektionen:
Systemische Nebenwirkungen/Infektionen werden wie folgt definiert: Fieber > 39,5 °C über mindestens 12 Stunden, Fieber > 38,5 °C über mindestens 48 Stunden, miliare Pneumonie, granulomatöse Hepatitis, Leberfunktionstests abnormal, Organstörungen (außerhalb des Urogenitaltrakts) mit bioptisch gesicherten Granulomen, ReiterSyndrom. Schwere systemische BCG-Reaktion/Infektion kann zu BCG-Sepsis führen, die eine lebensbedrohliche Situation darstellt.
Behandlungsempfehlungen siehe unten stehende Tabelle 2.
Tabelle 2
|
Behandlung von Symptomen und Syndromen | |
|
Symptom oder Syndrom |
Behandlung |
|
1) Symptome einer Blasenirritation < 48 h |
Symptomatische Behandlung |
|
2) Symptome einer Blasenirritation > 48 h |
Unterbrechung der BCG-Behandlung und Beginn einer Behandlung mit Quinolonen. Falls nach 10 Tagen kein vollständiger Rückgang der Symptomatik eingetreten ist, ist für 3 Monate Isoniazid (INH)* zu geben. Falls eine tuberkulostatische Behandlung eingeleitet wurde, muss die BCG-Therapie abgebrochen werden. |
|
3) Bakterielle Harnwegsinfektion |
Aussetzen der BCG-Therapie bis zur Normalisierung des Urinbefundes und beendeter antibiotischer Behandlung. |
|
4) Andere unerwünschte Effekte im Urogenitaltrakt: symptomatische granulomatöse Prostatitis, Epididymi-tis und Orchitis, Harnstauung und Nierenabszess |
Unterbrechung der BCG-Therapie. Gabe von Isoniazid (INH)* und Rifampicin* für 3 bis 6 Monate. Falls eine tuberkulostatische Behandlung eingeleitet wurde, muss die BCG-Therapie abgebrochen werden. |
|
5) Fieber < 38,5 °C für < 48 h |
Symptomatische Behandlung mit Paracetamol. |
|
6) Hautausschläge, Arthralgie oder Arthritis oder Reiter-Syndrom |
Unterbrechung der BCG-Therapie. Behandlung mit Antihistaminika oder nicht-steroidalen anti-inflammatorischen Arzneimitteln. Falls kein Rückgang der Symptome: Gabe von Isoniazid* für 3 Monate. Falls eine tuberkulostatische Behandlung eingeleitet wurde, muss die BCG-Therapie abgebrochen werden. |
|
7) Systemische BCG-Reaktion/-Infektion** ohne Zeichen eines septischen Schocks ** siehe Definition systemische BCGReaktion/-Infektion |
Unbedingter Abbruch der BCG-Behandlung. Evtl. Konsultation eines Spezialisten für Infektionskrankheiten. Dreifachtherapie mit Tuberkulostatika* über 6 Monate. |
|
8) Systemische BCG-Reaktion/-Infektion mit Zeichen eines septischen Schocks |
Unbedingter Abbruch der BCG-Behandlung. Sofortige Dreifachtherapie mit Tuberkulostatika* kombiniert mit Hochdosistherapie schnellwirksamer Kortikoide. Konsultation eines Spezialisten für Infektionskrankheiten. |
* Hinweis: BCG-Bakterien sind derzeit gegenüber allen gängigen Tuberkulostatika sensitiv, außer gegenüber Pyrazinamid. Bei einer Notwendigkeit einer Dreifachtherapie werden derzeit zumeist Isoniazid (INH), Rifampicin und Ethambutol empfohlen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel (Details siehe unten) anzuzeigen.
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51 - 59
63225 Langen
Tel: + 49 6103 77 0
Fax: + 49 6103 77 1234
Website: www.pei.de
4.9 Überdosierung
Das Auftreten einer Überdosierung ist unwahrscheinlich, da eine Durchstechflasche einer Dosis entspricht.
Es liegen keine Daten vor, die andeuten, dass eine Überdosierung zu anderen Symptomen als den dargestellten Nebenwirkungen führt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Immunstimulans ATC Code: L03AX03
BCG-medac ist eine gefriergetrocknete Suspension lebender Bacillus Calmette-Guerin Bakterien, die von Mycobacterium bovis, Stamm RIVM, abstammen.
BCG-medac stimuliert das Immunsystem und besitzt Antitumor-Aktivität.
Studienergebnisse deuten an, dass BCG als ein nicht-spezifisches Immunstimulans auftritt, dessen Wirkung auf einer Vielzahl von Interaktionen mit den Zellen des Immunsystems beruht. BCG zeigt einen stimulierenden Effekt auf die Milz, ruft einen Anstieg der Makrophagenaktivität in der Milz hervor und aktiviert körpereigene Killerzellen. Eine BCG-Instillation bewirkt einen Anstieg der Granulozyten, Monozyten/Makrophagen und T-Lymphozyten, was auf eine lokale Aktivierung des Immunsystems hindeutet.
Die Zytokine IL1, IL2, IL6 und TNFa nehmen ebenfalls zu.
5.2 Pharmakokinetische Eigenschaften
Die meisten BCG-Bakterien werden in den ersten Stunden nach Instillation mit dem Urin ausgeschieden. Ob die Mykobakterien die intakte Harnblasenwand überwinden können, ist noch unbekannt. Es wurde über Einzelfälle berichtet, bei denen die BCG-Bakterien länger als 16 Monate in den Harnwegen verblieben sind.
5.3 Präklinische Daten zur Sicherheit
Toxizitäten, immunstimulierende Eigenschaften und Antitumor-Aktivität des BCG-Stammes RIVM wurden an verschiedenen Tieren gestestet. Hohe Dosen von BCG verursachten einen Gewichtsverlust in Mäusen. Außerdem wurde eine Beeinträchtigung der Leberfunktion beobachtet. Eine intravenöse Injektion in Kaninchen schien pyrogen zu sein. Wiederholte Instillationen in Meerschweinchen induzierten entzündliche Reaktionen in der Harnblasenwand. Als Nebenwirkungen traten bei hohen Dosen granulomatöse Läsionen in der Leber und Lunge auf. Eine intravesikale Anwendung in Hunden zeigte minimale mechanische Läsionen des Urothels. Es wurden keine Anzeichen für eine aktive Entzündung in der suburothelialen Stroma beobachtet.
Studien zur Mutagenität, Karzinogenität und Reproduktionstoxizität wurden nicht durchgeführt.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Pulver: Polygeline, wasserfreie Glucose und Polysorbat 80.
Lösungsmittel: Natriumchlorid und Wasser für Injektionszwecke.
6.2 Inkompatibilitäten
BCG-medac verträgt sich nicht mit hypotonen und hypertonen Lösungen.
6.3 Dauer der Haltbarkeit
2 Jahre oder 3 Jahre, sofern die Anzahl lebensfähiger Einheiten bei Freigabe größer als 5 x 108 cfu/Durchstechflasche ist, in jedem Fall nicht länger als 4 Jahre nach dem Datum der Ernte.
Nach Rekonstitution sollte das Präparat sofort verwendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2 °C - 8 °C).
Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Lagerungsbedingungen des rekonstituierten Arzneimittels siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Pulver in einer Durchstechflasche (Typ I Glas) mit einem Gummistopfen + 50 ml Lösungsmittel in einem Beutel (PVC) mit Adaptern für Durchstechflasche und Katheter (konischer oder Luer-Lock-Adapter) mit/ohne Katheter - Packungsgrößen 1,3, 5 oder 6.
Es werden möglicherweise nicht alle Packungsgrößen von der axicorp Pharma GmbH in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Handhabung und Beseitigung
Hinweise für die Handhabung
Vor der Verwendung muss das Präparat unter aseptischen Bedingungen mit steriler 0,9-prozentiger Natriumchloridlösung resuspendiert werden (siehe unten). Die Suspension sollte vor Anwendung durch leichtes Drehen gemischt werden. Hautkontakt mit BCG-medac ist zu vermeiden. Der Einsatz von Handschuhen wird empfohlen.
Makroskopisch erkennbare Partikel haben keinen Einfluss auf die Wirksamkeit und Sicherheit des Präparates.
Die folgenden Hinweise für die Handhabung gelten für das System mit konischem oder Luer-Lock-Adapter.
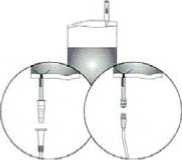
1. Schutzhülle aufreißen, aber nicht ganz entfernen! So bleibt die Spitze des Instillations-Systems bis zuletzt vor Kontamination geschützt.

2. Die Abdeckkappen der Durchstechflasche und des Instillationssystems entfernen. Entsorgungsbeutel zurechtlegen.
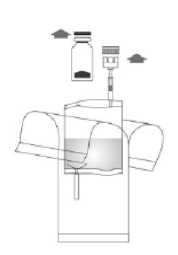
3. Die BCG-medac-Durchstechflasche senkrecht und fest auf den Adapter des Instillationssystems drücken. Die Durchstechflasche 3 - 4-mal in beide Richtungen drehen.
J»
A
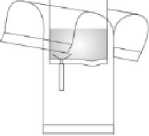
4. Mechanismus im Schlauchteil des Flaschenadapters durch wiederholtes Knicken in beide Richtungen aufbrechen. Herstellen der Verbindung. Während des Vorgangs bitte den Beutel und nicht die Flasche festhalten!

5. Die Flüssigkeit in die Durchstechflasche pumpen. Bitte sicherstellen, dass die Flasche nicht vollständig gefüllt ist.

6. Das ganze System umdrehen. Die Durchstechflasche nach oben halten und Luft einpumpen. Die rekonstituierte BCG-Suspension in das Instillations-System ziehen. Flasche nicht abnehmen.

7. Instillations-System senkrecht halten. Nun die Schutzhülle ganz entfernen. Katheter-Adapter mit dem Katheter verbinden. Erst jetzt Verschlussmechanismus
im Schlauchteil durch Knicken in beide Richtungen aufbrechen und die Suspension instillieren. Nach der Instillation Katheter mit Luft freidrücken. Den Lösungsmittelbeutel zusammengedrückt halten und mit dem Katheter in den Entsorgungsbeutel geben.
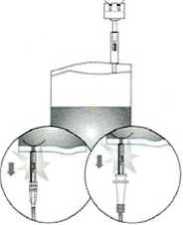
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
axicorp Pharma GmbH Max-Planck-Str. 36 b D—61381 Friedrichsdorf
8. ZULASSUNGSNUMMER(N)
PEI.H.11770.01.1
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
10. STAND DER INFORMATION
08.2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig.