Beclomet Easyhaler 0,2Mg /Dosis Pulver Zur Inhalation
Fachinformation
1. Bezeichnung des Arzneimittels
Beclomet Easyhaler 0,2 mg/Dosis Pulver zur Inhalation
2. Qualitative und quantitative Zusammensetzung
Wirkstoff: Beclometason-17,21-dipropionat
Eine Einzeldosis zu 8 mg Pulver enthält 0,2 mg Beclometason-17,21-dipropionat; dies entspricht einer (aus dem Mundstück) abgegebenen Dosis von 0,18 mg Beclometason-17,21-dipropionat.
Sonstiger Bestandteil: Lactose-Monohydrat (enthält geringe Mengen Milchprotein).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Pulver zur Inhalation
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Behandlung von Atemwegserkrankungen, wenn die Anwendung von Glukokortikoiden erforderlich ist, wie z. B. bei
- Asthma bronchiale
- chronisch obstruktive Bronchitis.
Hinweis:
Beclomet Easyhaler 0,2 mg/Dosis ist nicht zur Behandlung von plötzlich auftretenden Atemnotanfällen (akuter Asthmaanfall oder Status asthmaticus) geeignet.
4.2 Dosierung, Art und Dauer der Anwendung
Die Dosierung sollte sich an den Erfordernissen des Einzelfalles und dem klinischen Ansprechen des Patienten orientieren. Es sollte auf die niedrigste Dosis, mit der eine effektive Kontrolle des Asthmas aufrecht erhalten werden kann, eingestellt werden. Die Tagesdosis sollte in 2 Gaben (morgens und abends) aufgeteilt werden, in besonderen Fällen (mangelnde Wirksamkeit im Intervall), kann sie auf 3-4 Einzelgaben aufgeteilt werden.
In der Regel sollte die Tageshöchstdosis bei Kindern 0,5 mg und bei Jugendlichen und Erwachsenen 2,0 mg Beclometason-17,21-dipropionat nicht überschreiten.
Die folgenden Dosierungsangaben können als Richtlinie gelten. Erwachsene und Jugendliche über 12 Jahre:
2-mal täglich 1-2 Pulverinhalationen
Kinder von 6 bis 12 Jahren: 1-2-mal täglich 1 Pulverinhalation
Art und Dauer der Anwendung
Beclomet Easyhaler 0,2 mg/Dosis sollte regelmäßig in den empfohlenen Zeitabständen eingesetzt werden. Bei Stabilisierung der Krankheitssymptome sollte die tägliche Dosis von Beclomet Easyhaler 0,2 mg/Dosis bis zur niedrigst möglichen Erhaltungsdosis reduziert werden. Grundsätzlich ist Beclomet Easyhaler 0,2 mg/Dosis ein Arzneimittel zur Langzeitbehandlung des Asthma bronchiale.
Beclomet Easyhaler 0,2 mg/Dosis sollte vor einer Mahlzeit angewendet werden, wenn dieses nicht möglich ist, sollte nach der Inhalation der Mund ausgespült werden.
Bedienungsanleitung
Lesen Sie die folgenden Hinweise sorgfältig, bevor Sie Beclomet Easyhaler 0,2 mg/Dosis anwenden. Befolgen Sie bitte unbedingt die hier gemachten Angaben.
Ein Pulverinhalator enthält 200 Dosen Beclometason-17,21-dipropionat zu je 0,2 mg.
Der Pulverinhalator sollte in der dazugehörigen Schutzbox aufbewahrt werden.
A. EINSETZEN DES EASYHALER IN DIE SCHUTZBOX Abb. 1 ^vennhateto!-
1. Entnehmen Sie den Easyhaler aus der Folienverpackung.
Er befindet sich in einer Folie, um das Pulver vor Feuchtigkeit zu schützen. Entnehmen Sie den Easyhaler der Folienverpackung nur, wenn Sie ihn anschließend auch gebrauchen wollen.
Schutzkappe
Mundstück
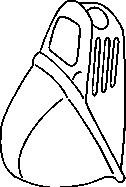
Der Easyhaler kann mit oder ohne Schutzbox verwendet werden (Abb. 1). Die Aufbewahrung in der Schutzbox erhöht die Stabilität des Arzneimittels während des Gebrauchs und schützt den Easyhaler vor Beschädigung. Wenn Sie die Schutzbox nicht benutzen, gehen Sie weiter zu Punkt B.
2. Öffnen Sie die Schutzbox (Abb. 2).
3. Stecken Sie den Easyhaler in die Schutzbox (Abb. 2).
Die Schutzkappe auf dem Mundstück des Easyhaler (Abb. 1) Schutz
blockiert diesen und verhindert eine versehentliche Betätigung
des Easyhaler beim Einstecken in die Schutzbox. Abb. 2
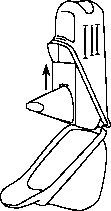
4. Wenn Sie den Easyhaler nicht sofort benötigen, schließen Sie die Schutzbox bis zum Anschlag.
Hinweis: Das aufklappbare und wiederverschließbare Etikett an der Rückseite Ihres Easyhaler enthält wichtige Informationen über das Arzneimittel. Vermeiden Sie bitte Beschädigungen dieses Etiketts und achten Sie darauf, dass dieses beim Einsetzen des Easyhaler in die Schutzbox verschlossen ist.
B. BEDIENUNG DES EASYHALER
Die Abbildungen 3a-7a zeigen den Gebrauch des Easyhaler mit Schutzbox. Die Abbildungen 3b-7b zeigen den Gebrauch des Easyhaler ohne Schutzbox.
1. Öffnen Sie die Schutzbox, sofern Sie diese verwenden.
Entfernen Sie die Schutzkappe vom Mundstück.
2. Schütteln Sie den Easyhaler kräftig (Abb. 3a und 3b). Halten Sie den Easyhaler dabei senkrecht.
Abb. 3a Abb.3b
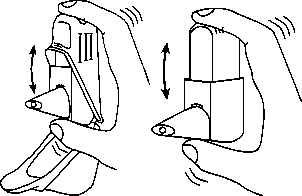
3. Zur Freisetzung einer Einzeldosis drücken Sie den Easyhaler zwischen Daumen und Zeigefinger 1-mal herunter bis Sie ein Klick-geräusch hören. (Abb. 4a und 4b).
Anschließend lassen Sie den Easyhaler in seine Ausgangsposition zurückgleiten. Halten Sie den Easyhaler dabei weiter senkrecht.
Abb. 4a Abb. 4b
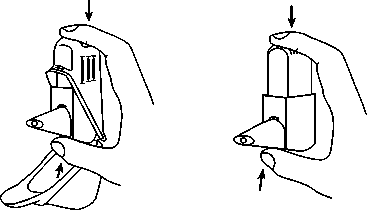
4. Inhalieren Sie den Arzneistoff entsprechend der folgenden Anweisung: Atmen Sie normal aus, bevor Sie das Mundstück in den Mund nehmen. Atmen Sie nie in den Easyhaler hinein.
5. Nehmen Sie nun das Mundstück in den Mund und atmen Sie tief und kräftig ein (Abb. 5a und 5b).
Nehmen Sie dann das Mundstück aus dem Mund und halten Sie für 5 bis 10 Sekunden den Atem an.
Abb. 5a Abb. 5b
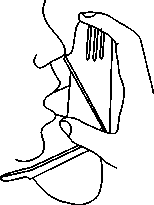
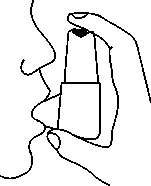
Sollten Sie mehr als eine Einzeldosis benötigen, beginnen Sie wieder bei Punkt B.2.
6. Setzen Sie die Schutzkappe wieder auf das Mundstück.
Dadurch wird der Easyhaler blockiert, d.h. auch bei versehentlicher Betätigung des Easyhaler wird keine Dosis freigesetzt.
7. Schließen Sie die Schutzbox, sofern Sie diese verwenden.
8. Spülen Sie Ihren Mund nach der Inhalation mit Wasser aus
und spucken Sie das Wasser danach aus.
Wichtig
Eine Einzeldosis sollte nur freigesetzt werden, wenn diese anschließend inhaliert wird. Bei versehentlichem Freisetzen einer Einzeldosis kann diese durch Ausklopfen auf einer festen Unterlage aus dem Mundstück des Easyhaler entfernt werden (Abb. 6a und 6b). Wiederholen Sie dann die Bedienung des Easyhaler ab Punkt B.2.
Abb. 6a Abb. 6b
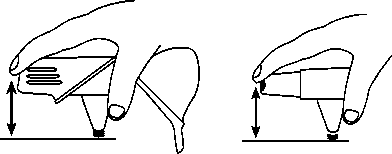
Reinigung
Reinigen Sie das Mundstück des Easyhaler mindestens einmal wöchentlich mit einem trockenen Tuch.
Verwenden Sie kein Wasser, da das Pulver im Easyhaler feuchigkeitsempfindlich ist.
Aufbewahrung
Bewahren Sie den Easyhaler bei Raumtemperatur an einem trockenen Ort auf.
Die Funktion des Beclomet Easyhaler 0,2 mg/Dosis kann durch Feuchtigkeit beeinträchtigt werden. Aus diesem Grund sollte der Easyhaler in der Schutzbox aufbewahrt werden.
Der Easyhaler hat ein Zählwerk, das die Anzahl der verbleibenden Dosen anzeigt (Abb. 7a und 7b). Nach jeder 5. Anwendung bewegt sich das Zählwerk weiter.
Abb. 7a Abb. 7b

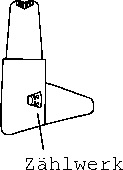
Erscheint eine rote Markierung im Sichtfenster, stehen noch 20 Einzeldosen zur Verfügung. Sie sollten sich zu diesem Zeitpunkt um einen neuen Easyhaler bemühen.
Zeigt das Zählwerk 0 an, wurden 200 Einzeldosen abgegeben. Sie müssen nun den Easyhaler durch einen neuen ersetzen, da die korrekte Dosierung nicht mehr gewährleistet ist. Die vorhandenen Pulverrestmengen sind produktionstechnisch bedingt.
Beim Ersatz des Beclomet Easyhaler 0,2 mg/Dosis durch einen neuen können Sie die alte Schutzbox wieder verwenden.
Hinweis:
Um eine falsche Anwendung zu vermeiden, ist eine gründliche Einweisung des Patienten in den korrekten Gebrauch vorzunehmen. Kinder sollten dieses Arzneimittel nur unter Aufsicht eines Erwachsenen anwenden.
4.3 Gegenanzeigen
Beclomet Easyhaler 0,2 mg/Dosis darf nicht angewendet werden bei Überempfindlichkeit gegenüber Beclometason-17,21-dipropionat oder Milchprotein (der sonstige Bestandteil Lactose von Beclomet Easyhaler 0,2 mg/Dosis enhält geringe Mengen Milchprotein).
Bei Lungentuberkulose soll Beclomet Easyhaler 0,2 mg/Dosis nur angewendet werden, wenn gleichzeitig eine wirksame tuberkulostatische Therapie durchgeführt wird.
Bei Mykosen oder anderen Infektionen im Bereich der Atemwege soll Beclomet Easyhaler 0,2 mg/Dosis Dosis nur eingesetzt werden, wenn diese angemessen behandelt werden.
Beclomet Easyhaler 0,2 mg/Dosis ist nicht indiziert zur Behandlung von Kindern unter 6 Jahren.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Inhalativ anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über lange Zeiträume gegeben werden. Solche Reaktionen treten deutlich seltener auf als bei oraler Glukokortikoidgabe. Mögliche systemische Effekte umfassen das Cushing-Syndrom, cushingoide Erscheinungen, eine adrenale Suppression, eine Verminderung der Knochendichte, Wachstumsverzögerungen bei Kindern und Jugendlichen sowie Katarakt, Glaukom und seltener eine Reihe von psychologischen- oder Verhaltensstörungen einschließlich psychomotorische Überaktivität, Schlafstörungen, Angst, Depression oder Aggression (insbesondere bei Kindern).. Deshalb ist es wichtig, dass die niedrigste Dosis, mit der eine effektive Kontrolle des Asthmas aufrecht erhalten werden kann, verabreicht wird.
Es wird empfohlen, das Wachstum von Kindern, die eine Langzeittherapie mit inhalativ anzuwendenden Glukokortikoiden erhalten, regelmäßig zu kontrollieren. Bei Wachstumsverzögerungen sollte die Therapie überdacht werden mit dem Ziel, die Dosis des inhalativ anzuwendenden Glukokortikoids auf die niedrigste Dosis zu verringern, mit der eine effektive Kontrolle des Asthmas aufrecht erhalten werden kann.
Bei der Behandlung mit hohen Dosen, insbesondere bei Überschreitung der empfohlenen Dosierung, kann eine klinisch relevante Funktionsminderung der Nebennierenrinde mit einer verminderten Produktion bzw. einer bei gesteigertem Bedarf (Stresssituationen) nicht mehr ausreichend steigerbaren Produktion körpereigener Glukokortikoide auftreten. In solchen Fällen sollte in Stresssituationen (z. B. vor Operationen) eine vorübergehende zusätzliche Glukokortikoidgabe zum Ausgleich der verminderten natürlichen Glukokortikoidproduktion erwogen werden.
Innerhalb der ersten Monate nach Umstellung von der systemischen Glukokortikoidgabe auf die Inhalationsbehandlung ist u.U. in Stresssituationen oder Notfällen
(z. B. schwere Infektionen, Verletzungen, Operationen), eine erneute systemische Gabe von Glukokortikoiden notwendig, weil wegen einer möglicherweise noch bestehenden Nebennierenrindeninsuffizienz eine adäquate Kortisolausschüttung nicht gewährleistet ist.
Verschlimmert sich die Atemnot nach der Inhalation akut (paradoxe Bronchospastik), so sollte die Behandlung sofort abgesetzt werden und der Behandlungsplan überprüft werden.
Hinweise für nicht mit Glukokortikoiden vorbehandelte Patienten:
Bei Patienten, die zuvor keine oder nur gelegentlich eine kurzdauernde Glukokortikoidbehandlung erhalten haben, sollte die vorschriftsmäßige, regelmäßige Anwendung von Beclomet Easyhaler 0,2 mg/Dosis nach ca. 1 Woche zu einer Verbesserung der Atmung führen. Starke Verschleimung und entzündliche
Veränderungen können allerdings die Bronchien soweit verstopfen, dass Beclometason-17,21-dipropionat lokal nicht voll wirksam werden kann. In diesen Fällen sollte die Einleitung der Therapie mit systemischen Glukokortikoiden (beginnend mit 40-60 mg Prednisonäquivalent pro Tag) ergänzt werden. Die Inhalationen werden auch nach schrittweisem Abbau der systemischen Glukokortikoidgabe fortgesetzt.
Hinweise für die Umstellung glukokortikoidabhängiger Patienten auf die Inhalationsbehandlung
Patienten, die systemisch mit Glukokortikoiden behandelt werden, sollten zu einem Zeitpunkt auf Beclomet Easyhaler 0,2 mg/Dosis umgestellt werden, an dem ihre Beschwerden unter Kontrolle sind. Bei diesen Patienten, deren Nebennierenrindenfunktion gewöhnlich eingeschränkt ist, muss die systemische Glukokortikoidgabe allmählich abgesetzt und darf nicht plötzlich unterbrochen werden.
Zu Beginn der Umstellung sollte Beclomet Easyhaler 0,2 mg/Dosis für etwa 1 Woche zusätzlich verabreicht werden. Dann wird die systemische Glukokortikoid-Tagesdosis entsprechend dem jeweiligen Ansprechen im Abstand von 1-2 Wochen um 2,5 mg Prednisonäquivalent herabgesetzt.
Kommt es innerhalb der ersten Monate nach Umstellung von der systemischen Glukokortikoidgabe auf die Inhalationsbehandlung zu besonderen Stresssituationen oder Notfällen (z. B. schwere Infektionen, Verletzungen, Operationen), kann eine erneute systemische Gabe von Glukokortikoiden notwendig werden.
Exazerbation der Krankheitssymptome durch akute Atemwegsinfektionen:
Bei Verschlimmerung der Krankheitssymptome durch akute Atemwegsinfektionen ist die Gabe entsprechender Antibiotika zu erwägen. Die Dosis von Beclomet Easyhaler 0,2 mg/Dosis kann ggf. angepasst werden, u. U. ist die systemische Gabe von Glukokortikoiden indiziert.
Die Anwendung von Beclomet Easyhaler 0,2 mg/Dosis kann bei Dopingkontrollen zu positiven Ergebnissen führen. Die Anwendung von Beclomet Easyhaler 0,2 mg/Dosis als Dopingmittel kann zu einer Gefährdung der Gesundheit führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Beclomet Easyhaler 0,2 mg/Dosis kann die Wirksamkeit von ^-Sympathomimetika zur Inhalation verstärken.
4.6 Schwangerschaft und Stillzeit
Die Notwendigkeit einer Anwendung während der Schwangerschaft ist besonders sorgfältig abzuwägen. Obwohl nach den bisherigen Erfahrungen bei Schwangeren keine Anhaltspunkte dafür vorliegen, dass die im Tierversuch aufgetretenen teratogenen Wirkungen von Beclometason für den Menschen von Bedeutung sind, können andere Formen der Schädigung (z. B. intrauterine Wachstumsstörungen, Atrophie der Nebennierenrinde) und Spätfolgen bei Langzeittherapie nicht sicher ausgeschlossen werden. Insbesondere synthetische Glukokortikoide, die von der Plazenta nur unzureichend inaktiviert werden können, stehen in Verdacht, durch eine in utero Programmierung beim Feten zu späteren kardiovaskulären Erkrankungen beizutragen.
Es liegen keine Daten zum Übergang von Beclometason in die Muttermilch vor. Andere Glukokortikoide gehen in geringen Mengen in die Muttermilch über. Die Belastung des Säuglings wird dabei in der Regel weniger als 1/100 der systemisch bei der stillenden Mutter zur Verfügung stehenden Dosis betragen. Sollten Substanzwirkungen beim Säugling beobachtet werden, ist abzustillen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1000 bis < 1/100)
(> 1/10 000 bis < 1/1000) (< 1/10 000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Gelegentlich Reizwirkungen im Rachenraum und Heiserkeit sowie lokale Pilzinfektionen. Das Risiko kann vermindert werden, wenn Beclomet Easyhaler 0,2 mg/Dosis vor einer Mahlzeit angewendet wird, nach der Inhalation der Mund ausgespült wird und/oder ein Spacer verwendet wird.
Überempfindlichkeitsreaktionen einschließlich Hautausschlag, Urtikaria, Juckreiz, Erythem und Ödeme von Augen, Gesicht, Lippen und Rachen sind berichtet worden.
Über folgende Nebenwirkungen mit nicht bekannter Häufigkeit wurde ebenfalls berichtet: Erhöhte motorische Aktivität, Schlafstörungen, Angstgefühl, Depression, Aggressivität, Verhaltensänderungen (insbesondere bei Kindern).
Bei Umstellung von Glukokortikoidtabletten oder -injektionen auf die Inhalationsbehandlung mit Beclomet Easyhaler 0,2 mg/Dosis können Allergien auftreten, die durch die bisherige Behandlung unterdrückt waren, wie z. B. allergische Rhinitis, allergische Ekzeme, rheumatoide Beschwerden. Diese Symptome sollten mit geeigneten Arzneimitteln zusätzlich behandelt werden.
Inhalativ anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über lange Zeiträume gegeben werden. Mögliche Nebenwirkungen schließen die adrenale Suppression, die Verminderung der Knochendichte, Wachstumsverzögerungen bei Kindern und Jugendlichen sowie Katarakt und Glaukom ein. Es können weitere glukokortikoidübliche Wirkungen, wie z. B. eine erhöhte Infektanfälligkeit, auftreten. Die Stressanpassung kann behindert sein. Bei Erwachsenen konnte bei Dosen von 0,4-0,8 mg Beclometason-17,21-dipropionat pro Tag bei der Mehrzahl der Patienten keine Suppression der Nebennierenrinde gefunden werden. Bei Dosen von 1,6-2,0 mg pro Tag ist ein relevanter Effekt nicht auszuschließen.
Bei einzelnen Patienten, die mit 2,0 mg BDP täglich behandelt wurden, wurden erniedrigte Kortisolwerte im Plasma berichtet.
In Einzelfällen können paradoxe Bronchospasmen ausgelöst werden.
Lactose enthält geringe Mengen Milchprotein und kann deshalb allergische Reaktionen hervorrufen.
4.9 Überdosierung
a) Symptome einer Überdosierung
Bei kurzfristiger Überdosierung kann eine Suppression der Hypothalamus-Hypophysenvorderlappen-Nebennierenrinden-Funktion eintreten. Bei längerfristiger Überdosierung kann es zusätzlich zur Nebennierenrindenatrophie kommen.
Es können glukokortikoidübliche Wirkungen, wie eine erhöhte Anfälligkeit für Infektionen, auftreten. Die Stressanpassung kann behindert sein.
b) Therapiemaßnahmen bei Überdosierung
Bei kurzfristiger Überdosierung ist grundsätzlich keine spezielle Notfallbehandlung erforderlich. Bei fortgesetzter Inhalationsbehandlung in vorgeschriebener Dosierung, sollte sich die Funktion der Hypothalamus-Hypophysenvorderlappen-Nebennierenrinden-Achse nach ca. 1-2 Tagen normalisieren.
In Stresssituationen kann eine Glukokortikoidschutzbehandlung (z. B. hochdosierte Gabe von Hydrocortison) erforderlich sein.
Bei Nebennierenrindenatrophie gilt der Patient als steroidabhängig und ist auf die entsprechende Erhaltungsdosis eines systemischen Steroids einzustellen, bis sich der Zustand stabilisiert hat.
PHARMAKOLOGISCHE EIGENSCHAFTEN
5.
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Glukokortikoid zur Inhalation / Antiasthmatikum
Beclometason-17,21-dipropionat ist ein synthetisches Glukokortikoid. Nach oraler Inhalation hat es einen lokalen entzündungshemmenden Effekt auf die Bronchialschleimhaut. Klinisch macht sich dieser Effekt zum Beispiel durch eine Reduktion krankheitsbezogener Symptome, wie Atemnot bemerkbar. Die Hyperreagibilität des Bronchialsystems auf exogene Reize wird reduziert.
ATC-Code: R03BA01
5.2 Pharmakokinetische Eigenschaften
Nach Inhalation wird Beclometason-17,21-dipropionat zu Beclometason-17-propionat hydrolysiert, welches zu Beclometason-21-propionat umgeestert und nachfolgend zu Beclometason hydrolysiert wird. Neben Beclometason-17,21-dipropionat ist auch Beclometason-17-propionat antientzündlich wirksam.
Maximale Plasmaspiegel treten 3-5 Stunden nach Inhalation auf. Die Plasmaproteinbindung beträgt 87 %.
Etwa 15-20 % des inhalierten Beclometason-17,21-dipropionat gelangen in die Lunge. Der Rest setzt sich im Mund-Nasen-Rachenraum ab und wird zum großen Teil verschluckt. Ca. 90 % des verschluckten Beclometason-17,21-dipropionat werden hauptsächlich als Beclometason-17-propionat, Dipropionat und freier Alkohol aus dem Gastrointestinaltrakt resorbiert. In der Leber werden sie mittels First-pass-Effekt in pharmakologisch inaktive Metaboliten umgewandelt. Damit sind systemische Bioverfügbarkeit und Toxizität begrenzt. Die Metaboliten werden zum größeren Teil über den Faeces und zu ca. 15 % über den Urin ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Siehe Abschnitt 4.9 Überdosierung.
b) Chronische Toxizität
Untersuchungen zur chronischen Toxizität an verschiedenen Tierspezies bei unterschiedlicher Applikationsart zeigten dosisabhängig Symptome der Glukokortikoidüberdosierung.
c) Mutagenes und tumorerzeugendes Potential
Mutagenitätsuntersuchungen mit Beclometasondipropionat in Kombination mit Salbutamol verliefen im Ames-Test und im Mikrokerntest an der Maus negativ. Langzeituntersuchungen an der Ratte bei kombinierter inhalativer und oraler Applikation ergaben keine Hinweise auf ein tumorerzeugendes Potential.
d) Reproduktionstoxizität
Beclomet Easyhaler 0,2 mg/Dosis verursachte bei Mäusen und Kaninchen Gaumenspalten und Embryoletalität. Bei Rhesusaffen sind eine erhöhte Abortrate und intrauterine Wachstumsretardierungen beobachtet worden.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat (enthält geringe Mengen Milchprotein).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt 3 Jahre.
Nach Öffnen der Folienverpackung ist Beclomet Easyhaler 0,2 mg/Dosis 6 Monate haltbar.
Dieses Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
Den Inhalt vor Feuchtigkeit schützen. Nach Anwendung muss die Schutzbox sofort wieder geschlossen werden.
6.5 Art und Inhalt des Behältnisses
Der Multidosis-Pulverinhalator besteht aus sieben Plastikteilen und einer rostfreien Stahlfeder. Die Plastikmaterialien des Pulverinhalators sind: Polyester, LDPE, Polycarbonat, Acetal, Styrol-Butadien-Copolymer, Polypropylen. Der Inhalator ist in einer Laminatfolie versiegelt und, ggf. zusammen mit der Schutzbox, in einer Faltschachtel aus Karton verpackt.
1 Pulverinhalator zu 2,2 g Pulver zur Inhalation (entsprechend mindestens 200 Einzeldosen + Schutzbox
1 Pulverinhalator zu 2,2 g Pulver zur Inhalation (entsprechend mindestens 200 Einzeldosen)
2 Pulverinhalatoren zu je 2,2 g Pulver zur Inhalation (entsprechend je mindestens 200 Einzeldosen)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Orion Corporation Orionintie 1 FI-02200 Espoo Finnland
8. Zulassungsnummer(n)
34979.00.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
13.05.1998/25.03.2003
10. Stand der Information
Januar 2015
11. Verkaufsabgrenzung
Verschreibungspflichtig
13