Beriplex P/N 1000
CSL Behring
Beriplex® P/N
1. BEZEICHNUNG DES ARZNEIMITTELS
Beriplex® P/N 250/500/1000
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung zur intravenösen Anwendung.
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Beriplex besteht aus einem Pulver und Lösungsmittel zur Herstellung einer Injektionslösung zur intravenösen Anwendung. Der humane Prothrombinkomplex enthält folgende I.E. der unten genannten Gerinnungsfaktoren:
|
Name des Bestandteils |
Konzentration gebrauchsfertiger Lösung (I.E./ml) |
Beriplex P/N 250 Inhalt pro Flasche (I.E.) |
Beriplex P/N 500 Inhalt pro Flasche (I.E.) |
Beriplex P/N 1000 Inhalt pro Flasche (I.E.) |
|
Arzneilich wirksame Bestandteile | ||||
|
Humaner Blutgerinnungsfaktor II |
20 - 48 |
200 - 480 |
400 - 960 |
800 - 1920 |
|
Humaner Blutgerinnungsfaktor VII |
10 - 25 |
100 - 250 |
200 - 500 |
400 - 1000 |
|
Humaner Blutgerinnungsfaktor IX |
20 - 31 |
200 - 310 |
400 - 620 |
800 - 1240 |
|
Humaner Blutgerinnungsfaktor X |
22 - 60 |
220 - 600 |
440 - 1200 |
880 - 2400 |
|
Weitere arzneilich wirksame Bestandteile | ||||
|
Protein C |
15 - 45 |
150 - 450 |
300 - 900 |
600 - 1800 |
|
Protein S |
12 - 38 |
120 - 380 |
240 - 760 |
480 - 1520 |
Der Gesamtproteingehalt der gebrauchsfertigen Lösung beträgt 6 - 14 mg/ml.
Die spezifische Aktivität von Faktor IX beträgt 2,5 I.E. pro mg Gesamtprotein.
Alle Aktivitäten der Faktoren und der Proteine C und S (Antigen) werden gemäß den derzeit gültigen internationalen WHO-Standards bestimmt.
Sonstige Bestandteile mit bekannter Wirkung:
Natrium bis zu 343 mg (etwa 15 mmol) pro 100 ml Lösung.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung zur intravenösen Anwendung.
Weißes bis schwach gelblich gefärbtes Pulver oder bröckelige Substanz.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
- Behandlung und perioperative Prophylaxe von Blutungen bei einem erworbenen Mangel an Prothrombinkomplex-Faktoren, wie zum Beispiel ein durch die Behandlung mit Vitamin-K-Antagonisten verursachter Mangelzustand oder eine Überdosierung von Vitamin-K-Antagonisten, wenn eine schnelle Korrektur des Mangels erforderlich ist.
- Behandlung und perioperative Prophylaxe von Blutungen bei einem angeborenen Mangel eines Vitamin-K-abhängigen Gerinnungsfaktors, sofern keine Einzelfaktorkonzentrate zur Verfügung stehen.
4.2 Dosierung und Art der Anwendung
Dosierung
Nachfolgend werden nur allgemeine Dosierungsrichtlinien gegeben. Die Therapie soll unter Aufsicht eines in der Behandlung von Gerinnungsstörungen erfahrenen Arztes erfolgen.
Dosierung und Dauer der Substitutionstherapie richten sich nach der Indikation, dem Schweregrad der Gerinnungsstörung, nach Ort und Ausmaß der Blutung und nach dem klinischen Zustand des Patienten.
Die Dosierung und Häufigkeit der Anwendung sollen sich stets an der klinischen Wirksamkeit im Einzelfall orientieren. Die erforderlichen Dosierungsintervalle müssen an die zn-vivo-Halbwertszeit der unterschiedlichen Gerinnungsfaktoren des Prothrombinkomplexes angepasst werden (siehe Abschnitt 5.2). Grundlage der individuellen Dosierung sind die regelmäßige Bestimmung der Plasmakonzentration der entsprechenden Gerinnungsfaktoren, oder globale Gerinnungstests zur Charakterisierung der Prothrombinkomplex-Plasmaspiegel (z. B. INR, Quick-Wert) sowie die kontinuierliche Überwachung des klinischen Zustandes des Patienten.
Vor allem bei größeren chirurgischen Eingriffen ist eine genaue gerinnungsanalytische Überwachung (spezifischer Test auf Gerinnungsfaktoren und/oder globale Gerinnungstests der Prothrombinkomplex-Konzentration) der Substitutionstherapie unerlässlich.
- Blutungen und perioperative Prophylaxe von Blutungen während der Behandlung mit Vitamin-K-Antagonisten.
Die Dosierung hängt vom Ausgangswert der INR vor der Behandlung und der angestrebten INR ab. Um die benötigte Beriplex Dosis möglichst genau berechnen zu können, sollte die INR vor der Behandlung möglichst kurz vor Verabreichung gemessen werden. In der folgenden Tabelle sind die zu verabreichenden Mengen (ml/kg Körpergewicht des rekonstituierten Produktes bzw. I.E. Faktor IX/kg KG) aufgeführt, die zur Normalisierung der INR (d.h. < 1,3) bei unterschiedlichen Ausgangswerten der INR benötigt werden:
|
INR vor der Behandlung |
2,0 - 3,9 |
4,0 - 6,0 |
> 6,0 |
|
ca. Quick % |
40 - 25 |
20 - 25 |
< 20 |
|
Dosierung in ml/kg Körpergewicht |
1 |
1,4 |
2 |
|
Dosierung in I.E. (Faktor IX)/kg Körpergewicht |
25 |
35 |
50 |
Die Dosis basiert auf einem Körpergewicht von bis zu aber nicht mehr als 100 kg. Für Patienten, die mehr als 100 kg wiegen, sollte die maximale Einzeldosis (I.E. Faktor IX) 2500 I.E. für eine INR von 2,0 - 3,9, 3500 I.E. für eine INR von 4,0 - 6,0 und 5000 I.E. für eine INR > 6,0 nicht überschreiten.
Üblicherweise wird die Korrektur der durch die Vitamin-K-Antagonisten induzierten Störung der Haemostase etwa 30 Minuten nach der Injektion erreicht. Bei Patienten, die Beriplex aufgrund einer dringend notwendigen Umkehr des gerinnungshemmenden Effektes von Vitamin-K-Antagonisten erhalten, sollte die gleichzeitige Gabe von Vitamin K immer in Erwägung gezogen werden, da die Wirkung von Vitamin K normalerweise innerhalb von 4 - 6 Stunden einsetzt. Eine wiederholte Gabe von Beriplex bei Patienten, die eine dringend notwendige Umkehr des gerinnungshemmenden Effektes von Vitamin-K-Antagonisten benötigen, wird nicht durch klinische Daten gestützt und wird daher nicht empfohlen.
Diese Ergebnisse beruhen auf Daten aus klinischen Prüfungen mit einer begrenzten Anzahl an Probanden. Die Recovery und Dauer der Wirksamkeit können variieren, daher ist eine Überwachung der INR während der Behandlung unerlässlich.
- Behandlung von Blutungen und perioperative Prophylaxe bei einem angeborenen Mangel eines Vitamin-K-abhängigen Gerinnungsfaktors, sofern keine Einzelfaktorkonzentrate zur Verfügung stehen.
Die Berechnung der benötigten Dosierung an Prothrombinkomplex-Konzentrat basiert auf Daten aus klinischen Prüfungen. Es ist zu erwarten, dass
• 1 I.E. Faktor IX pro kg Körpergewicht die Faktor-IX-Aktivität im Plasma um 1,3 % (0,013 I.E./ml) des Normalwertes
• 1 I.E. Faktor VII pro kg KG die Plasma-Faktor-VII-Aktivität um 1,7 %
(0,017 I.E./ml) des Normalwertes
• 1 I.E. Faktor II pro kg KG die Plasma-Faktor-II-Aktivität um 1,9 % (0,019 I.E./ml) des Normalwertes
• 1 I.E. Faktor X pro kg KG die Plasma-Faktor-X-Aktivität um 1,9 % (0,019 I.E./ml) des Normalwertes anhebt.
Die Menge des verabreichten spezifischen Gerinnungsfaktors wird in Internationalen Einheiten (I.E.) angegeben, die dem gegenwärtigen WHO-Standard für Gerinnungsfaktoren entsprechen. Die Aktivität der spezifischen Gerinnungsfaktoren im Plasma wird entweder als Prozentsatz (bezogen auf das normale Humanplasma) oder in I.E. (bezogen auf den Internationalen Standard für spezifische Gerinnungsfaktoren) angegeben.
Eine I.E. eines Gerinnungsfaktors entspricht der Menge, die in 1 ml normalem Humanplasma enthalten ist.
Die Berechnung der benötigten Dosis am Beispiel von Faktor X basiert auf dem Ergebnis aus der klinischen Untersuchung, dass 1 I.E. Faktor X pro kg Körpergewicht die Faktor-X-Aktivität im Plasma um ca. 0,019 I.E./ml anhebt.
Die benötigte Dosis wird nach folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht [kg] x gewünschter Faktor-X-Anstieg [I.E./ml] x 53 wobei 53 (ml/kg) der reziproke Wert der geschätzten Recovery ist.
Diese Berechnung basiert auf Daten von Patienten, die Vitamin-K-Antagonisten erhalten. Eine Berechung, die auf Daten von gesunden Probanden basiert, würde eine niedrigere benötigte Dosis ergeben.
Sofern die individuelle Recovery bekannt ist, wird dieser Wert zur Berechnung verwendet.
Es stehen produktspezifische Informationen zur Verfügung, die aus klinischen Studien mit gesunden Freiwilligen (N = 15) sowie aus Studien zur Umkehr des gerinnungshemmenden Effektes von Vitamin-K-Antagonisten im Falle von starken Blutungen oder zur perioperativen Prophylaxe von Blutungen (N = 98, N = 43) (siehe Kapitel 5.2) gewonnen wurden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Beriplex bei Kindern und Jugendlichen wurde bisher noch nicht in kontrollierten klinischen Studien untersucht (siehe Kapitel 4.4).
Ältere Menschen
Die Dosierung und Art der Anwendung bei älteren Menschen (> 65 Jahre) entspricht den allgemeinen Empfehlungen.
Art der Anwendung
Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6. Das fertig zubereitete Präparat wird intravenös verabreicht (nicht mehr als 8 ml/Minute1).
Bei einem angeborenen Mangel eines Vitamin-K-abhängigen Gerinnungsfaktors sollten -sofern verfügbar - spezifische Gerinnungsfaktorprodukte verwendet werden.
Bei Auftreten von allergoiden/anaphylaktoiden Reaktionen ist Beriplex sofort abzusetzen (z. B. durch Unterbrechung der Injektion) und eine situationsgerechte Behandlung einzuleiten. Therapeutische Maßnahmen richten sich nach Art und Schweregrad der Nebenwirkung. Die aktuellen medizinischen Richtlinien zur Schockbehandlung sind zu beachten.
Wenn Patienten mit erworbenem oder angeborenem Mangel mit ProthrombinkomplexKonzentrat behandelt werden, muß - insbesondere bei wiederholter Gabe - mit einem erhöhten Risiko zur Thrombosebildung bzw. Verbrauchskoagulopathie gerechnet werden. Das Risiko ist besonders hoch bei der Behandlung des isolierten Faktor-VII-Mangels, da die anderen Vitamin-K-abhängigen Gerinnungsfaktoren aufgrund ihrer längeren Halbwertszeit zu einem über den Normalwert hinausgehenden höheren Plasmaspiegel kumulieren. Patienten unter Behandlung mit Prothrombinkomplex-Konzentrat müssen engmaschig auf Anzeichen einer Thrombose und Verbrauchskoagulopathie überwacht werden.
Wegen der Gefahr thromboembolischer Komplikationen ist bei der Anwendung von Beriplex eine enge Überwachung geboten bei Patienten mit koronarer Herzerkrankung oder Myokardinfarkt, Lebererkrankungen, während und nach Operationen, bei Neugeborenen oder bei Patienten mit Risiko einer Thromboembolie oder Verbrauchskoagulopathie oder bei einem gleichzeitig bestehenden Mangel an Gerinnungshemmstoffen. In jedem dieser Fälle soll der mögliche Nutzen einer Therapie mit Beriplex gegen das mögliche Risiko solcher Komplikationen abgewogen werden.
Bei Verbrauchskoagulopathie kann unter Umständen eine Substitution der Gerinnungsfaktoren des Prothrombinkomplexes erforderlich sein. Diese darf jedoch nur nach Unterbrechung des Verbrauchs (z. B. durch Therapie der auslösenden Ursache, dauerhafte Normalisierung des Antithrombin-III-Spiegels) erfolgen.
Die Umkehr des gerinnungshemmenden Effektes der Vitamin-K-Antagonisten bedeutet für die Patienten, dass sie wieder dem thromboembolischen Risiko der zugrundeliegenden Krankheit ausgesetzt sind. Die Wiederaufnahme der Antikoagulation sollte daher so schnell wie möglich in Erwägung gezogen werden.
Unerwünschte Wirkungen können das Auftreten von Heparin-induzierter Thrombozytopenie Typ II (HIT, Typ II) beinhalten. Besondere Merkmale der HIT sind ein Thrombozytenabfall um mehr als als 50 % und / oder das Auftreten von neuen oder unerklärlichen thromboembolischen Komplikationen während der Therapie mit Heparin. Diese Symptome treten charakteristischer Weise während eines Zeitraums von 4 bis 14 Tagen nach Beginn der Heparintherapie auf. Bei Patienten, die innerhalb der letzten 100 Tage mit Heparin behandelt worden sind, können diese Nebenwirkungen aber auch innerhalb von 10 Stunden auftreten.
In Einzelfällen wurde das Auftreten eines nephrotischen Syndroms nach versuchter Induktion einer Immuntoleranz bei Hämophilie-B-Patienten mit Faktor-IX-Hemmkörpern und bekannter allergischer Reaktion beobachtet.
Es liegen keine Daten über die Anwendung von Beriplex zur Behandlung von perinatalen Blutungen aufgrund von Vitamin-K Mangel bei Neugeborenen vor.
Beriplex enthält bis zu 343 mg Natrium (etwa 15 mmol) pro 100 ml Lösung. Dies sollte bei Patienten, die eine salzarme Diät einhalten müssen, berücksichtigt werden.
Virussicherheit
Standardmethoden zur Vermeidung von Infektionskrankheiten, die im Rahmen der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln auftreten können, umfassen die Auswahl der Spender, die Prüfung jeder einzelnen Spende und jedes Plasmapools auf spezifische Marker für Infektionen, sowie die Einbeziehung effektiver Herstellungsschritte zur Inaktivierung/Eliminierung von Viren. Trotz dieser Maßnahmen kann die Möglichkeit der Übertragung von Erregern bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln nicht vollständig ausgeschlossen werden. Dies gilt auch für bisher unbekannte Viren und andere Pathogene. Die getroffenen Maßnahmen werden als wirksam angesehen für umhüllte Viren wie z. B. das humane Immundefizienzvirus (HIV), das Hepatitis B-Virus (HBV) und das Hepatitis C-Virus (HCV) sowie für das nicht-umhüllte Hepatitis A-Virus und Parvovirus B19.
Für Patienten, die regelmäßig Prothrombinkomplex Präparate aus menschlichem Blut oder Plasma erhalten, wird eine Impfung gegen Hepatitis A und B empfohlen.
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Produkte aus humanem Prothrombinkomplex neutralisieren die Wirksamkeit einer Behandlung mit Vitamin-K-Antagonisten. Wechselwirkungen mit anderen Medikamenten sind nicht bekannt.
Bei der Durchführung von Heparin-sensitiven Gerinnungstests bei Patienten, die hohe Dosen Beriplex erhalten, ist die im Prothrombinkomplex enthaltene Menge Heparin zu berücksichtigen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft und Stillzeit
Die Sicherheit der Anwendung von Produkten aus humanem Prothrombinkomplex in der Schwangerschaft und während der Stillzeit wurde bisher nicht geprüft. Untersuchungen am Tier sind unzureichend für die Beurteilung der Auswirkungen auf die Schwangerschaft, die Entwicklung des Embryos oder Foetus, die Geburt oder nachgeburtliche Entwicklung.
Produkte aus humanem Prothrombinkomplex sollten in der Schwangerschaft und Stillzeit nur nach sorgfältiger Indikationsstellung angewendet werden.
Fertilität
Es liegen keine Daten zur Fertilität vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien über die Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofiles
Allergisch-anaphylaktische Reaktionen, einschließlich schwerer anaphylaktischer Reaktionen, wurden gelegentlich beobachtet (siehe Abschnitt 4.4).
Im Rahmen der Substitutionstherapie kann es zur Bildung von neutralisierenden Antikörpern (Inhibitoren) gegen einen oder mehrere Faktoren des Prothrombinkomplexes kommen. Wenn solche Inhibitoren auftreten, manifestiert sich der Zustand als unzureichende klinische Antwort. In solchen Fällen wird empfohlen, ein spezialisiertes Hämophilie-Zentrum zur Unterstützung hinzuzuziehen. Bei Patienten mit Antikörpern gegen Faktoren, die in Beriplex enthalten sind, wurden anaphylaktische Reaktionen beobachtet.
Ein Anstieg der Körpertemperatur wurde häufig beobachtet.
Es besteht die Gefahr von thromboembolischen Ereignissen in Folge der Gabe von humanem Prothrombinkomplex (siehe Abschnitt 4.4).
Tabellarische Aufstellung der Nebenwirkungen von Beriplex
Die im Folgenden genannten Nebenwirkungen basieren auf Daten aus klinischen Studien, Analysen von Postmarketing Daten sowie wissenschaftlicher Literatur.
Die unten aufgeführte Tabelle entspricht der MedDRA Systemorganklassifikation (Systemorganklasse (SOC) und Preferred Term Level (PT)). Die Häufigkeiten basieren auf Daten aus klinischen Studien und wurden entsprechend der nachfolgenden Konventionen berechnet: sehr häufig (>1/10); häufig (> 1/100 und < 1/10); gelegentlich (> 1/1000 und < 1/100); selten (> 1/10.000 und <1/1000); sehr selten (< 1/10.000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
MedDRA Systemorganklasse |
Nebenwirkung gemäß PT |
Häufigkeit |
|
Gefässerkrankungen und andere SOCs |
Thromboembolische Ereignisse* |
häufig |
|
Erkrankungen des Blutes und des Lymphsystems |
Verbrauchskoagulopathie |
nicht bekannt |
|
Erkrankungen des Immunsystems |
Überempfindlichkeit oder allergische Reaktionen |
gelegentlich |
|
Anaphylaktische Reaktionen einschließlich anayphalyktischem Schock |
nicht bekannt | |
|
Bildung von Inhibitoren |
nicht bekannt | |
|
Erkrankungen des Nervensystems |
Kopfschmerzen |
häufig |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Anstieg der Körpertemperatur |
häufig |
|
*einschließlich Fälle mit töd |
ichem Ausgang | |
Informationen zur Virussicherheit siehe Abschnitt 4.4.
Kinder und Jugendliche
Es liegen keine Daten zu der Anwendung von Beriplex bei Kindern und Jugendlichen vor. Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51 - 59, 63225 Langen, Telefon: +49 6103 770, Telefax: +49 6103 77 1234, Webseite: www.pei.de anzuzeigen.
4.9 Überdosierung
Zur Vermeidung von Überdosierungen sind regelmäßige Kontrollen der Gerinnung während der Therapie angezeigt, da nach Anwendung hoher Dosen Prothrombinkomplex-Konzentrat (Überdosierung) Fälle von Myokardinfarkt, Verbrauchskoagulopathie, Venenthrombose und Lungenembolie beobachtet wurden. Im Falle einer Überdosierung besteht bei RisikoPatienten ein erhöhtes Risiko thromboembolischer Komplikationen oder einer Verbrauchskoagulopathie.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antihämorrhagika, Blutgerinnungsfaktor II, VII, IX und X in Kombination ATC-Code: B02B D01
Die Gerinnungsfaktoren II, VII, IX und X, die Vitamin-K abhängig in der Leber synthetisiert werden, werden im allgemeinen als Prothrombinkomplex bezeichnet.
Zusätzlich zu den Gerinnungsfaktoren sind in Beriplex die Vitamin-K abhängigen Gerinnungsinhibitoren Protein C und Protein S enthalten.
Faktor VII ist das Zymogen der aktiven Serinprotease Faktor VIIa, welche die extrinsischen Abläufe der Blutgerinnung initiiert. Der Komplex aus Gewebsthromboplastin und Faktor VIIa aktiviert die Gerinnungsfaktoren X und IX zu Xa und IXa. Im weiteren Verlauf der Gerinnungskaskade wird Prothrombin (Faktor II) zu Thrombin gespalten. Durch Thrombin wird aus Fibrinogen Fibrin gebildet, das zu einem Gerinnsel vernetzt wird. Die physiologische Bildung von Thrombin hat eine vitale Bedeutung für die Plättchenfunktion als Teil der primären Haemostase.
Der isolierte schwere Mangel an Faktor VII führt aufgrund einer gestörten primären Hämostase mit einer reduzierten Thrombin- und Fibrinbildung zu Blutungsneigungen. Der isolierte Mangel an Faktor IX ist eine der klassischen Hämophilien (Hämophilie B). Der isolierte Mangel an Faktor II oder Faktor X ist sehr selten, kann aber in schweren Fällen Blutungen wie bei klassischen Hämophilien verursachen.
Die weiteren Bestandteile, die Gerinnungsinhibitoren Protein C und Protein S, werden ebenfalls in der Leber synthetisiert. Die biologische Aktivität von Protein C wird durch den Cofaktor Protein S verstärkt.
Aktiviertes Protein C hemmt die Gerinnung durch Inaktivierung der Gerinnungsfaktoren Va und VIIIa. Protein S ist als Cofaktor von Protein C an der Hemmung der Gerinnung beteiligt. Protein-C-Mangel kann mit einem Thromboserisiko einhergehen.
Der erworbene Mangel an Vitamin-K-abhängigen Gerinnungsfaktoren tritt im Rahmen der Behandlung mit Vitamin-K-Antagonisten auf. Bei einem schwerwiegenden Mangel kommt es zu einer starken Blutungstendenz, die eher durch retroperitoneale, zerebrale Blutungen als durch Muskel- und Gelenksblutungen charakterisiert ist. Eine schwere Leberinsuffizienz führt ebenfalls zu einer deutlichen Reduzierung der Vitamin-K-abhängigen Gerinnungsfaktoren und einer meist komplexen Blutungsneigung, aufgrund einer gleichzeitig reduzierten intravasalen Gerinnung, einer erniedrigten Thrombozytenzahl, einer Reduzierung der Gerinnungsinhibitoren sowie einer verminderten Fibrinolyse.
Die Verabreichung von humanem Prothrombinkomplex-Konzentrat führt zu einem Anstieg der Vitamin-K-abhängigen Gerinnungsfaktoren im Plasma und kann, bei Patienten die unter einem Mangel an einem oder mehreren Vitamin-K-abhängigen Gerinnungsfaktoren leiden, die Gerinnungsstörung vorübergehend korrigieren.
5.2 Pharmakokinetische Eigenschaften
Pharmakokinetische und in-vivo Recovery Daten wurden in einer Studie mit gesunden Freiwilligen (N = 15) sowie in zwei Studien zur Umkehr des gerinnungshemmenden Effektes von Vitamin-K-Antagnonisten bei starken Blutungen oder zur perioperativen Prophylaxe von Blutungen (N = 98, N = 43) erhoben.
Studie mit gesunden Freiwilligen:
15 gesunden Freiwilligen wurden 50 I.E./kg Beriplex verabreicht. Die IVR ist der Anstieg der messbaren Plasmakonzentration an Gerinnungsfaktoren (I.E./ml), der nach einer Infusion dieser Gerinnungsfaktoren (I.E./kg) in Form einer Dosis Beriplex erwartet wird. Die inkrementellen IVRs der Faktoren II, VII, IX, X sowie der Proteine C und S wurden gemessen. Alle Maximalspiegel der Komponenten traten innerhalb eines 3-Stunden Intervals auf. Die Mittelwerte der inkrementellen IVRs lagen zwischen 0,016 I.E./ml für Faktor IX und 0,028 I.E./ml für Protein C. Die folgende Tabelle zeigt den Median der Plasmahalbwertszeiten und die inkrementellen IVRs:
Parameter
Median Plasmahalbwertszeit (Bereich)/Stunden
Inkrementelle IVR (I.E./ml pro I.E./kg Körpergewicht)
90 % CIf
Geometrischer
Mittelwert
Faktor II Faktor VII
Faktor IX Faktor X Protein C
Protein S 49 (33 - 83) 3
0,022
0,024
0,016
0,021
0,028
0,020
(0,020 - 0,023) (0,023 - 0,026) (0,014 - 0,018) (0,020 - 0,023) (0,027 - 0,030) (0,018 - 0,021)
Beriplex verhält sich bei der Verteilung im Organismus wie die körpereigenen Gerinnungsfaktoren II, VII, IX und X und wird wie diese abgebaut.
Das Präparat wird intravenös appliziert und ist sofort in der der Dosierung entsprechenden Plasmakonzentration verfügbar.
Studie zur Umkehr des gerinnungshemmenden Effektes von Vitamin-K-Antagonisten bei starken Blutungen:
Der Mittelwert der in-vivo Recovery (IVR) wurde in 98 Probanden, die Beriplex zur Behandlung von Blutungen während einer Vitamin-K-Antagonist Behandlung erhalten haben, berechnet. Die inkrementelle IVR betrug zwischen 0,016 I.E./ml für Faktor VII und 0,019 I.E./ml für Protein C.
Studie zur Umkehr des gerinnungshemmenden Effektes von Vitamin-K-Antagonisten bei starken Blutungen oder zur perioperative Prophylaxe von Blutungen:
Der Mittelwert der in-vivo Recovery (IVR) wurde in 43 Probanden, die Beriplex zur Behandlung von Blutungen oder zur perioperative Prophylaxe von Blutungen im Zuge einer Vitamin-K-Antagonist Behandlung erhalten haben, berechnet. Die intravenöse Gabe von 1 I.E./kg Beriplex erhöhte die Plasmaspiegel der Vitamin-K abhängigen Gerinnungsfaktoren von 0,013 bis 0,023 I.E./ml.
5.3 Präklinische Daten zur Sicherheit
Die in Beriplex enthaltenen arzneilich wirkenden Bestandteile sind die Faktoren des Prothrombinkomplexes (Faktoren II, VII, IX und X). Sie werden aus humanem Plasma gewonnen und verhalten sich wie die körpereigenen Plasmabestandteile.
Toxizitätsstudien mit dem pasteurisierten aber nicht nanofiltrierten Vorgängerprodukt an Mäusen mit einer Einmaldosis von 200 I.E./kg (die höchste getestete Dosis) zeigten moderate Toxizität. Eine einzelne intravenöse Dosis des pasteurisierten und nanofiltrierten Produkts von bis zu 100 I.E./kg wurde in Ratten toleriert. Präklinische Studien mit wiederholten Dosisgaben (chronische Toxizität, Kanzerogenität und Reproduktionstoxizität) können in herkömmlichen Tiermodellen nicht sinnvoll durchgeführt werden, da aufgrund der Verabreichung heterologer humaner Proteine Antikörper gebildet werden.
Die lokale Verträglichkeit nach intravenöser Gabe von Beriplex wurde an Kaninchen gezeigt. Eine Neoantigenitätsstudie an Kaninchen ergab keinen Hinweis auf die Bildung eines Neoepitops durch den Pasteurisierungsprozess.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Pulver:
Heparin
Humanes Albumin Humanes Antithrombin III Natriumchlorid Natriumcitrat
HCl bzw. NaOH (in geringen Mengen zur Einstellung des pH-Wertes)
Lösungsmittel:
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Das Arzneimittel darf, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
3 Jahre
Die physiko-chemische Stabilität ist für 24 Stunden bei Raumtemperatur (bis max. +25 °C) belegt. Allerdings sollte das Präparat aus mikrobiologischer Sicht sofort verwendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
Nicht einfrieren.
Die Flasche in der geschlossenen Faltschachtel aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels, siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Beriplex P/N 250:
Pulver: Injektionsflasche aus farblosem Glas (Typ II), verschlossen mit einem latex-freien Gummistopfen (Bromobutyl) und versiegelt mit einer Aluminium/Kunststoff-Bördelkappe. Lösungsmittel: 10 ml Wasser für Injektionszwecke in einer Injektionsflasche aus farblosem Glas (Typ I), verschlossen mit einem latex-freien Gummistopfen (Chlorobutyl) und versiegelt mit einer Aluminium/Kunststoff-Bördelkappe.
Set zur Anwendung: 1 Filter Transfer Set 20/20
Beriplex P/N 500:
Pulver: Injektionsflasche aus farblosem Glas (Typ II), verschlossen mit einem latex-freien Gummistopfen (Bromobutyl) und versiegelt mit einer Aluminium/Kunststoff-Bördelkappe. Lösungsmittel: 20 ml Wasser für Injektionszwecke in einer Injektionsflasche aus farblosem Glas (Typ I), verschlossen mit einem latex-freien Gummistopfen (Chlorobutyl) und versiegelt mit einer Aluminium/Kunststoff-Bördelkappe.
Set zur Anwendung: 1 Filter Transfer Set 20/20
Beriplex P/N 1000:
Pulver: Injektionsflasche aus farblosem Glas (Typ II), verschlossen mit einem latex-freien Gummistopfen (Bromobutyl) und versiegelt mit einer Aluminium/Kunststoff-Bördelkappe. Lösungsmittel: 40 ml Wasser für Injektionszwecke in einer Injektionsflasche aus farblosem Glas (Typ I), verschlossen mit einem latex-freien Gummistopfen (Chlorobutyl) und versiegelt mit einer Aluminium/Kunststoff-Bördelkappe.
Set zur Anwendung: 1 Filter Transfer Set 20/20
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Art der Anwendung
Allgemeine Hinweise
- Die Lösung sollte klar oder leicht opaleszent sein. Rekonstituiertes Produkt sollte nach der Filtration/dem Aufziehen der Lösung in die Spritze (siehe unten) und vor der Anwendung auf Partikel und Verfärbungen visuell überprüft werden.
- Trübe Lösungen oder Lösungen mit Rückständen (Niederschlägen) sind nicht zu verwenden.
- Zubereitung und Entnahme müssen unter aseptischen Bedingungen erfolgen. Zubereitung
Erwärmen Sie das Lösungsmittel auf Raumtemperatur. Vor dem Öffnen der Mix2Vial Packung die Flip-Off-Kappen der Lösungsmittel- und Produktflaschen entfernen und die Stopfen mit einer antiseptischen Lösung behandeln und anschließend trocknen lassen.
1. Entfernen Sie das Deckpapier von der Mix2Vial Packung. Das Mix2Vial nicht aus dem Blister entnehmen!
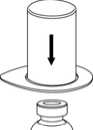
3
2
2. Die Lösungsmittelflasche auf eine ebene, saubere Fläche stellen und festhalten. Das Mix2Vial Set mit dem Blister greifen und den Dorn des blauen Adapters senkrecht in den Stopfen der Lösungsmittelflasche einstechen.
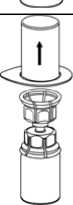
3. Vorsichtig die Verpackung vom Mix2Vial Set entfernen, indem man den Blister am Siegelrand fasst und ihn senkrecht nach oben abzieht. Dabei ist darauf zu achten, dass nur der Blister und nicht das Mix2Vial entfernt wird.
4
4. Die Produktflasche auf eine feste Unterlage stellen. Die Lösungsmittelflasche mit dem aufgesetzten Mix2Vial Set herumdrehen und den Dorn des transparenten Adapters senkrecht in den Stopfen der Produktflasche einstechen. Das Lösungsmittel läuft automatisch in die Produktflasche über.
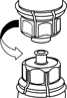
• - 5

6
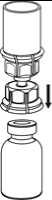
5. Mit der einen Hand die Produktseite und mit der anderen Hand die Lösungsmittelseite des Mix2Vial greifen und das Set vorsichtig gegen den Uhrzeigersinn auseinander schrauben. Entsorgen Sie die Lösungsmittelflasche mit dem blauen Mix2Vial Adapter.
6. Die Produktflasche mit dem transparenten Adapter vorsichtig schwenken, bis das Produkt vollständig gelöst ist. Nicht schütteln.
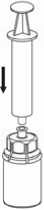
7
7. Luft in eine leere, sterile Spritze aufziehen. Die Produktflasche aufrecht halten, die Spritze mit dem Luer Lock Anschluss des Mix2Vial Set verbinden, indem man sie im Uhrzeigersinn aufschraubt und die Luft in die Produktflasche injiziert.
Aufziehen der Lösung in die Spritze und Anwendung
8
8. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und die Lösung durch langsames Zurückziehen der Kolbenstange in die Spritze aufziehen.
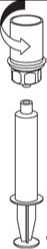
9
9. Nachdem die Lösung vollständig in die Spritze überführt ist, den Spritzenzylinder fassen (dabei die Kolbenstange in ihrer Position halten) und die Spritze vom transparenten Mix2Vial Adapter gegen den Uhrzeigersinn abdrehen.
Es ist darauf zu achten, dass kein Blut in die gefüllte Spritze gelangt, da die Gefahr besteht, dass es dort gerinnt und dadurch dem Patienten Fibringerinnsel verabreicht werden.
Wenn mehr als ein Fläschchen Beriplex für eine einmalige Infusionsapplikation benötigt wird, kann man die Inhalte mehrerer Fläschchen in einem handelsüblichen Infusionszubehör zusammenführen.
Die Beriplex Lösung darf grundsätzlich nicht verdünnt werden.
Die Lösung soll intravenös verabreicht werden (nicht mehr als 8 ml/Minute4) .
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
CSL Behring GmbH
- Emil-von-Behring-Str. 76 35041 Marburg
- Verkauf Deutschland Philipp-Reis-Str. 2 65795 Hattersheim Tel.: (069) 305 - 8 44 37 Fax: (069) 305 - 1 71 29
8. ZULASSUNGSNUMMERN
Beriplex® P/N 250 10500a/95
Beriplex® P/N 500 10501a/95
Beriplex® P/N 1000 10501a/95a
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Erstzulassung: 16. Februar 1996
Letzte Verlängerung der Zulassung: 11. Januar 2013
10. STAND DER INFORMATION
November 2014
11. HERKUNFTSLÄNDER DES BLUTPLASMAS
Deutschland, Österreich, Polen, USA
12. VERSCHREIBUNGSSTATUS
Verschreibungspflichtig
In klinischen Studien wurde Beriplex Patienten mit einem Körpergewicht <70 kg mit einer maximalen Infusionsgeschwindigkeit von 0,12 ml/kg/Min (weniger als 8 ml/Min) verabreicht.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Bei Verbrauchskoagulopathie dürfen Prothrombinkomplex-Präparate nur nach Unterbrechung des Verbrauchs appliziert werden.
Anamnestisch bekannte Heparin-induzierte Thrombozytopenie.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Der Rat eines in der Behandlung von Gerinnungsstörungen erfahrenen Spezialisten sollte eingeholt werden.
Bei Patienten mit erworbenem Mangel an Vitamin-K-abhängigen Gerinnungsfaktoren (z. B. verursacht durch die Behandlung mit Vitamin-K-Antagonisten) darf Beriplex nur gegeben werden, wenn eine schnelle Korrektur des Prothrombinkomplex-Spiegels notwendig ist, wie zum Beispiel im Rahmen von starken Blutungen oder notfallmäßigen Operationen. In anderen Fällen ist die Erniedrigung der Dosis des Vitamin-K-Antagonisten und/oder die Gabe von Vitamin-K im üblichen ausreichend.
Patienten, die Vitamin-K-Antagonisten erhalten, können eine Hyperkoagulationsbereitschaft haben, die durch die Infusion von humanem Prothrombinkomplex verstärkt werden kann.
fKonfidenzintervall
Terminale Halbwertszeit; Zwei-Kompartiment-Modell
In klinischen Studien wurde Beriplex Patienten mit einem Körpergewicht <70 kg mit einer maximalen Infusionsgeschwindigkeit von 0,12 ml/kg/Min (weniger als 8 ml/Min) verabreicht.