Berlinsulin H Normal 3 Ml Pen
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Berlinsulin H Normal 3 ml Pen 100 IE/ml Injektionslösung in Patrone
Wirkstoff: Insulin human
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml enthält 100 I.E. Insulin human (gentechnisch hergestellt aus E. coli K12). Eine Patrone enthält 3 ml entsprechend 300 I.E. Normalinsulin.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung in einer Patrone.
Berlinsulin H Normal ist eine sterile, klare, farblose, wässrige Lösung von Insulin human.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Behandlung von Patienten mit Diabetes mellitus, die Insulin für die Aufrechterhaltung einer normalen Glukosehomöostase benötigen.
4.2 Dosierung und Art der Anwendung
Dosierung
Die Dosierung wird vom Arzt entsprechend den Bedürfnissen des Patienten festgesetzt.
Kinder und Jugendliche Es liegen keine Daten vor.
Art der Anwendung
Berlinsulin H Normal ist subkutan zu applizieren. Es kann auch, obwohl dies nicht empfohlen wird, intramuskulär verabreicht werden. Die intravenöse Gabe ist möglich.
Die subkutane Verabreichung sollte in Oberarm, Oberschenkel, Gesäß oder Abdomen erfolgen. Die Injektionsstellen sind zu wechseln, so dass dieselbe Einstichstelle nicht öfter als ca. einmal im Monat verwendet wird.
Bei Injektion der Berlinsulin H-Präparate sollte darauf geachtet werden, dass kein Blutgefäß getroffen wird. Nach der Injektion sollte die Injektionsstelle nicht massiert werden. Um die korrekte Injektionstechnik zu erlernen, müssen die Patienten entsprechend unterwiesen werden.
Jede Packung enthält eine Gebrauchsinformation mit Hinweisen zur Insulin-Injektion.
4.3 Gegenanzeigen Hypoglykämie
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile, mit Ausnahme der Verabreichung im Rahmen eines Desensibilisierungsprogrammes.
Unter keinen Umständen darf eine andere Berlinsulin H-Zubereitung als Berlinsulin H Normal intravenös appliziert werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Umstellung eines Patienten auf einen anderen Insulintyp oder ein Insulin eines anderen Herstellers muss unter strenger ärztlicher Aufsicht erfolgen. Jede Änderung hinsichtlich Stärke,
Marke (Hersteller), Insulintyp (Normal, Basal [NPH], Mischinsuline), Art des Insulins (tierisches Insulin, Humaninsulin, Humaninsulin-Analog) und/oder Herstellungsmethode (rekombinante DNA-Technologie bzw. Insulin tierischer Herkunft) kann eine Veränderung des Insulinbedarfs nach sich ziehen.
Bei manchen Patienten kann eine Veränderung der Humaninsulindosis gegenüber der bisher benötigten Dosis von Insulin tierischen Ursprungs erforderlich sein. Die Notwendigkeit zur Dosisanpassung kann sich mit der ersten Applikation oder allmählich über die ersten Wochen oder Monate ergeben.
Einige Patienten, die nach Umstellung auf Humaninsulin hypoglykämische Reaktionen entwickelten, berichteten, dass die Frühwarnsymptome entweder weniger ausgeprägt oder aber anders als bislang bei Gebrauch von Insulin tierischen Ursprungs waren. Bei Patienten mit erheblich verbesserter Blutzuckerkontrolle, z. B. durch intensivierte Insulintherapie, können einige oder alle der Hypoglykämie-Warnsymptome ausfallen. Die Patienten sind darauf hinzuweisen. Weitere Umstände, die die Frühwarnsymptome einer Hypoglykämie anders als gewohnt oder weniger ausgeprägt erscheinen lassen, sind lange bestehender Diabetes, diabetische Neuropathie oder Begleitmedikation wie z. B. Betablocker. Unbehandelte Hypo- oder Hyperglykämien können zu Bewusstlosigkeit, Koma oder zum Tod führen.
Die Gabe einer unzureichenden Dosis, bzw. die Unterbrechung einer Behandlung, insbesondere bei Patienten mit einem insulinpflichtigen Diabetes, kann zu einer Hyperglykämie und einer diabetischen Ketoazidose führen; diese Zustände sind potentiell lebensbedrohlich.
Die Behandlung mit Humaninsulin kann zur Bildung von Antikörpern führen; diese Antikörpertiter liegen dann allerdings niedriger als solche, die sich aufgrund einer Gabe von gereinigtem Insulin tierischen Ursprungs aufbauen.
Der Insulinbedarf kann sich signifikant ändern bei Erkrankungen der Nebenniere, der Hypophyse oder der Schilddrüse sowie im Fall einer Nieren- oder Leberfunktionsstörung.
Der Insulinbedarf kann durch Krankheit oder durch seelische Belastungen erhöht sein.
Eine Anpassung der Insulindosis kann ebenfalls notwendig werden, wenn Patienten den Umfang ihrer körperlichen Aktivitäten oder ihre Ernährungsgewohnheiten ändern.
Kombination von Humaninsulin und Pioglitazon
Unter einer Kombinationstherapie von Pioglitazon und Insulin wurden Fälle von Herzinsuffizienz berichtet. Besonders waren Patienten betroffen, bei denen ein erhöhtes Risiko für das Auftreten einer
Herzinsuffizienz bestand. Sollte die Kombination von Pioglitazon und Humaninsulin erwogen werden, ist dies zu beachten. Im Fall einer Kombinationsbehandlung sind bei den Patienten Anzeichen und Symptome einer Herzinsuffizienz, Gewichtszunahme und Ödeme zu überwachen. Pioglitazon muss abgesetzt werden, falls sich die kardiale Symptomatik verschlechtert.
Hinweise zur Anwendung und für die Handhabung
Um die mögliche Übertragung von Krankheiten zu vermeiden, darf jede Patrone nur von einem Patienten angewendet werden, auch wenn die Nadel des Injektionsgeräts gewechselt wird.
Die Anwendung von Berlinsulin H Normal kann bei Dopingkontrollen zu positiven Ergebnissen führen. Ein Fehlgebrauch zu Dopingzwecken kann eine Gesundheitsgefährdung verursachen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Von einigen Arzneimitteln ist bekannt, dass sie den Glukose-Stoffwechsel beeinflussen. Die zusätzliche Anwendung weiterer Arzneimittel neben Humaninsulin muss daher mit dem Arzt abgestimmt werden (siehe Abschnitt 4.4). Der Arzt muss mögliche Wechselwirkungen berücksichtigen und sollte den Patienten immer fragen, welche Arzneimittel er anwendet.
Der Insulinbedarf kann sich durch Arzneimittel mit hyperglykämischer Wirkung wie z. B. Glucokortikoide, Schilddrüsenhormone, Wachstumshormon, Danazol oder Beta2-Sympathomimetika (wie Ritodrin, Salbutamol, Terbutalin) und Thiazide erhöhen.
Der Insulinbedarf kann sich durch die zusätzliche Verabreichung von Arzneimitteln mit hypoglykämischer Wirksamkeit wie z. B. orale Antidiabetika (OAD), Salicylate (z. B. Acetylsalicylsäure), bestimmte Antidepressiva (MAO-Hemmer), bestimmte ACE-Hemmer (Captopril, Enalapril), Angiotensin II Rezeptorblocker, nicht-selektive Betarezeptorenblocker und Alkohol reduzieren.
Somatostatin Analoga (Octreotid, Lanreotid) können die erforderliche Insulindosis sowohl erhöhen als auch senken.
4.6 Fertilität, Schwangerschaft und Stillzeit
Es ist wichtig, eine gute Kontrolle der mit Insulin behandelten Patientinnen während der Schwangerschaft beizubehalten. Dies gilt sowohl bei insulinpflichtigem als auch bei GestationsDiabetes. Der Insulinbedarf ist normalerweise während des ersten Trimesters erniedrigt und während des zweiten und dritten Trimesters erhöht. Patientinnen sollte daher geraten werden, ihren Arzt zu informieren, wenn sie schwanger sind oder eine Schwangerschaft planen.
Eine genaue Blutzuckerkontrolle sowie ein allgemein guter Gesundheitszustand sind bei Schwangeren mit Diabetes besonders wichtig.
Eine Anpassung der Insulindosis und/oder der Ernährungsgewohnheiten während der Stillzeit kann bei Diabetes-Patientinnen erforderlich sein.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Eine Hypoglykämie kann die Konzentrations- und Reaktionsfähigkeit eines Patienten herabsetzen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z. B. beim Fahren eines Autos oder beim Bedienen von Maschinen), ein Risiko darstellen.
Dem Patienten sollte geraten werden, Vorsichtsmaßnahmen zur Vermeidung von Hypoglykämien beim Führen von Kraftfahrzeugen zu treffen. Dieses ist bei Patienten mit häufigen Hypoglykämie-
Episoden oder verringerter oder fehlender Wahrnehmung von Hypoglykämie-Wamsymptomen besonders wichtig. In diesen Fällen sollte überlegt werden, ob das Führen eines Kraftfahrzeugs überhaupt ratsam ist.
4.8 Nebenwirkungen
Die häufigste unerwünschte Wirkung jeder Insulinbehandlung ist die Hypoglykämie. Schwere Hypoglykämien können zu Bewusstlosigkeit und im Extremfall zum Tod führen. Eine genaue Häufigkeitsangabe zum Auftreten von Hypoglykämien erfolgt nicht, da das Auftreten einer Hypoglykämie aus dem Zusammenspiel von Insulindosis und anderen Faktoren wie Ernährung und körperlicher Betätigung resultiert.
Lokale allergische Reaktionen kommen bei Patienten häufig vor (1/100 bis < 1/10). Hautrötungen, Schwellungen oder Juckreiz können an der Injektionsstelle auftreten. Diese Zustände verschwinden gewöhnlich innerhalb weniger Tage bis weniger Wochen von selbst. In einigen Fällen können diese lokalen Reaktionen durch andere Faktoren als Insulin verursacht werden, z. B. durch Hautdesinfektionsmittel oder mangelhafte Injektionstechnik.
Eine systemische Allergie ist sehr selten (< 1/10.000), aber potentiell gefährlicher und stellt eine generalisierte Insulinallergie dar. Sie kann Hautausschlag am ganzen Körper, Kurzatmigkeit, keuchenden Atem, Blutdruckabfall, schnellen Puls oder Schwitzen hervorrufen. Schwere generalisierte allergische Reaktionen können lebensbedrohlich sein.
In dem seltenen Fall einer schweren allergischen Reaktion auf Berlinsulin H ist eine sofortige Behandlung erforderlich. Ein Insulin-Wechsel oder eine Desensibilisierung können erforderlich sein.
An der Injektionsstelle kann gelegentlich (1/1.000 bis < 1/100) eine Lipodystrophie auftreten.
Im Zusammenhang mit Insulin-Therapie wurde über Ödeme berichtet, insbesondere wenn eine schlechte metabolische Kontrolle durch intensivierte Insulintherapie verbessert wurde.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es existiert keine spezielle Definition für eine Überdosierung von Insulin, da die Blutglukosekonzentration das Resultat eines komplexen Wechselspiels von Insulinspiegel, Glukoseverfügbarkeit und anderen metabolischen Prozessen ist. Eine Hypoglykämie kann als Folge eines relativen Insulinüberschusses im Hinblick auf die Nahrungsaufnahme oder den Energieverbrauch auftreten.
Eine Hypoglykämie kann im Zusammenhang stehen mit Teilnahmslosigkeit, Verwirrtheit, Herzklopfen, Kopfschmerzen, Schwitzen und Erbrechen.
Leichte Hypoglykämien reagieren auf orale Aufnahme von Glukose oder zuckerhaltigen Produkten.
Die Behebung von mittelgradig schweren Hypoglykämien kann durch intramuskuläre oder subkutane Glukagoninjektionen erreicht werden, gefolgt von einer oralen Gabe von Kohlenhydraten, sobald sich der Patient ausreichend erholt hat. Den Patienten, die nicht auf Glukagon ansprechen, muss eine Glukoselösung intravenös verabreicht werden.
Ist der Patient komatös, sollte Glukagon intramuskulär oder subkutan verabreicht werden. Ist kein Glukagon vorhanden oder spricht der Patient nicht auf Glukagon an, muss eine Glukoselösung intravenös verabreicht werden. Sobald der Patient wieder bei Bewusstsein ist, sollte er eine Mahlzeit zu sich nehmen.
Es kann notwendig sein, die Kohlenhydrat-Aufnahme und Beobachtung fortzuführen, da eine Hypoglykämie nach nur scheinbarer Genesung nochmals auftreten kann.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Berlinsulin H Normal: ATC-Code A10A B01 Berlinsulin H Normal ist eine schnell wirksame Insulin-Zubereitung.
Die Hauptwirkung des Insulins ist die Regulierung des Glukose-Stoffwechsels.
Außerdem haben Insuline zahlreiche anabole und anti-katabole Wirkungen in einer Vielzahl unterschiedlicher Gewebe. Im Muskelgewebe umfasst dies eine Steigerung der Glykogen-, Fettsäure-, Glycerol- und Proteinsynthese sowie der Aminosäureaufnahme; gleichzeitig werden die Glykogenolyse, die Glukoneogenese, die Ketogenese, die Lipolyse, der Proteinkatabolismus und der Aminosäuretransport aus der Zelle vermindert.
Das typische Aktivitätsprofil (Glukoseverwertungs-Kurve) nach einer subkutanen Injektion ist in der nachstehenden Graphik illustriert. Abweichungen, die sich bei einem Patienten in Bezug sowohl auf die zeitliche Abfolge als auch auf die Intensität der Insulinaktivität zeigen können, werden durch die schattierte Fläche dargestellt. Individuelle Abweichungen hängen von Faktoren wie Dosishöhe, der Injektionsstelle, der Temperatur sowie der körperlichen Aktivität des Patienten ab.
Berlinsulin H Normal (100 % Normalinsulin)
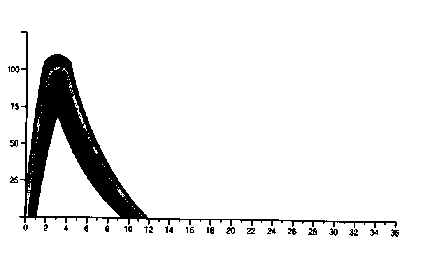
Zeit (Stunden)
Insulin
Aktivität
5.2 Pharmakokinetische Eigenschaften
Die Pharmakokinetik des Insulins gibt nicht die Auswirkungen dieses Hormons auf den Stoffwechsel wieder. Es ist daher sinnvoller, die Glukoseverwertungs-Kurven (wie oben diskutiert), zur Beschreibung der Insulinaktivität zu betrachten.
Präklinische Daten zur Sicherheit
5.3
Berlinsulin H ist Humaninsulin, das über eine Rekombinationstechnologie hergestellt wurde. Aus subchronischen Toxizitätsstudien wurden keine schwerwiegenden Ereignisse gemeldet. Humaninsulin zeigte in einer Reihe gentoxikologischer in vitro und in vivo Untersuchungen keine mutagenen Effekte.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Metacresol (Ph.Eur.)
Glycerol
Wasser für Injektionszwecke
Folgende Hilfsstoffe können zur pH-Einstellung verwendet worden sein: Salzsäure und/oder Natriumhydroxid.
6.2 Inkompatibilitäten
Berlinsulin H-Zubereitungen dürfen nicht mit Humaninsulin anderer Hersteller oder mit Insulinen tierischen Ursprungs gemischt werden.
6.3 Dauer der Haltbarkeit
Unbenutzte Patronen 2 Jahre
Nach Einlegen der Patrone 28 Tage
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Unbenutzte Patronen
Im Kühlschrank lagern (zwischen 2 °C und 8 °C). Nicht einfrieren. Nicht starker Hitze oder direktem Sonnenlicht aussetzen.
Nach Einlegen der Patrone
Unter 30 °C lagern. Nicht einfrieren. Nach Einlegen der Patrone darf der Pen nicht mit aufgesetzter Nadel gelagert werden.
6.5 Art und Inhalt des Behältnisses
3 ml Lösung in einer Patrone (Typ I Klarglas) mit einem Gummi-Patronenkolben am unteren Ende der Patrone und mit einer Gummi-Scheibenkappe am oberen Ende der Patrone.
Packungen mit 5 Patronen
Packungen mit 10 Patronen (Bündelpackung mit 2 x 5 Patronen)
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nadel nicht wiederverwenden. Entsorgen Sie die Nadeln verantwortungsbewusst. Verwenden Sie nur Ihre eigenen Nadeln und Ihre eigenen Pens. Die Patronen können verwendet werden, bis sie leer sind und sind dann sachgerecht zu entsorgen. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Hinweise zur Anwendung und für die Handhabung
Um die mögliche Übertragung von Krankheiten zu vermeiden, darf jede Patrone nur von einem Patienten angewendet werden, auch wenn die Nadel des Injektionsgeräts gewechselt wird.
Injektionslösung in einer 3 ml-Patrone. Mit einem CE-zertifizierten Pen entsprechend den vom Pen-Hersteller beigelegten Instruktionen zu verwenden.
a) Vorbereitung einer Dosis
Patronen, die Berlinsulin H Normal enthalten, erfordern kein Resuspendieren. Sie sollen nur dann benutzt werden, wenn die Lösung klar und farblos ist, keine sichtbaren festen Partikel enthält und wenn es von einer wasserartigen Erscheinung ist.
Die Patronen sind so konstruiert, dass sie eine Mischung mit anderen Insulinen in der Patrone nicht erlauben. Die Patronen sind nicht zum Wiederauffüllen geeignet.
Die Instruktionen des Herstellers für den einzelnen Pen hinsichtlich des Einlegens der Patrone, des Aufsetzens der Nadel und der Gabe der Insulin-Injektion müssen befolgt werden.
b) Injektion einer Dosis
Injizieren Sie die korrekte Insulindosis, wie Sie es von Ihrem Arzt oder Ihrer Diabetesberaterin erlernt haben.
Die Injektionsstelle sollte immer wieder gewechselt werden, so dass dieselbe Stelle nicht öfter als ca. einmal im Monat benutzt wird.
Jede Packung enthält eine Gebrauchsinformation mit Hinweisen zur Insulin-Injektion.
7. INHABER DER ZULASSUNG
BERLIN-CHEMIE AG Glienicker Weg 125 12489 Berlin, Deutschland
Telefon: (030) 6707-0 (Zentrale)
Telefax: (030) 6707-2120 www.berlin-chemie.de
8. ZULASSUNGSNUMMER(N)
96090.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 24. September 2015
10. STAND DER INFORMATION
Juli 2016
11. VERKAUFSABGRENZUNG
V erschreibungspflichtig
In Lizenz von Eli Lilly
8