Berodual Ls

1. BEZEICHNUNG DES ARZNEIMITTELS
Berodual® LS
250 / 500 Lösung für einen Vernebler
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoffe: Ipratropiumbromid und Fenoterolhydrobromid 1 ml (= 10 Hübe mit dem Lösungsspender) enthält:
261 (ig Ipratropiumbromid 1 H2O (entspricht 250 ^g Ipratropiumbromid) und 500 ^g Fenoterolhydrobromid.
1 Hub enthält:
26,1 ^g Ipratropiumbromid 1 H2O (entspricht 25 ^g Ipratropiumbromid) und 50 ^g Fenoterolhydrobromid.
Sonstiger Bestandteil mit bekannter Wirkung: Benzalkoniumchlorid (siehe Abschnitt 4.4). Vollständige Auflistung der sonstigen Bestandteile: siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Lösung für einen Vernebler
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur Verhütung und Behandlung von Atemnot bei chronisch obstruktiven Atemwegserkrankungen: Asthma bronchiale allergischer und nicht-allergischer (endogener) Ursache, Anstrengungsasthma und chronisch obstruktive Bronchitis mit und ohne Emphysem.
Hinweis:
Sofern eine Dauerbehandlung erforderlich ist, soll stets eine begleitende antiinflammatorische Therapie erfolgen.
4.2 Dosierung und Art der Anwendung Nur zur Inhalation mit einem Vernebler
Die Behandlung sollte unter ärztlicher Betreuung initiiert und verabreicht werden, z.B. im Krankenhaus. Eine Behandlung zu Hause kann nach Beratung mit einem erfahrenen Arzt bei Patienten empfohlen werden, bei denen ein niedrig dosierter kurz-wirksamer Beta-Agonist-Bronchodilatator wie z.B. Berodual N Dosier-Aerosol zur Erleichterung der Atmung nicht ausreichend war. Sie kann auch bei Patienten empfohlen werden, die eine Behandlung mittels Vernebler aus anderen Gründen benötigen (z. B. Handhabungsprobleme eines Dosier-Aerosols) oder bei erfahrenen Patienten, die höhere Dosen benötigen.
Die Dosierung mit der Vernebler-Lösung sollte immer mit der niedrigsten empfohlenen Dosis begonnen werden. Die Dosierung sollte an die individuellen Erfordernisse angepasst und entsprechend des Schweregrads der akuten Episode zugeschnitten werden. Die Verabreichung sollte beendet werden, wenn eine ausreichende Erleichterung der Atmung erreicht ist.
Die Vernebler-Lösung ist nur zur Inhalation mit geeigneten Vernebler-Geräten bestimmt und darf nicht eingenommen werden.
Zur Anwendung soll die empfohlene Dosis von Berodual LS Inhalationslösung mit physiologischer (0,9 %iger) Kochsalzlösung auf 3-4 ml verdünnt werden. Die verdünnte (gebrauchsfertige) Lösung soll solange inhaliert werden, bis sich die Symptome ausreichend gebessert haben.
Die verdünnte (gebrauchsfertige) Lösung soll vor jeder Anwendung frisch zubereitet werden. Die verdünnte (gebrauchsfertige) Lösung soll unmittelbar nach der Zubereitung inhaliert werden, etwaige Reste sind zu entsorgen. Dabei ist die Bedienungsanleitung des Inhalationsgerätes zu befolgen.
Es wird empfohlen, die vernebelte Lösung über ein Mundstück zu verabreichen. Wenn kein Mundstück verfügbar ist und eine Vernebler-Maske angewendet wird, muss diese richtig passen. Patienten mit einer Prädisposition für ein Glaukom sollten gewarnt werden, speziell ihre Augen zu schützen.
Die Lösung zur Inhalation kann mit verschiedenen zur Verfügung stehenden Verneblern verabreicht werden. Die Lungen- und systemische Verfügbarkeit ist vom verwendeten Vernebler abhängig und kann abhängig von der Effizienz des Verneblers höher als beim Berodual N Dosier-Aerosol sein.
Art der Anwendung
Es gelten folgende Dosierungsempfehlungen:
Erwachsene und Jugendliche ab 12 Jahren:
Zur Akutbehandlung plötzlich auftretender Bronchialkrämpfe werden - abhängig vom Schweregrad der akuten Episode - 10-25 Hübe (1,0-2,5 ml) Berodual LS nach Verdünnung mit physiologischer Kochsalzlösung auf 3-4 ml inhaliert.
In außergewöhnlich schweren Fällen können bis zu 40 Hübe (4 ml) Berodual LS nach Verdünnung mit physiologischer Kochsalzlösung auf 3-4 ml inhaliert werden.
Zur gezielten Vorbeugung bei Anstrengungsasthma oder vorhersehbarem Allergenkontakt werden 1-2 Hübe (0,1-0,2 ml) Berodual LS, verdünnt mit 2-3 ml physiologischer Kochsalzlösung, wenn möglich 10-15 Minuten vorher, inhaliert.
Kinder von 6 bis 12 Jahren:
Zur Akutbehandlung von akuten Asthma-Episoden werden - abhängig vom Schweregrad der akuten Episode und vom Alter - 5-20 Hübe (0,5-2,0 ml) Berodual LS nach Verdünnung mit physiologischer Kochsalzlösung auf 3-4 ml inhaliert.
Zur gezielten Vorbeugung bei Anstrengungsasthma oder vorhersehbarem Allergenkontakt werden 1-2 Hübe (0,1-0,2 ml) Berodual LS, verdünnt mit 2-3 ml physiologischer Kochsalzlösung, wenn möglich 10-15 Minuten vorher, inhaliert.
Kinder unter 6 Jahren:
Für diese Altergruppe liegen nur begrenzte Erfahrungen vor, daher wird die Anwendung nur unter ärztlicher Überwachung in folgender Dosierung empfohlen: 1 Hub (0,1 ml) pro kg Körpergewicht bis maximal 5 Hübe (0,5 ml) nach Verdünnung mit physiologischer Kochsalzlösung auf 3-4 ml.
4.3 Gegenanzeigen
Berodual LS ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber den Wirkstoffen Fenoterolhydrobromid und/oder Ipratropiumbromid, atropinähnlichen Substanzen oder einem der sonstigen Bestandteile (siehe Abschnitt 6.1), sowie bei Patienten mit hypertropher obstruktiver Kardiomyopathie und Tachyarrhythmie.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Patienten müssen darauf hingewiesen werden, dass bei akuter, sich rasch verschlimmernder Dyspnoe unverzüglich ein Arzt aufgesucht werden muss.
Wie andere Inhalativa kann Berodual zu paradoxen Bronchospasmen führen, die lebensbedrohlich sein können. Falls diese auftreten, sollte Berodual sofort abgesetzt und durch eine Alternativtherapie ersetzt werden.
Bei Patienten mit
• unzureichend eingestelltem Diabetes mellitus,
• frischem Myokardinfarkt,
• Myokarditis,
• schweren organischen Herz- oder Gefäßerkrankungen (insbesondere bei Vorliegen einer
Tachykardie),
• Hyperthyreose,
• Phäochromozytom
sollte Berodual LS, speziell bei Überschreiten der empfohlenen Dosierung, nur nach einer sorgfältigen
Nutzen/Risiko-Abwägung eingesetzt werden.
Kardiovaskuläre Nebenwirkungen können bei Sympathomimetika, zu denen auch Berodual zählt, beobachtet werden. Es gibt Hinweise nach Markteinführung sowie aus Veröffentlichungen für ein seltenes Auftreten einer mit Beta-Agonisten assoziierten Myokardischämie. Mit Berodual behandelte Patienten, die an einer schweren Grunderkrankung des Herzens leiden (z. B. ischämische Herzerkrankung, Arrhythmie oder schwere Herzinsuffizienz), sollten ärztlichen Rat einholen, wenn bei ihnen Schmerzen in der Brust oder andere Anzeichen einer sich verschlechternden Herzerkrankung auftreten. Besondere Aufmerksamkeit ist bei der Beurteilung von Symptomen wie Atemnot und Schmerzen in der Brust geboten, da diese einen respiratorischen oder kardialen Ursprung haben können.
Wie andere Anticholinergika sollte Berodual LS bei Patienten mit
• Prädisposition für ein Engwinkelglaukom,
• vorbestehender Obstruktion der ableitenden Harnwege (z. B. Prostatahyperplasie oder Harnblasenhalsverengung),
• Niereninsuffizienz,
• Leberinsuffizienz
nur mit Vorsicht angewendet werden.
Vereinzelt wurde über Augenkomplikationen berichtet (d. h. Mydriasis, erhöhter Augeninnendruck, Engwinkelglaukom und Augenschmerzen), wenn vernebeltes Ipratropiumbromid allein oder in Kombination mit einem adrenergen Beta2-Agonisten in Kontakt mit den Augen kommt.
Achtung! Die Patienten müssen daher in der korrekten Anwendung von Berodual LS unterwiesen werden. Es muss darauf geachtet werden, dass das Produkt nicht in die Augen gelangt.
Anzeichen eines akuten Engwinkelglaukoms können sein:
• Augenschmerzen oder -beschwerden,
• verschwommenes Sehen,
• Augenhalos,
• unwirkliches Farbempfinden,
• gerötete Augen bedingt durch Blutstauungen in der Bindehaut und Hornhautödem.
Bei Auftreten eines oder mehrerer dieser Symptome sollte der Patient unverzüglich einen Augenarzt aufsuchen, damit eine Behandlung mit miotischen Augentropfen eingeleitet werden kann.
Insbesondere bei Patienten mit zystischer Fibrose kann es bei Behandlung mit inhalativen Anticholinergika häufiger zu gastrointestinalen Motilitätsstörungen kommen.
Daueranwendung
• Bei Patienten mit Asthma sollte Berodual nur bei Bedarf angewendet werden. Bei Patienten mit leichter COPD ist eine bedarfsorientierte (symptomorientierte) Anwendung einer regelmäßigen Anwendung unter Umständen vorzuziehen.
• Zur Kontrolle der Atemwegsentzündung und zur Vorbeugung einer Verschlechterung des Krankheitsbildes bei Patienten mit Asthma oder einer auf Glucokortikoide ansprechenden COPD sollte die zusätzliche Gabe oder die Dosiserhöhung antiinflammatorischer Arzneimittel in Betracht gezogen werden.
Bei Asthmapatienten ist ein ansteigender Bedarf von Arzneimitteln mit Beta2-Agonisten, wie Berodual LS, zur Behandlung der Bronchialobstruktion ein Anzeichen für eine Verschlechterung der Erkrankung.
Verschlimmert sich die Bronchialobstruktion, so ist ein erhöhter Gebrauch von Arzneimitteln mit Beta2-Agonisten über die empfohlene Dosis hinaus über einen längeren Zeitraum ungeeignet und möglicherweise bedenklich. In dieser Situation muss der Therapieplan des Patienten und besonders die Notwendigkeit der antiinflammatorischen Therapie mit inhalativen Glucokortikoiden überprüft werden, eine Dosisanpassung einer bereits bestehenden antiinflammatorischen Therapie oder die zusätzliche Gabe weiterer Arzneimittel neu festgesetzt werden, um einer potenziell lebensbedrohlichen Verschlimmerung der Beschwerden vorzubeugen.
Es ist wiederholt über ein erhöhtes Risiko für das Auftreten schwerer Komplikationen der Grunderkrankung bis hin zu Todesfällen berichtet worden, wenn das Bronchialasthma mit Beta2-Sympathomimetika zur Inhalation über längere Zeit mit hohen und überhöhten Dosen behandelt wurde und die entzündungshemmende Therapie unzureichend war. Die ursächlichen Zusammenhänge konnten bisher nicht hinreichend geklärt werden. Eine entscheidende Rolle scheint aber die unzureichend entzündungshemmende Therapie zu spielen.
Andere sympathomimetische Bronchodilatoren sollten nur unter ärztlicher Kontrolle in Kombination mit Berodual LS angewendet werden (siehe Abschnitt 4.5).
Die hoch dosierte Behandlung mit Beta2-Agonisten kann möglicherweise zu einer schweren Hypokaliämie führen (siehe Abschnitt 4.9). Bei niedrigen Ausgangswerten für Kalium ist der Kaliumspiegel zu kontrollieren.
Der Blutzuckerspiegel kann ansteigen. Bei Diabetes mellitus ist deshalb der Blutzuckerspiegel zu kontrollieren.
Nach der Anwendung von Berodual LS können in seltenen Fällen Überempfindlichkeitsreaktionen vom Soforttyp wie Urtikaria, Angioödem, Ausschlag, Bronchospasmus und oropharyngeales Ödem sowie andere allergische Reaktionen auftreten.
Dieses Arzneimittel enthält das Konservierungsmittel Benzalkoniumchlorid und den Stabilisator Natriumedetat. Beim Inhalieren können diese Bestandteile bei sensiblen Patienten mit hyperreaktiven Atemwegen Bronchospasmen verursachen.
Die Anwendung von Berodual LS kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Dauertherapie von Berodual zusammen mit anderen Anticholinergika wurde bisher nicht untersucht und wird daher nicht empfohlen.
Die Wirkung von Berodual LS kann bei gleichzeitiger Behandlung durch die nachfolgend genannten Arzneistoffe bzw. Arzneimittelgruppen beeinflusst werden.
• Verstärkung der Wirkung bis hin zu erhöhtem Nebenwirkungsrisiko:
- andere Beta-Adrenergika (alle Anwendungsarten),
- andere Anticholinergika (alle Anwendungsarten),
- Xanthinderivate (wie Theophyllin),
- antiinflammatorischen Substanzen (Kortikosteroide),
- Monoaminoxidasehemmer,
- trizyklische Antidepressiva,
- Narkose mit halogenierten Kohlenwasserstoffen (z. B. Halothan, Trichlorethylen und Enfluran).
Hierbei können vor allem die Wirkungen auf das Herz-Kreislauf-System verstärkt sein.
• Abschwächung der Wirkung:
- gleichzeitige Gabe von Beta-Rezeptorenblockern.
• Sonstige mögliche Wechselwirkungen:
Eine durch Beta2-Agonisten hervorgerufene Hypokaliämie kann durch die gleichzeitige Behandlung mit Xanthinderivaten, Glucokortikoiden und Diuretika verstärkt werden. Dies sollte insbesondere bei Patienten mit schwerer Atemwegsobstruktion berücksichtigt werden.
Hypokaliämie kann bei Patienten, die Digoxin erhalten, zu einer verstärkten Arrhythmieneigung führen. Zusätzlich kann eine Hypoxie die Auswirkungen einer Hypokaliämie auf den Herzrhythmus verstärken. In diesen Fällen empfiehlt sich die Überwachung des Serumkaliumspiegels.
Die Gefahr eines akuten Glaukomanfalls (siehe Abschnitt 4.4) wird erhöht, wenn vernebeltes Ipratropiumbromid allein oder in Kombination mit einem Beta2-Agonisten in die Augen gelangt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Nicht-klinische Daten in Kombination mit vorliegender Erfahrung beim Menschen haben keine Hinweise auf unerwünschte Effekte von Fenoterol oder Ipratropium in der Schwangerschaft erbracht. Trotzdem sollten die üblichen Vorsichtsmaßnahmen hinsichtlich des Gebrauchs von Arzneimitteln während der Schwangerschaft angewendet werden.
Die hemmende Wirkung von Fenoterol auf Kontraktionen der Gebärmutter sollte beachtet werden. Die Anwendung von Beta2-Agonisten am Ende der Schwangerschaft oder in hohen Dosen kann beim Neugeborenen nachteilige Wirkungen hervorrufen (Tremor, Tachykardie, Blutzucker-Schwankungen, Hypokaliämie).
Nicht-klinische Daten haben gezeigt, dass Fenoterol in die Muttermilch ausgeschieden wird. Es ist unbekannt, ob Ipratropium in die Muttermilch ausgeschieden wird; aber es ist unwahrscheinlich, dass Ipratropium den Säugling in einem nennenswerten Ausmaß erreichen würde, insbesondere beim Zuführen als Aerosol. Wenn Berodual einer stillenden Frau verabreicht wird, ist Vorsicht angebracht.
Klinische Daten zur Fertilität liegen weder für die Kombination von Ipratropiumbromid und Fenoterolhydrobromid noch für die Einzelkomponenten vor. Nicht-klinische Studien, die mit den Einzelkomponenten Ipratropiumbromid und Fenoterolhydrobromid durchgeführt wurden, zeigten keine unerwünschten Effekte auf die Fertilität (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Jedoch sollte den Patienten mitgeteilt werden, dass bei ihnen während der Behandlung mit Berodual Nebenwirkungen wie zum Beispiel Schwindel, Tremor, Akkommodationsstörungen, Pupillenerweiterung und verschwommenes Sehen auftreten können und sie daher beim Autofahren oder beim Bedienen von Maschinen vorsichtig sein sollten. Beim Auftreten solcher Nebenwirkungen sollten die Patienten potenziell gefährliche Tätigkeiten wie zum Beispiel Autofahren oder das Bedienen von Maschinen vermeiden.
4.8 Nebenwirkungen
Wie alle Arzneimittel kann Berodual Nebenwirkungen haben.
a) Allgemeine Beschreibung
Viele der aufgeführten Nebenwirkungen können auf die anticholinergen und beta-adrenergen Eigenschaften von Berodual zurückgeführt werden.
b) Tabelle der Nebenwirkungen
Die aufgelisteten Nebenwirkungen basieren auf Daten aus klinischen Prüfungen und der Arzneimittelüberwachung der Anwendung nach der Zulassung.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Immunsystems
Selten: anaphylaktische Reaktionen*, Überempfindlichkeit*
Erkrankungen des Stoffwechsels und der Ernährung
Selten: Hypokaliämie*
Sehr selten: Blutzuckeranstieg
Psychische Erkrankungen Gelegentlich: Nervosität
Selten: Agitation, psychische Veränderungen
Erkrankungen des Nervensystems
Gelegentlich: Kopfschmerz, Tremor, Schwindel
Häufigkeit nicht bekannt: Hyperaktivität
Augenerkrankungen
Selten: Glaukom*, Anstieg des Augeninnendrucks*, Akkommodationsstörungen*,
Mydriasis*, verschwommenes Sehen*, Augenschmerzen*, Hornhautödem*, Hyperämie der Augenbindehaut*, Sehen von Farbkreisen*
Herzerkrankungen
Gelegentlich: Tachykardie, Palpitationen
Selten: Arrhythmien, Vorhofflimmern, supraventrikuläre Tachykardie*,
Myokardischämie*
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten
Gelegentlich: Pharyngitis, Dysphonie
Selten: Bronchospasmus, Reizungen in Hals und Rachen, Pharynxödem,
Verkrampfung der Kehlkopfmuskulatur*, inhalationsbedingter (paradoxer) Bronchospasmus*, trockener Hals*
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Erbrechen, Übelkeit, Mundtrockenheit
Selten: Stomatitis, Glossitis, gastrointestinale Motilitätsstörungen**, Durchfall,
Verstopfung*, Mund-Ödem*, Sodbrennen
Erkrankungen der Haut und des Unterhautzellgewebes
Selten: Urtikaria, Hautausschlag, Juckreiz, Angioödem*, Petechien, Hyperhidrosis*
Erkrankungen der Muskeln, des Skeletts und Bindegewebes
Selten: Muskelschwäche, Muskelkrämpfe, Muskelschmerzen
Erkrankungen der Nieren und Harnwege Selten: Harnverhalt
Untersuchungen
Gelegentlich: Blutdrucksteigerung (systolisch)
Selten: Blutdrucksenkung (diastolisch), Thrombozytopenie
* Diese Nebenwirkung wurde in keiner der ausgewählten klinischen Studien beobachtet. Die Abschätzung der Häufigkeit stützt sich auf die Obergrenze des 95 %-Konfidenzintervalls, berechnet mit der Gesamtzahl behandelter Patienten gemäß EU SmPC Guideline (3/4968 = 0,0006 entspricht „selten“).
** Insbesondere bei Patienten mit zystischer Fibrose kann es bei Behandlung mit inhalativen Anticholinergika (wie auch in Berodual enthalten) häufiger zu gastrointestinalen Motilitätsstörungen kommen.
c) Angaben zu häufig auftretenden Nebenwirkungen
Wie bei jeder inhalativen Therapie können auch unter Berodual Anzeichen von lokaler Reizung auftreten. In klinischen Prüfungen waren die am häufigsten berichteten Nebenwirkungen: Husten, trockener Mund, Kopfschmerz, Tremor, Pharyngitis, Übelkeit, Schwindel, Dysphonie, Tachykardie, Palpitationen, Erbrechen, Anstieg des systolischen Blutdrucks und Nervosität.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn,
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
a) Symptome der Intoxikation
Je nach Grad einer Überdosierung können folgende - für Beta2-Adrenergika bekannte -Nebenwirkungen auftreten:
Gesichtsrötung, Benommenheit, Kopfschmerzen, Tachykardie, Palpitationen, Arrhythmien, Hypotonie bis hin zum Schock, Blutdrucksteigerung, Ruhelosigkeit, Brustschmerzen, Erregung, eventuell Extrasystolen und heftiger Tremor insbesondere der Finger, aber auch am ganzen Körper.
Es kann zur Hyperglykämie kommen.
Vor allem nach oraler Intoxikation können gastrointestinale Beschwerden einschließlich Übelkeit und Erbrechen auftreten.
Eine metabolische Azidose sowie Hypokaliämie wurden beobachtet, wenn Fenoterol in höherer als für die zugelassenen Indikationen von Berodual empfohlener Dosierung angewendet wurde.
Symptome einer Überdosierung mit Ipratropiumbromid (z. B. Mundtrockenheit, Sehstörungen) sind von leichter Natur, da die systemische Verfügbarkeit von inhaliertem Ipratropiumbromid sehr gering ist.
Die Behandlung mit Berodual sollte beendet werden. Ein Monitoring von Säure-Basen-Haushalt und Elektrolyten sollte in Betracht gezogen werden.
Gabe von Sedativa und Tranquilizern. In schweren Fällen ist eine Behandlung auf der Intensivstation angezeigt. Die Wirkungen von Fenoterol können durch Beta-Rezeptorenblocker (vorzugsweise beta1-selektiv) antagonisiert werden. Hierbei ist jedoch der Gefahr der Auslösung eines schweren (möglicherweise tödlichen) Bronchospasmus bei Patienten mit Asthma bronchiale oder COPD durch vorsichtige Titration Rechnung zu tragen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mittel bei obstruktiven Atemwegserkrankungen, Sympathomimetika in Kombination mit Anticholinergika; ATC-Code: R03AL01
Berodual enthält zwei aktive bronchodilatatorische Bestandteile: Ipratropiumbromid, welches eine anticholinerge Wirkung aufweist und Fenoterolhydrobromid, einen beta-adrenergen Wirkstoff.
Ipratropiumbromid ist eine quartäre Ammoniumverbindung mit anticholinergen (parasympatholytischen) Eigenschaften. In nicht-klinischen Studien hemmt es Vagus-vermittelte Reflexe durch Antagonisierung der Wirkung von Acetylcholin, der vom Vagusnerven freigesetzte Transmitter. Anticholinergika verhindern den Anstieg der intrazellulären Ca++-Konzentration, der durch die Interaktion von Acetylcholin mit dem Muskarin-Rezeptor auf der glatten Muskulatur der Bronchien verursacht wird. Die Freisetzung von Ca++ wird durch das Second-Messenger-System, das aus IP3 (Inositoltriphosphat) und DAG (Diaglycerol) besteht, vermittelt.
Bei der Bronchodilatation nach Inhalation von Ipratropiumbromid handelt es sich primär um einen lokalen, standortspezifischen Effekt und nicht um einen systemischen.
Fenoterolhydrobromid ist ein direkt wirkender sympathomimetischer Wirkstoff, der im therapeutischen Dosisbereich selektiv Beta2-Rezeptoren stimuliert. Die Stimulation von Beta1-Rezeptoren kommt bei höheren Dosisbereichen zum Ausdruck. Die Besetzung der Beta2-Rezeptoren aktiviert die Adenylatzyklase über ein stimulatorisches Gs-Protein. Der Anstieg von zyklischem AMP aktiviert die Proteinkinase A, welche dann Zielproteine in glatten Muskelzellen phosphoryliert. Dies wiederum führt zur Phosphorylierung von Myosin-Leichtketten-Kinase, Hemmung der Hydrolyse von Phosphoinositol und Öffnung von bestimmten Calcium-aktivierten Kaliumkanälen.
Fenoterolhydrobromid relaxiert die glatte Muskulatur der Gefäße und Bronchien und schützt vor bronchokonstriktorischen Stimuli wie Histamin, Metacholin, kalte Luft und Allergen (frühe Antwort). Nach Verabreichung wird die Freisetzung von bronchokonstriktorischen und proinflammatorischen Mediatoren aus Mastzellen blockiert. Des Weiteren wurde eine Steigerung der mucoziliaren Clearance nach Gabe von Fenoterol (0,6 mg) nachgewiesen.
Höhere Plasmakonzentrationen, die häufiger mit oraler und noch häufiger mit intravenöser Verabreichung erreicht werden, hemmen die uterine Motilität. Ebenfalls bei höheren Dosen werden metabolische Effekte beobachtet: Lipolyse, Glykogenolyse, Hyperglykämie und Hypokaliämie. Letztere wird durch eine erhöhte K+-Aufnahme primär in den Skelettmuskel verursacht. Beta-adrenerge Wirkungen auf das Herz wie Anstieg der Herzfrequenz und -kontraktilität sind auf die vaskulären Effekte von Fenoterol, kardiale Beta2-Stimulation und - bei supratherapeutischen Dosen -die Stimulation von Beta1-Rezeptoren zurückzuführen. Wie bei anderen beta-adrenergen Wirkstoffen sind Verlängerungen der QT-Zeit berichtet worden. Für Fenoterol Dosier-Aerosole waren diese schwach ausgeprägt und wurden bei höheren als den empfohlenen Dosen beobachtet. Jedoch kann die
systemische Exposition nach Verabreichung mit Verneblern (Lösung zur Inhalation) höher sein als mit den für Dosier-Aerosole empfohlenen Dosen. Die Bedeutung für den Patienten ist nicht bewiesen. Tremor ist ein häufiger beobachteter Effekt von Beta-Agonisten. Im Unterschied zu den Wirkungen auf die glatte Muskulatur der Bronchien unterliegen die systemischen Wirkungen von Beta-Agonisten auf die Skelettmuskulatur der Toleranz-Entwicklung.
Durch die gleichzeitige Anwendung dieser beiden Wirkstoffe werden die Bronchien durch Beeinflussung verschiedener pharmakologischer Wirkstellen dilatiert. Die beiden Wirkstoffe ergänzen sich daher gegenseitig in ihrer spasmolytischen Wirkung auf die bronchialen Muskeln und erlauben einen breiten therapeutischen Einsatz im Feld bronchopulmonaler Erkrankungen, die mit einer Konstriktion des Respirationstrakts bzw. der Atemwege assoziiert sind. Durch die sich gegenseitig ergänzende Wirkung wird nur ein sehr kleiner Anteil des beta-adrenergen Bestandteils benötigt, um die gewünschte Wirkung zu erzielen, was eine individuelle, für jeden Patienten geeignete Dosierung mit einem Minimum an Nebenwirkungen erleichtert.
5.2 Pharmakokinetische Eigenschaften
Die therapeutische Wirkung der Kombination von Ipratropiumbromid und Fenoterolhydrobromid wird durch eine lokale Wirkung in den Atemwegen hervorgerufen. Die Pharmakodynamik des Bronchodilatation ist daher unabhängig von der Pharmakokinetik der wirksamen Bestandteile des Präparats.
Nach inhalativer Anwendung werden 10-39 % einer Dosis normalerweise in den Lungen deponiert, abhängig von der Formulierung, der Inhalationstechnik und dem Inhalationssystem. Der restliche Anteil der Dosis wird im Mundstück, im Mund sowie in den oberen Atemwegen (Oropharynx) deponiert. Eine ähnliche Menge der Dosis wird nach Inhalation mit einem Dosier-Aerosol in den Atemwegen deponiert. In Versuchen wurde beobachtet, dass insbesondere nach Inhalation der wässrigen Lösung mit dem Respimat®-Inhalator die Lungendeposition um mehr als das 2-fache höher ist als unter Anwendung eines Dosier-Aerosols. Die oropharyngeale Deposition ist entsprechend vermindert und ist bei der Anwendung eines Respimat®-Inhalators deutlich geringer als bei der Anwendung eines Dosier-Aerosols. Der in der Lunge deponierte Anteil der Dosis geht schnell (innerhalb von Minuten) in den Blutkreislauf über. Der Anteil des im Oropharyngealbereich deponierten Wirkstoffs wird langsam verschluckt und passiert den Gastrointestinaltrakt. Deshalb hängt die systemische Exposition sowohl von der oralen als auch der pulmonalen Bioverfügbarkeit ab.
Es gibt keinen Hinweis dafür, dass sich die Pharmakokinetik der beiden Wirkstoffe in der Kombination von der Pharmakokinetik der Monosubstanzen unterscheidet.
Fenoterolhydrobromid
Der verschluckte Anteil wird vorwiegend zu Sulfatkonjugaten metabolisiert. Die absolute Bioverfügbarkeit nach oraler Anwendung ist gering (etwa 1,5 %).
Nach intravenöser Gabe nähern sich das freie und das konjugierte Fenoterol einem Prozentsatz von 15 % und 27 % der verabreichten Dosis im kumulativen 24-Stunden-Urin an. Nach inhalativer Anwendung von Berodual Dosier-Aerosol wird etwa 1 % der inhalierten Dosis als freies Fenoterol mit dem 24-Stunden-Urin ausgeschieden. Auf Grundlage dieser Daten wird die systemische GesamtBioverfügbarkeit von inhalierten Dosen Fenoterolhydrobromid auf 7 % geschätzt.
Kinetische Parameter zur Beschreibung der Disposition von Fenoterol wurden aus den Plasmakonzentrationen nach intravenöser Gabe berechnet. Nach intravenöser Gabe können Plasmakonzentrations-Zeit-Kurven mit einem 3-Kompartiment-Modell beschrieben werden, wobei die terminale Halbwertszeit etwa 3 Stunden beträgt. In diesem 3-Kompartiment-Modell liegt das scheinbare Verteilungsvolumen von Fenoterol im Steady-State (VDss) bei etwa 189 l (« 2,7 l/kg).
Die Plasmaproteinbindung des Präparats liegt bei etwa 40 %.
Nicht-klinische Studien an Ratten zeigten, dass Fenoterol und seine Metaboliten die Blut-HirnSchranke nicht passieren. Die Gesamt-Clearance von Fenoterol beträgt 1,8 l/min und die renale Clearance 0,27 l/min.
In einer Studie zum Ausscheidungsgleichgewicht betrug die kumulative renale Ausscheidung (2 Tage) der radioaktiv markierten Substanzen (einschließlich der Muttersubstanz und aller Metaboliten) nach intravenöser Gabe 65 % der Dosis. Die über den Stuhl ausgeschiedene Gesamt-Radioaktivität betrug 14,8 % der Dosis. Nach oraler Gabe betrug die innerhalb von 48 Stunden über den Urin ausgeschiedene Gesamt-Radioaktivität ca. 39 % der Dosis und die über den Stuhl ausgeschiedene Gesamt-Radioaktivität 40,2 % der Dosis.
Ipratropiumbromid
Die kumulative renale Ausscheidung (0-24 h) von Ipratropium (Muttersubstanz) nähert sich einem Prozentsatz von 46 % der intravenös verabreichten Dosis, weniger als 1 % der oral verabreichten Dosis und etwa 3-13 % der mittels Berodual Dosier-Aerosol inhalierten Dosis an. Auf Grundlage dieser Daten wird die systemische Gesamt-Bioverfügbarkeit von oralen und inhalierten Dosen von Ipratropiumbromid auf 2 % bzw. 7-28 % geschätzt. Demnach tragen verschluckte Anteile von Ipratropiumbromid-Dosen nicht maßgeblich zur systemischen Exposition bei.
Kinetische Parameter zur Beschreibung der Disposition von Ipratropium wurden aus den Plasmakonzentrationen nach intravenöser Gabe berechnet. Dabei wurde eine rasche biphasische Abnahme der Plasmakonzentrationen beobachtet. Das scheinbare Verteilungsvolumen im Steady State (VDss) liegt bei etwa 176 l (~ 2,4 l/kg). Die Plasmaproteinbindung des Präparats ist minimal (weniger als 20 %). Nicht-klinische Studien an Ratten und Hunden zeigten, dass das quartäre Amin Ipratropium die Blut-Hirn-Schranke nicht passiert.
Die Halbwertszeit der terminalen Eliminationsphase beträgt etwa 1,6 Stunden. Die Gesamt-Clearance von Ipratropium beträgt 2,3 l/min und die renale Clearance 0,9 l/min. Vermutlich werden nach intravenöser Gabe etwa 60 % der Dosis hauptsächlich in der Leber durch Oxidation metabolisiert.
In einer Studie zum Ausscheidungsgleichgewicht betrug die kumulative renale Ausscheidung (6 Tage) der radioaktiv markierten Substanzen (einschließlich der Muttersubstanz und aller Metaboliten)
72,1 % nach intravenöser Gabe, 9,3 % nach oraler Gabe und 3,2 % nach Inhalation. Die über den Stuhl ausgeschiedene Gesamt-Radioaktivität betrug 6,3 % nach intravenöser Gabe, 88,5 % nach oraler Gabe und 69,4 % nach Inhalation. Die Ausscheidung der radioaktiv markierten Substanzen nach intravenöser Gabe erfolgt hauptsächlich über die Nieren. Die Eliminationshalbwertszeit der radioaktiv markierten Substanzen (Muttersubstanz und Metaboliten) beträgt 3,6 Stunden. Die Bindung der Hauptmetaboliten im Urin an den Muscarin-Rezeptor ist vernachlässigbar und die Metaboliten werden als unwirksam betrachtet.
5.3 Präklinische Daten zur Sicherheit
Toxizitätsstudien mit einzelnen Dosen der Kombination von Ipratropiumbromid und Fenoterolhydrobromid im Verhältnis 1:2,5 (Ipratropiumbromid/Fenoterolhydrobromid) an Mäusen und Ratten nach oraler, intravenöser und inhalativer Gabe zeigten eine geringe akute Toxizität. Verglichen mit den Einzelsubstanzen, wurden die LD50-Werte der Kombination beider Substanzen mehr von Ipratropiumbromid als von Fenoterolhydrobromid bestimmt, ohne Hinweise auf Potenzierung.
Toxizitätsstudien mit wiederholten Gaben der Kombination von Ipratropiumbromid und Fenoterolhydrobromid wurden an Ratten (oral, inhalativ) und Hunden (intravenös, inhalativ) über bis zu 13 Wochen durchgeführt. Dabei wurde bei bis zu mehrere hundertmal höheren Konzentrationen als denen für Menschen empfohlenen nur geringe toxische Effekte beobachtet. Myokardiale Vernarbungen am linken Ventrikel wurden nur bei einem Tier der höchsten Behandlungsgruppe (84 pg/kg/Tag) in der 4-wöchigen Studie an Hunden mit intravenösen Gaben gesehen. Die 13-wöchige Studie an Ratten mit oralen Gaben sowie die 13-wöchige Studie an Hunden mit inhalativen Gaben zeigten keine toxikologischen Veränderungen, die über die proportional für die Einzelsubstanzen auftretenden Veränderungen hinausgehen.
Nichts wies auf eine Potenzierung der Toxizität bei einer Kombination der beiden Substanzen verglichen mit den Monosubstanzen hin. Alle beobachteten unerwünschten Ereignisse sind sowohl für Fenoterolhydrobromid als auch für Ipratropiumbromid wohl bekannt.
Bei Ratten und Kaninchen traten nach inhalativer Gabe der Kombination von Ipratropiumbromid und Fenoterolhydrobromid keine teratogenen Effekte auf. Ebenso wurden keine teratogenen Effekte nach Gabe von Ipratropiumbromid und nach inhalativer Gabe von Fenoterolhydrobromid beobachtet. Nach oraler Gabe induzierte Fenoterolhydrobromid bei Dosen > 25 mg/kg/Tag (Kaninchen) und > 38,5 mg/kg/Tag (Mäuse) eine erhöhte Fehlbildungsrate.
Die beobachteten Fehlbildungen werden als Klasseneffekt von Beta-Agonisten betrachtet. Die Fertilität war bei Ratten bei oralen Dosen bis zu 90 mg/kg/Tag Ipratropiumbromid und bis zu 40 mg/kg/Tag Fenoterolhydrobromid nicht beeinträchtigt.
Studien zur Genotoxizität der Kombination beider Wirkstoffe wurden nicht durchgeführt. In-vitro- und in-vivo-Tests zeigten, dass weder Fenoterolhydrobromid noch Ipratropiumbromid ein mutagenes Potenzial aufweisen.
Studien zur Karzinogenität der Kombination beider Wirkstoffe wurden nicht durchgeführt. In Langzeitstudien mit Ipratropiumbromid an Mäusen und Ratten wurden keine kanzerogenen Effekte festgestellt. Für Fenoterolhydrobromid wurden Studien zur Karzinogenität nach oraler (Mäuse,
18 Monate, Ratten, 24 Monate) und inhalativer Verabreichung (Ratten, 24 Monate) durchgeführt. Bei oralen Dosen von 25 mg/kg/Tag wurde bei Mäusen eine erhöhte Inzidenz von Leiomyomen des Uterus mit unterschiedlicher mitotischer Aktivität und bei Ratten eine erhöhte Inzidenz von Leiomyomen des Mesovariums beobachtet. Diese Befunde sind bekannte Effekte, die durch die lokale Wirkung von Beta-Adrenergika an den glatten Muskelzellen des Uterus von Mäusen und Ratten verursacht werden. Unter Berücksichtigung des heutigen Forschungsstandes sind diese Ergebnisse für den Menschen nicht zutreffend. Alle anderen gefundenen Neoplasien wurden als häufige Formen von Neoplasie betrachtet, die spontan in den verwendeten Stämmen auftreten und zeigten keine sich aus einer Behandlung mit Fenoterolhydrobromid ergebende biologisch relevante Erhöhung der Inzidenz.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
100 pg Benzalkoniumchlorid/ml, Natriumchlorid, Natriumedetat (Ph. Eur.), gereinigtes Wasser, Salzsäure 3,6 % (zur pH-Einstellung)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Die individuell zubereiteten Lösungen sind zur unmittelbaren Anwendung bestimmt.
Berodual LS Lösung mit Lösungsspender ist nach Anbruch nicht länger als 10 Wochen zu verwenden. Die Dauer der Haltbarkeit beträgt 3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Keine
6.5 Art und Inhalt des Behältnisses
Lösung zum Inhalieren Packungsgrößen:
• Originalpackung mit 20 ml Lösung
• Originalpackung mit 5 x 20 ml Lösung
• Klinikpackung mit 10 x 20 ml Lösung
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Zur Anwendung soll die empfohlene Dosis von Berodual LS Inhalationslösung mit physiologischer (0,9 %iger) Kochsalzlösung auf 3-4 ml verdünnt werden. Die gebrauchsfertige Lösung soll unmittelbar nach der Zubereitung inhaliert werden. Die Inhalation sollte möglichst im Sitzen oder Stehen erfolgen. Dabei ist die Gebrauchsanweisung des Inhalationsgerätes zu befolgen.
1. Zur Entnahme der Lösung Flasche schräg halten und den Dosierkopf mit dem Zeigefinger bis zum Anschlag niederdrücken (Abb. 1).
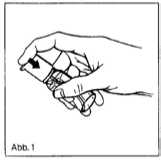
2. Vor der erstmaligen Anwendung den Pumpmechanismus mehrmals betätigen, um die Luft aus dem System zu entfernen. Die erste freigesetzte Flüssigkeitsmenge ist zu verwerfen.
3. Es ist darauf zu achten, dass bei abnehmender Flaschenfüllung das gekrümmte Steigrohr in die Flüssigkeit reicht (Abb. 2).
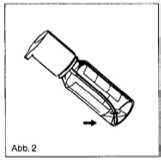
Hierdurch wird erreicht, dass die Lösung bis auf einen Rest, der technisch bedingt in der Flasche zurückbleibt, entnommen werden kann.
Sobald beim Pumpen dieser Restlösungsmenge Luft mit angesaugt wird, ist keine exakte Dosierung gewährleistet; der verbleibende Rest soll aus diesem Grunde nicht mehr verwendet werden.
Die Inhalationsdauer kann durch das Verdünnungsvolumen gesteuert werden.
Die Patienten müssen hinsichtlich der korrekten Anwendung der Berodual LS Lösung instruiert werden. Sorgfältig muss darauf geachtet werden, dass die Lösung bzw. der Inhalationsnebel nicht in die Augen gelangt. Die vernebelte Lösung sollte mittels eines Mundstückes inhaliert werden. Wenn kein Mundstück verfügbar ist und eine Verneblungsmaske verwendet wird, muss auf deren korrekten Sitz geachtet werden. Patienten mit Neigung zu Glaukom sollen ausdrücklich angewiesen werden, ihre Augen zu schützen.
Berodual LS Lösung ist zur gleichzeitigen Inhalation mit Bisolvon® und Mucosolvan® Inhalationslösung geeignet.
7. INHABER DER ZULASSUNG
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Str. 173
55216 Ingelheim am Rhein
Telefon: 0 800 / 77 90 900
Telefax: 0 61 32 / 72 99 99
E-Mail: info@boehringer-ingelheim.de
8. ZULASSUNGSNUMMER
11704.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung 03. Oktober 1988 Datum der letzten Verlängerung der Zulassung 18. März 2004
10. STAND DER INFORMATION
Oktober 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 14 von 14