Berotec N 100 Μg Dosier-Aerosol
F achinformation
Boehringer n| \v Ingelheim
1. BEZEICHNUNG DES ARZNEIMITTELS
Berotec® N 100 pg Dosier-Aerosol Druckgasinhalation, Lösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Fenoterolhydrobromid 1 Aerosolstoß enthält 100 pg Fenoterolhydrobromid Sonstiger Bestandteil mit bekannter Wirkung: Ethanol 99 % (Alkohol) (siehe Abschnitt 4.4). Vollständige Auflistung der sonstigen Bestandteile: siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Druckgasinhalation, Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
• Symptomatische Behandlung von akuten Asthmaanfällen.
• Prophylaxe von belastungsinduziertem Asthma bronchiale.
• Symptomatische Behandlung von Asthma bronchiale allergischer und nichtallergischer Ursache und/oder anderen Erkrankungen, die mit einer reversiblen Obstruktion der Atemwege einhergehen, z. B. chronisch obstruktive Bronchitis mit und ohne Lungenemphysem.
Hinweis:
Sofern eine Dauerbehandlung erforderlich ist, soll stets eine begleitende antiinflammatorische Therapie erfolgen.
4.2 Dosierung und Art der Anwendung
Dosierung
Die Dosierung richtet sich nach Art und Schwere der Erkrankung. Soweit nicht anders verordnet, gelten für Erwachsene und Kinder ab 6 Jahren folgende Empfehlungen:
• Zur Akutbehandlung plötzlich auftretender Bronchialkrämpfe und anfallsweise auftretender Atemnot wird eine Einzeldosis von 100 pg Fenoterolhydrobromid (1 Hub) inhaliert.
Meist führt bei einem akuten Anfall von Luftnot bereits das einmalige Inhalieren zu einer raschen Erleichterung der Atmung. Sollte sich die Atemnot 5 Minuten nach Inhalation des ersten Hubes nicht spürbar gebessert haben, kann 1 weiterer Hub inhaliert werden. Kann ein schwerer Anfall von Luftnot auch durch eine zweite Anwendung nicht behoben werden, können weitere Hübe erforderlich werden. In diesen Fällen muss unverzüglich ärztliche Hilfe in Anspruch genommen werden (siehe Abschnitt 4.4).
• Falls eine Dauerbehandlung mit Beta2-Sympathomimetika für notwendig befunden wird, beträgt die Dosierung 1 - 2 Hübe von Berotec N 100 pg Dosier-Aerosol 3 - 4-mal pro Tag. Vorzugsweise sollten Zeitpunkt und Dosis der jeweiligen Einzelanwendung von Berotec N
100 pg Dosier-Aerosol entsprechend der Häufigkeit und Schwere der Atemnot (symptomorientiert) gewählt werden. Sie soll insbesondere bei Asthma bronchiale von einer entzündungshemmenden Dauertherapie begleitet werden. Der Abstand der einzelnen Inhalationen soll mindestens 3 Stunden betragen. Die Gesamttagesdosis soll 8 Hübe und die maximale Einzeldosis 4 Hübe nicht überschreiten, da eine höhere Dosierung im Allgemeinen keinen zusätzlichen therapeutischen Nutzen erwarten lässt, aber die Wahrscheinlichkeit des Auftretens auch schwerwiegender Nebenwirkungen erhöht werden kann.
• Zur gezielten Vorbeugung bei Anstrengungsasthma oder vorhersehbarem Allergenkontakt werden 1 - 2 Hübe von Berotec N 100 pg Dosier-Aerosol, wenn möglich 10 - 15 Minuten vorher, inhaliert.
Soweit nicht anders verordnet, gilt für Kinder von 4 bis 6 Jahren folgende Dosierungsempfehlung:
• Zur Akutbehandlung plötzlich auftretender Bronchialkrämpfe und anfallsweise auftretender Atemnot wird eine Einzeldosis von 100 pg Fenoterolhydrobromid (1 Hub) inhaliert.
• Zur Dauerbehandlung oder zur Anfallsprophylaxe werden 100 pg Fenoterolhydrobromid 4-mal täglich inhaliert. Vorzugsweise sollten Zeitpunkt und Dosis der jeweiligen Einzelanwendung von Berotec N 100 pg Dosier-Aerosol entsprechend der Häufigkeit und Schwere der Atemnot (symptomorientiert) gewählt werden. Sie soll insbesondere bei Asthma bronchiale von einer entzündungshemmenden Dauertherapie begleitet werden. Der Abstand der einzelnen Inhalationen soll mindestens 3 Stunden betragen. Die Gesamttagesdosis soll 4 Hübe und die maximale Einzeldosis 2 Hübe nicht überschreiten, da eine höhere Dosierung im Allgemeinen keinen zusätzlichen therapeutischen Nutzen erwarten lässt, aber die Wahrscheinlichkeit des Auftretens auch schwerwiegender Nebenwirkungen erhöht werden kann.
• Zur gezielten Vorbeugung bei Anstrengungsasthma oder vorhersehbarem Allergenkontakt wird eine Einzeldosis von 100 pg Fenoterolhydrobromid, wenn möglich 10 - 15 Minuten vorher, inhaliert.
Für Kinder unter 4 Jahren ist diese Anwendungsform im Allgemeinen nicht geeignet.
Warnhinweis:
Kommt es trotz der verordneten Behandlung zu keiner befriedigenden Besserung oder gar zu einer Verschlechterung des Leidens, ist ärztliche Beratung erforderlich, um die Therapie gegebenenfalls durch eine Kombination mit anderen Arzneimitteln - entzündungshemmenden wie Kortikoiden, die Bronchien erweiternden wie Theophyllin - oder eine Änderung der Dosierung neu festzulegen. Eine plötzliche und zunehmende Verschlechterung der Asthmabeschwerden kann lebensbedrohlich sein. In diesen Fällen muss unverzüglich ärztliche Hilfe in Anspruch genommen werden. Eine erhebliche Überschreitung der vorgeschriebenen Dosis kann gefährlich sein.
Es ist wiederholt über ein erhöhtes Risiko für das Auftreten schwerer Komplikationen der Grunderkrankung bis hin zu Todesfällen berichtet worden, wenn das Bronchialasthma mit Beta2-Sympathomimetika zur Inhalation über längere Zeit mit hohen und überhöhten Dosen behandelt wurde und die entzündungshemmende Therapie unzureichend war. Die ursächlichen Zusammenhänge konnten bisher nicht hinreichend geklärt werden. Eine entscheidende Rolle scheint aber die unzureichend entzündungshemmende Therapie zu spielen.
Spezielle Therapiehinweise:
Die Behandlung von Bronchialasthma sollte dem Schweregrad entsprechend stufenweise erfolgen.
Der Erfolg der Therapie sollte durch regelmäßige ärztliche Untersuchungen überprüft werden.
Es ist für den Patienten möglicherweise gefährlich, ohne ärztliche Anweisungen den Gebrauch von Beta2-Sympathomimetika, wie Berotec N 100 pg Dosier-Aerosol, von sich aus zu erhöhen.
Eine plötzliche und zunehmende Verschlechterung der Asthmabeschwerden kann lebensbedrohlich sein.
Ein ansteigender Bedarf von Beta2-Sympathomimetika, wie Berotec N 100 pg Dosier-Aerosol, ist ein Anzeichen für eine Verschlechterung der Erkrankung. In dieser Situation muss der Therapieplan durch den Arzt überdacht und ggf. durch eine Kombination mit entzündungshemmenden Arzneimitteln, eine Dosisanpassung einer bereits bestehenden entzündungshemmenden Therapie oder die zusätzliche Gabe weiterer Arzneimittel neu festgesetzt werden.
Zur ärztlichen Beurteilung des Krankheitsverlaufes sowie des Therapieerfolges der atemwegserweiternden und entzündungshemmenden Behandlung ist eine tägliche Selbstkontrolle nach ärztlicher Anleitung wichtig. Dies erfolgt z. B. durch die Aufzeichnung des mit dem Peak-flow-Meter gemessenen Atemstoßes.
Art der Anwendung
Gemäß Gebrauchsanweisung inhalieren!
Die richtige Handhabung des Dosier-Aerosol-Gerätes ist für den Behandlungserfolg entscheidend. Bei der Inhalation zeigt der Pfeil am Behälter stets senkrecht nach oben und das Mundstück nach unten, unabhängig von der Position, in der inhaliert wird. Die Anwendung sollte möglichst im Sitzen oder Stehen erfolgen.
Vor der ersten Anwendung das Dosier-Aerosol 2-mal betätigen.
Bei jeder Anwendung ist Folgendes zu beachten:
1. Schutzkappe abnehmen (Abb. 1).
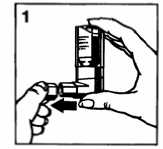
2. Tief ausatmen.
3. Dosier-Aerosol entsprechend der Abbildung 2 in die Hand nehmen und das Mundstück mit den Lippen fest umschließen. Dabei zeigt der Pfeil am Behälter nach oben und das Mundstück nach unten.
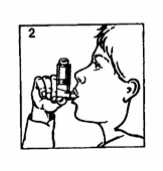
4. Tief einatmen und gleichzeitig fest auf den Boden des Behälters drücken, wodurch 1 Aerosolstoß freigegeben wird. Atem einige Sekunden anhalten, dann das Mundstück aus dem Mund nehmen und langsam ausatmen.
Wenn eine tiefe Einatmung wegen schwerer Atemnot nicht möglich ist, werden eine Erleichterung der Atmung und die weitere korrekte Anwendung dadurch ermöglicht, dass zunächst 1 Aerosolstoß in die Mundhöhle gesprüht wird.
Wenn eine zweite Inhalation erforderlich ist, sind die Schritte 2 - 4 zu wiederholen.
5. Nach Gebrauch Schutzkappe wieder aufsetzen.
Zur Vorbereitung ("Lungenöffnung") und Unterstützung einer Aerosoltherapie mit Kortikosteroiden, Solen und Cromoglicinsäure-Dinatriumsalz (DNCG) sollte Berotec N 100 ^g Dosier-Aerosol vorher inhaliert werden.
Die Dauer der Behandlung richtet sich nach Art, Schwere und Verlauf der Erkrankung und ist vom Arzt individuell zu entscheiden.
Weitere Hinweise:
Um eine falsche Anwendung zu vermeiden, ist eine gründliche Einweisung des Patienten in den korrekten Gebrauch vorzunehmen. Kinder sollten dieses Arzneimittel nur unter Aufsicht eines Erwachsenen und nach Vorschrift des Arztes anwenden.
Sollte das Dosier-Aerosol einmal länger als 3 Tage nicht benutzt worden sein, sollte es vor der neuerlichen Anwendung 1-mal betätigt werden.
Reinigen Sie das Mundrohr mindestens einmal pro Woche.
Es ist wichtig, das Mundrohr sauber zu halten, um sicherzustellen, dass sich kein Arzneimittel ablagert und das Spray blockiert.
Zum Reinigen nehmen Sie zuerst die Schutzkappe ab, entfernen den Behälter vom Mundrohr und spülen das Mundrohr mit warmen Wasser bis keine Arzneimittelrückstände und/oder Schmutz mehr sichtbar sind.
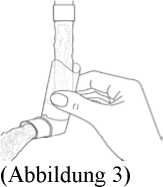
Nach dem Reinigen schütteln Sie das Mundrohr aus und lassen es an der Luft ohne Anwendung eines Heizsystems trocknen. Sobald das Mundrohr trocken ist, setzen Sie den Behälter wieder ein und die Schutzkappe auf.
(Abbildung 4)
Das Mundrohr wurde speziell für die Verwendung mit Berotec N 100 pg Dosier-Aerosol entwickelt. Benutzen Sie das Mundrohr nicht mit anderen Dosier-Aerosolen. Verwenden Sie Berotec N 100 pg Dosier-Aerosol ausschließlich mit dem mitgelieferten Mundrohr.
Der unter Überdruck stehende Behälter darf nicht gewaltsam geöffnet werden.
4.3 Gegenanzeigen
Das Arzneimittel darf nicht angewendet werden bei:
• Überempfindlichkeit gegen Fenoterolhydrobromid oder einen der sonstigen Bestandteile des Arzneimittels (siehe Abschnitt 6.1);
• hypertropher obstruktiver Kardiomyopathie;
• tachykarden Arrhythmien.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Berotec N 100 pg Dosier-Aerosol sollte nur bei strenger Indikationsstellung und mit Vorsicht angewendet werden bei: schweren Herzerkrankungen, insbesondere frischem Herzinfarkt und koronarer Herzkrankheit, Einnahme von Herzglykosiden, schwerer und unbehandelter Hypertonie, Aneurysmen, Hyperthyreose, unausgeglichener diabetischer Stoffwechsellage sowie Phäochromozytom.
Eine Therapie mit Beta2-Agonisten kann eine möglicherweise schwerwiegende Hypokaliämie verursachen. Besondere Vorsicht ist bei schwerem Asthma angezeigt, weil dieser Effekt durch gleichzeitige Behandlung mit Xanthinderivaten, Glucocorticosteroiden und Diuretika verstärkt werden kann. Zusätzlich kann eine Hypoxie die Effekte einer Hypokaliämie auf den Herzrhythmus verstärken. Hypokaliämie kann bei Patienten, die Digoxin erhalten, zu einer erhöhten Anfälligkeit für Arrythmien führen.
In solchen Situationen sollte der Serumkaliumspiegel kontrolliert werden.
Kardiovaskuläre Nebenwirkungen können bei Sympathomimetika, zu denen auch Berotec zählt, beobachtet werden. Es gibt Hinweise nach Markteinführung sowie aus Veröffentlichungen für ein Auftreten einer mit Beta-Agonisten assoziierten Myokardischämie. Mit Berotec behandelte Patienten, die an einer schweren Grunderkrankung des Herzens leiden (z. B. ischämische Herzerkrankung, Arrhythmie oder schwere Herzinsuffizienz), sollten ärztlichen Rat einholen, wenn bei ihnen Schmerzen in der Brust oder andere Anzeichen einer sich verschlechternden Herzerkrankung auftreten. Besondere Aufmerksamkeit ist bei der Beurteilung von Symptomen wie Atemnot und Schmerzen in der Brust geboten, da diese einen respiratorischen oder kardialen Ursprung haben können.
Hinweise:
Da der Blutzuckerspiegel bei Applikation hoher Dosen ansteigen kann, ist bei Patienten mit Diabetes mellitus eine engmaschige Blutzuckerkontrolle erforderlich.
Da keine Daten zur Pharmakokinetik von Fenoterol bei Leber- und Niereninsuffizienz vorliegen, soll bei diesen Patienten die Anwendung besonders abgewogen werden.
Enthält Ethanol 99 % (Alkohol; weniger als 100 mg pro Einzelgabe).
Die Anwendung von Berotec N 100 pg Dosier-Aerosol kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei gleichzeitiger Therapie mit anderen Beta2-Adrenergika, Methylxanthinen (z. B. Theophyllin), Anticholinergika und Kortikosteroiden kann die Wirkung von Berotec N 100 pg Dosier-Aerosol erhöht werden. Wenn Berotec N 100 pg Dosier-Aerosol mit anderen Beta2-Adrenergika, Methylxanthinen (z. B. Theophyllin) oder systemisch verfügbaren Anticholinergika (wie z. B. Pirenzepin-haltige Präparate) angewendet wird, können verstärkt Nebenwirkungen auftreten (z. B. Tachykardie, Arrhythmie).
Die gleichzeitige Anwendung von Berotec N 100 pg Dosier-Aerosol und Beta-Rezeptorenblockern führt zu einer gegenseitigen Wirkungsabschwächung, wobei die Gabe von Beta-Rezeptorenblockern bei Patienten mit Asthma bronchiale das Risiko der Auslösung schwerer Bronchospasmen birgt.
Weiterhin kann die Blutzucker senkende Wirkung von Antidiabetika bei Behandlung mit Berotec N 100 pg Dosier-Aerosol vermindert werden. Hiermit ist jedoch im Allgemeinen erst bei höheren Dosen zu rechnen, wie sie bei systemischer Gabe (als Tabletten oder Injektion/ Infusion) üblich sind.
Bei der Anwendung halogenierter Anästhetika, wie z. B. Halothan, Methoxyfluran oder Enfluran, muss bei Patienten, die mit Berotec N 100 pg Dosier-Aerosol behandelt werden, mit einem erhöhten Risiko für schwere Herzrhythmusstörungen und Blutdrucksenkung gerechnet werden (siehe Hinweis unten).
Die gleichzeitige Anwendung von Berotec N 100 pg Dosier-Aerosol und Monoaminoxidasehemmern oder trizyklischen Antidepressiva kann eine verstärkte Wirkung von Fenoterol auf das Herz-KreislaufSystem auslösen.
Da unter hoch dosierter Anwendung eine Hypokaliämie auftreten kann, ist in diesem Fall eine Kontrolle der Elektrolyte erforderlich. Dies gilt insbesondere bei gleichzeitiger Verabreichung von Diuretika und Digitalisglykosiden.
Hinweis:
Wenn eine Narkose unter Verwendung von halogenierten Anästhetika geplant ist, sollte darauf geachtet werden, dass Fenoterol innerhalb von mindestens 6 Stunden vor Narkosebeginn möglichst nicht mehr angewendet wird.
4.6 Fertilität, Schwangerschaft und Stillzeit
Fenoterol passiert die Plazentaschranke.
Obwohl im Tierversuch keine den Embryo schädigenden Wirkungen festgestellt werden konnten, sollte Fenoterol besonders während der ersten 3 Monate der Schwangerschaft und während der Stillperiode nur nach sorgfältiger Nutzen-Risiko-Abwägung inhaliert werden.
Es ist unbekannt, ob Fenoterol unerwünschte Wirkungen auf das Neugeborene hat. Da Fenoterol in die Muttermilch übergeht, wird die Anwendung in der Stillzeit nur nach sorgfältiger Nutzen-RisikoAbwägung empfohlen.
Eine tokolytische Wirkung bei inhalativer Anwendung ist unwahrscheinlich, obwohl sie nicht völlig ausgeschlossen werden kann.
Klinische Daten zur Fertilität liegen für Fenoterol nicht vor. Nichtklinische Studien, die mit Fenoterol durchgeführt wurden, zeigten keine unerwünschten Effekte auf die Fertilität (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Jedoch sollte den Patienten mitgeteilt werden, dass bei ihnen während der Behandlung mit Berotec N 100 pg Dosier-Aerosol Nebenwirkungen wie z. B. Schwindel auftreten können und sie daher beim Autofahren oder beim Bedienen von Maschinen vorsichtig sein sollten. Beim Auftreten solcher Nebenwirkungen sollten die Patienten potenziell gefährliche Tätigkeiten wie zum Beispiel Autofahren oder das Bedienen von Maschinen vermeiden.
4.8 Nebenwirkungen
Wie alle Arzneimittel kann Berotec N 100 pg Dosier-Aerosol Nebenwirkungen haben.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Störungen des Immunsystems:
Nicht bekannt: Überempfindlichkeitsreaktionen (z. B. Juckreiz, Exanthem, Purpura,
Thrombopenie, Gesichtsödem)
Stoffwechsel und Ernährungsstörungen:
Gelegentlich: Hypokaliämie
Selten: Hyperglykämie
Die Hypokaliämie kann besonders ausgeprägt sein bei Patienten mit schwerem Asthma bronchiale, die gleichzeitig mit Xanthinderivaten (z. B. Theophyllin), Kortikosteroiden und/oder Diuretika behandelt werden. Zusätzlich kann eine Hypoxie die Auswirkungen der Hypokaliämie auf den Herzrhythmus beeinflussen. In diesen Fällen empfehlen sich Kontrollen des Serumkaliums.
Anstieg des Blutspiegels von Insulin, freien Fettsäuren, Glycerol und Ketonkörpern wurde beobachtet.
Psychische Störungen:
Gelegentlich: psychische Veränderungen, Erregung
Nicht bekannt: Nervosität
Die psychischen Veränderungen äußern sich in Übererregbarkeit, hyperaktiven Verhaltensauffälligkeiten, Schlafstörungen sowie Halluzinationen. Diese Beobachtungen wurden überwiegend bei Kindern im Alter bis zu 12 Jahren gemacht.
Störungen des Nervensystems:
Häufig: Tremor, Schwindel
Nicht bekannt: Kopfschmerzen
Funktionsstörungen des Herzens:
Gelegentlich: Arrhythmien, pektanginöse Beschwerden, ventrikuläre Extrasystolen
Nicht bekannt: Tachykardie, Herzklopfen, Myokardischämie
Respiratorische Störungen:
Häufig: Husten
Gelegentlich: paradoxe Bronchospasmen
Nicht bekannt: lokale Irritationen
Beim Auftreten von paradoxen Bronchospasmen soll die Therapie sofort abgesetzt werden.
Gastrointestinale Beschwerden:
Häufig: Übelkeit
Gelegentlich: Erbrechen, Sodbrennen
Störungen der Haut:
Häufig: Schwitzen
Gelegentlich: Juckreiz
Nicht bekannt: Urticaria, Hautreaktionen wie Exanthem
Störungen des Muskel- und Bewegungsapparates:
Gelegentlich: Muskelkrämpfe
Nicht bekannt: Muskelschwäche, Myalgie
Störungen der Niere und des Urogenitaltraktes:
Gelegentlich: Miktionsstörungen
Sonstige Beobachtungen:
Gelegentlich: Blutdrucksenkungen oder -Steigerungen
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte,
Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn,
Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
a) Symptome einer Überdosierung
Je nach Grad einer Überdosierung können folgende - für Beta2-Adrenergika bekannte -Nebenwirkungen auftreten:
Gesichtsrötung, Benommenheit, Kopfschmerzen, Tachykardie, Palpitationen, Arrhythmien, Hypotonie bis hin zum Schock, Blutdrucksteigerung, Ruhelosigkeit, Brustschmerzen, Erregung, eventuell Extrasystolen und heftiger Tremor insbesondere der Finger, aber auch am ganzen Körper.
Es kann zur Hyperglykämie kommen.
Vor allem nach oraler Intoxikation können gastrointestinale Beschwerden einschließlich Übelkeit und Erbrechen auftreten.
Bei Überdosierung von Fenoterol kann es verstärkt zu Verschiebungen von Kalium in den Intrazellularraum mit der Folge einer Hypokaliämie sowie zu Hyperglykämie, Hyperlipidämie und Hyperketonämie kommen.
Darüber hinaus wurde eine metabolische Azidose beobachtet, wenn Fenoterol in höherer als für die zugelassenen Indikationen empfohlener Dosierung angewendet wurde.
b) Therapiemaßnahmen bei Überdosierung
Die Behandlung nach beta-sympathomimetischer Überdosierung erfolgt hauptsächlich symptomatisch. Die Wirkungen von Fenoterol können durch Beta-Rezeptorenblocker antagonisiert werden. Hierbei ist jedoch der Gefahr der Auslösung eines schweren Bronchospasmus bei Patienten mit Asthma bronchiale Rechnung zu tragen (vorsichtige Titration). Dies gilt auch für so genannte kardioselektive Beta-Rezeptorenblocker.
Zur kardialen Überwachung ist EKG-Monitoring angezeigt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mittel bei obstruktiven Atemwegserkrankungen, selektive
Beta2-Adrenorezeptor-Agonisten
ATC-Code: R03AC04
Berotec ist ein effektiver Bronchodilatator für die Anwendung bei akutem Asthma und bei anderen Zuständen mit reversibler Atemwegsverengung wie zum Beispiel chronische obstruktive Bronchitits mit oder ohne Lungenemphysem.
Nach oraler Gabe wirkt Berotec innerhalb von ein paar Minuten mit einer Wirkdauer von bis zu 8 Stunden.
Nach Inhalation von Fenoterol tritt die Bronchodilatation bei obstruktiven Lungenerkrankungen innerhalb von ein paar Minuten ein. Die bronchialerweiternde Wirkung dauert 3 - 5 Stunden an.
Fenoterol ist ein direkt wirkendes Beta-Sympathomimetikum mit überwiegender Wirkung auf Beta2-Rezeptoren. Eine Stimulation der Beta1-Rezeptoren kommt erst bei höheren Dosen (z. B. wie sie zur Tokolyse verabreicht werden) zum Ausdruck.
Fenoterol verursacht eine Erschlaffung der glatten Muskulatur in den Bronchien und Blutgefäßen. Die Relaxation der glatten Muskulatur ist dosisabhängig. Sie soll über Effekte auf das Adenylatcyclase-System in der Weise ausgelöst werden, dass die Bindung des Beta-Agonisten an seinen Rezeptor, vermittelt durch Guanosin-bindendes Protein, zur Aktivierung der Adenylatcyclase führt. Erhöhtes intrazelluläres cAMP bewirkt dann über Proteinphosphorylierung (Proteinkinase A) die Relaxation der glatten Muskulatur. In hohen Dosen hat Fenoterol auch einen Effekt auf die quer gestreifte Muskulatur (Tremor). Ferner hemmt Fenoterol die Mediatorfreisetzung aus den Mastzellen. Eine Steigerung der mukoziliären Clearance ist nach Verabreichung von Fenoterol (0,6 mg) nachweisbar.
Die Wirkung von Fenoterol am Herzen ist positiv inotrop und chronotrop (direkt und/oder reflektorisch). Einfluss auf den Stoffwechsel von Lipiden und Zucker (Lipolyse, Glykogenolyse und Hyperglykämie) sowie relative Hypokaliämie durch Erhöhung der K+-Aufnahme in die Skelettmuskulatur sind pharmakologische Effekte, die erst unter höheren Dosen zur Geltung kommen. Wie bei anderen beta-adrenergen Wirkstoffen sind Verlängerungen der QT-Zeit berichtet worden. Für Fenoterol Dosier-Aerosole waren diese schwach ausgeprägt und wurden bei höheren als den empfohlenen Dosen beobachtet. Die Bedeutung für den Patienten ist nicht bewiesen.
Auf Grund der hohen Beta2-Rezeptorendichte des Myometriums kann Fenoterol auch die Uterusmuskulatur relaxieren. Diese Wirkung ist besonders ausgeprägt am schwangeren Uterus. Die Dosierung von Fenoterol zur Tokolyse liegt wesentlich höher als zur Bronchospasmolyse. Aus diesem Grund sind auch die Nebenwirkungsmöglichkeiten größer.
5.2 Pharmakokinetische Eigenschaften
Die Pharmakokinetik von Fenoterol wurde nach intravenöser, inhalativer und oraler Gabe untersucht.
Der therapeutische Effekt von Berotec wird durch eine lokale Wirkung in den Atemwegen erzielt.
Eine Korrelation der Blutspiegel mit der pharmakodynamischen Zeitwirkungskurve nach Inhalation liegt nicht vor.
Nach Inhalation gelangen abhängig von der Inhalationstechnik und dem angewandtem System etwa 10 - 30 % des Fenoterols in die tieferen Abschnitte der Atemwege, während sich der Rest im oberen Abschnitt des Atemtraktes und im Mund absetzt und anschließend verschluckt wird.
Die absolute Bioverfügbarkeit von Fenoterol nach Inhalation von Berotec N 100 qg Dosier-Aerosol beträgt 18,7 %.
Nach Inhalation wurde eine Resorptionsrate von 13 % der Dosis ermittelt, von der im biphasischen Profil 30 % rasch mit einer Halbwertszeit von 11 Minuten und 70 % langsam mit einer Halbwertszeit von 120 Minuten resorbiert wurden.
Fenoterol wird nach oraler Verabreichung zu ca. 60 % resorbiert. Der resorbierte Anteil unterliegt einem intensiven First-pass-Metabolismus, was zu einer oralen Bioverfügbarkeit von ca. 1,5 % führt. Daher ist der Beitrag des verschluckten Anteils des Wirkstoffes an der Plasmakonzentration nach Inhalation gering. Maximale Plasmakonzentrationen werden nach 60 - 120 Minuten erreicht.
Fenoterol wird im Körper weit verteilt. Das Verteilungsvolumen im Steady State nach intravenöser Verabreichung (Vss) beträgt 1,9 - 2,7 l/kg.
Die Disposition von Fenoterol im Plasma nach intravenöser Verabreichung wird durch ein 3-Kompartiment-Modell adäquat beschrieben. Die Halbwertszeiten betragen ta = 0,42 Min., tß = 14,3 Min. und tY = 3,2 Std. Die Plasmaproteinbindung beträgt 40 - 55 %.
Fenoterol wird beim Menschen durch Sulfatierung und Glukuronidierung extensiv metabolisiert. Nach oraler Verabreichung wird Fenoterol vorwiegend durch Sulfatierung metabolisiert. Die metabolische Inaktivierung der Muttersubstanz beginnt bereits in der Darmwand.
Die Biotransformation einschließlich biliärer Ausscheidung macht das Hauptgewicht (ca. 85 %) der durchschnittlichen totalen Clearance, welche 1,1 - 1,8 l/min nach intravenöser Verabreichung beträgt, aus. Die renale Clearance von Fenoterol (0,27 l/min) entspricht ca. 15 % der durchschnittlichen totalen Clearance einer systemisch verfügbaren Dosis. Unter Berücksichtigung des Anteils an Arzneimittel, der an Plasmaproteine gebunden ist, weist die Größe der renalen Clearance auf tubuläre Sekretion von Fenoterol zusätzlich zu glomerulärer Filtration hin.
Die in den Urin ausgeschiedene totale Radioaktivität nach oraler und intravenöser Verabreichung beträgt ca. 39 % bzw. 65 % der Dosis, die in den Stuhl ausgeschiedene totale Radioaktivität 40,2 % bzw. 14,8 % der Dosis innerhalb von 48 Stunden. 0,38 % der Dosis wird nach oraler Verabreichung als Muttersubstanz im Urin ausgeschieden, während 15 % nach intravenöser Verabreichung unverändert ausgeschieden werden. Nach Inhalation mit einem Dosier-Aerosol werden 2 % der Dosis innerhalb von 24 Stunden unverändert renal ausgeschieden.
Fenoterol kann in nicht metabolisiertem Zustand die Plazenta passieren.
Sympathomimetische Effekte beim Fetus können auftreten. Nach Langzeitinfusionen wurden im fetalen Blut Fenoterolspiegel bis zu 50 % der mütterlichen Fenoterolkonzentration gemessen. Beim Frühgeborenen ist die Fenoterol-Elimination gegenüber der Ausscheidung beim Erwachsenen wesentlich verzögert.
Fenoterol geht in die Muttermilch über.
Ausreichende Daten zur Auswirkung bei diabetischer Stoffwechsellage liegen nicht vor.
Bei Neugeborenen und Kleinkindern bis ca. 20 Monate kann die Wirkung verringert sein oder fehlen.
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Untersuchungen am Tier zur akuten Toxizität haben keine besondere Empfindlichkeit ergeben (s. a. Abschnitt 4.9).
b) Chronische Toxizität
Untersuchungen zur chronischen Toxizität wurden an verschiedenen Tierspezies (Ratte, Maus, Hund, Kaninchen) bei unterschiedlicher Applikationsart durchgeführt. Bei extrem hohen bzw. toxischen Dosen wurden Herzmuskelnekrosen nachgewiesen.
c) Mutagenes und tumorerzeugendes Potenzial
Tests zur Mutagenität von Fenoterol in vitro und in vivo verliefen negativ.
Unter Langzeitgabe von sehr hohen Dosen an Ratten und Mäusen kommt es wie auch bei anderen Beta2-Sympathomimetika zur Ausbildung von gutartigen Leiomyomen unterschiedlicher mitotischer Aktivität im Mesovarium und Uterus. Nach vorherrschender Meinung ist eine Übertragbarkeit auf den Menschen jedoch nicht gegeben.
d) Reproduktionstoxizität
Mit oraler, intravenöser oder inhalativer Applikation zeigten sich beim Tier außer bei extrem hohen Dosierungen keine teratogenen Schädigungen. Andere embryotoxische Wirkungen wurden bei Ratten ab einer oralen Dosis von 7 mg/kg/Tag beobachtet. Bei Mäusen wurden bis zu oralen Dosen von 38,5 mg/kg/Tag keine embryotoxischen oder teratogenen Veränderungen festgestellt. Wehen hemmende Effekte traten bei der Ratte ab einer Dosis von 1,75 mg/kg/Tag auf. Fertilität und Aufzucht der Jungtiere waren nicht beeinträchtigt.
Die Erfahrungen beim Menschen mit der Anwendung während der Schwangerschaft beschränken sich auf das zweite und das letzte Schwangerschaftsdrittel. Nachteilige Wirkungen für den Fötus und das Neugeborene sind bisher nicht beschrieben.
e) Lokale Verträglichkeit
Die durchgeführten Toxizitätsstudien mit inhalativer Verabreichung ergaben, dass Berotec lokal im Respirationstrakt gut vertragen wurde.
Darüber hinaus wurden Berotec-Lösungen in Konzentrationen von 0,001 - 0,1 % intraarteriell, intravenös, intraokular und intranasal auf lokale Verträglichkeit getestet. In allen Fällen wurden die geprüften Lösungen gut toleriert. In einem in-vitro-Test hatte Fenoterolhydrobromid keinen Effekt auf Blutkoagulation, Hämolyse oder Erythrozytenresistenz.
Lediglich bei einer intraokularen, nicht jedoch bei epikutaner Applikation von Fenoterol (20 mg) zeigte sich eine geringfügige Schleimhautreizung.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Norfluran, wasserfreie Citronensäure (Ph. Eur.), Ethanol 99 % (Alkohol), gereinigtes Wasser
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit 3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Den Behälter nicht gewaltsam öffnen, vor direkter Sonneneinstrahlung, Erwärmung über + 50 °C und Frost schützen.
6.5 Art und Inhalt des Behältnisses
Unter Druck stehende Lösung (10 ml = 200 Aerosolstöße) in einem Behälter aus rostfreiem Stahl mit Dosierventil, mit abnehmbarem Mundrohr aus Kunststoff (PP) und hellblauer Verschlusskappe aus Kunststoff.
Originalpackung mit 10 ml Lösung Originalpackung mit 3 x 10 ml Lösung Klinikpackung mit 30 x 10 ml Lösung
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Der Aerosolbehälter ist nicht durchsichtig. Daher kann man nicht erkennen, wann dieser leer ist. Das Dosier-Aerosol enthält 200 Hübe. Nachdem diese verbraucht sind, kann im Dosier-Aerosol noch eine geringe Menge an Flüssigkeit enthalten sein. Das Dosier-Aerosol sollte dennoch ersetzt werden, da Sie ansonsten eventuell nicht die richtige Menge an Arzneimittel zur Behandlung erhalten.
Der ungefähre Füllungsgrad des Dosier-Aerosols kann folgendermaßen überprüft werden: Ziehen Sie den Aerosolbehälter aus dem Mundrohr und legen Sie ihn in ein mit Wasser gefülltes Gefäß. Die Lage des Aerosolbehälters gibt einen Hinweis zum ungefähren Füllungsgrad.
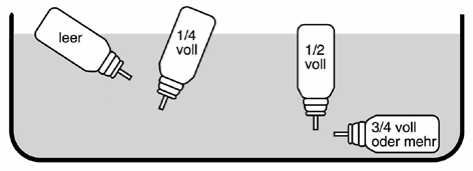
Die verschiedenen Lagen des Aerosolbehälters sollen den ungefähren Füllungsgrad wiedergeben.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Str. 173
55216 Ingelheim am Rhein
Telefon: 0 800 / 77 90 900
Telefax: 0 61 32 / 72 99 99
E-Mail: info@boehringer-ingelheim.de
8. ZULASSUNGSNUMMER
8863.00.00
9. DATUM DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 15.12.1988
Datum der letzten Verlängerung der Zulassung: 26.01.2009
10. STAND DER INFORMATION
Februar 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 13 von 13