Betahistindihydrochlorid Hennig 24 Mg Tabletten
FACHINFORMATION, ZUSAMMENFASSUNG DER MERKMALE DES
ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
Betahistindihydrochlorid Hennig 24 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Tablette enthält 24 mg Betahistindihydrochlorid.
Sonstiger Bestandteil mit bekannter Wirkung: 142,5 mg Lactose.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette
Weiße, flache, runde, abgekantete Tabletten mit äußeren Kerben und Bruchrillen auf beiden Seiten. Die Tablette kann in gleiche Dosen geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Betahistin wird angewendet zur Behandlung des Meniere'schen Symptomenkomplexes, dessen Symptome Schwindel (oft in Verbindung mit Übelkeit und/oder Erbrechen), Tinnitus und Hörverlust beinhalten können.
4.2 Dosierung und Art der Anwendung
Dosierung
Die übliche Tagesdosis beträgt 24-48 mg Betahistindihydrochlorid, aufgeteilt in 1-2 gleiche Einzeldosen.
Art der Anwendung
Die Tabletten sind unzerkaut mit ausreichend Flüssigkeit während oder nach der Mahlzeiten einzunehmen.
Die Anwendungsdauer richtet sich nach dem Krankheitsbild und -verlauf. In der Regel handelt es sich um eine Langzeitbehandlung.
Kinder und Jugendliche
Betahistin wird aufgrund des Fehlens ausreichender Daten zur Unbedenklichkeit und Wirksamkeit nicht empfohlen für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren.
4.3 Gegenanzeigen
Betahistin darf nicht angewendet werden bei:
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
• Phaeochromocytom,
• Schwangerschaft und Stillzeit (siehe Abschnitt 4.6).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Obwohl Untersuchungen an gesunden Personen ergaben, dass Betahistindihydrochlorid, der Wirkstoff von Betahistindihydrochlorid Hennig 24 mg, keine Erhöhung der Magensäureproduktion hervorrief, empfiehlt es sich Patienten mit Gastrointestinal-Ulzera in der Anamnese besonders zu beobachten.
Bei der Behandlung von Patienten mit Bronchialasthma ist Vorsicht geboten.
Bei der Verschreibung von Betahistin an Patienten mit Urtikaria, Hautausschlag oder allergischer Rhinitis ist ebenfalls Vorsicht geboten, da die Möglichkeit einer Verschlechterung der Symptome besteht.
Bei der Behandlung von Patienten mit ausgeprägter Hypotonie ist Vorsicht geboten.
Betahistin sollte nicht angewendet werden bei Patienten mit gleichzeitiger Behandlung mit Antihistaminika (siehe Abschnitt 4.5).
Dieses Arzneimittel enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Untersuchungen zu Wechselwirkungen mit anderen Arzneimitteln, die gleichzeitig zur Behandlung im unter Abschnitt 4.1 angegebenen Indikationsbereich eingesetzt werden (Vasodilatantien; Psychopharmaka, insbesondere Sedativa, Tranquilizer und Neuroleptika, Parasympathikolytika, Vitamine), liegen nicht vor.
Betahistin sollte nicht gleichzeitig mit einem Antihistaminikum eingenommen werden, da sich aus Ergebnissen tierexperimenteller Untersuchungen ergibt, dass sich die Wirkungen gegenseitig abschwächen können.
Hinweis:
Wird Betahistin im Anschluss an die Behandlung mit Antihistaminika gegeben, ist zu beachten, dass die meisten Antihistaminika eine sedierende Wirkung haben und bei plötzlichem Absetzen oft unangenehme Entzugserscheinungen wie Schlafstörungen und Unruhe auftreten. Daher sollte die Behandlung mit einem Antihistaminikum langsam ausschleichend über etwa 6 Tage beendet werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Betahistin ist in der Schwangerschaft und während der Stillzeit kontraindiziert (siehe Abschnitt 4.3), da keine ausreichenden Untersuchungen am Tier und keine Erfahrungen beim Menschen mit der Anwendung in der Schwangerschaft und während der Stillzeit vorliegen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Langzeitstudien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Es wurden relativ wenige Nebenwirkungen beobachtet. Diese sind im Folgenden sortiert nach Organklasse und Häufigkeit aufgelistet.
Die Häufigkeiten werden wie folgt definiert:
Sehr häufig (>1/10)
Häufig (>1/100, <1/10)
Gelegentlich (>1/1.000, <1/100)
Selten (>1/10.000, <1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Immunsystems Nicht bekannt: Anaphylaxis
Erkrankungen des Nervensystems Selten: Kopfdruck
Nicht bekannt: Kopfschmerzen und gelegentlich Benommenheit Herzerkrankungen
Selten: Palpitation, Brustbeklemmungen
Erkrankungen der Atemwege, des Brustraums und Mediastinums Selten: Ein bestehendes Bronchialasthma kann verschlechtert werden.
Erkrankungen des Gastrointestinaltrakts
Selten: Brechreiz, Sodbrennen, Magendrücken und -schmerzen, Blähungen Nicht bekannt: Übelkeit, Erbrechen
Erkrankungen der Haut und des Unterhautzellgewebes Sehr selten: temporär Urtikaria, Hautausschlag und Pruritus
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Selten: Hitzegefühl
Hinweis:
Magenunverträglichkeiten lassen sich in der Regel durch die Einnahme von Betahistindihydrochlorid Hennig 24 mg während oder nach den Mahlzeiten oder durch eine Reduzierung der Dosis vermeiden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung:
Sollte es zur Überdosierung kommen, so ist in Analogie zu Histamin mit folgender Symptomatik zu rechnen:
Kopfschmerzen, Gesichtsrötung, Schwindel, Tachykardie, Hypotonie, Bronchospasmus, Ödeme, vorwiegend an der Schleimhaut der oberen Atemwege (Quincke-Ödem).
In sehr wenigen Fällen ist über Intoxikationen berichtet worden. In den meisten dieser Fälle sind keine Intoxikationszeichen in Erscheinung getreten. Bei Dosierungen über 200 mg zeigten sich bei einigen Patienten leichte bis mäßig ausgeprägte Symptome. Bei einem Patienten sind nach der Einnahme von 728 mg Betahistin Krampfanfälle beobachtet worden. In allen Fällen waren die Patienten vollständig wiederhergestellt.
Therapiemaßnahmen bei Überdosierung:
Es gibt kein spezifisches Antidot. Neben allgemeinen Maßnahmen zur Toxinelimination (Magenspülung, Gabe von Aktivkohle) erfolgt die Behandlung symptomatisch.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: andere Mittel für das Nervensystem; Antivertiginosa, ATC-Code: N07CA01
Betahistin ist eine Verbindung aus der Gruppe der Beta-2-Pyridylalkylamine.
Betahistin ist strukturverwandt mit dem endogenen Amin Histamin.
Der präzise Wirkmechanismus von Betahistin auf biochemischer Ebene sowie seine Rezeptorenspezifität und -affinität sind bislang nicht geklärt worden.
Die Untersuchungsergebnisse aus pharmakodynamischen Tiermodellen mit Betahistin weisen überwiegend auf H1-Rezeptoren-agonistische Effekte des Wirkstoffes hin. Aufgrund tierexperimenteller Untersuchungsergebnisse wurden hinsichtlich des Wirkungsmechanismus von Betahistin auf die vestibulären Funktionen zahlreiche Hypothesen in Betracht gezogen.
5.2 Pharmakokinetische Eigenschaften
Pharmakokinetische/pharmakodynamische Zusammenhänge
Das Erkenntnismaterial zur Pharmakokinetik von Betahistin beim Menschen ist unzureichend.
Resorption
Betahistin wird nach oraler Gabe schnell und vollständig resorbiert.
Biotransformation und Elimination
Es wird innerhalb von 24 Stunden fast vollständig als 2-Pyridyl-Essigsäure mit dem Urin ausgeschieden. Reines Betahistin konnte bisher im menschlichen Organismus nicht nachgewiesen werden.
Bioverfügbarkeit
Im Jahr 2009 wurde mit Betahistindihydrochlorid Hennig 24 mg 24 mg eine randomisierte Einzeldosis-Bioäquivalenzstudie an 36 Probanden durchgeführt. Test- und Referenzmedikation wurden nach einem leichten Frühstück eingenommen. Primärer Zielparameter war die Konzentration des Metaboliten 2-Pyridyl-Essigsäure im Plasma (siehe nachstehende Abbildung und Tabelle).
Linearität/Nicht-Linearität
Die Ergebnisse bestätigen die Bioäquivalenz von Betahistindihydrochlorid Hennig 24 mg zum Referenzpräparat (93.4% Konfidenzintervall) innerhalb enger Signifikanzgrenzen für die Fläche unter der Kurve (AUC, 90%-110%) und innerhalb konventioneller Grenzen bei der maximalen Plasmakonzentration (Cmax, 80 und 125%).
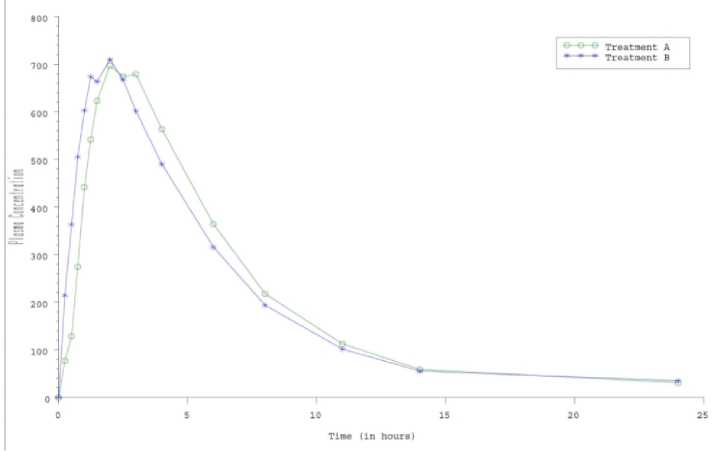
Abb. 1: Mittelwerte der Plasmakonzentration von 2-Pyridyl-Essigsäure nach Einmalgabe einer Tablette der Medikation A (Betahistindihydrochlorid Hennig 24 mg Tabletten) bzw. Medikation B (Referenzpräparat Betahistindihydrochlorid 24 mg Tabletten).
|
Parameter |
Test (A)* |
Referenz (B)* |
Test / Referenz** |
|
Maximale Plasmakonzentration |
818.0 |
875.9 |
0.93 |
|
(Cmax) [ng/ml] |
(± 352.3) |
(± 352.7) |
(0.87-0.99) |
|
Fläche unter der Kurve |
4557.3 |
4375.4 |
1.00 |
|
(AUCo-®) [ng/ml.h] |
(± 2759.0) |
(±2091.1) |
(0.95- 1.07) |
|
Eliminationshalbwertszeit |
3.15 |
3.10 |
1.02 |
|
(t1/2) [h] |
(± 0.78) |
(± 0.78) |
(0.96- 1.08) |
* Arithmetischer Mittelwert (± Standardabweichung), ** Punktschätzung (93.4% Konfidenzintervall) Tab. 1: Zusammenfassende Statistik der primären pharmakokinetischen Parameter.
5.3 Präklinische Daten zur Sicherheit
In Studien zur chronischen Toxizität an Hunden über eine Dauer von 6 Monaten und an Ratten über eine Dauer von 18 Monaten zeigten sich in Dosierungen von 2,5 bis 120 mg/kg keine klinisch relevanten schädigenden Befunde. Betahistin weist kein mutagenes Potential auf und in Ratten gibt es keine Hinweise auf ein karzinogenes Potential. Versuche in schwangeren Kaninchen zeigten keine teratogenen Effekte.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat
Maisstärke
mikrokristalline Cellulose Citronensäure Povidon K 25 Crospovidon Typ A hydriertes Pflanzenöl
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 25°C lagern.
6.5 Art und Inhalt des Behältnisses
Die Tabletten sind in PVC/PE/PVDC-Aluminium Blister verpackt.
Die Packungen enthalten 20, 24, 30, 48, 50, 60, 96 und 100 Tabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Hennig Arzneimittel GmbH & Co. KG Liebigstraße 1-2 65439 Flörsheim am Main Deutschland
Tel.+49 (0) 61 45 -508 0 Fax: +49 (0) 61 45 -508 140 E-Mail: info@hennig-am.de
8. ZULASSUN GSNUMMER(N)
. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung:
10. STAND DER INFORMATION
06/2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 6 von 6