Betavert N 8 Mg Tabletten
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Betavert N 8 mg T abletten Betavert N 16 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Betavert N 8 mg Tabletten:
1 Tablette enthält 8 mg Betahistindihydrochlorid
Sonstiger Bestandteil mit bekannter Wirkung: 47,5 mg Lactose
Betavert N 16 mg Tabletten:
1 Tablette enthält 16 mg Betahistindihydrochlorid Sonstiger Bestandteil mit bekannter Wirkung: 95,0 mg Lactose
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette
Betavert N 8 mg Tabletten: Weiße, runde Tabletten
|
Betavert N 16 mg Tabletten. | ||
|
Weiße, flache, runde, abgekantete Tabletten mit äußeren Kerben und Bruchrille auf | ||
|
beiden Seiten. | ||
Die Tablette kann in gleiche Dosen geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Betahistin wird angewendet zur Behandlung des Meniere'schen Symptomenkomplexes, dessen Symptome Schwindel (oft in Verbindung mit Übelkeit und/oder Erbrechen), Tinnitus und Hörverlust beinhalten können.
4.2 Dosierung undArt und der Anwendung
Dosierung
Die übliche Tagesdosis beträgt 24-48 mg Betahistindihydrochlorid, aufgeteilt in 3 gleiche Einzeldosen.
Art der Anwendung
Die Tabletten sind unzerkaut mit ausreichend Flüssigkeit während oder nach der Mahlzeiten einzunehmen.
Die Anwendungsdauer richtet sich nach dem Krankheitsbild und -verlauf. In der Regel handelt es sich um eine Langzeitbehandlung.
Kinder und Jugendliche
Betavert N wird aufgrund des Fehlens ausreichender Daten zur Unbedenklichkeit und Wirksamkeit nicht empfohlen für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren.
4.3 Gegenanzeigen
Betavert N darf nicht angewendet werden bei:
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
• Phaeochromocytom,
• Schwangerschaft und Stillzeit.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Obwohl Untersuchungen an gesunden Personen ergaben, dass Betahistindihydrochlorid, der Wirkstoff von Betavert N, keine Erhöhung der Magensäureproduktion hervorrief, empfiehlt es sich Patienten mit Gastrointestinal-Ulzera in der Anamnese besonders zu beobachten.
Bei der Behandlung von Patienten mit Bronchialasthma ist Vorsicht geboten.
Bei der Verschreibung von Betahistin an Patienten mit Urtikaria, Hautausschlag oder allergischer Rhinitis ist ebenfalls Vorsicht geboten, da die Möglichkeit einer Verschlechterung der Symptome besteht.
Bei der Behandlung von Patienten mit ausgeprägter Hypotonie ist Vorsicht geboten.
Betavert N sollte nicht angewendet werden bei Patienten mit gleichzeitiger Behandlung mit Antihistaminika (siehe Abschnitt 4.5).
Dieses Arzneimittel enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lapp-Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Betavert N nicht anwenden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Untersuchungen zu Wechselwirkungen mit anderen Arzneimitteln, die gleichzeitig zur Behandlung im unter Abschnitt 4.1 angegebenen Indikationsbereich eingesetzt werden (Vasodilatantien; Psychopharmaka, insbesondere Sedativa, Tranquilizer und Neuroleptika, Parasympathikolytika, Vitamine), liegen nicht vor.
Betavert N sollte nicht gleichzeitig mit einem Antihistaminikum eingenommen werden, da sich aus Ergebnissen tierexperimenteller Untersuchungen ergibt, dass sich die Wirkungen gegenseitig abschwächen können.
Hinweis:
Wird Betahistin im Anschluss an die Behandlung mit Antihistaminika gegeben, ist zu beachten, dass die meisten Antihistaminika eine sedierende Wirkung haben und bei plötzlichem Absetzen oft unangenehme Entzugserscheinungen wie Schlafstörungen und Unruhe auftreten. Daher sollte die Behandlung mit einem Antihistaminikum langsam ausschleichend über etwa 6 Tage beendet werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Betavert N ist in der Schwangerschaft und während der Stillzeit kontraindiziert (siehe Abschnitt 4.3), da keine ausreichenden Untersuchungen am Tier und keine Erfahrungen beim Menschen mit der Anwendung in der Schwangerschaft und während der Stillzeit vorliegen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Langzeitstudien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Es wurden relativ wenige Nebenwirkungen beobachtet. Diese sind im Folgenden sortiert nach Organklasse und Häufigkeit aufgelistet.
Die Häufigkeiten werden wie folgt definiert:
Sehr häufig (>1/10)
Häufig (>1/100 bis <1/10)
Gelegentlich (>1/1.000, <1/100)
Selten (>1/10.000 bis <1/1.000)
Sehr selten (<1/10.000),
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Immunsystems Nicht bekannt: Anaphylaxis
Herzerkrankungen
Selten: Palpitation, Brustbeklemmungen
Erkrankungen des Nervensystems Selten: Kopfdruck
Nicht bekannt: Kopfschmerzen und gelegentlich Benommenheit
Erkrankungen der Atemwege, des Brustraums und Mediastinums Selten: Ein bestehendes Bronchialasthma kann verschlechtert werden.
Erkrankungen des Gastrointestinaltrakts
Selten: Würgereflex, Sodbrennen, Magendrücken und -schmerzen, Blähungen Nicht bekannt: Übelkeit, Erbrechen
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Selten: Hitzegefühl
Erkrankungen der Haut und des UnterhautzellgewebesSehr selten: temporär Urtikaria, Hautausschlag und Pruritus
Hinweis:
Magenunverträglichkeiten lassen sich in der Regel durch die Einnahme von Betavert N während oder nach den Mahlzeiten oder durch eine Reduzierung der Dosis vermeiden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung:
Sollte es zur Überdosierung kommen, so ist in Analogie zu Histamin mit folgender Symptomatik zu rechnen: Kopfschmerzen, Gesichtsrötung, Schwindel, Tachykardie, Hypotonie, Bronchospasmus, Ödeme, vorwiegend an der Schleimhaut der oberen Atemwege (Quincke-Ödem).
In sehr wenigen Fällen ist über Intoxikationen berichtet worden. In den meisten dieser Fälle sind keine Intoxikationszeichen in Erscheinung getreten. Bei Dosierungen über 200 mg zeigten sich bei einigen Patienten leichte bis mäßig ausgeprägte Symptome. Bei einem Patienten sind nach der Einnahme von 728 mg Betahistin Krampfanfälle beobachtet worden. In allen Fällen waren die Patienten vollständig wiederhergestellt.
Therapiemaßnahmen bei Überdosierung:
Es gibt kein spezifisches Antidot. Neben allgemeinen Maßnahmen zur Giftelimination (Magenspülung, Gabe von Aktivkohle) erfolgt die Behandlung symptomatisch.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antivertiginosa ATC-Code: N07CA01
Betahistin ist eine Verbindung aus der Gruppe der Beta-2-Pyridylalkylamine.
Betahistin ist strukturverwandt mit dem endogenen Amin Histamin.
Der präzise Wirkmechanismus von Betahistin auf biochemischer Ebene sowie seine Rezeptorenspezifität und -affinität sind bislang nicht geklärt worden.
Die Untersuchungsergebnisse aus pharmakodynamischen Tiermodellen mit Betahistin weisen überwiegend auf H1-Rezeptoren-agonistische Effekte des Wirkstoffes hin. Aufgrund tierexperimenteller Untersuchungsergebnisse wurden hinsichtlich des Wirkungsmechanismus von Betahistin auf die vestibulären Funktionen zahlreiche Hypothesen in Betracht gezogen.
Pharmakokinetische/pharmakodynamische Zusammenhänge Das
Erkenntnismaterial zur Pharmakokinetik von Betahistin beim Menschen ist unzureichend.
Resorption
Betahistin wird nach oraler Gabe schnell und vollständig resorbiert.
Biotransformation und Elimination
Es wird innerhalb von 24 Stunden fast vollständig als 2-Pyridyl-Essigsäure mit dem Urin ausgeschieden. Reines Betahistin konnte bisher im menschlichen Organismus nicht nachgewiesen werden.
Bioverfügbarkeit
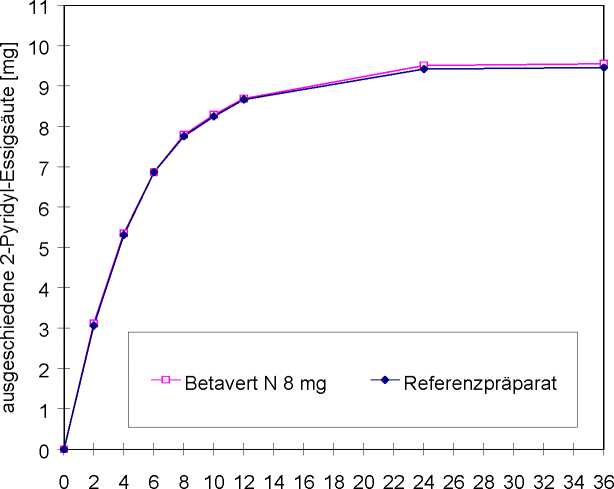
Im Jahr 1994 wurde mit Betavert N eine Bioäquivalenzstudie an 32 Probanden durchgeführt. Primärer Zielparameter war die im fraktioniert gesammelten Urin ausgeschiedene Gesamtmenge des Metaboliten 2-Pyridyl-Essigsäure.
Linearität/Nicht-Linearität
Das 90%-Konfidenzintervall der Ausscheidung des Metaboliten 2-Pyridyl-Essigsäure für alle Zeiträume und für alle Probanden lag zwischen 80 und 125%.
Verlauf der Mittelwerte der kumulierten Harnausscheidungskurve siehe Abbildung:
Zeit [h]
Abb.: Verlauf der Mittelwerte der kumulierten Harnausscheidungskurve
5.3 Präklinische Daten zur Sicherheit
In Studien zur chronischen Toxizität an Hunden über eine Dauer von 6 Monaten und an Ratten über eine Dauer von 18 Monaten zeigten sich in Dosierungen von 2,5 bis 120 mg/kg keine klinisch relevanten schädigenden Befunde. Betahistin weist kein mutagenes Potential auf und in Ratten gibt es keine Hinweise auf ein karzinogenes Potential. Versuche in schwangeren Kaninchen zeigten keine teratogenen Effekte.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Betavert N 8 mg Tabletten
Lactose-Monohydrat
Maisstärke
Mikrokristalline Cellulose Citronensäure Povidon K 25 Crospovidon Typ A Hydriertes Pflanzenöl
|
Betavert N 16 mg Tabletten | |
|
Lactose-Monohydrat | |
|
Maisstärke | |
|
Mikrokristalline Cellulose | |
|
Citronensäure Povidon K 25 | |
|
Crospovidon Typ A Hydriertes Pflanzenöl | |
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern.
6.5 Art und Inhalt des Behältnisses
Die Tabletten sind in PVC/PE/PVDC-Aluminium Blister verpackt. Die Packungen enthalten 20, 24, 30, 48, 50, 60, 96 und 100 Tabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung <und sonstige Hinweise zur Handhabung>
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
HENNIG ARZNEIMITTEL GmbH & Co. KG Liebigstraße 1-2 65439 Flörsheim am Main Deutschland
Telefon: +49 (0) 61 45-508 0 Telefax: +49 (0) 61 45-508 140 info@hennig-am.de
Betavert N 8 mg Tabletten Zul.-Nr.: 63925.00.00
Betavert N 16 mg Tabletten Zul.-Nr.: 63926.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLANGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 12.04.2007 Datum der Verlängerung der Zulassung: 17.10.2012
10. STAND DER INFORMATION
01/2014
Verkaufsabgrenzung
Verschreibungspflichtig
Page 1.3.1.1 - 8