Bioseed(R)-C Autologes 3D-Chondrozytentransplantat, 28,8 Mio. Zellen Pro Einheit
BioSeed-C
Autologes 3D-Chondrozyten-Transplantat
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
BioSeed®-C Autologes 3D-Chondrozytentransplantat, 28,8 Mio. Zellen pro Einheit.
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
2.1 Allgemeine Beschreibung
Autologes intraartikuläres Knorpeltransplantat
2.2 Qualitative und quantitative Zusammensetzung
Eine Einheit BioSeed®-C besteht aus einer rechteckigen Trägermatrix, basierend auf resorbierbarem Polyglykolsäure-Polymermaterial.
BioSeed®-C enthält interkonnektierende Hohlräume, in welche 28,8 Millionen autologe (körpereigene), in vitro expandierte Knorpelzellen gleichmäßig mittels einer gelartigen Matrix (Fibrin) eingebettet sind.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Es stehen folgende Darreichungsformen von BioSeed®-C zur Verfügung:
• 1 BioSeed®-C der Größe 30 x 20 x 1,1 mm (L x B x H) mit 28,8 Mio. autologen Chondrozyten fixiert mit Fibrinkleber
• 1 BioSeed®-C der Größe 30 x 30 x 1,1 mm (L x B x H) mit 28,8 Mio. autologen Chondrozyten fixiert mit Fibrinkleber
• 1 BioSeed®-C der Größe 50 x 20 x 1,1 mm (L x B x H) mit 28,8 Mio. autologen Chondrozyten fixiert mit Fibrinkleber
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Indikationen für eine Behandlung mit BioSeed®-C sind traumatische und fokale chondrale Defekte (Grad III bis IV nach Outerbridge; < 10cm2) im Knie bei Erwachsenen. Der Nachweis der Wirksamkeit basiert auf klinischen Anwendungsbeobachtungen.
4.2 Dosierung und Art der Anwendung
BioSeed®-C ist von einem einschlägig qualifizierten Chirurgen anzuwenden und seine Anwendung ist auf Krankenhäuser beschränkt. BioSeed®-C ist
ausschließlich für die autologe Anwendung bestimmt. Seine Anwendung sollte in Verbindung mit einem vorbereitenden Debridement (Entfernen des gesamten defekten Knorpelgewebes ohne Verletzung der Knochenlamelle) und eine Vermessung der Defektzone erfolgen. Tiefgreifende knöcherne Läsionen benötigen ggf. vor einer Transplantation eine Spongiosaplastik. Anschließend wird BioSeed®-C auf die bestimmte Defektgröße zugeschnitten und mit einer entsprechenden Fixationsmethode (Knorpelnaht, transossäre Fixierung, resorbierbare Nägel oder Fibrinkleber) befestigt. Die Anwendung von BioSeed®-C erfordert die Einhaltung eines post-operativen
Rehabilitationsprogrammes.
Dosierung
Die zu verabreichende Menge an BioSeed®-C richtet sich nach der Größe des Knorpeldefekts (Fläche in cm2). Jedes BioSeed®-C enthält eine einzelne Behandlungsdosis mit einer ausreichenden Zellzahl zur Behandlung der Läsion mit definierter Größe. Die eingesetzte Wirkstoffmenge beträgt 28,8 Millionen Zellen pro Transplantat, woraus Dosierungen von 2,9-4,8 Mio. Zellen pro cm2 je nach verwendeter Transplantatgröße resultieren.
Ältere Patienten
Die vorhandenen Daten bei Patienten über 60 Jahre sind begrenzt.
Kinder und Jugendliche
Die Unbedenklichkeit und Wirksamkeit bei Kindern und Jugendlichen (unter 18 Jahren) ist nicht nachgewiesen. BioSeed®-C darf daher bei Kindern und Jugendlichen unter 18 Jahren nicht angewendet werden.
Art der Anwendung
Voraussetzung für den Erfolg der Methode ist eine eindeutige Indikationsstellung. Diese ist nur durch eine Arthroskopie möglich.
BioSeed®-C ist ausschließlich für die Anwendung bei der autologen Knorpelrevision bestimmt und wird bei Patienten im Rahmen einer autologen Matrixgestützten Chondrozytenimplantation angewendet. Die Implantation von BioSeed®-C ist unter sterilen Bedingungen im Rahmen einer Arthrotomie oder Arthroskopie vorzunehmen und erfordert die Vorbereitung der Defektzone, das Zuschneiden von BioSeed®-C auf die Defektgröße und die Fixierung von BioSeed®-C.
Der Transplantation sollte entsprechend ärztlicher Empfehlungen (siehe Abschnitt 4.4) eine angemessene Rehabilitation von einer etwa einjährigen Dauer folgen.
Anweisungen zur Vorbereitung und Handhabung von BioSeed®-C sowie technische Einzelheiten zu den Verfahren in Zusammenhang mit dieser Transplantationstechnik sind in Abschnitt 6.6 beschrieben.
4.3 Gegenanzeigen
BioSeed®-C ist kontraindiziert bei:
• fortgeschrittener Osteoarthrose im betroffenen Gelenk (Grad III und IV entsprechend Kellgren und Lawrence)
• „kissing lesions" größer als ICRS Grad II
• aktive Infektionen mit Hepatitis B, C oder HIV-Infektion
• Patienten mit nicht vollständig geschlossener Wachstumsfuge
• Patienten unter 18 Jahren
• aktueller oder aus der Anamnese bekannter allergisch bedingter Thrombozytopenie (Typ II) auf Heparin
• bekannter Überempfindlichkeit gegen Rindereiweiß, Penicillin, Gentamycin, Amphotericin B oder einen Bestandteil der Präparate: Dem Endprodukt werden keine Antibiotika zugesetzt. Die verwendeten Kulturmedien enthalten jedoch zu Beginn Penicillin, Amphotericin B und Gentamycin. Der Gehalt geringer Spuren von Penicillin und Amphotericin B sowie sehr geringer Spuren von Gentamycin im Produkt ist daher möglich.
• metabolischen, inflammatorischen, neoplastischen oder immunologischen Erkrankungen
• Patienten mit komplexer Knieinstabilität. Diese sind im Vorfeld abzuklären bzw. einzustellen.
• Patienten, die kein autologes Gewebe und Blut bereitstellen
• Patienten, die nicht mit der Untersuchung ihres Blutserums einverstanden sind
• Patienten, die nicht mit der Speicherung
personenbezogener Daten während der Herstellung der/des Transplantate/s
einverstanden sind
• Patienten, bei denen derzeit eine virale Infektion bekannt ist
• Patienten, bei denen derzeit eine Syphiliserkrankung (Treponema pal.) bekannt ist
• Patienten, bei denen eine akute oder chronisch persistierende bakterielle Infektion, wie Brucellose, Fleckfieber und andere Rickettsiosen, Lepra, Rückfallfieber, Melioidose oder Tularämie, besteht oder derzeit bekannt ist
4.4 Besondere Warnhinweise und
Vorsichtsmaßnahmen für die Anwendung
Allgemein
BioSeed®-C ist ein autologes Produkt und darf unter keinen Umständen bei anderen Patienten angewendet werden.
Warnhinweise
BioSeed®-C wird unter der Verwendung von Fibrinkleber (Tissucol Duo S oder Beriplast P Combi Set) hergestellt. Bei der Anwendung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt werden, ist die Übertragung von Infektionserkrankungen durch Übertragung von
Erregern - auch bislang unbekannter Natur - nicht völlig auszuschließen. Deshalb werden die Spender nach strengen Kriterien ausgewählt, die Plasmaspenden getestet und selektiert sowie die Plasmapools kontrolliert. Im Herstellungsprozess sind Maßnahmen zur Abtrennung und Inaktivierung von Viren enthalten. Diese Maßnahmen werden für umhüllte Viren wie z.B. HIV, HBV und HCV für wirksam erachtet. Diese Maßnahmen können bei nicht-umhüllten Viren, wie z.B. HAV und Parvovirus B19, eingeschränkt wirksam sein. Parvovirus B19-Infektionen können bei Schwangeren (fötale Infektion) und Personen mit Immundefekten oder gesteigerter Erythropoese (z.B. hämolytische Anämie) zu schweren Erkrankungen führen.
BioSeed®-C enthält Fibrinkleber. Bei wiederholter Anwendung von Fibrinkleber oder/und der Fixierung von BioSeed®-C mit Fibrinkleber sowie zusätzlicher systemischer Verabreichung von Aprotinin oder einem anderen, möglicherweise Aprotonin enthaltenen Bestandteil, kann es zum Auftreten anaphylaktischer oder anaphylaktoider Reaktionen kommen, falls keine prophylaktische Prämedikation gegeben wird. Es kann nicht ausgeschlossen werden, dass diese Reaktionen auch bei Patienten auftreten, die erstmals BioSeed®-C verabreicht bekommen. Aufgrund des möglichen Heparingehaltes von BioSeed®-C können - bedingt durch den Fibrinkleber - seltene, antikörpervermittelte schwere Thrombozytopenien (Typ II) mit Thrombozytenwerten unter 100.000 Thrombozyten/pl oder einem schnellen Abfall auf weniger als 50% des Ausgangswertes nicht ausgeschlossen werden. Bei nicht sensibilisierten Patienten beginnt der Thrombozytenabfall in der Regel 6-14 Tage nach Behandlungsbeginn, bei sensibilisierten Patienten unter Umständen innerhalb von Stunden.
Bei bestehender Überempfindlichkeit gegen Amphotericin B, Penicillin, Gentamycin, Rindereiweiß (Aprotinin) und/oder andere Bestandteile von BioSeed®-C bzw. Tissucol Duo S oder Beriplast P Combi Set kann es zu allergischen bzw. anaphylaktischen Reaktionen kommen.
Vorsichtsmaßnahmen für die Anwendung
Bei Patienten über 60 Jahren, Patienten mit Knorpeldefekten des Tibiakopfes, fortgeschrittenen arthrotischen Veränderungen, flächenhaftem Knorpelabrieb im medialen bzw. lateralen Kompartiment oder im Femoropatellargelenk, inkorrekten Beinachsen, z.B. Varus- oder Valgusanomalie und Zustand nach Meniskektomie sowie Patienten mit allergischer Diathese, insbesondere gegen Aprotinin, sowie bei Patienten, die Aprotinin bereits in der Vergangenheit erhalten haben, ist eine sorgfältige Nutzen-Risiko-Abwägung notwendig.
Bei Patienten, die unter einem Knorpelschaden im Rahmen einer Osteochondrosis dissecans leiden, sollte vor der Anwendung von BioSeed®-C eine stadiengerechte Therapie gemäß den Leitlinien der Fachgesellschaften erfolgen.
Im Vorfeld der Behandlung ist die optimale Einstellung eventuell vorhandener Stoffwechseloder Grunderkrankungen wie z.B. eines Diabetes mellitus oder einer koronaren Herzkrankheit notwendig.
Für die Zellzüchtung ist autologes Serum notwendig, das durch Eigenblutspende gewonnen wird. Bei der Eigenblutspende ist darauf zu achten, dass eventuell bestehende Grunderkrankungen kein Ausschlusskriterium darstellen (z.B. Störungen der Blutbildung, schwere Herzleistungsschwäche, ausgeprägte Hypertonie).
Bei der Biopsatentnahme bzw. bei dem Einsatz von BioSeed®-C müssen die notwendigen klinischen und hygienischen Anforderungen eingehalten werden. Dazu gehört z.B. die antibiotische Abschirmung von Patienten mit Herzklappenersatz. Der Einsatz von BioSeed®-C per se erfordert keine antibiotische Abschirmung.
Nach der Transplantation sollte der Patient sich einer geeigneten Rehabilitation unterziehen. Die Wiederaufnahme körperlicher Aktivität sollte nach ärztlicher Empfehlung erfolgen. Je nach Position und Größe der Läsion und dem Profil des Patienten werden geeignete Rehabilitationsanweisungen empfohlen. Zu frühe und intensive Aktivität kann das Einheilen von BioSeed®-C und die Nachhaltigkeit des klinischen Nutzens von BioSeed®-C beeinträchtigen. Das behandelte Knie muss daher entsprechend den Empfehlungen des angemessenen Rehabilitationsplans geschützt werden, um eine frühzeitige Schädigung zu vermeiden, die zu Transplantatversagen führen könnte. Anbei erhalten Sie eine Empfehlung für einen Rehabilitationsplan. Dieser Nachbehandlungsplan ist keinesfalls bindend. Ein detaillierter Behandlungsplan sollte vom behandelnden Arzt speziell für jeden Patienten erstellt werden.
Reh abilitationsempfehlung 1. - 6. Woche
(Therapie mit einer Motorschiene und Teilbelastung)
Postoperativer Tag:
Beginn mit passiven Bewegungsübungen durch die Motorschiene, um die transplantierten Chondrozyten zur Übernahme ihrer natürlichen Funktion zu stimulieren. Die Knorpelzellen werden hierbei zur Bildung der Knorpelmatrix angeregt.
Mobilisierung und Teilbelastung mit 15% des Körpergewichtes (d.h. Fußsohlenkontakt)
Isometrische Spannungsübungen
7. - 12. Woche (Bewegungstraining)
Schrittweise Steigerung der Belastung, spezielles Aufbautraining,
Entlastung des operierten Knies durch Gehstützen
evtl. Ergometer-Training auf einer leichten Stufe
Aktive Physiotherapie
Ab 13. Woche
(erste schonende sportliche Aktivitäten)
Schrittweise Steigerung der Gewichtsbelastung und des Muskel- und Koordinationstrainings bis zur Vollbelastung
Wenig belastende Aktivitäten (z.B. Radfahren, Joggen) ab dem 6. Monat
Stark belastende Aktivitäten (z.B. Tennis, Fußball) ab dem 12. Monat, da die endgültige Reifung und Aushärtung des neu gebildeten Knorpels erst nach 11 bis 24 Monaten abgeschlossen ist.
Fälle, in denen BioSeed®-C nicht angewendet
werden kann
Bisweilen kommt es vor, dass die Spender-chondrozyten des Patienten nicht expandiert werden können oder dass aufgrund minderer Biopsatqualität, bestimmten Patientenmerkmalen oder Herstellungsausfällen die Freigabekriterien nicht erfüllt sind. Es kann daher vorkommen, dass BioSeed®-C nicht ausgeliefert werden kann. Der Chirurg wird so frühzeitig wie möglich während des Prozesses informiert und sollte dann für den betroffenen Patienten eine Alternativbehandlung wählen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Substanzen, die oxidierend wirken (z.B. Iod, H2O2), Proteine denaturieren (z.B. Alkohol) oder Schwermetalle enthalten (z.B. Thiomersal) können die Vitalität der Zellen und damit die Wirksamkeit von BioSeed®-C beeinträchtigen und sollten deshalb nicht mit BioSeed®-C in Berührung kommen. Arzneimittel zur Schmerzbehandlung sind nach den Empfehlungen des verantwortlichen Chirurgen anzuwenden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Erfahrungen zur Anwendung in der Schwangerschaft und Stillzeit liegen nicht vor. Eine Anwendung während der Schwangerschaft oder Stillzeit sollte daher nur nach einer sehr sorgfältigen Nutzen/ Risikoabwägung erfolgen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Da es sich bei der Behandlung mit BioSeed®-C um einen chirurgischen Eingriff handelt, hat die Implantation von BioSeed®-C maßgeblichen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Während der Rehabilitation im Anschluss an die Behandlung mit BioSeed®-C sollten die Patienten ihren
behandelnden Arzt befragen und dessen Ratschläge strikt einhalten. Die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen können während des Rehabilitationszeitraums eingeschränkt sein.
Identifizierte Nebenwirkungen
|
System-OrganKlassen (SOC) |
bevorzugte MedDRA-Terms |
Häufigkeit |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Gelenkschwellung, Gelenkerguss |
z.Z. nicht bekannt |
|
eingeschränkte Gelenkbeweglichkeit, Gelenkkrepitation |
z.Z. nicht bekannt | |
|
Knorpelhypertrophie |
z.Z. nicht bekannt | |
|
Arthralgie |
z.Z. nicht bekannt | |
|
Infektionen und parasitäre Erkrankungen |
Gelenkinfektion |
z.Z. nicht bekannt |
|
Empyem |
z.Z. nicht bekannt | |
|
Allgemeine Erkrankungen und Beschwerden am |
subchondrales Ödem |
z.Z. nicht bekannt |
|
therapeutisches Produkt nicht |
z.Z. nicht bekannt |
|
Verabreichungsort |
wirksam | |
|
Pyrexie NNB |
z.Z. nicht bekannt | |
|
Untersuchungen |
Arthroskopie |
z.Z. nicht bekannt |
|
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen |
Transplantat versagen |
z.Z. nicht bekannt |
|
Lokales Ablösung eines Transplantats |
z.Z. nicht bekannt | |
|
Komplikation beim Transplantat |
z.Z. nicht bekannt | |
|
Erkrankungen des Immunsystems |
Überempfindlichkeit, allergische Reaktionen |
z.Z. nicht bekannt |
4.8 Nebenwirkungen
Im Rahmen einer Anwendungsbeobachtung wurden Nebenwirkungen, die bei der Behandlung mit BioSeed®-C von post-traumatischen und
degenerativen Kniegelenkdefekten in 70 Patienten und in einer Folgebetrachtungszeit von 4 Jahren auftraten, identifiziert. Als häufigste Nebenwirkungen wurden Gelenkschwellung/ Gelenkerguss, eingeschränkte Gelenkbeweglichkeit/ Gelenkkrepitation, Knorpelhypertrophie und Arthralgie in dieser Anwendungsbeobachtung festgestellt. Die bisher identifizierten Nebenwirkungen sind in der nachstehenden Tabelle aufgeführt, können aber zur Zeit auf Grundlage der verfügbaren Datenlage noch nicht mit präzisen Häufigkeiten benannt werden.
Eine präzise Bewertung der Häufigkeiten für das Auftreten dieser Nebenwirkungen wird im Rahmen einer randomisierten klinischen Studie erfolgen.
Die Nebenwirkungen wurden nach der Häufigkeit ihres Auftretens in folgende Kategorien klassifiziert: Sehr häufig (>1/10), häufig (>1/100 bis <1/10), gelegentlich (>1/1.000 bis <1/100), selten (>1/10.000 bis <1/1.000), sehr selten (<1/10.000) und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
4.9 Überdosierung
Es wurden keine Fälle von Überdosierung berichtet.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere
Medikamente für Erkrankungen des Stützapparates ATC-Code: M09AX02
Wirkmechanismus
Die Wirkung von BioSeed®-C ist die Deckung von Knorpeldefekten einhergehend mit der Kompensation eines Zellmangels im Defekt. BioSeed®-C bildet knorpeliges Reparaturgewebe aus.
Pharmakodynamische Wirkungen
Bezüglich der pharmakodynamischen Wechselwirkungen mit dem umliegenden Gewebe wurde in einer Anwendungsbeobachtung von 79 Patienten festgestellt, dass während der Transplantation von BioSeed®-C intraoperativ kein Lockern, kein Ablösen oder ein Verschieben von BioSeed®-C zu beobachten war1. Vierzehn Patienten wurden nach der Transplantation einer Arthroskopie unterzogen. Die transplantierten BioSeed®-C Einheiten füllten
vollständig den Defekt und bildeten einen belastbaren hyalin-artigen Knorpel aus. Auch die MRT-Beurteilung der Defekte 6 und 12 Monaten nach der Transplantation zeigten eine gute Defektfüllung. Die BioSeed®-C Transplantate waren gut in das umgebende Gewebe integriert und zeigten eine gute Verbindung zum Knorpel und zum unterliegenden Knochen. Auch in der MRT-Untersuchung wurden keine Anzeichen für ein Ablösen oder einengen von BioSeed®-C festgestellt. Histologische Analysen von vier Gewebeproben 9 bis 12 Monate nach der Transplantation von BioSeed®-C zeigten eine gute Verbindung von BioSeed®-C mit dem unterliegenden Knochen. Es wurden keine Anzeichen einer abnormalen Kalzifizierung, von Gewebenekrose oder Zelltod festgestellt. BioSeed®-C integriert gut in das umliegende Knorpel- bzw. Knochengewebe.
Bezüglich der pharmakodynamischen Wechselwirkungen von Knorpelzellen als aktive Substanz mit biologisch aktiven Molekülen und nicht-zellulären Elementen ist präklinisch beschrieben, dass die Wirkung von BioSeed®-C auf Knorpelzellen als aktive Substanz zurückzuführen ist. Diese Wirkung ist nicht auf umliegendes Gewebe oder biologisch aktive Moleküle angewiesen. Daher sind pharmako-dynamische Wechselwirkungen mit biologisch aktiven Molekülen nicht gegeben1.
Die Knorpelzellen als aktive Substanz sind in Fibrin und eine Polyglykolsäure-basierte Matrix als nichtzelluläre Elemente eingebettet. Die im Rahmen der Studie gewonnenen histologischen Schnittpräparate zeigen 9 bis 12 Monate nach der Transplantation keinerlei Hinweise auf die Präsenz von Überresten der Polyglykolsäure-basierte Matrix oder Fibrin. Die histologischen Dünnschnitte lassen 9 bis 12 Monate nach der Transplantation keine Bestandteile der Polyglykolsäure-basierten Matrix erkennen, während sich die Knorpelzellen als vital und sich das gebildete Gewebe frei von abnormaler Kalzifizierung, Zelltod oder Gewebenekrose darstellt. Eine pharmako-dynamische Wechselwirkung zwischen Zellen und den nicht-zellulären Elementen ist nicht nachweisbar. Zur pharmakodynamischen Wechselwirkung mit dem umliegenden Gewebe, sprich der in situ-Integration konnte im Rahmen der Anwendungsbeobachtung anhand von intraoperativen Beobachtungen, MRT-Aufnahmen und histologischen Schnittpräparaten festgestellt werden, dass BioSeed®-C gut in das umliegende Knorpel- und Knochengewebe integriert. Ein vollständiges Lösen von BioSeed®-C wurde auch 6 bzw. 12 Monate nach der Transplantation nicht beobachtet.
Klinische Sicherheit
Bei BioSeed®-C handelt es sich um autologe, patienteneigene Knorpelzellen, die mit autologem Serum vermehrt wurden. Die Knorpelzellen als
aktive Substanz werden in erprobte Hilfsstoffe Fibrin und Polyglykolsäure-basierte Matrix eingebracht. Fibrin ist ein Arzneimittel und wird zum Verkleben von Geweben und Wunden eingesetzt. Polyglykolsäure-basierte Matrices sind bereits seit Jahren z.B. in Form von Nahtmaterial im klinischen Einsatz.
Für die Sicherheit von BioSeed®-C ist eine sichere Verankerung im Defekt von essentieller Bedeutung, um eine Defektfüllung und die Ausbildung von knorpeligem Ersatzgewebe zu bewirken und ein Wandern von BioSeed®-C und eine potentielle Schädigung des umliegenden Gewebes zu verhindern.
Für BioSeed®-C sind verschiedene Techniken beschrieben, die eine sichere Verankerung des Produktes im Gelenkdefekt sicherstellen. BioSeed®-C kann mit Fibrin in den Defekt geklebt, am umliegenden Knorpel mittels chondraler Naht befestigt, transossär2,4 am subchondralen Knochen fixiert und mittels resorbierbarer Nägeln3 auf den subchondralen Knochen genagelt werden.
Ausgehend von einer Anwendungsbeobachtung von BioSeed®-C mit einer Nachbeobachtungszeit von bis zu 4 Jahren, in der 79 Patienten mit BioSeed®-C behandelt wurden1, nahmen 70 der 79 Patienten an einer Befragung zur Sicherheit von BioSeed®-C teil7. In der Anwendungsbeobachtung wurde BioSeed®-C auf die Größe des zu deckenden Defektes
zugeschnitten und mittels transossärer Fixierungstechnik im Defekt verankert1. Diese Verankerung ermöglichte eine gute Integration von BioSeed®-C im umliegenden Gewebe und
verhinderte ein Wandern von BioSeed®-C. Klinisch wurde kein Lockern oder Ablösen von BioSeed®-C festgestellt1.
Bei der Evaluierung zur Sicherheit bei der
Anwendung von BioSeed®-C ist zu berücksichtigen, dass bei den 70 befragten Patienten 36 begleitende chirurgische Prozeduren, die häufig mit der Behandlung von traumatischen oder degenerativen Defekten einhergehen, durchgeführt wurden. Daher kann nicht ausgeschlossen werden, dass etwaige Nebenwirkungen oder andere sicherheitsrelevante Aspekte auf die Begleitoperationen zurückzuführen sind.
Nach der Transplantation von BioSeed®-C traten typische Begleiterscheinungen nach
Knieoperationen auf: Bei 34 Patienten traten Schwellungen auf, die mittels Punktur behandelt wurden. Bei 14 Patienten wurde ein zeitlich begrenztes Blockieren des Gelenks beobachtet.
Allergische Reaktionen wurden nicht beobachtet.
Ein Patient zeigte eine Immunreaktion direkt nach der Transplantation, was jedoch keine Re-Operation nach sich zog.
In 4 von 70 Fällen wurden Symptome einer Knieinfektion festgestellt. In 2 der 4 potentiellen Infektionsfälle musste BioSeed®-C entfernt werden, die beiden anderen Fälle mussten nicht re-operiert werden. Gemäß Test auf Sterilität nach dem Europäischen Arzneibuch waren alle 4 ausgelieferten BioSeed®-C steril und die Knieinfektionen nicht auf eine fehlende Sterilität der Transplantate zurückzuführen.
Keiner der behandelten Patienten zeigte Anzeichen einer Hypersensivität.
In einem Fall trat ein von BioSeed®-C unabhängiges intraartikuläres Empyem auf.
Es gab weder Anzeichen für toxische Effekte oder Vergiftungen noch für maligne Transformationen, Reproduktionsdefekte und teratogenen Effekte.
Es wurde kein Organversagen, keine Leber- oder Nierenversagen bzw. keine Organschädigung festgestellt.
Insgesamt wurden bei 8 der 70 Patienten Re-Operationen durchgeführt. Das entspricht einer Rate von 11,4% und ist im Rahmen der berichteten Re-Operationsraten von 0-25% bei Autologer
Chondrozyten Transplantation (ACT).
Ein Versagen von BioSeed®-C wurde in 5 von 70 Fällen festgestellt. Das entspricht einer Rate von 7,1% und liegt im Rahmen der berichteten Versagerquoten von 5-13% bei ACT.
Demzufolge ist die Transplantation von BioSeed®-C als sicher einzustufen. Die Transplantation von BioSeed®-C ist vom Aspekt der Sicherheit her vergleichbar zu der konventionellen Transplantation von autologen Knorpelzellen (ACT).
Klinische Wirksamkeit
Zur Beurteilung der Wirksamkeit von BioSeed®-C wurde eine prospektive Anwendungsbeobachtung (observational case report study) zur Transplantation von BioSeed®-C mit Nachbeobachtungszeiten von bis zu 4 Jahren initiiert1,5,6. In dieser Anwendungsbeobachtung wurden Patienten mit traumatischen oder traumatisch-degenerativen, klinisch symptomatischen Defekten des Kniegelenkknorpels eingeschlossen. Die Wirksamkeit wurde anhand von etablierten klinischen Bewertungssystemen, wie dem IKDC (International Knee Documentation Committee) Score, ICRS (International Cartilage Repair Society) Score, Lysholm Score, Noyes Aktivitätsscore und KOOS (Knee Injury and Osteoarthritis Outcome Score) im Vergleich zur präoperativen Situation untersucht. Zusätzlich wurde die Wirksamkeit anhand von MRT-Untersuchungen 48-60 Monaten postoperativ und durch die histologische Beurteilung von Regeneratgewebe-Biopsien, die 9-12 Monate nach der Transplantation von BioSeed®-C entnommen wurden, beurteilt.
Es wurden insgesamt 79 Patienten im Alter von 17 bis 64 Jahren (30 weiblich, 49 männlich) in die Studie eingeschlossen. Bei 30 der 79 Patienten wurden aufgrund von osteoarthrotischen Symptomen Röntgenbilder des betreffenden Gelenk angefertigt und nach dem Kellgren-Lawrence-
Bewertungssystem bewertet. Ein Kellgren-Lawrence-Score von 2 oder mehr zeigt eine Osteoarthrose in dem betreffenden Gelenk an. Osteoarthrose wurde bei 24 Patienten anhand dieses Bewertungssystems
festgestellt1,5.
In der Publikation von Kreuz et al. 2009 sind die klinischen Ergebnisse für 19 von 24 Patienten (25-50 Jahre; 8 weiblich, 11 männlich) mit radiologisch gesicherter Osteoarthrose und einer Nachbeobachtungszeit von bis zu 60 Monaten beschrieben5:
Die Knorpeldefekte betrafen die mediale Femurkondyle (14), die Patella (3) und die laterale Femurkondyle (2). 4 Patienten wiesen zwei
Knorpeldefekte auf. Die durchschnittliche Defektgröße des ersten Defektes betrug 4 cm2 und des zweiten Defektes 3 cm2. Vor der Transplantation von BioSeed®-C wurden die Defekte bereits zuvor operativ mit Osteotomien (5), Knorpelglättung (10), Abrasion (4), knochenmarkstimulierenden Techniken (1), Meniskusresektion (6) oder Kreuzbandplastik (7) behandelt5.
Für die klinische Bewertung wurden Unterschiede im Lysholm Score, IKDC Score, ICRS Score und KOOS zwischen dem Bewertungsergebnis nach der Transplantation (48 Monate postoperativ) und dem präoperativen Ergebnis erfasst.
Im Lysholm Score konnte eine Erhöhung von 55,0 auf 89,0 nach 48 Monaten postoperativ im Vergleich zur präoperativen Situation festgestellt werden5.
Im subjektiven IKDC Score zeigte sich nach 48 Monaten eine Verbesserung von 49,0 auf 70,1 im Vergleich zur präoperativen Situation.
Auch der ICRS Score zeigte eine Verbesserung von 4,0 präoperativ zu 2,0 nach 4 Jahren5.
Im KOOS konnte eine Verbesserung im Score in den Subkategorien Schmerz (von 69 auf 89), Aktivitäten des täglichen Lebens (von 72 auf 96) und
Lebensqualität (von 25 auf 56) nach 48 Monaten postoperativ im Vergleich zur präoperativen Situation festgestellt werden. In der Subkategorie Sport und Freizeitaktivitäten wurde eine Erhöhung im Score von 10 auf 65 und in der Kategorie Symptome wurde eine Erhöhung von 71 auf 82 in der Nachbeobachtungszeit von 48 Monaten gegenüber der Situation vor der Transplantation erfasst5.
Die MRT-Untersuchungen 48-60 Monate nach der Transplantation zeigten auf, dass die Transplantation von BioSeed®-C in 11 von 19 Fällen zu einer vollständigen und in 5 von 19 Fällen zu einer Defektfüllung von über 50% führte. Einer von 19 Defekten wurde moderat gefüllt5.
In einer weiteren Veröffentlichung von Kreuz et al. 2011 wurden die klinischen Ergebnisse nach der BioSeed-C® Behandlung von traumatischen chondralen Kniegelenkdefekten mit einer Nachbeobachtungszeit von 48-60 Monaten beschrieben6.
Es wurden insgesamt 52 Patienten (17-51 Jahre; 25 weiblich, 27 männlich) aus der zuvor beschriebenen Kohorte von 79 Patienten in diese Studie eingeschlossen. Die Knorpeldefekte waren in der Femurkondyle (31 von 52), in der Patella (13 von 52), in der Trochlea (7 von 52) und in der Tibia (1 von 52) lokalisiert. 4 Patienten wiesen zwei Knorpeldefekte auf6. Die durchschnittliche Defektgröße des ersten Defektes betrug 4,76 cm2. Vor der Transplantation von BioSeed®-C wurden die Defekte bereits zuvor operativ behandelt6.
Für die klinische Auswertung wurden Vergleiche zwischen dem Bewertungsergebnis (Scores) 48 Monate nach der Transplantation und dem Ergebnis vor der Transplantation durchgeführt6. Es konnten 50 von 52 Patienten in diese Bewertung eingeschlossen werden:
Im subjektiven IKDC Score zeigte sich nach 48 Monaten eine Verbesserung im Score von 47,5 auf 71,5 im Vergleich zur präoperativen Situation. Auch im ICRS Score wurde ein Unterschied von 3,8 präoperativ zu 2,0 nach 48 Monaten festgestellt6.
Im Lysholm Score konnte eine Verbesserung von 51,8 nach 48 Monaten post-operativ zu 80,7 im Vergleich zur präoperativen Situation gezeigt werden6.
Im KOOS konnte eine Verbesserung im Score in den Subkategorien Schmerz (von 62 auf 78), Aktivitäten des täglichen Lebens (von 68 auf 85), Sport und Freizeitaktivitäten (von 19 auf 55) und Lebensqualität (von 30 auf 55) nach 48 Monaten postoperativ im Vergleich zur präoperativen Situation festgestellt werden. In der Subkategorie Symptome zeigte sich ebenfalls eine Erhöhung im Score von 68 auf 76 nach 48 Monaten postoperativ6. Die MRT-Untersuchungen belegten in 44 Patienten nach 48-60 Monaten postoperativ, dass die Transplantation von BioSeed®-C in 32 von 44 Fällen zu einer vollständigen Defektfüllung und in 11 von 44 Fällen zu einer Füllung von über 50% des Defektes führte. Einer von 44 Defekten wurde moderat gefüllt6.
Histologische Untersuchungen des im Defekt gebildeten Ersatzgewebes, welches 9 bis 12 Monate nach der Transplantation von BioSeed®-C entnommen wurde, zeigten auf, dass sich in 3 von 4 Gewebeproben ein hyalin-artiges knorpeliges Ersatzgewebe bildete1. Eine Gewebeprobe wies ein Mischgewebe aus fibrösem Knorpel und hyalinartigem knorpeligen Ersatzgewebe auf. Die histologische Untersuchungen belegten, dass die Transplantation von BioSeed®-C zur Bildung von knorpeligem Ersatzgewebe führt1.
Zusammenfassend konnte histologisch und radiologisch gezeigt werden, dass die Transplantation von BioSeed®-C zu einer Deckung des Defektes und zur Ausbildung eines knorpeligen Ersatzgewebes führt. Des Weiteren konnte die Wirksamkeit von BioSeed®-C anhand der postoperativen Verbesserung nach 48 Monaten in den etablierten klinischen Bewertungssystemen (ICRS Score, IKDC Score, Lysholm Score, Noyes Aktivitätsscore und KOOS) im Vergleich zur präoperativen Situation gezeigt werden. Zudem zeigte sich die BioSeed®-C Behandlung von posttraumatischen sowie von fokal
osteoarthrotischen Defekten durch eine
Verbesserung der postoperativen Patientensituation im Vergleich zum präoperativen Zustand als wirksam.
Kinder und Jugendliche
Die Behandlung mit BioSeed®-C von Patienten unter 18 Jahren ist nicht indiziert.
5.2 Pharmakokinetische Eigenschaften
Hinsichtlich der Biodistribution ist anzumerken, dass BioSeed®-C aus Knorpelzellen als aktive Substanz und den nicht-zellulären Elementen Fibrin und Polyglykolsäure-basierte Matrix besteht. Fibrin und die Polyglykolsäure-basierte Matrix sind resorbierbar und werden vollständig metabolisiert. Einhergehend mit dem Abbau der nicht-zellulären Elemente wird knorpeliges Ersatzgewebe aufgebaut, welches die Knorpelzellen umgibt.
BioSeed®-C ist für Defekte in Gelenken,
insbesondere in Kniegelenken vorgesehen. Das Knie ist ein abgeschlossenes Kompartiment. Der Knorpel selbst weist keinen direkten Zugang zum Blutkreislauf oder zum Lymphsystem auf. Die Knorpelzellen als aktive Substanz sind in Fibrin und in der Polyglykolsäure-basierte Matrix immobilisiert. BioSeed®-C wird im Gelenkdefekt fixiert. Im Rahmen der Anwendungsbeobachtung wurde BioSeed®-C transossär am subchondralen Knochen fixiert5,6.
Eine Migration von Knorpelzellen aus BioSeed®-C wurde klinisch nicht beobachtet. Vielmehr zeigen MRT-Untersuchungen und histologische Analysen, dass BioSeed®-C auch 12 Monate nach der Transplantation sich nicht lockert, löst oder ablöst. BioSeed®-C integrierte gut in das umliegende Knorpel- und Knochengewebe1. Kreuz und Kollegen beschreiben, dass es nach der Behandlung von fokal degenerativen Knorpeldefekten keinerlei Anzeichen für eine Wanderung von Chondrozyten festgestellt wurden5.
Aufgrund der Abgeschlossenheit des Gelenks, der Immobilisierung der aktiven Substanz in Fibrin und Polyglykolsäure-basierte Matrix sowie der sicheren Fixierung von BioSeed®-C im Defekt, ist eine Migration von Knorpelzellen aus BioSeed®-C in andere Gewebe auszuschließen.
5.3 Präklinische Daten zur Sicherheit
Spezielle Studien zur Toxikologie von BioSeed®-C wurden nicht durchgeführt.
Hier ist zu beachten, dass es sich bei BioSeed®-C um ein autologes Knorpeltransplantat mit autologen Knorpelzellen, welche mit autologem Serum vermehrt wurden, als aktive Substanz handelt. Das heißt, dass dem zu behandelnden Patienten seine eigenen Zellen entnommen und wieder transplantiert werden. Toxische Effekte aufgrund körpereigener Zellen sind nicht zu erwarten.
Bei den nicht-zellulären Elementen von BioSeed®-C handelt es sich um zugelassene Arzneimittel bzw. klinisch bewerte Produkte. Das nicht-zelluläre Element Fibrin ist ein zugelassenes Arzneimittel. Polyglykolsäure-basierte Matrizes sind seit Jahren klinisch im Einsatz.
In Studien zur Transplantation von BioSeed®-C sind keinerlei toxischen Effekte nach Transplantation von BioSeed®-C beschrieben.
Nach orthotoper Transplantation von BioSeed®-C in Gelenkdefekte des Kaninchens konnten in den ersten Wochen Ansammlungen von mononukleären
Zellen, welche als Entzündungszellen interpretiert werden könnten, festgestellt werden. 3 Monate nach der Transplantation konnten keine Entzündungszellen nachgewiesen werden. Nekrosen oder Granulationsgewebebildung traten nicht auf 89. Basierend auf diesen Studien lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Literatur:
1. Ossendorf C, Kaps C, Kreuz PC, et al.
2007.Treatment of posttraumatic and focal osteoarthritic cartilage defects of the knee with autologous polymer-based three-dimensional
chondrocyte grafts: 2-year clinical results. Arthritis Res Ther 9:R41.
2. Erggelet C. 2004. BioSeed®-C - autologous three-dimensional chondrocytes graft for the treatment of traumatic and degenerative articular cartilage lesions. Interim Report BioSeed®-C:1-64
3. Petersen W, Zelle S, Zantop T. 2008. Arthroscopic implantation of a three dimensional scaffold for autologous chondrocyte transplantation. Arch Orthop Trauma Surg. May;128(5):505-8.
4. Erggelet C, Sittinger M, Lahm A. 2003 The arthroscopic implantation of autologous chondrocytes for the treatment of full-thickness cartilage defects of the knee joint. Arthroscopy. Jan;19(1):108-10.
5. Kreuz PC, Müller S, Ossendorf C, Kaps C, Erggelet C. 2009. Treatment of focal degenerative cartilage defects with polymer-based autologous chondrocyte grafts: four-year clinical results. Arthritis Res Ther.;11(2):R33.
6. Kreuz PC, Müller S, Freymann U, Erggelet C, Niemeyer P, Kaps C, Hirschmüller A. 2011. Repair of focal cartilage defects with scaffold-assisted autologous chondrocyte grafts: clinical and biomechanical results 48 months after transplantation. Am J Sports Med. 2011 Aug;39(8):1697-705.
7. Tanczos E, Kaps C. 2009. Clinical safety of BioSeed®-C treatment in patients after 4 years follow-up. BioTissue Technologies GmbH. BTT-C-4210-055.
8. Perka C, Schultz O, Sittinger M, et al. 2000. Chondrocyte transplantation in PGLA/polydioxanone fleece. Orthopade 29:112-119.
9. Perka C, Sittinger M, Schultz O, et al. 2000. Tissue engineered cartilage repair using cryopreserved and noncryopreserved chondrocytes. Clin Orthop Relat Res:245-254.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Pro BioSeed®-C Einheit:
• Polymervlies aus reiner Polyglykolsäure (ITVP-
PGA-Felt, Fa. ITV Produktservice GmbH,
Denkendorf, DE; Soft PGA Felt®, Fa. Alpha Research Deutschland GmbH, Berlin, DE)
• 760-960 ^l Chondrozyten-Differenzierungs-
medium bestehend aus Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12-Medium) mit 104^g/ml
Ascorbinsäurephospat, 34^g/ml L-Prolin,
10mmol/ml Hydroxyethylpiperazin-
Ethansulfonsäure (HEPES)-Puffer, 4^mol/ml L-Glutamin und 5 % autologem Humanserum
• Fibrinkleber: Tissucol Duo S (Fa. Baxter
Deutschland GmbH, DE) oder Beriplast P Combi Set (Fa. CSL Behring GmbH, Marburg; DE), jeweils 480 ^l Fibrinogen+ 280 ^l
Thrombinlösung (1:10 Verdünnung)
• 30 ml BioSeed®-C Transportmedium, bestehend aus Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12-Medium) mit 25mmol/ml HEPES-Puffer. Jede BioSeed®-C Einheit wird in je 30 ml Transportmedium versendet und kann daher Rückstände/ Spuren davon enthalten
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht in
Kombination mit anderen Arzneimitteln, außer mit Fibrin als Gewebekleber, transplantiert werden.
6.3 Dauer der Haltbarkeit
96 Stunden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Bei 4°-25°C lagern. Nicht einfrieren. Nicht bestrahlen. BioSeed®-C kann nach Erhalt bis zum Transplantationstermin in der sterilen Verpackung im temperierten Isolierbehälter aufbewahrt werden.
6.5 Art und Inhalt des Behältnisses
Die mit jeweils 28,8 Mio. Knorpelzellen beimpften BioSeed®-C Vliese werden einzeln, zusammen mit 30ml BioSeed®-C Transportmedium in einem sterilen Cleerpeel Beutel steril verschlossen. Die steril verschlossene Primärverpackung wird in einen zweiten sterilen Cleerpeel Beutel verpackt (Sekundärverpackung).
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
BioSeed®-C ist ausschließlich für die autologe Anwendung bestimmt. Vor der Implantation ist zu überprüfen, ob der Name des Patienten mit den Angaben zum Patienten/Spender auf den Versandunterlagen und der Produktverpackung identisch ist.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
• Unmittelbar vor der Transplantation wird das gesamte defekte Knorpelgewebe entfernt, ohne dabei die Knochenlamelle zu verletzen.
• Vorbereitend für die Anwendung wird der innere sterile Beutel, in dem sich die Einheit BioSeed®-C befindet, geöffnet. Die Einheit(en) wird/werden zusammen mit dem Transportmedium in ein steriles Gefäß z.B. eine Nierenschale abgegossen. Die Konsistenz von BioSeed®-C erlaubt das vorsichtige Halten, Transportieren und Applizieren mit anatomischen oder chirurgischen Pinzetten oder den Händen. Eine Austrocknung von BioSeed®-C ist dabei unbedingt zu vermeiden. BioSeed®-C sollte regelmäßig kurz in die Transportflüssigkeit oder in sterile physiologische Kochsalzlösung zur Infusion eingetaucht werden. Austrocknung bedeutet Zelltod!
• Der präparierte Bereich wird ausgemessen und BioSeed®-C auf die entsprechende Größe zugeschnitten und mit einer entsprechenden Fixationsmethode befestigt.
• Es gibt folgende Möglichkeiten BioSeed®-C zu fixieren:
- Einnähen von BioSeed®-C
- Transossäre Fixierung
- Resorbierbare Nägel (z.B. SmartNail® der Firma Conmed Linvatec)
- Fibrinkleber (bei kleinen Defekten)
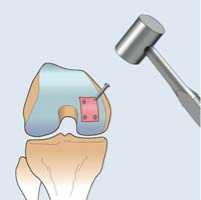
Fixierung mittels resorbierbarer Nägel
BioSeed®-C kann wie folgt mit resorbierbaren Nägeln (Abb. 1), z.B. SmartNail® der Firma Conmed Linvatec, fixiert werden:
1. Bohren: Damit die resorbierbaren Nägel in den Knochen eingeführt werden können, ist zunächst ein passender Tunnel zu bohren. Dies erfolgt nach Einlegen von BioSeed®-C mittels eines konisch gespitzten Kirschnerdrahts (eine andere Spitzenform, z.B. pyramiden- oder diamantenförmig, würde BioSeed®-C beschädigen). Die Abmessung des Tunnels muss passend zum eingesetzten Nagel sein.

Abb. 1: Abb. 2:
Resorbierbarer Nagel Einkl°pfen des Nagels
mittels chirurgischen Hammers
2. Einführung des Nagels: BioSeed®-C wird je nach Defektgröße und -form mit einem oder mehreren Nägeln befestigt. Diese können mittig sowie am Rand von BioSeed®-C gesetzt werden. Das Einführen erfolgt durch leichtes Einklopfen der Nägel in den vorbereiteten Tunnel (Abb. 2) bis der Nagelkopf die Gelenkoberfläche berührt. Die Nägel sind im rechten Winkel zur Gelenkoberfläche einzuführen, um eine Beschädigung des umliegenden Gewebes zu vermeiden.
Eine Ecke nach der anderen wird wie folgt mit eckseitigen Doppelknotenschlaufen versehen:
1. Diagonaler Stich: BioSeed®-C wird an der jeweiligen Ecke durch einen diagonalen Stich mit einem resorbierbaren Faden (Vicryl® 2-0) versehen.
2. Verankerungsknoten: Im Abstand von ca. 1 cm zum BioSeed®-C (Abstand abhängig von der zu behandelnden Stelle) wird mit Hilfe eines Knotens eine erste Schlaufe gebildet. Der Abstand des Knotens zum BioSeed®-C (und damit die Größe dieser ersten Schlaufe) wird mit Hilfe eines Nadelhalters festgelegt. Dies verhindert auch das Anziehen des Knotens bis zum Rand von BioSeed®-C. Dieser Verankerungsknoten besteht aus drei chirurgischen Knoten (4-fach rechts, 4-fach links, 4fach rechts), die Knotengröße entspricht so dem Durchmesser der Kirschnerdrähte.
3. Durchzugsschlaufe: Im Abstand von etwa 1 cm zum ersten Knoten wird danach mittels eines zweiten Knotens eine Durchzugsschlaufe gebildet. Dieser Knoten besteht aus zwei chirurgischen Knoten (3-fach rechts, 3-fach links)
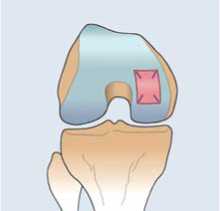
4. Bohren und Verankern: Die Fixierung von BioSeed®-C erfolgt durch Verankerungsknoten, die durch eckseitige transossäre Bohrungen (mit Kirschner Drähten der Stärke 1,7mm/ 35cm lang mit Öse) mit Hilfe der Kirschnerdrähte und Zugfäden eingezogen werden (Abb. 4).
Achtung!
Bohrungsverlauf immer ventral der Bizepssehne. Beim Einziehen der Kirschnerdrähte mit Zugfäden ist, z.B. durch Gegenhalten, darauf zu achten, dass kein starker Zug direkt aufs BioSeed®-C einwirkt.
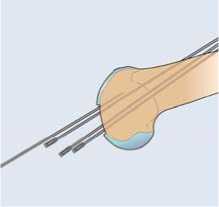
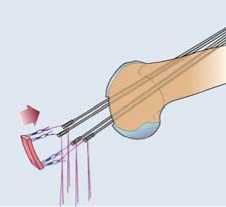
Abb. 4:
Schematische Darstellung der transossären Fixierung von BioSeed®-C im Defekt
Transossäre Knotentechnik
BioSeed®-C wird an den Ecken mit einer Doppelknotenschlaufe versehen (Abb. 3). Die verwendete Fadenstärke (chirurgisches Nahtmaterial) sollte mindestens 2,0 (Vicryl®) sein.
1. Diagonaler Stich
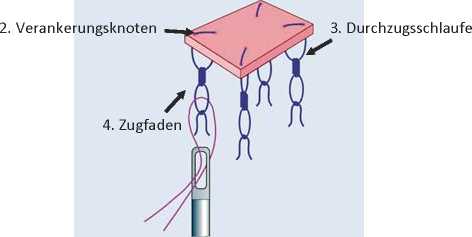
Abb. 3: Transossäre Knotentechnik
Der Wundverschluss entspricht dem üblichen Vorgehen.
7. INHABER DER GENEHMIGUNG
BioTissue Technologies GmbH Engesserstr. 4b D-79108 Freiburg Deutschland
Telefon: +49 (0)761 - 76 76 - 580 Fax: +49 (0)761 - 76 76 - 430 E-mail: customerservice@biotissue.de
8. GENEHMIGUNGSNUMMER
Gen.-Nr.: PEI.A.11485.01.1
9. DATUM DER ERTEILUNG DER GENEHMIGUNG
04.06.2014
10. STAND DER INFORMATION
15.05.2014
12 / 12