Braunovidon Salbe
Gebrauchsinformation: Information für den Anwender
Braunovidon Salbe 10 %
Povidon-Iod
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
Dieses Arzneimittel ist ohne Verschreibung erhältlich. Um einen bestmöglichen Behandlungserfolg zu erzielen, muss Braunovidon Salbe jedoch vorschriftsmäßig angewendet werden.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Fragen Sie Ihren Apotheker, wenn Sie weitere Informationen oder einen Rat benötigen.
• Wenn sich Ihre Symptome verschlimmern oder nach 2 bis 5 Tagen keine Besserung eintritt, müssen Sie auf jeden Fall einen Arzt aufsuchen.
• Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie
Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker._
Diese Packungsbeilage beinhaltet:
1. Was ist Braunovidon Salbe und wofür wird sie angewendet?
2. Was müssen Sie vor der Anwendung von Braunovidon Salbe beachten?
3. Wie ist Braunovidon Salbe anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Braunovidon Salbe aufzubewahren?
6. Weitere Informationen
1. WAS IST BRAUNOVIDON SALBE UND WOFÜR WIRD SIE ANGEWENDET?
Dieses Arzneimittel ist ein Povidon-Iod-haltiges, keimtötendes Mittel (Antiseptikum) zur antimikrobiellen Haut- und Wundbehandlung.
Braunovidon Salbe dient zur wiederholten, zeitlich begrenzten Anwendung als Antiseptikum bei geschädigter Haut, wie z.B. Decubitus (Druckgeschwür), Ulcus cruris (Unterschenkelgeschwür), oberflächlichen Wunden und Verbrennungen, infizierten und superinfizierten Hauterkrankungen.
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON BRAUNOVIDON SALBE BEACHTEN?
Braunovidon Salbe darf nicht angewendet werden
- wenn Sie überempfindlich (allergisch) gegen Povidon-Iod oder einen der sonstigen Bestandteile von Braunovidon Salbe sind.
- wenn Sie an einer Schilddrüsenerkrankung leiden
- wenn Sie an Dermatitis herpetiformis Duhring (seltene Hauterkrankung mit Brennen, Juckreiz und verschiedenartigen Hauterscheinungen, vor allem an Armen, Beinen, Schultern und Gesäß) erkrankt sind
- wenn bei Ihnen eine Strahlentherapie der Schilddrüse mit Iod (Radioiodtherapie) geplant oder durchgeführt worden ist (bis zum Abschluss der Behandlung).
- bei Neugeborenen und Säuglingen bis zum Alter von 6 Monaten
Besondere Vorsicht bei der Anwendung von Braunovidon Salbe ist erforderlich:
Wegen der Gefahr von Verätzungen durch Quecksilberiodid darf Povidon-Iod nicht gleichzeitig oder kurzfristig nachfolgend mit Quecksilberderivaten angewendet werden.
Hinweise zur Beeinflussung diagnostischer Untersuchungen:
Wegen der oxidierenden Wirkung von Povidon-Iod können verschiedene diagnostische Untersuchungen zu falschen Ergebnissen führen (u.a. o-Toluidin und Guajakharz zur Hämoglobinoder Glukosebestimmung).
Unter der Gabe von Povidon-Iod kann die Iodaufnahme der Schilddrüse herabgesetzt sein.
Dies kann zu Störungen bei bestimmten Schilddrüsentests wie der Schilddrüsenszintigraphie (nuklearmedizinische Untersuchung der Schilddrüse), der PBI-Bestimmung (indirekte Bestimmungsmethode für Schilddrüsenhormone) und der Radioiod-Diagnostik (nuklearmedizinische Untersuchung der Schilddrüsenfunktion) führen sowie eine geplante Radioiod-Therapie (Behandlung mit radioaktivem 131Iod) unmöglich machen. Bis zur Aufnahme eines neuen Szinti-gramms sollte eine Wartezeit von mindestens 1 - 2 Wochen nach Absetzen der Povidon-Iod-Behandlung eingehalten werden.
Bei Anwendung von Braunovidon Salbe mit anderen Arzneimitteln:
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einneh-men/anwenden bzw. vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Iod reagiert mit Quecksilberverbindungen zu stark ätzendem Quecksilberiodid.
Povidon-Iod darf nicht mit Taurolidin und Wasserstoffperoxid angewendet werden.
Wenn Sie mit Lithium-Präparaten behandelt werden, sollten Sie eine regelmäßige, insbesondere großflächige Anwendung von Braunovidon Salbe vermeiden, da aufgenommenes Iod die durch Lithium mögliche Auslösung einer Schilddrüsenunterfunktion fördern kann.
Der Povidon-Iod-Komplex ist bei pH-Werten zwischen 2 und 7 wirksam. Es ist zu erwarten, dass der Komplex mit Eiweiß und bestimmten anderen organischen Verbindungen reagiert, wodurch seine Wirksamkeit beeinträchtigt wird.
Es dürfen gleichzeitig mit Povidon-Iod keine enzymatischen Wundbehandlungsmittel angewendet werden, da die Enzymkomponente unwirksam wird.
Schwangerschaft und Stillzeit
Braunovidon Salbe sollte bis zur 9. Schwangerschaftswoche nur nach sorgfältiger Abwägung von Nutzen und Risiko durch den behandelnden Arzt angewendet werden.
Nach der 9. Schwangerschaftswoche und während der Stillzeit darf Braunovidon Salbe nicht angewendet werden, da Iod, auch aus Povidon-Iod, plazentagängig ist und in die Muttermilch übertritt.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Es sind keine besonderen Vorsichtsmaßnahmen erforderlich.
3. WIE IST BRAUNOVIDON SALBE ANZUWENDEN?
Wenden Sie Braunovidon Salbe immer genau nach der Anweisung in dieser Packungsbeilage an. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Die Salbe wird entsprechend der Grösse der zu behandelnden Flächen bei Bedarf mehrmals täglich aufgetragen.
Zu Beginn der Behandlung stark entzündeter oder nässender Wunden sollte die Salbe alle 4 - 6 Stunden erneut aufgetragen werden, um eine optimale mikrobizide Wirkung zu erhalten.
Zur lokalen, antiseptisch-therapeutischen Anwendung werden die betroffenen Partien vollständig bestrichen. Die Dauer der Anwendung von Braunovidon Salbe ergibt sich aus der jeweils vorliegenden Indikationsstellung.
Die Salbe kann längere Zeit auf der Wunde verbleiben und sollte spätestens nach Entfärbung neu aufgetragen werden.
Hinweis:
Die Braunfärbung der Salbe ist eine Eigenschaft des Präparates. Sie zeigt das Vorhandensein von verfügbarem Iod und damit die Wirksamkeit an. Bei Nachlassen der Braunfärbung ist nachzudosieren, wobei eine vollständige Belegung der betroffenen Areale notwendig ist, da Braunovidon Salbe eine ausschliesslich lokale antiseptische Wirkung aufweist.
Wenn Sie eine größere Menge von Braunovidon Salbe angewendet haben, als Sie sollten
kann dies der Wunde nicht schaden. Überschüssige Salbe außerhalb des zu behandelnden Bereiches sollte mit einem sauberen Tuch entfernt werden, um eine Verschmutzung der Kleidung zu vermeiden.
Braunovidon Salbe soll nur äußerlich angewendet werden. Nach versehentlicher Einnahme größerer Mengen der Salbe ist unverzüglich ärztlicher Rat einzuholen, da es zu einer schweren Schilddrüsenfunktionsstörung kommen kann.
Hinweis für den Arzt:
Bei einer Vergiftung durch Einnahme von Povidon-Iod sollte eine Magenspülung mit Stärkesuspension oder mit 5% Natriumthiosulfat durchgeführt werden und gegebenenfalls eine Behandlung der Wasser- und Elektrolytstörungen erfolgen. Nach bereits erfolgter Resorption, auch nach Wundbehandlung, können toxische Serum-Iod-Spiegel durch Peritoneal- oder Hämodialyse effektiv gesenkt werden. Die weitere Behandlung richtet sich nach der Grundkrankheit und anderen evtl. vorliegenden Symptomen, wie z. B. metabolischer Acidose und Nierenfunktionsstörung, und folgt den allgemeinen Grundsätzen. Das Ansprechen auf eine thyreostatische Therapie kann bei iodinduzierter Hyperthyreose verzögert sein.
Wenn Sie die Anwendung von Braunovidon Salbe vergessen haben
setzen Sie die Behandlung entsprechend der angegebenen Dosierung fort.
Wenn Sie die Anwendung von Braunovidon Salbe abbrechen
kann es zu einer Verschlechterung des Wundzustandes kommen.
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann Braunovidon Salbe Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Sehr häufig: Häufig: Gelegentlich: Selten:
Sehr selten:
mehr als 1 von 10 Behandelten
weniger als 1 von 10, aber mehr als 1 von 100 Behandelten weniger als 1 von 100, aber mehr als 1 von 1000 Behandelten weniger als 1 von 1000, aber mehr als 1 von 10 000 Behandelten weniger als 1 von 10 000 Behandelten, oder unbekannt
Bedeutsame Nebenwirkungen oder Zeichen, auf die Sie achten sollten, und Maßnahmen, wenn Sie betroffen sind:
Wenn Sie von einer der nachfolgend genannten Nebenwirkungen betroffen sind, wenden Sie Braunovidon Salbe nicht weiter an und suchen Sie Ihren Arzt möglichst umgehend auf.
Bei längerer Behandlung kann eine Störung der Wundheilung sowie vorübergehend Schmerzen, Brennen und Wärmegefühl auftreten.
Sehr selten kann es zu Überempfindlichkeitsreaktionen gegen Iod (Iodallergie) kommen.
Sehr selten kann es zu akuten Reaktionen des Immunsystems (anaphylaktischen Reaktionen) unter Beteiligung anderer Organe kommen (z. B. Haut, Atemwege, Kreislauf).
Nach umfangreicher Anwendung von Povidon-Iod oder z. B. bei der Behandlung großflächiger Verbrennungen sind sehr selten Störungen des Salz- und des Säuren-Basen-Haushaltes (Elektrolyt- und Serumosmolaritätsstörungen sowie metabolische Acidose) beschrieben worden. Dabei kann es sehr selten zur Niereninsuffizienz kommen.
Bei Patienten mit Schilddrüsenerkrankungen soll regelmäßig eine Überwachung der Schilddrüsenfunktion erfolgen, wenn Braunovidon Salbe großflächig oder oft, besonders auf geschädigter Haut, angewendet wird.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. WIE IST BRAUNOVIDON SALBE AUFZUBEWAHREN?
Arzneimittel für Kinder unzugänglich aufbewahren.
Sie dürfen das Arzneimittel nach dem auf der Tuben oder dem Tiegel nach "Verwendbar bis:" angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Für Braunovidon Salbe im Tiegel wird empfohlen, die Salbe nach dem ersten Öffnen des Tiegels innerhalb von 6 Monaten aufzubrauchen, jedoch nicht über das Haltbarkeitsdatum hinaus.
Aufbewahrungsbedingungen:
Nicht über 25 °C lagern.
6. WEITERE INFORMATIONEN
Was Braunovidon Salbe enthält:
Der Wirkstoff ist: Povidon Iod 100 g Salbe enthalten:
10 g Povidon-Iod mit 10 % verfügbarem Iod (PVP mittl. Mw 40 000)
Die sonstigen Bestandteile sind:
Macrogol 400, Macrogol 4000, Gereinigtes Wasser, Natriumhydrogencarbonat Wie Braunovidon Salbe aussieht und Inhalt der Packung:
Braunovidon Salbe ist eine braune Salbe in Tuben zu 20 g, 100 g, 250 g, in Tiegeln zu 250 g.
Pharmazeutischer Unternehmer und Hersteller
B. Braun Melsungen AG Carl-Braun-Straße 1 34212 Melsungen Tel. 05661-71 0 Fax 05661-71 45 67
Diese Gebrauchsinformation wurde zuletzt überarbeitet im 05/2015.
Anwendungshinweise:
Braunovidon Salbe in der praktischen Dispensertube 20 g
Ideal zur punktuellen oder flächigen Wundbehandlung bei Verletzungen, Verbrennungen und Hauterkrankungen.
Fettfrei, abwaschbar
a) Dispenser bei Bedarf auf den gewünschten Durchmesser kürzen.
Anwendungshinweis
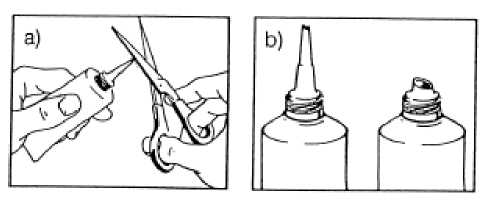
b) Gezieltes Aufbringen der gewünschten Salbenmenge durch kleine oder grössere Öffnung. Nach Gebrauch Schraubkappe aufsetzen.
Wegen der Wasserlöslichkeit von Povidon-Iod lassen sich Flecken aus textilem Gewebe mit Wasser und Seife, in hartnäckigen Fällen mit Salmiakgeist oder Thiosulfatlösung leicht entfernen.
Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt:
Bei bestehendem Verdacht auf eine Allergisierung durch Braunovidon Salbe sind die einzelnen Inhaltsstoffe des Produktes in dermatologisch sinnvoller Verdünnung vom Hersteller zur epicutanen Austestung beziehbar.
Seite 6 von 6