Breakyl Start
ANHANGI
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Breakyl 200 Mikrogramm Buccalfilm
Breakyl 400 Mikrogramm Buccalfilm
Breakyl 600 Mikrogramm Buccalfilm
Breakyl 800 Mikrogramm Buccalfilm
Breakyl 1200 Mikrogramm Buccalfilm
Breakyl Start 200, 400, 600 und 800 Mikrogramm Buccalfilm
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Breakyl 200 Mikrogramm Buccalfilm
Jeder Buccalfilm enthält: 200 Mikrogramm Fentanyl (als Fentanylcitrat), Breakyl 400 Mikrogramm Buccalfilm
Jeder Buccalfilm enthält: 400 Mikrogramm Fentanyl (als Fentanylcitrat), Breakyl 600 Mikrogramm Buccalfilm
Jeder Buccalfilm enthält: 600 Mikrogramm Fentanyl (als Fentanylcitrat), Breakyl 800 Mikrogramm Buccalfilm
Jeder Buccalfilm enthält: 800 Mikrogramm Fentanyl (als Fentanylcitrat), bzw. Breakyl 1200 Mikrogramm Buccalfilm
Jeder Buccalfilm enthält: 1200 Mikrogramm Fentanyl (als Fentanylcitrat).
Sonstige Bestandteile:
|
Breakyl, Stärke (Mikrogramm) sonstiger Bestandteil |
200 |
400 |
600 |
800 |
1200 |
|
Propylenglycol (E1520) (mg) |
0,17 |
0,35 |
0,52 |
0,70 |
1,04 |
|
Natriumbenzoat (E211) (mg) |
0,11 |
0,23 |
0,34 |
0,46 |
0,69 |
|
Methyl-4-hydroxybenzoat (E218) (mg) |
0,12 |
0,24 |
0,36 |
0,48 |
0,71 |
|
Propyl-4-hydroxybenzoat (E216) (mg) |
0,03 |
0,06 |
0,09 |
0,12 |
0,18 |
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Buccalfilm
Breakyl ist ein lösliches, rechteckiges, flaches und flexibles Filmplättchen (Buccalfilm) mit einer rosafarbenen und einer weißen Seite, das die Abgabe von Fentanyl direkt in die Blutbahn ermöglicht. Der Wirkstoff Fentanyl befindet sich in der rosafarbenen Schicht. Die weiße Deckschicht minimiert die Menge Fentanyl, die in den Speichel abgegeben wird, um ein Verschlucken des Wirkstoffes zu vermeiden.
Die folgende Abbildung zeigt die Größe der verfügbaren Stärken von Breakyl:

0,78 cm2 1,56 cm2 2,34 cm2 3,11 cm2 4,67 cm2
(Bei elektronischer Ansicht werden die Größen möglicherweise nicht korrekt angezeigt.)
Jeder Buccalfilm ist einzeln in einem kindergesicherten Beutel verpackt.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Breakyl ist angezeigt für die Behandlung von Durchbruchschmerzen bei erwachsenen Krebspatienten, die bereits eine Opioid-Basistherapie gegen ihre chronischen Tumorschmerzen erhalten.
Bei Durchbruchschmerzen handelt es sich um eine vorübergehende Verschlimmerung der Schmerzen, die trotz anderweitig kontrollierter Dauerschmerzen auftritt.
Zu den Patienten, die eine Opioid-Basistherapie erhalten, werden diejenigen gezählt, die mindestens 60 mg orales Morphin täglich, mindestens 25 Mikrogramm transdermales Fentanyl pro Stunde, mindestens 30 mg Oxycodon täglich, mindestens 8 mg orales Hydromorphon täglich oder eine analgetisch gleichwertige Dosis eines anderen Opioids über eine Woche oder länger erhalten.
4.2 Dosierung, Art und Dauer der Anwendung
Die Behandlung sollte von einem Arzt eingeleitet und weitergeführt werden, der Erfahrung mit einer Opioid-Therapie bei Krebspatienten hat. Zur Minimierung des Risikos von Opioid-bedingten Nebenwirkungen und zur Ermittlung der individuell wirksamen Dosis ist es unabdingbar, die Patienten während des Titrationsprozesses engmaschig ärztlich zu überwachen.
Da die individuell ausreichend wirksame Dosis von Breakyl für Durchbruchschmerzen nicht anhand der täglichen Opioid-Basistherapie oder anhand einer anderen Medikation für Durchbruchschmerzen vorherzubestimmen ist, muss diese durch Dosistitration ermittelt werden.
Dosistitration
Voraussetzung für die Dosistitration von Breakyl ist, dass die Dauerschmerzen der Patienten durch eine Opioid-Basistherapie angemessen kontrolliert werden. Für Patienten, bei denen innerhalb eines Tages mehr als vier Attacken von Durchbruchschmerzen auftreten, sollte eine Erhöhung der Opioid-Basistherapie in Erwägung gezogen werden, bevor mit der Dosistitration von Breakyl begonnen wird.
Titration bei Patienten, die von anderen Fentanyl-haltigen Arzneimitteln umgestellt werden
Aufgrund unterschiedlicher Resorptionsprofile darf die Umstellung nicht im Verhältnis 1:1 erfolgen. Wenn von einem anderen oralen Fentanylcitrat-haltigen Arzneimittel umgestellt wird, ist eine unabhängige Dosistitration mit Breakyl erforderlich, da die Bioverfügbarkeit der Arzneimittel signifikant unterschiedlich ist (siehe Abbildung im Abschnitt 5.2).
Anfangsdosis:
Die Anfangsdosis von Breakyl sollte 200 Mikrogramm betragen. Diese kann nach Bedarf durch das Spektrum der verfügbaren Dosisstärken (200, 400, 600, 800 und 1200 Mikrogramm) auftitriert werden. Der Titrationsprozess sollte sorgfältig überwacht werden, bis die Dosis ermittelt ist, die während einer Durchbruchschmerzattacke eine hinreichende Analgesie bei akzeptablen Nebenwirkungen bewirkt.
Diese Dosis wird als die individuell wirksame Dosis bezeichnet. Zwischen den Anwendungen von Breakyl sollte mindestens ein Abstand von vier Stunden eingehalten werden.
Für die Dosistitration steht Breakyl in zwei Versionen zur Verfügung:
Breakyl Start 200, 400, 600 und 800 Mikrogramm Buccalfilm, das jeweils einen Buccalfilm in den Stärken
200, 400, 600 und 800 Mikrogramm enthält,
und
Breakyl 200 Mikrogramm, Buccalfilm.
Eine höhere Dosierung lässt sich auch mit Breakyl 200 Mikrogramm erreichen, indem mehrere Buccalfilme der Stärke 200 Mikrogramm gleichzeitig angewendet werden:
1 Buccalfilm Breakyl 200 entspricht einer Dosis von 200 Mikrogramm
2 Buccalfilme Breakyl 200 entsprechen einer Dosis von 400 Mikrogramm
3 Buccalfilme Breakyl 200 entsprechen einer Dosis von 600 Mikrogramm
4 Buccalfilme Breakyl 200 entsprechen einer Dosis von 800 Mikrogramm
Sollte die höchste Stärke von Breakyl Start (800 Mikrogramm) oder die gleichzeitige Anwendung von 4 Buccalfilmen der Stärke 200 Mikrogramm (800 Mikrogramm) zur Schmerzlinderung nicht ausreichen, kann die Anwendung von Breakyl 1200 Mikrogramm angezeigt sein. Dies ist die höchste verfügbare Stärke von Breakyl.
Wenn nach Anwendung einer bestimmten Dosisstärke eine ausreichende Schmerzlinderung erzielt wird, sollten nachfolgende Durchbruchschmerzattacken mit der so ermittelten Breakyl-Dosis behandelt werden.
Wenn innerhalb von 30 Minuten nach der Anwendung einer bestimmten Breakyl-Dosis keine ausreichende Schmerzlinderung erzielt wird, und der Patient die Dosis vertragen hat, sollte der Patient zur Behandlung der folgenden Durchbruchschmerzattacke die nächst höhere Breakyl-Dosis anwenden.
Wird innerhalb von 30 Minuten nach Anwendung von Breakyl Buccalfilm 1200 Mikrogramm (der höchsten verfügbaren Stärke) keine ausreichende Schmerzlinderung erzielt, sollten der behandelnde Arzt und der Patient andere Therapiemöglichkeiten besprechen.
Während des Titrationsvorgangs ist es möglich, durch die Kombination von niedrig dosierten Buccalfilmen zur nächst höheren Dosis zu gelangen. Die kombinierte Anwendung von Dosen, die insgesamt 1200 Mikrogramm überschreiten, wurde nicht unter kontrollierten Bedingungen geprüft.
Soweit vom behandelnden Arzt verordnet, darf der Patient ein weiteres Arzneimittel gegen Durchbruchschmerzen anwenden, wenn während einer Durchbruchschmerzattacke innerhalb von 30 Minuten nach der Anwendung eines Breakyl-Buccalfilms keine ausreichende Schmerzlinderung erzielt wird. Wenn nicht akzeptable Nebenwirkungen von Breakyl oder Anzeichen für eine Opioid-Toxizität beobachtet wurden, dürfen keine weiteren Opioid-haltigen Arzneimittel angewendet werden,.
Breakyl ist in 5 Dosisstärken verfügbar; 200, 400, 600, 800 und 1200 Mikrogramm
Start ^ Die Anfangsdosis beträgt 200 Mikrogramm
4
Die Dosisierung ist schrittweise unter Verwendung der nächst höheren Breakyl-Dosis soweit aufzutitrieren, bis die Dosis erreicht ist, die beim Patienten eine _ausreichende Analgesie bei akzeptablen Nebenwirkungen bewirkt._
4
JA
Sobald eine ausreichende Schmerzlinderung erreicht ist, werden nachfolgende
Durchbruchschmerzattacken mit der ermittelten Dosis behandelt.
NEIN
Wenn innerhalb von 30 Minuten nach der Anwendung keine ausreichende Schmerzlinderung erreicht wird, und der Patient die Dosis vertragen hat, sollte die folgende Durchbruchschmerzattacke mit der nächst höheren Breakyl-Dosis behandelt werden..
Zwischen den Anwendungen von Breakyl sollte ein Abstand von mindestens vier Stunden eingehalten werden. Tritt während der Durchbruchschmerzattacke innerhalb von 30 Minuten keine hinreichende Schmerzlinderung ein, kann der Patient notfalls ein weiteres Arzneimittel nach Anweisung des behandelnden Arztes anwenden.
Erhaltungstherapie
Sobald die individuell wirksame Dosis ermittelt worden ist, sollte die Anwendung von Breakyl auf vier oder weniger Durchbruchschmerzattacken pro Tag beschränkt werden. Zwischen den Anwendungen ist ein Abstand von mindestens 4 Stunden einzuhalten. Breakyl sollte pro Attacke nur einmal angewendet werden.
Anpassung der Dosis
Um dauerhaft eine ausreichende Linderung der Durchbruchschmerzen zu erreichen, kann bei einigen Patienten eine Anpassung der Breakyl- bzw. der Opioid-Basistherapie erforderlich werden. Bei Patienten, bei denen über einen Zeitraum von mehr als vier aufeinander folgenden Tagen mehr als vier Attacken von Durchbruchschmerzen pro Tag auftreten, sollte eine Dosiserhöhung der für den Dauerschmerz verwendeten Opioid-Basistherapie in Erwägung gezogen werden. Wird die Dosis des lang wirksamen Opioids erhöht, kann eine Überprüfung der zur Behandlung der Durchbruchschmerzen verabreichten Breakyl-Dosis erforderlich werden.
Es ist unerlässlich, dass jede Änderung der Schmerztherapie unter engmaschiger ärztlicher Kontrolle erfolgt.
Beendigung der Therapie
Solange die Patienten die Opioid-Basistherapie für ihren Dauerschmerz fortführen, kann die Anwendung von Breakyl normalerweise jederzeit beendet werden, wenn diese für die Durchbruchschmerzen nicht mehr benötigt wird.
Bei Patienten, bei denen die gesamte Opioid-Therapie abgesetzt werden muss, sollte die Breakyl-Dosis bei der schrittweisen Senkung der Opioid-Dosis berücksichtigt werden, um das plötzliche Auftreten von Entzugserscheinungen zu vermeiden.
Anwendung von Breakyl Der Patient sollte:
• den Beutel mit Breakyl erst unmittelbar vor der Anwendung entsprechend der auf dem Beutel gegebenen Hinweise öffnen;
• die Innenseite der Wange mit Hilfe der Zunge benetzen, oder den Mund mit Wasser ausspülen, um so die für die Platzierung von Breakyl vorgesehene Stelle anzufeuchten;
• den Breakyl-Buccalfilm mit trockenen Händen so zwischen Daumen und Zeigefinger nehmen, dass die rosafarbene Seite zum Daumen hin zeigt;
• den Breakyl-Buccalfilm so im Mund platzieren, dass die rosafarbene Seite flach an der Innenseite der Wange anliegt, und
• den Film dann dort mindestens 5 Sekunden lang andrücken, bis er fest haftet. Jetzt ist die weiße Seite sichtbar.
Hinweis für Breakyl 200 Mikrogramm Buccalfilm:
• Falls mehrere Breakyl-Buccalfilme gleichzeitig angewendet werden, sollte der Patient darauf achten, dass jeder Film direkt an der Mundschleimhaut haftet. Um eine Überlappung zu vermeiden, ist es auch möglich, die Filme jeweils an der linken und der rechten Wangeninnenseite zu platzieren.
Nun sollte der Breakyl-Buccalfilm von selbst dort haften bleiben. Nach 5 Minuten dürfen die Patienten etwas trinken.
Normalerweise löst sich der Breakyl-Buccalfilm innerhalb von 15 bis 30 Minuten nach der Anwendung vollständig auf. In einzelnen Fällen kann dieser Vorgang auch länger als 30 Minuten dauern. Dies beeinflusst jedoch nicht die Aufnahme des Wirkstoffs. Die Patienten sollten darauf hingewiesen werden, dass jede Manipulation des Buccalfilms mit der Zunge oder den Fingern zu vermeiden ist. Solange dieser sich nicht vollständig aufgelöst hat, sollten die Patienten nichts essen.
Wird ein Breakyl-Buccalfilm gekaut und/oder verschluckt, könnte das zu geringeren maximalen Konzentrationen und damit zu einer geringeren Bioverfügbarkeit als bei der bestimmungsgemäßen Anwendung führen (siehe Abschnitt 5.2).
Anwendung bei Kindern und Jugendlichen
Breakyl wird nicht empfohlen zur Anwendung bei Kindern und Jugendlichen unter 18 Jahren, da keine Daten zur Sicherheit und Wirksamkeit vorliegen.
Anwendung bei älteren Menschen
Es wurde gezeigt, dass ältere Patienten im Vergleich zu jüngeren empfindlicher auf intravenös verabreichtes Fentanyl reagieren. Bei älteren Menschen verläuft die Eliminierung von Fentanyl langsamer, und die terminale Halbwertzeit ist länger. Dadurch kann es zu einer Akkumulation des Wirkstoffes und somit zu einem höheren Risiko für unerwünschte Wirkungen kommen. Aus diesem Grund ist die Dosistitration mit besonderer Vorsicht anzugehen.
In klinischen Studien wurde jedoch kein Unterschied hinsichtlich der mittleren titrierten Dosis von Breakyl bei Patienten im Alter von 65 Jahren und älter und solchen, die jünger als 65 Jahre waren, festgestellt.
Anwendung bei speziellen Patientengruppen
Bei Patienten mit Leber- oder Nierenfunktionseinschränkungen ist während des Titrationsvorgangs besondere Vorsicht geboten.
Patienten mit einer Mukositis vom Schweregrad 1 sollten sorgfältig überwacht werden. Gegebenenfalls ist eine Dosisanpassung zu erwägen. Die Wirksamkeit und Unbedenklichkeit von Breakyl bei Patienten mit einem höheren Schweregrad der Mukositis als Grad 1 wurden nicht untersucht.
Falls der Beutel vor dem Öffnen bereits beschädigt wurde, darf der Buccalfilm nicht verwendet werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegenüber Fentanyl oder einem der sonstigen Bestandteile (siehe Abschnitt 6.1).
Gleichzeitige Anwendung von Monoaminoxidase-Hemmern (MAO-Hemmer), bzw. innerhalb von zwei Wochen nach Beendigung einer Therapie mit MAO-Hemmern (siehe auch Abschnitt 4.5).
Schwere Atemdepression oder schwere obstruktive Lungenerkrankungen.
Patienten ohne Opioid-Basistherapie (siehe Abschnitt 4.1), da ein erhöhtes Risiko für eine Atemdepression besteht.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Patienten und die sie pflegenden Personen müssen darüber in Kenntnis gesetzt werden, dass Breakyl einen Wirkstoff in einer Menge enthält, die für ein Kind tödlich sein kann. Daher ist Breakyl stets außerhalb der Reichweite und außer Sicht von Kindern und Nicht-Patienten aufzubewahren.
Zur Minimierung des Risikos von Opioid-bedingten Nebenwirkungen und zur Ermittlung der individuell wirksamen Dosis ist es unabdingbar, die Patienten während des Titrationsprozesses engmaschig ärztlich zu überwachen.
Es ist wichtig, dass die Basistherapie mit retardierten Opioiden zur Behandlung der Dauerschmerzen stabil eingestellt ist, bevor die Therapie mit Breakyl begonnen wird.
Im Zusammenhang mit der Anwendung von Breakyl besteht das Risiko einer klinisch relevanten Atemdepression. Besondere Vorsicht ist bei der Titration von Breakyl bei Patienten mit nicht schwerwiegender chronisch obstruktiver Lungenerkrankung oder anderen Erkrankungen geboten, die diese Patienten für eine Atemdepression prädisponieren. Bei diesen Patienten kann es sogar bei den üblichen therapeutischen Dosen von Breakyl zu Verringerung des Atemantriebes bis hin zur respiratorischen Insuffizienz kommen.
Breakyl sollte nur mit äußerster Vorsicht bei Patienten angewendet werden, die besonders anfällig für intrakraniale Wirkungen einer CO2-Retention sein können, wie zum Beispiel Patienten mit Anzeichen eines erhöhten intrakranialen Drucks oder einer Bewusstseinseinschränkung. Opioide können den klinischen Verlauf bei Patienten mit Kopfverletzungen verschleiern und sollten nur dann zum Einsatz kommen, wenn dies klinisch gerechtfertigt ist.
Intravenös angewendetes Fentanyl kann eine Bradykardie hervorrufen. Deshalb ist bei der Anwendung von Breakyl bei Patienten mit vorher bestehender Bradyarrhythmie Vorsicht geboten.
Besondere Aufmerksamkeit erfordern auch Patienten mit Hypovolämie und Hypotonie.
Ebenfalls mit Vorsicht sollte Breakyl bei Patienten mit Leber- oder Nierenfunktionsstörungen angewendet werden. Der Einfluss einer eingeschränkten Leber- oder Nierenfunktion auf die Pharmakokinetik des Arzneimittels wurde nicht untersucht. Es konnte jedoch gezeigt werden, dass die Clearance von Fentanyl nach intravenöser Anwendung bei Bestehen einer Leber- oder Nierenerkrankung aufgrund der Veränderungen von metabolischer Clearance und Plasmaproteinen beeinflusst wird. Nach der Anwendung von Breakyl kann eine eingeschränkte Leber- bzw. Nierenfunktion sowohl die Bioverfügbarkeit des
Fentanyl erhöhen als auch dessen systemische Clearance herabsetzen, was verstärkte und verlängerte Opioideffekte zur Folge haben kann. Daher ist während des Titrationsvorgangs bei Patienten mit mittelschwerer oder schwerer Leber- oder Nierenerkrankung besondere Sorgfalt geboten.
Unter der wiederholten Anwendung von Opioiden wie Fentanyl kann sich eine Gewöhnung und physische und / oder psychische Abhängigkeit entwickeln. Allerdings ist eine iatrogen hervorgerufene Sucht nach therapeutischer Anwendung von Opioiden selten.
Das in diesem Arzneimittel enthaltene Fentanyl kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Breakyl enthält Natriumbenzoat, Methyl-4-hydroxybenzoat, Propyl-4-hydroxybenzoat und Propylenglycol. Natriumbenzoat kann leichte Reizungen an Haut, Augen und Schleimhäuten hervorrufen. Methyl-4-hydroxybenzoat und Propyl-4-hydroxybenzoat können Überempfindlichkeitsreaktionen, auch Spätreaktionen, hervorrufen. Propylenglycol kann Hautreizungen hervorrufen.
Patienten mit einer Mukositis vom Schweregrad 1 sollten sorgfältig überwacht werden. Gegebenenfalls ist eine Dosisanpassung zu erwägen. Die Wirksamkeit und Unbedenklichkeit von Breakyl bei Patienten mit einem höheren Schweregrad der Mukositis als Grad 1 wurden nicht untersucht (siehe auch Abschnitte 4.2 und 5.2).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Breakyl darf bei Patienten, die Monoaminoxidase-Hemmer (MAO-Hemmer) erhalten oder in den letzten 14 Tagen erhalten haben, nicht angewendet werden, da eine starke und nicht vorhersagbare Potenzierung der Wirkung von Opioid-Analgetika durch MAO-Hemmer berichtet wurde (siehe Abschnitt 4.3).
Fentanyl wird über das CYP3A4-Isoenzym in der Leber und der Darmschleimhaut metabolisiert (siehe auch Abschnitt 5.2).
CYP3A4-Inhibitoren, wie z.B.
• Makrolid-Antibiotika (z.B. Erythromycin, Clarithromycin und Telithromycin),
• Azolfungizide (z.B. Ketoconazol, Itraconazol und Fluconazol),
• bestimmte Protease-Hemmer (z.B. Ritonavir, Indinavir, Nelfinavir und Saquinavir),
• Kalziumkanalblocker (z.B. Diltiazem oder Verapamil),
• Antiemetika (z.B. Aprepitant oder Dronabinol),
• Antidepressiva (z.B. Fluoxetin),
• Antazida (z.B. Cimetidin)
oder Coffein und Alkohol können die Bioverfügbarkeit von oral appliziertem Fentanyl erhöhen und die systemische Clearance herabsetzen, was verstärkte und verlängerte Opioideffekte zur Folge haben kann, und zu einer möglicherweise tödlichen Atemdepression führt.
Ähnliche Wirkungen wurden auch bei gleichzeitiger Einnahme von Grapefruitsaft beobachtet, der bekanntlich das CYP3A4-Isoenzym hemmt. Daher ist bei gleichzeitiger Gabe von Fentanyl und CYP3A4-Inhibitoren besondere Vorsicht geboten. Patienten, die Breakyl erhalten und eine Therapie mit CYP3A4-Inhibitoren beginnen bzw. die Dosis ihrer CYP3A4-Inhibitoren erhöhen, sollten über längere Zeit sorgfältig auf Anzeichen einer Opioidtoxizität überwacht werden.
Die gleichzeitige Anwendung von Breakyl mit potenten CYP3A4-Induktoren, wie z.B.
• Barbiturate und andere Sedativa (z.B. Phenobarbital),
• Antiepileptika (z.B. Carbamazepin, Phenytoin und Oxcarbazepin),
• bestimmte antivirale Mittel (z.B. Efavirenz oder Nevirapin),
• entzündungshemmende Mittel oder Immunsuppressiva (z.B. Glucocorticoide),
• Antidiabetika (z.B. Pioglitazon),
• Antibiotika zur Behandlung von Tuberkulose (z.B. Rifabutin oder Rifampicin),
• psychotrope Substanzen (z.B. Modafinil),
• Antidepressiva (z.B. Johanniskraut),
oder Nikotin und Alkohol können die Plasmakonzentration von Fentanyl herabsetzen, und so zu einer verminderten Wirksamkeit von Breakyl führen. Mit Breakyl behandelte Patienten, die eine Therapie mit CYP3A4-Induktoren beenden bzw. auf eine geringere Dosis umgestellt werden, sollten auf Anzeichen einer verstärkten Aktivität bzw. einer Toxizität von Breakyl überwacht werden. Die Breakyl-Dosis sollte gegebenenfalls entsprechend angepasst werden.
Die gleichzeitige Gabe von anderen zentral-dämpfenden Substanzen wie anderen Opioiden, Sedativa oder Hypnotika, Allgemeinanästhetika, Phenothiazinen, Tranquilizern, Muskelrelaxanzien, sedierenden Antihistaminika und Alkohol kann die dämpfenden Effekte verstärken.
Durch die Verabreichung von Wirkstoffen mit einer antagonistischen Wirkung auf Opioide (wie z.B. Naloxon) oder partiellen Agonisten (z.B. Pentazocin, Butorphanol, Buprenorphin, Nalbuphin) können Entzugssymptome ausgelöst werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Es liegen keine hinreichenden Daten für die Anwendung von Fentanyl bei schwangeren Frauen vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Das potentielle Risiko für den Menschen ist nicht bekannt. Fentanyl darf nicht während der Schwangerschaft angewendet werden, es sei denn, dies ist unbedingt erforderlich.
Nach einer Langzeitanwendung kann Fentanyl beim Neugeborenen Entzugssymptome hervorrufen.
Es wird angeraten, Fentanyl nicht während der Wehen und der Geburt (und auch nicht bei einer Sectio caesarea) anzuwenden, da Fentanyl plazentagängig ist und beim Fetus eine Atemdepression hervorrufen kann. Wenn Breakyl dennoch angewendet wird, sollte gleichzeitig ein Antidot für das Kind bereitgehalten werden.
Fentanyl geht in die Muttermilch über und kann beim gestillten Kind eine Sedierung und Atemdepression hervorrufen. Fentanyl soll von stillenden Frauen nicht angewendet werden. Das Stillen sollte frühestens 48 Stunden nach der letzten Anwendung von Breakyl wieder aufgenommen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Jedoch können Opioid-Analgetika die erforderliche geistige und / oder körperliche Fähigkeit zur Bewältigung potentiell gefährlicher Aufgaben (z.B. das Führen eines Fahrzeugs oder das Bedienen von Maschinen) beeinträchtigen. Die Patienten sollten angewiesen werden, kein Fahrzeug zu führen und keine Maschinen zu bedienen, wenn sie bei der Anwendung von Breakyl Schläfrigkeit, Schwindel oder Sehstörungen bei sich bemerken.
4.8 Nebenwirkungen
Bei der Anwendung von Breakyl sind die für Opioide typischen unerwünschten Wirkungen zu erwarten. Häufig verschwinden diese im Rahmen der Titration auf die am besten geeignete Dosis ganz oder nehmen bei fortgesetzter Anwendung des Arzneimittels an Intensität ab. Zu den schwerwiegendsten Nebenwirkungen im Zusammenhang mit Opioiden einschließlich Breakyl zählen Atemdepression (die potentiell zu einem Atemstillstand führen kann), kardiovaskuläre Depression, Hypotonie und Schock. Alle Patienten müssen sorgfältig auf diese Nebenwirkungen hin beobachtet werden.
Ziel der klinischen Studien zu Breakyl war es, die Sicherheit und Wirksamkeit bei der Behandlung von Patienten mit Durchbruchschmerzen im Zusammenhang mit ihrer Krebserkrankung zu untersuchen. Dabei erhielten alle Patienten gegen ihre Dauerschmerzen gleichzeitig Opioide, wie retardiertes Morphin, retardiertes Oxycodon oder transdermales Fentanyl. Daher ist es nicht möglich, die alleinigen Effekte von Breakyl eindeutig abzugrenzen.
Die hier aufgeführten Informationen zu den Nebenwirkungen spiegeln zum einen die gegenwärtigen Erfahrungen mit Breakyl bei der Behandlung von Durchbruchschmerzen in Kombination mit einer gleichzeitigen Gabe von Opioiden gegen die Dauerschmerzen wider.
Zum anderen wurden nachstehend als "sehr selten" angegebene Nebenwirkungen früher mit der Substanz Fentanyl in Zusammenhang gebracht, sind aber bisher in klinischen Studien mit Breakyl nicht beobachtet worden. Es wurde nicht versucht, die Aufstellung mit Hinblick auf die gleichzeitige Anwendung anderer Opioide, die Dauer der Breakyl-Therapie oder auf krebsbedingte Symptome zu korrigieren.
Zu den häufigsten beobachteten Nebenwirkungen zählen Übelkeit, Schläfrigkeit und Schwindel.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: Sehr häufig (>1/10), häufig (>1/100 bis <1/10), gelegentlich(>1/1 000 bis <1/100), selten (>1/10 000 bis <1/1 000), sehr selten (<1/10 000) oder nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Die folgenden Nebenwirkungen stehen möglicherweise mit der Behandlung im Zusammenhang: Stoffwechsel- und Ernährungsstörungen Gelegentlich: Appetitlosigkeit Psychiatrische Erkrankungen
Häufig: Verwirrtheitszustand
Gelegentlich: Angst, Halluzinationen, Wahnvorstellungen, abnorme Träume, Nervosität, Schlaflosigkeit, Unruhe
Sehr selten: abnorme Gedanken, Depersonalisation, Depressionen, Stimmungsschwankungen, Euphorie
Erkrankungen des Nervensystems
Häufig: Schläfrigkeit, Schwindel, Kopfschmerz, Sedierung
Gelegentlich: Geschmacksstörungen, Lethargie, Amnesie, kognitive Störungen
Sehr selten: Myoklonus, Parästhesie (einschließlich Hyperästhesie / zirkumorale Parästhesie), abnormer Gang / Koordinationsstörungen
Augenerkrankungen
Häufig: Sehstörungen (verschwommen oder Doppelbilder sehen)
Gefäßerkrankungen
Gelegentlich: Hitzewallung Sehr selten: Vasodilatation
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Atemdepression, verstopfte Nase Sehr selten: Dyspnoe
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Obstipation, Erbrechen, Mundtrockenheit
Gelegentlich: Diarrhoe, Stomatitis, Zahnfleischbluten, Dyspepsie, Mundulzeration, Schmerzen in der
Mundhöhle, Schmerzen beim Schlucken
Sehr selten: Abdominalschmerz, Flatulenz, Blähbauch
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Pruritus
Gelegentlich: Hyperhidrosis, verstärkte Neigung zu Blutergüssen Sehr selten: Hautausschlag
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Muskelzuckungen, Muskelschwäche, Myalgie, Arthralgie, Schmerzen in den Extremitäten, Schmerzen im Kiefer
Erkrankungen der Nieren und Harnwege
Gelegentlich: Harninkontinenz Sehr selten: Harnretention
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Fatigue
Gelegentlich: Asthenie, Schüttelfrost, Fieber, Durst
Sehr selten: Unwohlsein
Untersuchungen
Gelegentlich: erhöhter Blutdruck
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Gelegentlich: zufällige Verletzungen (z.B. durch Stürze)
4.9 Überdosierung
Es ist zu erwarten, dass die Symptome einer Überdosierung mit Breakyl mit denen von intravenös angewendetem Fentanyl und anderen Opioiden vergleichbar sind, und eine Verstärkung der pharmakologischen Wirkungen darstellen. Hierbei ist die Atemdepression die schwerwiegendste unerwünschte Wirkung.
Das unmittelbare Vorgehen bei einer Opioid-Überdosierung beinhaltet das Entfernen des Breakyl-Buccalfilms, wenn sich dieser noch im Mund befindet, die Sicherstellung von freien Atemwegen, körperliche und verbale Stimulierung des Patienten, die Beurteilung der Bewusstseinslage, des Atem- und Kreislaufstatus sowie, falls erforderlich, eine assistierte Beatmung (Atemunterstützung).
Für die Behandlung einer Opioid-naiven Person, die versehentlich Breakyl angewendet hat, sollte ein intravenöser Zugang gelegt und je nach klinischer Indikationsstellung Naloxon oder ein anderer OpioidAntagonist verabreicht werden. Eine Atemdepression als Folge einer Überdosierung kann länger anhalten als die Wirkungsdauer des Opioid-Antagonisten (so liegt zum Beispiel die Halbwertzeit von Naloxon im Bereich von 30 bis 81 Minuten), so dass eine wiederholte Gabe von Naloxon oder anderer OpioidAntagonisten erforderlich sein kann. Einzelheiten zur Anwendung sind der Fachinformation des jeweiligen Opioid-Antagonisten zu entnehmen.
Für die Behandlung einer Überdosierung bei Patienten, die eine Opioid-Basistherapie erhalten, sollte ein intravenöser Zugang gelegt werden. Der adäquate Einsatz von Naloxon oder eines anderen OpioidAntagonisten kann in manchen Fällen gerechtfertigt sein, ist allerdings mit dem Risiko der Auslösung eines akuten Entzugssyndroms verbunden.
Obwohl nach der Anwendung von Breakyl keine die Atmung beeinträchtigende Muskelsteifigkeit beobachtet wurde, ist diese für Fentanyl und andere Opioide bekannt. In diesem Fall sollte mit einer assistierten Beatmung, der Gabe eines Opioid-Antagonisten und, als letzte Alternative, mit neuromuskulären Blockern behandelt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Analgetika; Opioide, Phenylpiperidin-Derivate ATC-Code: N02AB03
Der reine Opioid-Rezeptor-Agonist Fentanyl wirkt vor allem durch Bindung an p-Rezeptoren, die sich im Gehirn, im Rückenmark und in der glatten Muskulatur befinden.
Der primäre Angriffspunkt der therapeutischen Wirkung ist das zentrale Nervensystem (ZNS). Die aus klinischer Sicht nützlichste pharmakologische Wirkung von Fentanyl ist die Analgesie.
Bei Patienten mit chronischen Tumorschmerzen, die mit gleich bleibenden Dosen regelmäßig verabreichter Opioide zur Behandlung ihres Dauerschmerzes effektiv eingestellt sind, senkte Breakyl 15, 30, 45 und 60 Minuten nach der Verabreichung im Vergleich zu Placebo signifikant die Schmerzintensität, ausgedrückt als die Summe der Schmerzintensitätsdifferenzen vom Ausgangswert (Sum of Pain Intensity Differences = SPID).
Die analgetischen Wirkungen von Fentanyl sind abhängig vom Blutspiegel des Wirkstoffes, wobei die Verzögerung des Übergangs in das ZNS und aus dem ZNS berücksichtigt werden muss (ein Prozess mit einer Halbwertzeit von 3 bis 5 Minuten). Bei Patienten ohne Vorbehandlung mit Opioiden tritt die Analgesie bei Blutspiegeln von 1 bis 2 ng/ml ein, während Blutspiegel von 10 - 20 ng/ml zu einer chirurgischen Anästhesie und starker Atemdepression führen würden.
Sekundäre Wirkungen sind unter anderem ein Anstieg des Tonus und eine Verminderung der Kontraktionen der glatten Muskulatur des Magen-Darm-Trakts. Das führt zu einer Verlängerung der Magen-Darm-Trakt-Passage, und dürfte für die Obstipation bei einer Opioid-Therapie verantwortlich sein.
Während Opioide im Allgemeinen den Tonus der glatten Muskulatur des Harntrakts erhöhen, schwankt die Gesamtwirkung, wobei in einigen Fällen Harndrang und in anderen Fällen Schwierigkeiten beim Harnlassen ausgelöst werden.
Alle p-Rezeptor-Agonisten, einschließlich Fentanyl, verursachen eine dosisabhängige Atemdepression. Das Risiko einer Atemdepression ist bei Schmerzpatienten, die eine chronische Opioid-Therapie erhalten, geringer, weil diese Patienten hinsichtlich Atemdepression und anderen Opioid-Wirkungen eine Toleranz entwickeln.
5.2 Pharmakokinetische Eigenschaften
Allgemeine Einleitung
Fentanyl ist stark lipophil und kann sehr rasch über die Mundschleimhaut und etwas langsamer über den konventionellen gastrointestinalen Weg resorbiert werden. Es wird einer First-Pass-Metabolisierung in Leber und Darm unterzogen. Die Metaboliten haben keinen Anteil an den therapeutischen Wirkungen von Fentanyl.
Resorption
In einer pharmakokinetischen Untersuchung wurde Breakyl nach Anwendung in der Mundhöhle rasch resorbiert. Die absolute Bioverfügbarkeit betrug 71 %. Diese Studie zur absoluten Bioverfügbarkeit zeigte auch ähnliche pharmakokinetische Eigenschaften in den Untergruppen der 6 männlichen und 6 weiblichen erwachsenen Probanden.
Die Resorptionspharmakokinetik von Fentanyl aus Breakyl ist eine Kombination einer schnellen initialen Resorption durch die Mundschleimhaut und einer langsameren Resorption von geschlucktem Fentanyl aus dem Gastrointestinaltrakt. Wie aus der Studie zur absoluten Bioverfügbarkeit hervorgeht, werden etwa 51 % der Gesamtdosis Breakyl rasch durch die Mundschleimhaut resorbiert und systemisch verfügbar.
Die restlichen 49 % der Gesamtdosis werden mit dem Speichel geschluckt und dann langsam aus dem Gastrointestinaltrakt resorbiert. Etwa ein Drittel dieser Menge (20 % der Gesamtdosis) entgeht der FirstPass-Elimination in Leber und Darm und wird systemisch verfügbar. Somit verteilt sich die beobachtete absolute Bioverfügbarkeit von 71 % von Breakyl zwischen schneller transmukosaler Resorption und langsamerer Resorption aus dem Gastrointestinaltrakt. Wird eine Dosiereinheit Breakyl gekaut und/oder geschluckt, führt das wahrscheinlich zu einer geringeren maximalen Konzentration und zu einer geringeren Bioverfügbarkeit als bei der bestimmungsgemäßen Anwendung.
Die Dosisproportionalität wurde über den Bereich der verfügbaren Dosierungen (200 Mikrogramm bis 1200 Mikrogramm) von Breakyl nachgewiesen. Nach Anwendung eines einzelnen Breakyl-Buccalfilms (200 Mikrogramm bis 1200 Mikrogramm), bewegt sich der mittlere Cmax-Wert normalerweise in einem Bereich zwischen 0,38 und 2,19 ng/ml (abhängig von der Dosis) und der Tmax-Wert liegt zwischen 45 Minuten und 240 Minuten (Median: 60 Minuten). Die Anwendung von Breakyl auf einem aktiven Bereich einer Mukositis (Schweregrad 1) bei einer Gruppe von Krebspatienten führte zu einer Abnahme der Cmax- und AUCinf-Werte. Patienten mit einer Mukositis vom Schweregrad 1 sollten sorgfältig überwacht werden. Gegebenenfalls ist eine Dosisanpassung zu erwägen. Die Wirksamkeit und Unbedenklichkeit von Breakyl bei Patienten mit einem höheren Schweregrad der Mukositis als Grad 1 wurden nicht untersucht.
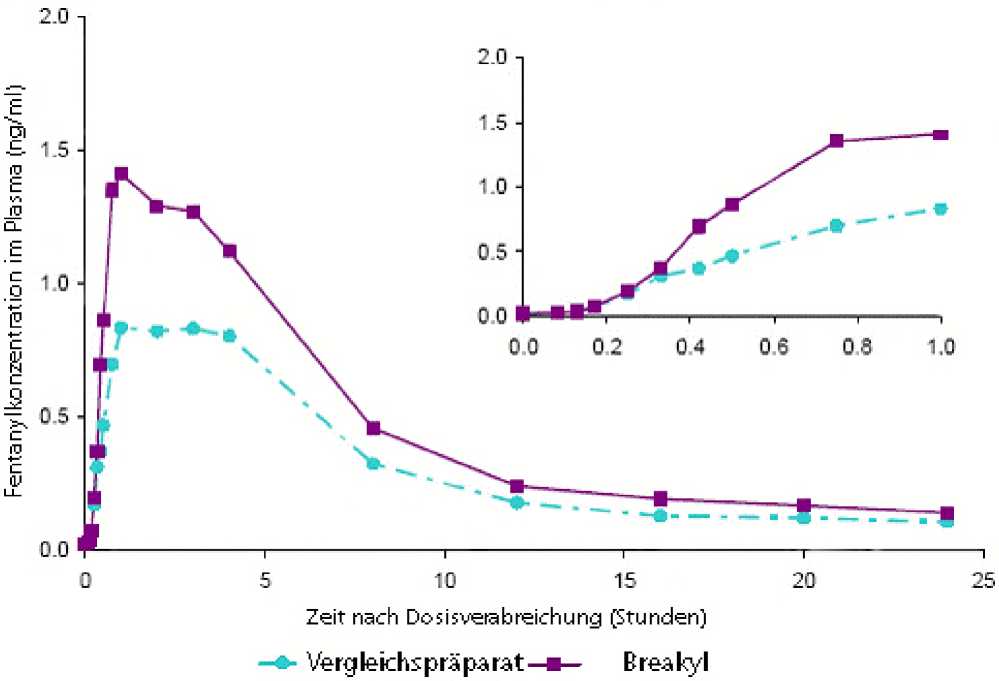
Mittlere Fentanyl-Plasma-Konzentration (24-Stunden- und 1-Stunden-Profil) nach Einzeldosen von 800 Mikrogramm Breakyl oder 800 Mikrogramm eines Vergleichspräparates (oromukosaler Fentanyl-Applikator) bei gesunden erwachsenen Probanden
Verteilung
Fentanyl ist stark lipophil. Tierexperimentelle Daten zeigen, dass Fentanyl sich nach der Resorption zunächst schnell in Gehirn, Herz, Lunge, Nieren und Milz verteilt und dann langsamer in Muskeln und Fett umverteilt wird. Die Plasmaproteinbindung von Fentanyl beträgt 80 % bis 85 %. Das wichtigste Bindungsprotein ist das saure alpha-1- Glykoprotein, aber auch Albumin und Lipoproteine tragen bis zu einem gewissen Maß dazu bei.
Der freie Anteil von Fentanyl erhöht sich bei Vorliegen einer Azidose. Im Steady State beträgt das mittlere Verteilungsvolumen (Vss) 4 l/kg.
Biotransformation
Fentanyl wird in der Leber und in der Darmschleimhaut durch das Cytochrom P450 (CYP3A4 Isoform) zu Norfentanyl metabolisiert. In Tierstudien ist Norfentanyl pharmakologisch nicht aktiv. Fentanyl wird hauptsächlich (zu mehr als 90 %) durch Biotransformation zu N-dealkylierten und hydroxylierten inaktiven Metaboliten eliminiert.
Elimination
Weniger als 7 % der Dosis wird unverändert im Urin ausgeschieden, und nur etwa 1 % wird unverändert in den Faeces ausgeschieden. Die Metaboliten werden vorwiegend über den Urin ausgeschieden, während die fäkale Exkretion eine geringere Rolle spielt. Die Gesamtplasma-Clearance von Fentanyl beträgt 0,5 l/Std./kg
(Bereich: 0,3 bis 0,7 l/Std./kg). Die klinisch relevante Halbwertzeit von Fentanyl nach der Gabe von Breakyl beläuft sich auf etwa sieben Stunden, die terminale Eliminationshalbwertzeit auf etwa 14 Stunden.
5.3 Präklinische Daten zur Sicherheit
Die präklinischen Daten aus den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität und Kanzerogenität lassen kein besonderes Gefahrenpotential für den Menschen erkennen.
Toxizitätsstudien zur embryonalen/fetalen Entwicklung an Ratten und Kaninchen zeigten keine Substanzinduzierten Missbildungen oder Entwicklungsstörungen bei Verabreichung während der Organogenese.
In einer Studie zur Fertilität und frühen embryonalen Entwicklung an Ratten wurde bei hohen Dosierungen (300 gg/kg/Tag, s.c.) ein durch die männlichen Tiere vermittelter Effekt beobachtet. Dieser Effekt hängt vermutlich mit den sedierenden Auswirkungen von Fentanyl im Tierversuch zusammen.
In Studien zur prä- und postnatalen Entwicklung an Ratten war bei ausgeprägt maternal toxischen Dosierungen die Überlebensrate der Nachkommen signifikant herabgesetzt. Weitere Befunde nach Gabe von maternal toxischen Dosen waren bei F1 Jungtieren eine Verzögerung der physischen Entwicklung, der sensorischen Funktionen, der Reflexe und des Verhaltens. Diese Effekte könnten entweder indirekt durch ein verändertes Pflegeverhalten der Mutter und/oder eine verminderte Milchproduktion oder durch eine direkte Wirkung von Fentanyl auf die Jungtiere ausgelöst worden sein.
Kanzerogenitätsstudien ergaben keine Hinweise auf ein krebsauslösendes Potential (26-wöchiger alternativer Haut-Bioassay an transgenen Tg.AC Mäusen; 2-jährige Studie an Ratten mit subkutaner Applikation).
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Wirkstoffhaltige Schicht:
Propylenglycol (E1520)
Natriumbenzoat (E211)
Methyl-4-hydroxybenzoat (Ph.Eur.) (E218)
Propyl-4-hydroxybenzoat (Ph.Eur.) (E216)
Eisen(III)-oxid (E172)
Citronensäure
all-rac-alpha-Tocopherolacetat (Ph.Eur.)
Natriumdihydrogenphosphat
Natriumhydroxid
Natriumphosphat
Polycarbophil
Hyprolose
Hyetellose
Carmellose-Natrium (Ph.Eur.)
Deckschicht:
Natriumbenzoat (E211)
Methyl-4-hydroxybenzoat (Ph.Eur.) (E218)
Propyl-4-hydroxybenzoat (Ph.Eur.) (E216)
Citronensäure
all-rac-alpha-Tocopherolacetat (Ph.Eur.)
Hyprolose
Hyetellose Titandioxid (E171) Saccharin-Natrium Pfefferminzöl
6.2 Inkompatibilitäten
Nicht bekannt.
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30° C lagern.
Nicht im Kühlschrank lagern.
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
Jeder Buccalfilm ist einzeln verpackt in einem kindergesicherten Beutel, der aus einem Schichtstoff aus Polyacrylnitril, Aluminium, Polyamid und Papier besteht. (Hinweis: Nur für das Aveva-Produkt)
Jeder Buccalfilm ist einzeln verpackt in einem kindergesicherten Beutel, der aus einem Schichtstoff aus Polyacrylnitril, Aluminium, Polyethylenterephthalat (PET) und Papier besteht. (Hinweis: Nur für das LTS-Produkt)
Breakyl 200, 400, 600, 800 und 1200 Mikrogramm Buccalfilm:
Packungen mit 4, 10 oder 28 Beuteln mit je einem Buccalfilm.
Breakyl Start 200, 400, 600 und 800 Mikrogramm Buccalfilm:
4 Beutel mit je einem Buccalfilm der Stärken 200, 400, 600 und 800 Mikrogramm in einer Packung.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNGEN
MEDA Pharma GmbH & Co. KG Benzstr. 1
61352 Bad Homburg
Tel.-Nr. 06172 888 01 Fax-Nr. 06172 888 2740 E-mail: medinfo@medapharma.de
8. ZULASSUNGSNUMMERN
73181.00. 00
73182.00. 00
73183.00. 00
73184.00. 00
73185.00. 00
73186.00. 00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung Zulassung: 28 Februar 2011 Datum der letzten Verlängerung der Zulassung: April 2013
10. STAND DER INFORMATION
Oktober 2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Betäubungsmittel
16