Brevibloc 10 Mg/Ml Infusionslösung
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Brevibloc 10 mg/ml Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Brevibloc 10 mg/ml Infusionslösung enthält 10 mg Esmololhydrochlorid pro ml. Ein 250 ml-Beutel enthält 2500 mg Esmololhydrochlorid.
Sonstige Bestandteile mit bekannter Wirkung: Dieses Arzneimittel enthält ca. 30,45 mmol (bzw. 700 mg) Natrium pro Beutel.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM Infusionslösung.
Klare, farblose bis leicht gelbliche Lösung.
Die Lösung hat einen pH-Wert zwischen 4,5 und 5,5 und eine Osmolarität von ca. 300 mOsm/l.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Brevibloc ist indiziert bei supraventrikulären Tachykardien (außer bei Präexitationssyndromen) und wenn eine schnelle Kontrolle einer erhöhten Kammerfrequenz bei Patienten mit Vorhofflimmern oder Vorhofflattern perioperativ, postoperativ oder unter anderen Bedingungen erwünscht ist und eine kurzdauernde Kontrolle der Kammerfrequenz mit einer kurzwirksamen Substanz angebracht ist. Brevibloc kann ebenfalls bei Tachykardie und Hypertonie in der perioperativen Phase und bei nicht kompensatorischer Sinustachykardie gegeben werden, wenn nach dem Urteil des behandelnden Arztes eine besondere Behandlungsnotwendigkeit besteht.
Brevibloc ist nicht indiziert für die Anwendung bei Kindern und Jugendlichen bis zu 18 Jahren (siehe Abschnitt 4.2). Brevibloc eignet sich nicht zur Behandlung von chronischen Erkrankungen.
4.2 Dosierung und Art der Anwendung
Brevibloc 10 mg/ml Infusionslösung ist eine gebrauchsfertige isoosmotische Lösung zur intravenösen Anwendung.
Sie wird zur Verabreichung einer geeigneten Einleitungs- bzw. Bolusdosis Brevibloc mittels Spritze verwendet.
Supraventrikuläre Tachyarrhythmie
Bei supraventrikulärer Tachyarrhythmie muss die Brevibloc-Dosis individuell titriert werden. Jede Stufe besteht aus einer Einleitungsdosis mit anschließender Erhaltungsdosis. Die wirksame Erhaltungsdosis liegt zwischen 50 und 200 Mikrogramm/kg/Minute, wobei auch Dosen von 25 bis 300 Mikrogramm/kg/Minute verwendet wurden.
Übersicht über Einleitung und Erhaltung der Behandlung
Infusion einer Einleitungsdosis von 500 Mikrogramm/kg/Minute über eine Minute, DANACH Infusion einer Erhaltungsdosis von 50 Mikrogramm/kg/Minute über 4 Minuten

Ansprechen
Aufrechterhalten der Infusion bei 50 Mikrogramm/kg/Minute
Unzureichendes Ansprechen innerhalb von 5 Minuten
Die Dosis von 500 Mikrogramm/kg/Minute über 1 Minute wiederholen Die Erhaltungsdosis auf
100 Mikrogramm/kg/Minute über 4 Minuten steigern
Ansprechen
Aufrechterhalten der Infusion bei 100 Mikrogramm/kg/Minute
Unzureichendes Ansprechen innerhalb von 5 Minuten
Die Dosis von 500 Mikrogramm/kg/Minute über 1 Minute wiederholen Die Erhaltungsdosis auf
150 Mikrogramm/kg/Minute über 4 Minuten steigern

Ansprechen
Aufrechterhalten der Infusion bei 150 Mikrogramm/kg/Minute
Unzureichendes Ansprechen
Die Dosis von 500 Mikrogramm/kg/Minute über 1 Minute wiederholen Die Erhaltungsdosis auf
200 Mikrogramm/kg/Minute steigern und beibehalten
Tabelle 1 und 2 enthalten Angaben zu der jeweiligen Einleitungsdosis und Erhaltungsdosis von Brevibloc in Abhängigkeit vom Patientengewicht.
Tabelle 1
Erforderliches Volumen von Brevibloc 10 mg/ml für eine EINLEITUNGSDOSIS von 500 pg/kg/Minute
|
Gewicht des Patienten (kg) | |||||||||
|
40 |
50 |
60 |
70 |
80 |
90 |
100 |
110 |
120 | |
|
Volumen (ml) |
2 |
2,5 |
3 |
3,5 |
4 |
4,5 |
5 |
5,5 |
6 |
Tabelle 2
Erforderliches Volumen von Brevibloc 10 mg/ml für eine ERHALTUNGSDOSIS bei Infusionsraten zwischen 12,5 und 300 pg/kg/Minute
|
Gewicht |
Dosisrate | ||||||
|
des Patienten (kg) |
12,5 pg/kg/min |
25 pg/kg/min |
50 pg/kg/min |
100 pg/kg/min |
150 pg/kg/min |
200 pg/kg/min |
300 pg/kg/min |
|
(kg) | |||||||
|
Erforderliche Menge zum Erreichen der Dosisrate pro Stunde (ml/h) | |||||||
|
40 |
3 ml/h |
6 ml/h |
12 ml/h |
24 ml/h |
36 ml/h |
48 ml/h |
72 ml/h |
|
50 |
3,75 ml/h |
7,5 ml/h |
15 ml/h |
30 ml/h |
45 ml/h |
60 ml/h |
90 ml/h |
|
60 |
4,5 ml/h |
9 ml/h |
18 ml/h |
36 ml/h |
54 ml/h |
72 ml/h |
108 ml/h |
|
70 |
5,25 ml/h |
10,5 ml/h |
21 ml/h |
42 ml/h |
63 ml/h |
84 ml/h |
126 ml/h |
|
80 |
6 ml/h |
12 ml/h |
24 ml/h |
48 ml/h |
72 ml/h |
96 ml/h |
144 ml/h |
|
90 |
6,75 ml/h |
13,5 ml/h |
27 ml/h |
54 ml/h |
81 ml/h |
108 ml/h |
162 ml/h |
|
100 |
7,5 ml/h |
15 ml/h |
30 ml/h |
60 ml/h |
90 ml/h |
120 ml/h |
180 ml/h |
|
110 |
8,25 ml/h |
16,5 ml/h |
33 ml/h |
66 ml/h |
99 ml/h |
132 ml/h |
198 ml/h |
|
120 |
9 ml/h |
18 ml/h |
36 ml/h |
72 ml/h |
108 ml/h |
144 ml/h |
216 ml/h |
Sobald die gewünschte Herzfrequenz oder der gewünschte Sicherheitsendpunkt (z. B. Blutdrucksenkung) erreicht wird, die Einleitungsdosis stoppen und die Erhaltungsdosis schrittweise von 50 Mikrogramm/kg/Minute auf 25 Mikrogramm/kg/Minute oder weniger reduzieren. Gegebenenfalls kann das Intervall zwischen den Titrationsstufen von 5 auf 10 Minuten gesteigert werden.
HINWEIS: Erhaltungsdosen von über 200 Mikrogramm/kg/Minute haben keine signifikanten Vorteile gezeigt. Die Sicherheit von Dosen über 300 Mikrogramm/kg/Minute wurde nicht untersucht.
Perioperative Tachykardie und Hypertonie
Bei der Behandlung von Tachykardie und/oder Hypertonie unter perioperativen Bedingungen können folgende Dosierungsschemata angewendet werden:
Bei der intraoperativen Behandlung - während der Anästhesie, wenn eine sofortige Kontrolle erforderlich ist,
• wird über 15 bis 30 Sekunden eine Bolusinjektion von 80 mg verabreicht, gefolgt von einer Infusion von 150 Mikrogramm/kg/Minute. Die Infusionsrate bei Bedarf bis auf 300 Mikrogramm/kg/Minute titrieren. In Tabelle 2 ist das Infusionsvolumen in Abhängigkeit vom Patientengewicht angegeben.
Nach dem Erwachen aus der Narkose
• eine Dosis von 500 Mikrogramm/kg/Minute über 4 Minuten infundieren, gefolgt von einer Infusion von 300 Mikrogramm/kg/Minute. In Tabelle 2 ist das Infusionsvolumen in Abhängigkeit vom Patientengewicht angegeben.
In postoperativen Situationen — sofern Zeit für die Titration bleibt
• vor jeder Titrationsstufe über 1 Minute die Einleitungsdosis von 500 Mikrogramm/kg/Minute verabreichen, um einen raschen Wirkungseintritt zu erreichen. Titrationsstufen von 50, 100, 150, 200, 250 und 300 Mikrogramm/kg/Minute über einen Zeitraum von 4 Minuten verabreichen, bis der gewünschte Therapieeffekt eintritt. In Tabelle 2 ist das Infusionsvolumen in Abhängigkeit vom Patientengewicht angegeben.
Potenzielle Effekte bei der Dosierung
Wenn Nebenwirkungen auftreten, kann die Gabe von Brevibloc reduziert oder abgebrochen werden. Unerwünschte pharmakologische Wirkungen sollten innerhalb von 30 Minuten abklingen.
Beim Auftreten lokaler Reizungen an der Infusionsstelle eine andere Infusionsstelle wählen. Dabei vorsichtig vorgehen, um eine Extravasation zu vermeiden.
Die Verabreichung von Brevibloc über einen Zeitraum von mehr als 24 Stunden wurde nicht hinreichend untersucht. Infusionen über einen Zeitraum von mehr als 24 Stunden dürfen nur mit Vorsicht durchgeführt werden.
Es wird empfohlen, die Infusion schrittweise zu beenden, um das Risiko eines übermäßigen Anstiegs der Herzfrequenz und des Blutdrucks (ReboundPhänomen) zu vermeiden. Da wie bei allen Beta-Blockern Entzugssymptome nicht ausgeschlossen werden können, darf die Brevibloc-Verabreichung bei Patienten mit Koronararterienerkrankungen nicht abrupt beendet werden.
Umstellung der Brevibloc-Therapie auf Alternativpräparate
Sobald eine ausreichende Kontrolle der Herzfrequenz erreicht worden ist und die Patienten klinisch stabil sind, kann auf alternative Medikamente (z. B. Antiarrhythmika oder Calciumantagonisten) umgestellt werden.
Dosisreduktion:
Wenn von Brevibloc auf Alternativpräparate umgestellt werden soll, sollte sich der Arzt mit der Packungsbeilage des ausgewählten Alternativmedikaments vertraut machen und die Dosierung von Brevibloc folgendermaßen herabsetzen:
• Innerhalb der ersten Stunde nach der ersten Gabe des Alternativpräparats die Infusionsrate von Brevibloc um die Hälfte (50 %) reduzieren.
• Nach der zweiten Dosis des Alternativpräparats überprüfen, wie der Patient auf das Präparat anspricht. Falls eine zufriedenstellende Kontrolle der Herzfrequenz während der ersten Stunde erreicht ist, die Infusion von Brevibloc beenden.
Weitere Hinweise zur Dosierung
Sobald die gewünschte therapeutische Wirkung oder der gewünschte Sicherheitsendpunkt (z. B. Blutdrucksenkung) erreicht ist, die Einleitungsdosis stoppen und die Dosis schrittweise auf 12,5 bis 25 Mikrogramm/kg/Minute herabsetzen.
Außerdem kann bei Bedarf das Intervall zwischen den Titrationsstufen von 5 auf 10 Minuten gesteigert werden.
Die Gabe von Brevibloc beenden, wenn die Sicherheitsgrenze der Herzfrequenz oder des Blutdrucks rasch erreicht bzw. überschritten wird. Nach Stabilisierung der hämodynamischen Parameter (Blutdruck, Herzfrequenz) ohne Einleitungsdosis mit einer niedrigeren Dosis fortfahren.
Spezielle Patientengruppen
Ältere Patienten
Ältere Patienten mit Vorsicht behandeln und mit einer niedrigeren Dosis beginnen.
Es wurden keine speziellen Studien mit älteren Patienten durchgeführt. Die Auswertung der Daten von 252 Patienten über 65 Jahren lässt aber darauf schließen, dass es im Hinblick auf die pharmakodynamische Wirkung keine Unterschiede im Vergleich zu den Daten von Patienten unter 65 Jahren gibt.
Patienten mit Niereninsuffizienz
Bei Patienten mit Niereninsuffizienz ist Vorsicht geboten, wenn Brevibloc als Infusion gegeben wird, da der Säuremetabolit von Brevibloc unverändert über die Nieren ausgeschieden wird. Die Ausscheidung des Säuremetaboliten ist bei Patienten mit terminaler Niereninsuffizienz deutlich vermindert, und die Plasmaspiegel sind deutlich erhöht.
Patienten mit Leberinsuffizienz
Bei Leberinsuffizienz sind keine besonderen Vorsichtsmaßnahmen erforderlich, da die Esterasen in den Erythrozyten eine wesentliche Rolle im Brevibloc-Stoffwechsel spielen.
Pädiatrische Patienten
Über die Wirksamkeit und Sicherheit von Brevibloc bei Kindern bis zu 18 Jahren liegen keine Daten vor. Daher ist Brevibloc nicht indiziert für die Anwendung bei Kindern und Jugendlichen (siehe Abschnitt 4.1). Zurzeit vorliegende Daten werden in Abschnitt 5.1 und 5.2 beschrieben, eine Dosierungsempfehlung kann jedoch nicht gegeben werden.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff, einen der in Abschnitt 6.1 genannten sonstigen Bestandteile oder andere Beta-Blocker (Kreuzallergien mit Beta-Blockern sind möglich)
• Schwere Sinusbradykardie (Herzfrequenz weniger als 50 Schläge/Minute)
• Sinusknotensyndrom, schwere Störungen der AV-Knotenleitung (ohne Herzschrittmacher), AV-Block zweiten oder dritten Grades
• Kardiogener Schock
• Schwere Hypotonie
• Dekompensierte Herzinsuffizienz
• Gleichzeitige oder kürzlich erfolgte intravenöse Verabreichung von Verapamil. Brevibloc darf erst 48 Stunden nach Absetzen von Verapamil angewendet werden (siehe Abschnitt 4.5)
• Unbehandeltes Phäochromozytom
• Pulmonale Hypertonie
• Akuter Asthmaanfall
• Metabolische Azidose
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Warnhinweise
Es wird empfohlen, bei allen Patienten, die mit Brevibloc behandelt werden, den Blutdruck und die Herzfrequenz (EKG) kontinuierlich zu überwachen.
Bei Patienten mit supraventrikulären Arrhythmien darf Brevibloc zur Kontrolle der ventrikulären Funktion nur mit Vorsicht angewendet werden, wenn die Patienten hämodynamisch instabil sind oder andere Arzneimittel einnehmen, die einen oder alle der folgenden Parameter herabsetzen: Peripherer Widerstand, Myokardfüllung, myokardiale Kontraktilität oder elektrische Reizübertragung im Myokard. Trotz des raschen Eintritts und Abklingens der Wirkung von Brevibloc können schwere Reaktionen auftreten, wie zum Beispiel Bewusstseinsverlust, kardiogener Schock, Herzstillstand. Es wurden mehrere Todesfälle im Zusammenhang mit komplexen klinischen Zuständen berichtet, bei denen Brevibloc vermutlich zur Kontrolle der Kammerfrequenz verabreicht wurde.
Die am häufigsten beobachtete Nebenwirkung ist Hypotonie, die zwar dosisabhängig ist, aber bei jeder Dosis auftreten kann. Diese kann schwerwiegend sein. Bei einer hypotensiven Episode unbedingt die Infusionsrate herabsetzen oder gegebenenfalls die Infusion beenden. Eine Hypotonie ist normalerweise reversibel (innerhalb von 30 Minuten nach Absetzen von Brevibloc). In einigen Fällen können zusätzliche Interventionen notwendig sein, um wieder normale Blutdruckwerte zu erreichen. Bei Patienten mit niedrigem systolischem Blutdruck ist bei der Anpassung der Dosis und während der Infusion der Erhaltungsdosis besondere Vorsicht geboten.
Bei der Anwendung von Brevibloc ist es zu Bradykardie - zum Teil mit schwerer Ausprägung - und Herzstillstand gekommen. Brevibloc bei Patienten mit niedriger Herzfrequenz vor der Behandlung nur mit besonderer Vorsicht und nur nach einer sorgfältigen Nutzen-RisikoAbwägung anwenden.
Brevibloc ist bei Patienten mit vorbestehender Sinusbradykardie kontraindiziert (siehe Abschnitt 4.3). Die Dosis reduzieren oder die Verabreichung beenden, wenn die Herzfrequenz auf weniger als 50 - 55 Schläge pro Minute in Ruhe sinkt und beim Patienten typische Symptome einer Bradykardie auftreten.
Eine Aktivierung des sympathischen Nervensystems ist notwendig, um bei dekompensierter Herzinsuffizienz die Kreislauffunktion zu unterstützen. Eine Beta-Blockade birgt das potenzielle Risiko, die myokardiale Kontraktilität weiter herabzusetzen und eine noch schwerere Herzinsuffizienz auszulösen. In manchen Fällen kann eine kontinuierliche Myokarddepression mit Beta-Blockern über einen längeren Zeitraum zu Herzversagen führen.
Bei der Anwendung von Brevibloc bei Patienten mit eingeschränkter Herzfunktion ist besondere Vorsicht geboten. Beim ersten Anzeichen oder Symptom eines bevorstehenden Herzversagens muss die Therapie mit Brevibloc abgebrochen werden. Obwohl es aufgrund der kurzen Eliminationshalbwertzeit von Brevibloc ausreichen kann, das Arzneimittel abzusetzen, sollte gegebenenfalls eine spezifische Behandlung in Erwägung gezogen werden (siehe Abschnitt 4.9). Brevibloc ist kontraindiziert bei Patienten mit dekompensierter Herzinsuffizienz (siehe Abschnitt 4.3).
Wegen der negativen Auswirkungen auf die Überleitungszeit des Herzens dürfen Beta-Blocker bei Patienten mit kardialem Block ersten Grades oder anderen kardialen Reizleitungsstörungen nur mit Vorsicht eingesetzt werden (siehe Abschnitt 4.3).
Bei Patienten mit Phäochromozytom darf Brevibloc nur mit Vorsicht und nur nach vorheriger Therapie mit Alpha-Rezeptorenblockern angewendet werden (siehe Abschnitt 4.3).
Vorsicht ist geboten, wenn Brevibloc zur Behandlung einer Hypertonie nach induzierter Hypothermie angewendet wird.
Patienten mit bronchospastischen Erkrankungen sollten im Allgemeinen keine Beta-Blocker erhalten. Wegen seiner relativen Beta-1-Selektivität und seiner Titrierbarkeit darf Brevibloc bei Patienten mit bronchospastischen Erkrankungen nur mit Vorsicht angewendet werden. Da die Beta-1-Selektivität jedoch nicht absolut ist, sollte Brevibloc sorgfältig titriert werden, um die niedrigste wirksame Dosis zu erreichen. Bei Bronchospasmen die Infusion sofort abbrechen und gegebenenfalls einen Beta-2-Agonisten verabreichen.
Wenn der Patient bereits ein Beta-2-Sympathikometikum verwendet, muss dieses gegebenenfalls neu dosiert werden.
Brevibloc bei Patienten mit bekannten Atembeschwerden oder Asthma nur mit Vorsicht einsetzen.
Vorsichtsmaßnahmen
Brevibloc bei Diabetes oder bei vermuteter oder tatsächlicher Hypoglykämie nur mit Vorsicht anwenden. Beta-Blocker können die prodromalen Symptome einer Hypoglykämie, wie z. B. Tachykardie, überdecken. Etwaige Benommenheit und Schweißausbrüche sollten davon unbeeinflusst bleiben. Durch gleichzeitige Gabe von Beta-Blockern und Antidiabetika kann die (blutzuckersenkende) Wirkung der Antidiabetika verstärkt werden (siehe Abschnitt 4.5).
Bei der Verwendung von Brevibloc 10 mg/ml und 20 mg/ml ist es zu Reaktionen an der Infusionsstelle gekommen. Hierzu gehörten Reizungen und Entzündungen an der Infusionsstelle sowie schwerere Reaktionen wie Thrombophlebitis, Nekrose und Blasenbildung, insbesondere im Zusammenhang mit Extravasation (siehe Abschnitt 4.8). Brevibloc möglichst nicht in kleine Venen oder über einen Butterfly-Katheter infundieren. Beim Auftreten lokaler Reizungen an der Infusionsstelle eine andere Infusionsstelle wählen.
Beta-Blocker können bei Patienten mit Prinzmetal-Angina die Anzahl und Dauer von anginösen Anfällen aufgrund einer ungehinderten alpha-Rezeptoren-vermittelten Vasokonstriktion der Koronararterien erhöhen. Nicht-selektive Beta-Blocker dürfen bei diesen Patienten überhaupt nicht, und Beta-1-selektive Blocker nur mit äußerster Vorsicht verwendet werden.
Bei hypovolämischen Patienten kann Brevibloc zu einer Abschwächung der Reflextachykardie führen und das Risiko eines Kreislaufkollaps erhöhen. Brevibloc sollte daher bei diesen Patienten nur mit Vorsicht eingesetzt werden.
Bei Patienten mit peripheren Kreislaufstörungen (Raynaud-Syndrom, Claudicatio intermittens) Beta-Blocker nur mit äußerster Vorsicht einsetzen, da sich diese Störungen verstärken können.
Manche - vor allem intravenöse applizierte - Beta-Blocker wie Brevibloc wurden mit einem Anstieg des Serum-Kaliumspiegels und Hyperkaliämie in Zusammenhang gebracht. Bei Patienten mit Risikofaktoren wie z. B. Nierenfunktionsstörungen und bei Hämodialyse-Patienten ist das Risiko erhöht.
Beta-Blocker können die Empfindlichkeit gegenüber Allergenen sowie den Schweregrad anaphylaktischer Reaktionen erhöhen. Patienten, die BetaBlocker verwenden, reagieren möglicherweise nicht auf die üblichen Dosen Epinephrin, die zur Behandlung anaphylaktischer oder anaphylaktoider Reaktionen eingesetzt werden (siehe Abschnitt 4.5).
Beta-Blocker können Psoriasis bzw. psoriasiforme Hautveränderung induzieren bzw. eine Psoriasis verstärken. Bei Patienten mit einer Psoriasis in der Eigen- oder Familienanamnese sollten BetaRezeptorenblocker nur nach sorgfältiger Nutzen-Risiko-Abwägung angewendet werden.
Beta-Blocker wie Propranolol und Metoprolol können bestimmte klinische Anzeichen einer Hyperthyreose (wie z. B. Tachykardie) überdecken. Patienten, bei denen die Gefahr einer Thyreotoxikose besteht oder vermutet wird, müssen engmaschig überwacht werden, da ein abruptes Absetzen von Beta-Blockern bei diesen Patienten eine thyreotoxische Krise auslösen kann.
Dieses Arzneimittel enthält ca. 30,45 mmol (bzw. 700 mg) Natrium pro Beutel. Dies ist zu berücksichtigen bei Personen unter Natriumkontrollierter Diät.
Die Anwendung von Brevibloc kann bei Dopingkontrollen zu positiven Ergebnissen führen. Die gesundheitlichen Folgen der Anwendung von Brevibloc als Dopingmittel können nicht abgesehen werden, schwerwiegende Gesundheitsgefährdungen sind nicht auszuschließen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei der Anwendung von Brevibloc mit anderen Antihypertonika oder anderen Arzneimitteln, die Hypotonie oder Bradykardie verursachen können, ist erhöhte Vorsicht geboten: Die Wirkungen von Brevibloc können gesteigert bzw. die Nebenwirkungen einer Hypotonie oder Bradykardie verstärkt werden.
Calciumantagonisten wie Verapamil und - in geringerem Ausmaß -Diltiazem wirken sich negativ auf die Kontraktilität und AV-Überleitung aus. Diese Kombination nicht bei Patienten mit Reizleitungsstörungen anwenden. Brevibloc erst 48 Stunden nach Absetzen von Verapamil verabreichen (siehe Abschnitt 4.3).
Calciumantagonisten, die zur Stoffklasse der Dihydropyridine gehören (z. B. Nifedipin), können zu einem erhöhten Hypotonie-Risiko führen. Bei Patienten mit Herzinsuffizienz, die mit Calciumantagonisten behandelt werden, kann eine Behandlung mit Beta-Blockern zu Herzversagen führen. Es wird empfohlen, Brevibloc vorsichtig zu titrieren und die Hämodynamik sorgfältig zu überwachen.
Die gleichzeitige Gabe von Brevibloc und Antiarrhythmika der Klasse I (z. B. Disopyramid, Chinidin) und Amiodaron kann die Wirkung auf die atriale Überleitungszeit verstärken und negativ inotrope Wirkungen hervorrufen.
Die gleichzeitige Gabe von Brevibloc und Insulin oder oralen Antidiabetika kann die blutzuckersenkende Wirkung verstärken (vor allem nicht-selektive Beta-Blocker). Eine Beta-adrenerge Blockade kann die Symptome einer Hypoglykämie (Tachykardie) überdecken, sonstige Manifestationen wie Benommenheit und Schweißausbrüche jedoch möglicherweise nicht.
Anästhetika: Wenn der Volumenstatus des Patienten unklar ist oder gleichzeitig blutdrucksenkende Medikamente verwendet werden, kann es zu einer Abschwächung der Reflextachykardie und einem erhöhten Hypotonie-Risiko kommen. Eine Fortsetzung der Beta-Blockade reduziert das Risiko von Herzrhythmusstörungen während der Narkoseeinleitung und Intubation. Der Anästhesist muss informiert werden, wenn der Patient zusätzlich zu Brevibloc einen Beta-Blocker erhält. Die blutdrucksenkende Wirkung von Inhalationsanästhetika kann durch Brevibloc verstärkt werden. Die Dosierung der Medikation sollte dann angepasst werden, um die gewünschte Hämodynamik aufrechtzuerhalten.
Die Kombination von Brevibloc mit Ganglienblockern kann die blutdrucksenkende Wirkung verstärken.
NSAIDs können die blutdrucksenkenden Wirkungen von Beta-Blockern verringern.
Bei gleichzeitiger Verwendung von Floctafenin oder Amisulprid und BetaBlockern ist besondere Vorsicht erforderlich.
Die gleichzeitige Gabe von trizyklischen Antidepressiva (wie z. B. Imipramin und Amitriptylin), Barbituraten oder Phenothiazinen (wie z. B. Chlorpromazin) sowie anderen Antipsychotika (wie z. B. Clozapin) kann die blutdrucksenkende Wirkung verstärken. Die Dosierung von Brevibloc sollte unbedingt verringert werden, um eine unerwartete Hypotonie zu verhindern.
Patienten, bei denen das Risiko einer anaphylaktischen Reaktion besteht, reagieren unter Einsatz von Beta-Blockern möglicherweise noch stärker auf Allergenexposition (zufällige, diagnostische oder therapeutische). Patienten, die Beta-Blocker anwenden, reagieren möglicherweise nicht auf die Dosen Epinephrin, die üblicherweise zur Behandlung anaphylaktischer Reaktionen eingesetzt werden (siehe Abschnitt 4.4).
Bei gleichzeitiger Verabreichung von Beta-Sympathomimetika muss mit antagonistischen Effekten gerechnet werden. Eventuell muss die Dosierung der Medikation je nach Ansprechen des Patienten angepasst oder die Verabreichung alternativer Therapeutika erwogen werden.
Katecholamin-depletierende Arzneimittel, z. B. Reserpin, können eine additive Wirkung haben, wenn sie zusammen mit Beta-Blockern verabreicht werden. Patienten, die gleichzeitig mit Brevibloc und einem Katecholamin-Depletor behandelt werden, sollten deshalb unbedingt engmaschig auf Anzeichen einer Hypotonie oder einer ausgeprägten Bradykardie, die zu Schwindel, Synkopen oder orthostatischer Hypotonie führen können, überwacht werden.
Bei gleichzeitiger Anwendung von Beta-Blockern mit Moxonidin oder Alpha-2-Antagonisten (wie z. B. Clonidin) ist das Risiko einer ReboundHypertonie nach Absetzen des Arzneimittels erhöht. Wenn Clonidin oder Moxonidin in Kombination mit einem Beta-Blocker angewendet werden und beide Behandlungen abgebrochen werden müssen, sollte immer zuerst der Beta-Blocker und dann ein paar Tage später Clonidin oder Moxonidin abgesetzt werden.
Die gleichzeitige Anwendung von Beta-Blockern und Ergot-Derivaten kann zu schwerer peripherer Vasokonstriktion und Hypertonie führen.
Ergebnisse einer Interaktionsstudie zwischen Brevibloc und Warfarin zeigten, dass die gleichzeitige Gabe von Brevibloc und Warfarin die Warfarin-Plasmaspiegel nicht verändert. Die Brevibloc-Konzentration war jedoch bei gleichzeitiger Gabe von Warfarin höher.
Bei gleichzeitiger intravenöser Anwendung von Digoxin und Brevibloc bei gesunden freiwilligen Testpersonen stiegen die Digoxin-Blutspiegel zu einigen Untersuchungszeitpunkten um 10 - 20 % an. Die Kombination aus Digitalisglykosiden und Brevibloc kann die AV-Überleitungszeit verlängern. Digoxin hatte keinen Einfluss auf die Pharmakokinetik von Brevibloc.
Bei der Untersuchung der Wechselwirkung zwischen intravenösem Morphin und Brevibloc in gesunden Probanden wurden keine Auswirkungen auf die Morphinkonzentration im Blut beobachtet. In Anwesenheit von Morphin waren die Blutspiegel im Steady-State für Brevibloc um 46 % erhöht, die anderen pharmakokinetischen Parameter blieben jedoch unverändert.
Die Wirkung von Brevibloc auf die Dauer einer durch Suxamethoniumchlorid oder Mivacurium induzierten neuromuskulären Blockade wurde an Patienten untersucht, die sich chirurgischen Eingriffen unterzogen. Brevibloc hatte keinen Einfluss auf die Induktion der neuromuskulären Blockade durch Suxamethoniumchlorid, aber die Dauer der neuromuskulären Blockade wurde von 5 Minuten auf 8 Minuten verlängert. Bei Mivacurium hatte Brevibloc eine mäßig verlängernde Wirkung auf die klinische Dauer (18,6 %) und den Recovery-Index (6,7 %).
Obwohl die in Studien mit Warfarin, Digoxin, Morphin, Suxamethoniumchlorid oder Mivacurium beobachteten Wechselwirkungen nicht von großer klinischer Bedeutung sind, darf Brevibloc nur mit Vorsicht bei Patienten titriert werden, die gleichzeitig mit Warfarin, Digoxin, Morphin, Suxamethoniumchlorid oder Mivacurium behandelt werden.
4.6 Fertiliät, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen nur sehr begrenzte Erfahrungen mit der Anwendung von Esmololhydrochlorid bei Schwangeren vor. Tierexperimentelle Studien ergaben Hinweise auf eine mögliche Reproduktionstoxizität (siehe
Abschnitt 5.3).
Die Anwendung von Esmololhydrochlorid während der Schwangerschaft wird nicht empfohlen.
Aufgrund der pharmakologischen Wirkung in einer späten Phase der Schwangerschaft sollten unbedingt Nebenwirkungen auf den Fötus oder das Neugeborene (insbesondere Hypoglykämie, Hypotonie und Bradykardie) berücksichtigt werden.
Falls eine Behandlung mit Brevibloc notwendig ist, sollten der uteroplazentare Blutfluss und das fetale Wachstum überwacht werden. Das Neugeborene muss engmaschig überwacht werden.
Stillzeit
Esmololhydrochlorid soll während der Stillzeit nicht angewendet werden.
Es ist nicht bekannt, ob Esmololhydrochlorid/Metabolite in die Muttermilch übergehen. Ein Risiko für Neugeborene/Säuglinge kann nicht ausgeschlossen werden.
Fertilität
Über die Wirkung von Esmolol auf die Fertilität des Menschen gibt es keine Daten.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
Im Falle von Nebenwirkungen kann die Gabe von Brevibloc reduziert oder abgebrochen werden.
Die meisten Nebenwirkungen waren nur leicht ausgeprägt und vorübergehender Natur. Besonders häufig wird eine Hypotonie nach Anwendung von Brevibloc beobachtet. Die folgenden Nebenwirkungen sind nach der MedDRA-Klassifizierung (System Organ Class, SOC) und ihrer Häufigkeit aufgeführt.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (>1/1.000 bis <1/100)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklasse |
Häufigkeit | ||||
|
Sehr häufig |
Häufig |
Gelegentlich |
Sehr selten |
Nicht bekannt | |
|
Stoffwechsel- und Ernährungsstörungen |
Anorexie |
Hyperkaliämie Metabolische Azidose | |||
|
Psychiatrische Erkrankungen |
Depression Angstzustände |
Gedankenstörungen | |||
|
Erkrankungen des Nervensystems |
Schwindelgefühl1 Somnolenz Kopfschmerzen Parästhesie Aufmerksamkeits störung Verwirrtheitszustand Unruhe |
Synkopen Krämpfe Sprach-/ Sprechstörungen | |||
|
Augenerkrankungen |
Sehstörungen | ||||
|
Herzerkrankungen |
Bradykardie Atrioventrikulärer Block Erhöhter Pulmonalarteriendruck Herzversagen Ventrikuläre Extrasystolen Nodaler Rhythmus Angina pectoris |
Sinusarrest Asystolie |
Akzelerierter idioventrikulärer Rhythmus Koronarer Arterienspasmus Herzstillstand | ||
|
Systemorganklasse |
Häufigkeit | ||||
|
Sehr häufig |
Häufig |
Gelegentlich |
Sehr selten |
Nicht bekannt | |
|
Gefäßerkrankungen |
Hypotonie |
Periphere Ischämie Blässe Hitzegefühl (Flushing) |
Thrombophlebitis2 | ||
1 Benommenheit und Diaphorese stehen in Zusammenhang mit Hypotonie-Symptomen. 2 In Zusammenhang mit Reaktionen an Injektions-/Infusionsstelle.
|
Systemorganklasse |
Häufigkeit | ||||
|
Sehr häufig |
Häufig |
Gelegentlich |
Sehr selten |
Nicht bekannt | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Dyspnea Lungenödem Bronchospasmus Keuchende Atmung Schwellung der Nasenschleimhäute Rasselgeräusche Pfeifende Atmung | ||||
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit Erbrechen |
Dysgeusie Dyspepsie Obstipation Trockener Mund Bauchschmerzen | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Diaphorese1 |
Hautverfärbung2 Erythem2 |
Hautnekrose2 (als Folge von Extravasation) |
Psoriasis3 Angioödem Urtikaria | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Schmerzen am Bewegungsapparat4 | ||||
|
Erkrankungen der Nieren und Harnwege |
Harnretention | ||||
|
Systemorganklasse |
Häufigkeit | ||||
|
Sehr häufig |
Häufig |
Gelegentlich |
Sehr selten |
Nicht bekannt | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Asthenie Müdigkeit Reaktionen an der Injektionsstelle Reaktionen an der Infusionsstelle Entzündliche Reaktionen an der Infusionsstelle Verhärtungen an der Infusionsstelle |
Schüttelfrost Pyrexie Schmerzen2 Brennender Schmerz an der Infusionsstelle Ekchymose an der Infusionsstelle |
Phlebitis an der Infusionsstelle Vesicula an der Infusionsstelle Blasenbildung2 | ||
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des NutzenRisiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es gab Fälle von versehentlichen massiven Überdosierungen mit konzentrierten Brevibloc-Lösungen. In einigen Fällen war der Ausgang tödlich, in anderen kam es zu dauerhaften Behinderungen. Todesfälle traten bei Einleitungsdosen von 625 mg bis 2,5 g (12,5 bis 50 mg/kg) auf.
Symptomatik
Bei einer Überdosierung können folgende Symptome auftreten: Schwere Hypotonie, Sinusbradykardie, atrioventrikulärer Block, Herzinsuffizienz, kardiogener Schock, Herzstillstand, Bronchospasmus, respiratorische Insuffizienz, Bewusstseinsverlust bis hin zum Koma, Krämpfe, Übelkeit, Erbrechen, Hypoglykämie und Hyperkalämie.
Behandlung
Wegen der kurzen Eliminationshalbwertzeit von Brevibloc (ungefähr 9 Minuten), sollte in einem ersten Schritt die Behandlung mit dem Arzneimittel abgebrochen werden. Wie lange es dauert, bis die Symptome einer Überdosierung abklingen, hängt von der verabreichten Brevibloc-Menge ab. Dies kann länger dauern als die 30 Minuten, die nach Absetzen therapeutisch wirksamer Brevibloc-Dosen beobachtet wurden. Eventuell ist eine künstliche Beatmung erforderlich. Je nachdem, welche klinischen Auswirkungen beobachtet werden, sollten auch folgende allgemeine Maßnahmen erwogen werden:
Bradykardie: Atropin oder ein anderes Anticholinergikum intravenös verabreichen. Wenn die Bradykardie nicht ausreichend behandelt werden kann, ist möglicherweise ein Herzschrittmacher erforderlich.
Bronchospasmus: Vernebelte Beta-2-Sympathomimetika verabreichen. Falls dies nicht ausreicht, können intravenöse Beta-2-Sympathomimetika oder Aminophyllin in Erwägung gezogen werden.
Symptomatische Hypotonie: Flüssigkeiten und/oder blutdrucksteigernde Arzneimittel intravenös verabreichen.
Herz-Kreislauf-Depression oder kardiogener Schock: Diuretika oder Sympathomimetika können verabreicht werden. Die Dosis der Sympathikomimetika (in Abhängigkeit von der Symptomatik: Dobutamin, Dopamin, Noradrenalin, Isoprenalin etc.) richtet sich nach dem Therapieeffekt.
Falls eine weitere Behandlung notwendig ist, können folgende Mittel je nach klinischer Situation und Ermessen des behandelnden Arztes intravenös gegeben werden:
• Atropin
• Inotrope Mittel
• Calciumionen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Beta-Rezeptorenblocker, selektiv.
ATC-Code: C07AB09
Brevibloc ist ein Beta-selektiver (kardioselektiver) adrenerger Rezeptorenblocker. In therapeutischen Dosen hat Brevibloc keine signifikante intrinsische sympathomimetische Aktivität (ISA) oder membranstabilisierende Aktivität.
Esmololhydrochlorid, der wirksame Bestandteil von Brevibloc, ist chemisch mit Beta-Blockern mit Phenoxypropanolamin-Struktur verwandt.
Aufgrund der pharmakologischen Eigenschaften hat Brevibloc einen raschen Wirkungseintritt und eine kurze Wirkungsdauer, wodurch die Dosis schnell angepasst werden kann.
Bei Verwendung einer geeigneten Einleitungsdosis werden innerhalb von 5 Minuten Steady-State-Blutspiegel erreicht. Die therapeutische Wirkung wird jedoch früher erreicht als die stabile Plasmakonzentration. Die Infusionsrate kann dann angepasst werden, um die gewünschte pharmakologische Wirkung zu erzielen.
Brevibloc zeigt die typischen hämodynamischen und elektrophysiologischen Wirkungen von Beta-Blockern:
• Verminderung der Herzfrequenz bei Ruhe und Belastung
• Abschwächung der Isoprenalin-induzierten Steigerung der Herzfrequenz
• Verlängerung der Sinusknoten-Erholungszeit
• Verzögerung der AV-Überleitung
• Verlängerung des AV-Intervalls während des normalen Sinusrhythmus und während der Vorhofstimulierung ohne Leitungsverzögerung im His-Purkinje-System
• Verlängerung der PQ-Zeit, Induktion eines AV-Blocks II. Grades
• Verlängerung der funktionellen Refraktärperiode von Atrien und Ventrikeln
• Negativ inotrope Wirkung und verminderte Auswurffraktion
• Blutdruckabfall.
Kinder
An 26 Kindern im Alter von 2 bis 16 Jahren mit supraventrikulärer Tachykardie (SVT) wurde eine nicht-kontrollierte Studie zur Pharmakokinetik/Wirksamkeit durchgeführt. Zunächst wurde eine Einleitungsdosis von 1.000 Mikrogramm/kg Brevibloc verabreicht, gefolgt von einer Dauerinfusion von 300 Mikrogramm/kg/Minute. Die SVT wurde bei 65 % der Patienten innerhalb von 5 Minuten nach Beginn der Anwendung von Brevibloc beendet.
In einer randomisierten, aber unkontrollierten Dosisvergleichsstudie wurde die Wirksamkeit an 116 Kindern im Alter von 1 Woche bis 7 Jahren bestimmt, die nach Operation einer Aortenisthmusstenose an Hypertonie litten. Den Patienten wurden zunächst entweder 125 Mikrogramm/kg, 250 Mikrogramm/kg oder 500 Mikrogramm/kg infundiert, gefolgt von einer Dauerinfusion von 125 Mikrogramm/kg/Minute, 250 Mikrogramm/kg/Minute bzw.
500 Mikrogramm/kg/Minute. Es gab zwischen den drei verschiedenen
Dosisgruppen keine signifikanten Unterschiede im Hinblick auf die blutdrucksenkende Wirkung. Insgesamt 54 % der Patienten insgesamt benötigten außer Brevibloc weitere Arzneimittel, um eine zufriedenstellende Blutdruckkontrolle zu erreichen. In dieser Hinsicht gab es keine Unterschiede zwischen den verschiedenen Dosisgruppen.
5.2 Pharmakokinetische Eigenschaften
Die Kinetik von Esmolol ist bei gesunden Erwachsenen linear, die Plasmakonzentration verhält sich proportional zur Dosis. Wenn keine Einleitungsdosis verwendet wird, werden bei Dosen von 50 bis 300 Mikrogramm/kg pro Minute innerhalb von 30 Minuten Steady-State-Blutspiegel erreicht.
Die Verteilungshalbwertzeit von Esmololhydrochlorid ist mit ca. 2 Minuten sehr kurz.
Das Verteilungsvolumen beträgt 3,4 l/kg.
Esmololhydrochlorid wird durch Esterasen zu einem Säuremetaboliten (ASL-8123) und Methanol abgebaut. Dies geschieht mittels Hydrolyse der Estergruppe durch Esterasen in den Erythrozyten.
Der Stoffwechsel von Esmololhydrochlorid ist unabhängig von der Dosis im Bereich zwischen 50 und 300 Mikrogramm/kg/Minute.
Esmololhydrochlorid wird zu 55 % an Humanplasmaproteine gebunden, wohingegen die Bindung des Säuremetaboliten nur bei 10 % liegt.
Nach intravenöser Verabreichung beträgt die Eliminationshalbwertzeit ungefähr 9 Minuten.
Die Gesamt-Clearance beträgt 285 ml/kg/Minute; sie hängt nicht vom Blutkreislauf der Leber oder eines anderen Organs ab. Esmololhydrochlorid wird über die Nieren ausgeschieden - teilweise unverändert (weniger als 2 % der verabreichten Menge) und teilweise als Säuremetabolit, der eine geringe (weniger als 0,1 % Esmolol) Beta-blockierende Wirkung besitzt. Der Säuremetabolit wird mit dem Harn ausgeschieden und hat eine Halbwertzeit von ungefähr 3,7 Stunden.
Kinder
An 22 pädiatrischen Patienten im Alter von 3 bis 16 Jahren wurde eine pharmakokinetische Studie durchgeführt. Zunächst wurde eine Einleitungsdosis von 1.000 Mikrogramm/kg Brevibloc verabreicht, gefolgt von einer Dauerinfusion von 300 Mikrogramm/kg/Minute. Die beobachtete mittlere Gesamtkörper-Clearance betrug 119 ml/kg/Minute, das mittlere Verteilungsvolumen 283 ml/kg, und die mittlere terminale Eliminationshalbwertzeit 6,9 Minuten. Dies deutet darauf hin, dass die Kinetik von Brevibloc bei Kindern ähnlich ist wie bei Erwachsenen.
Es wurde jedoch eine hohe interindividuelle Variabilität beobachtet.
5.3 Präklinische Daten zur Sicherheit
In Tierstudien wurde keine teratogene Wirkung beobachtet. Beim Kaninchen wurde eine embryotoxische Wirkung beobachtet (erhöhte fetale Resorption), die vermutlich von Brevibloc verursacht wurde. Diese Wirkung wurde bei Dosen beobachtet, die mindestens 10 Mal höher waren als die therapeutische Dosis. Es wurden keine Studien zur Wirkung von Brevibloc auf die Fruchtbarkeit und zu peri- und postnatalen Wirkungen durchgeführt. Brevibloc hat sich in mehreren in-vitro- und in-vivo-Untersuchungen als nicht mutagen herausgestellt. Die Sicherheit von Brevibloc wurde nicht in Langzeitstudien untersucht.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumacetat-Trihydrat Essigsäure 99 %
Natriumchlorid
Natriumhydroxid und/oder Salzsäure zur pH-Einstellung Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien vorliegen, darf das Arzneimittel nicht mit anderen Arzneimitteln oder Natriumbicarbonat-Lösungen gemischt werden.
6.3 Dauer der Haltbarkeit
2 Jahre.
Das Arzneimittel ist nach Anbruch 24 Stunden bei 2 bis 8 °C physiochemisch stabil.
Aus mikrobiologischer Sicht sollte die gebrauchsfertige Lösung unmittelbar verwendet werden. Wird die gebrauchsfertige Lösung nicht umgehend verabreicht, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich. Im Regelfall darf dann ein Zeitraum von 24 Stunden bei 2 bis 8°C nicht überschritten werden, es sei denn, das Behältnis wurde unter kontrollierten und validierten aseptischen Bedingungen geöffnet.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern. Nicht im Kühlschrank lagern oder einfrieren.
Zur Aufbewahrung der Lösung siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Latexfreier 250 ml-Kunststoffbeutel aus Polyolefin mit zwei Anschlüssen aus PVC. Packungsgröße: 1 Beutel.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Brevibloc 10 mg/ml Infusionslösung wird in 250 ml-Beuteln aus Kunststoff (IntraVia) geliefert. Es handelt sich dabei um gebrauchsfertige, latexfreie Polyolefin-Beutel mit zwei Anschlüssen aus PVC - einem Entnahmeanschluss und einem Verabreichungsanschluss. Der Entnahmeanschluss dient ausschließlich zur Entnahme des Initialbolus aus dem Beutel und nicht zur wiederholten Bolusgabe. Bei der Entnahme der Bolusdosis auf aseptische Arbeitsweise achten. Keine Arzneimittelzusätze zu Brevibloc hinzufügen. Die Beutel sind nur zum einmaligen Gebrauch bestimmt. Wenn das Sicherheitssiegel geöffnet und Lösung über einen der Anschlüsse entnommen wurde, den Beutelinhalt innerhalb von 24 Stunden verwenden. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen. Angebrochene Beutel nicht erneut anschließen.
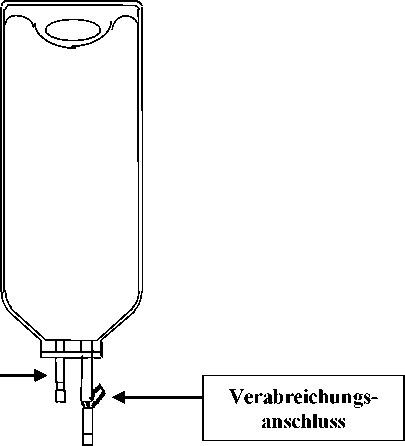
Entnahmeanschluss
(nur zur Entnahme des Initialbolus)
Abbildung 1: IntraVia-Beutel mit zwei Anschlüssen
ACHTUNG
Nicht mehrere Kunststoffbeutel miteinander verbinden. Es besteht sonst die Gefahr einer Embolie, da Lufteinschlüsse aus dem Primärbeutel aspiriert werden können, bevor der Inhalt des Sekundärbeutels vollständig verabreicht ist.
ÖFFNEN
Den Beutel erst unmittelbar vor Gebrauch aus der Umverpackung nehmen. Nicht verwenden, wenn die Umverpackung bereits geöffnet wurde oder beschädigt ist. Die Umverpackung schützt den Beutel vor Feuchtigkeit. Der innere Beutel gewährleistet die Sterilität der Lösung.
Die Umverpackung an der Einkerbung aufreißen und den Beutel mit der gebrauchsfertigen Lösung entnehmen. Das Kunststoffmaterial kann aufgrund von Feuchtigkeitsabsorption während des Sterilisationsprozesses eine gewisse Kondenswassertrübung aufweisen. Dies ist normal und beeinträchtigt weder die Qualität noch die Sicherheit der Lösung. Die Trübung bildet sich allmählich wieder zurück.
Den inneren Beutel fest zusammendrücken und so auf kleinste Undichtigkeiten prüfen. Sind undichte Stellen vorhanden, die Lösung verwerfen, da die Sterilität nicht mehr gewährleistet ist. Die Lösung vor der Anwendung auf sichtbare Partikel und Verfärbung überprüfen. Nur verwenden, wenn die Lösung klar und farblos oder leicht gefärbt ist.
Keine Arzneimittelzusätze zu Brevibloc 10 mg/ml Infusionslösung hinzufügen.
Vorbereitung zur intravenösen Anwendung (auf aseptische Arbeitsweise achten)
1. Den Beutel an der Ausstanzung aufhängen.
2. Die Kunststoff-Schutzkappe vom Verabreichungsanschluss an der Unterseite des Beutels abnehmen.
3. Das Infusionsbesteck anschließen. Bitte unbedingt die Gebrauchsanleitung des Infusionsbestecks beachten.
7. INHABER DER ZULASSUNG
Baxter Deutschland GmbH
Edisonstraße 4
85716 Unterschleißheim
Telefon: 089/31701-0
Fax: 089/31701-177
E-Mail-Adresse: info_de@baxter.com
8. ZULASSUNGSNUMMER
80430.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 06.08.2010
Datum der letzten Verlängerung der Zulassung: 02.07.2014
10. STAND DER INFORMATION
08/2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Baxter und Brevibloc sind Marken der Baxter International Inc.
Baxter Deutschland GmbH
Benommenheit und Diaphorese stehen in Zusammenhang mit Hypotonie-Symptomen. 2 In Zusammenhang mit Reaktionen an Injektions- und Infusionsstelle.
3 In einigen Situationen können Beta-Blocker als Arzneistoffklasse Psoriasis auslösen oder verschlimmern. 4 Einschließlich Schmerzen im Schulterblatt und
Costochondritis