Bricanyl 0,5 Mg
Fachinformation
(Zusammenfassung der Merkmale des Arzneimittels/SmPC)
1. Bezeichnung des Arzneimittels
Bricanyl® 0,5 mg Injektionslösung
2. Qualitative und quantitative Zusammensetzung
1 ml Injektionslösung enthält:
0,5 mg Terbutalinsulfat (Ph.Eur.)
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. Darreichungsform
Injektionslösung
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Akutbehandlung von Atemnotzuständen (Status asthmaticus, schwere bronchospastische Anfälle) infolge reversibler Verengung der Atemwege bei obstruktiven Atemwegserkrankungen, wenn die Gabe von kurz wirksamen Beta-2-Sympathomimetika zur Inhalation nicht möglich ist.
4.2 Dosierung und Art der Anwendung
Die Dosierung richtet sich nach Art und Schwere der Erkrankung und muss dem Einzelfall angepasst werden.
Für Erwachsene gelten, soweit nicht anders verordnet, folgende Dosierungsrichtlinien:
Zur Akutbehandlung von Atemnotständen werden 0,5 ml Bricanyl 0,5 mg (entspr. 0,25 mg Terbutalinsulfat) subkutan injiziert.
Falls erforderlich, kann die Einzeldosis auf maximal 1 ml Bricanyl 0,5 mg (entspr. 0,5 mg Terbutalinsulfat) erhöht werden.
Dieselbe Dosis kann, falls erforderlich, nach 15 - 20 Minuten wiederholt werden. Die Injektionen können bei Bedarf bis zu 4-mal täglich wiederholt werden.
Hinweis:
Zur Anwendung der Injektionslösung bei Kindern liegen keine ausreichenden Erfahrungen vor. Die Injektionslösung soll deshalb bei Kindern unter 12 Jahren nicht angewendet werden.
Anwendungshinweise Öffnen der Brechampulle
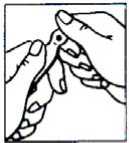

Abb. 1
Unterhalb des Punktes ist die Sollbruchstelle.
Abb. 2
Ampullenhals vom Punkt wegbrechen.
4.3 Gegenanzeigen
Bricanyl 0,5 mg darf nicht angewendet werden bei
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
- Hyperthyreose/Thyreotoxikose (Überfunktion der Schilddrüse),
- Tachykardie,
- Tachyarrhythmie,
- idiopathischer hypertropher subvalvulärer Aortenstenose (muskulärer Einengung im Bereich der Herzklappen),
- Phäochromozytom (Tumor des Nebennierenmarks).
Hinweis:
Zur Anwendung der Injektionslösung bei Kindern liegen keine ausreichenden Erfahrungen vor. Die Injektionslösung soll deshalb bei Kindern unter 12 Jahren nicht angewendet werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Besondere Vorsicht ist geboten bei Patienten mit
- frischem Herzinfarkt,
- unausgeglichener diabetischer Stoffwechsellage,
- Myokarditis,
- WPW-Syndrom,
- Mitralvitium,
- Hypokaliämie,
- okklusiven Gefäßerkrankungen (Arteriosklerose),
- Hypertonie,
- Aneurysmen,
- tachykarden Herzrhythmusstörungen,
- schwerer KHK.
Unter der Gabe von Sympathomimetika, einschließlich Terbutalinsulfat, können kardiovaskuläre Wirkungen beobachtet werden. Nach der Markteinführung erhobene sowie in der Literatur veröffentlichte Daten deuten darauf hin, dass im Zusammenhang mit Beta-Agonisten in seltenen Fällen eine Myokardischämie auftritt. Patienten mit einer schweren kardialen Grunderkrankung (z.
B. ischämische Herzkrankheit, Rhythmusstörungen oder schwere Herzinsuffizienz), bei denen Bricanyl 0,5 mg angewendet wird, sollten angewiesen werden, sich bei Schmerzen in der Brust oder anderen Symptomen einer sich verschlechternden Herzerkrankung an einen Arzt zu wenden. Die Bewertung von Symptomen wie Dyspnoe und Schmerzen in der Brust sollte mit Sorgfalt erfolgen, da diese entweder eine respiratorische oder eine kardiale Ursache haben können.
Eine Therapie mit Beta-2-Sympathomimetika kann möglicherweise zu einer schweren Hypokaliämie führen. Das damit verbundene Risiko wird durch eine Hypoxie erhöht, daher ist bei akutem schwerem Asthma besondere Vorsicht erforderlich.
Hypokaliämische Wirkungen können durch Begleitbehandlungen erhöht werden (siehe Abschnitt 4.5). In solchen Fällen wird eine Überwachung des Serumkaliumspiegels empfohlen.
Aufgrund der hyperglykämischen Effekte von Beta-2-Agonisten werden bei Diabetikern zu Beginn der Therapie zusätzliche Blutzuckerkontrollen empfohlen.
Im Zusammenhang mit hohen therapeutischen Dosen von kurz wirksamen Beta-Agonisten wurde bei parenteraler Therapie und bei Therapie mit einem Vernebler über eine Laktatazidose berichtet, insbesondere bei Patienten, die aufgrund einer akuten Asthma-Exazerbation behandelt wurden (siehe Abschnitte 4.8 und 4.9). Bei Patienten, die auf eine Akutbehandlung mit Bricanyl 0,5 mg nicht ausreichend ansprechen, sollte eine Laktatazidose als mögliche beitragende Ursache für die anhaltenden respiratorischen Symptome in Betracht gezogen werden.
Sehr seltene Todesfälle im Zusammenhang mit übermäßigem Gebrauch sind wahrscheinlich durch Hypoxämie und Herzstillstand zu erklären.
Hinweis:
Eine erhebliche Überschreitung, insbesondere der vorgegebenen Einzeldosis beim akuten Anfall, aber auch der Tagesdosis kann gefährlich sein wegen der Wirkungen auf das Herz (Herzrhythmusstörungen, Blutdruckanstieg) in Verbindung mit Veränderungen der Salzkonzentrationen in Körperflüssigkeiten (Elektrolytverschiebungen) und muss deshalb vermieden werden.
Die Anwendung des Arzneimittels Bricanyl 0,5 mg kann bei Dopingkontrollen zu positiven Ergebnissen führen. Durch eine Anwendung von Bricanyl 0,5 mg als Dopingmittel können schwerwiegende Herzrhythmusstörungen ausgelöst werden.
Bricanyl 0,5 mg enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Milliliter (ml).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Gabe von Bricanyl 0,5 mg mit anderen betasympathomimetisch wirkenden Substanzen oder Methylxanthinen (z. B. Theophyllin) kann die antiobstruktive Wirkung verstärken, es muss aber auch mit einer Zunahme unerwünschter Wirkungen, z. B. Herzrhythmusstörungen, gerechnet werden.
Die blutzuckersenkende Wirkung von Antidiabetika kann unter systemischer Gabe vermindert werden. Es soll überprüft werden, ob eine Dosisänderung des Antidiabetikums erforderlich ist.
Betarezeptorenblocker (einschließlich Augentropfen) können die Wirkung von Bricanyl 0,5 mg aufheben, sind aber bei Asthma kontraindiziert, weil sie einen Bronchospasmus auslösen können.
Die gleichzeitige Gabe von Bricanyl 0,5 mg und Digitalisglykosiden, Chinidin oder anderen Antiarrhythmika kann zu Herzrhythmusstörungen führen. Auch L-Dopa, L-Thyroxin, Oxytocin oder Alkohol können die kardialen und kreislaufregulatorischen sympathomimetischen Effekte von Bricanyl 0,5 mg verstärken.
Wegen der hypokaliämischen Wirkung von Beta-2-Agonisten sollte die gleichzeitige Anwendung von Bricanyl 0,5 mg mit Substanzen, die den Serumkaliumspiegel senken, mit Vorsicht erfolgen. Dies gilt z.B. für Diuretika, Methylxanthine und Kortikosteroide. Es wird empfohlen, in solchen Situationen den Serumkaliumspiegel zu bestimmen (siehe auch Abschnitt 4.4).
Die gleichzeitige Anwendung von intravenösen Beta-Agonisten und systemischen Kortikosteroiden erhöht den Blutzuckerspiegel. Darüber hinaus wird das Risiko für ein Lungenödem erhöht, wenn Beta-Agonisten gemeinsam mit Kortikosteroiden und intravenösen Flüssigkeiten angewendet werden.
Die gleichzeitige Anwendung von Bricanyl 0,5 mg und Monoaminoxidasehemmstoffen oder trizyklischen Antidepressiva kann eine verstärkte Wirkung von Bricanyl 0,5 mg auf das Herz-
Kreislauf-System auslösen (schwere Kopfschmerzen, Blutdruckkrisen, Arrhythmien bis hin zu Todesfällen).
Eine erhöhte Arrhythmiegefahr besteht bei gleichzeitiger Narkose mit halogenierten Kohlenwasserstoffen. Deshalb sollten diese mit Vorsicht zusammen mit Beta-2-Agonisten angewendet werden.
4.6 Schwangerschaft und Stillzeit
Zu einer Anwendung von Bricanyl 0,5 mg in den ersten drei Monaten der Schwangerschaft liegen keine Erfahrungen vor. Obwohl keine keimschädigenden Wirkungen bekannt sind, sollte Bricanyl 0,5 mg aus grundsätzlichen Erwägungen während der Schwangerschaft nur nach sorgfältiger Nutzen-Risiko-Abwägung angewendet werden.
Gegen Ende der Schwangerschaft können systemische Gaben von Bricanyl 0,5 mg wehenhemmend wirken. Eine Anwendung kurz vor der Geburt sollte daher nicht mehr erfolgen. Terbutalin geht in die Muttermilch über, daher sollte eine Behandlung stillender Frauen nur nach einer Nutzen-Risiko-Abwägung erfolgen.
Eine vorübergehende Hypoglykämie wurde bei Frühgeborenen, deren Mütter mit Beta-2-Agonisten behandelt wurden, beobachtet.
Die Plazentaschranke wird beim Menschen nach i.v.-Injektion von Terbutalin rasch überschritten. Nach 2 - 3 Stunden entspricht die Terbutalinplasmakonzentration im Nabelblut des Feten derjenigen im mütterlichen Kreislauf. Die Verteilung der Substanz in allen Organen des Feten ist nach weiteren 2 Stunden abgeschlossen. Sympathomimetische Effekte beim Feten können auftreten.
Terbutalin wird nach oraler Gabe von 3 - 5 mg täglich bei stillenden Müttern in der Milch in Konzentrationen von 2,5 - 4,6 ng/ml wieder gefunden. Im Plasma der Säuglinge ist der Wirkstoff weder nachgewiesen worden, noch sind sympathomimetische Symptome beobachtet worden.
Obwohl bisher keine teratogenen Wirkungen bekannt sind, sollte dieses Arzneimittel in der Schwangerschaft, insbesondere während des ersten Schwangerschaftsdrittels, nur nach besonders kritischer Indikationsstellung angewandt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Durch individuell auftretende unterschiedliche Reaktionen kann auch bei bestimmungsgemäßem Gebrauch dieses Arzneimittels die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt werden. Dies gilt besonders bei Behandlungsbeginn sowie im Zusammenwirken mit Alkohol, Beruhigungs- oder Schlafmitteln.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1000 bis < 1/100), selten (> 1/10 000 bis < 1/1000), sehr selten (< 1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Die meisten der beobachteten unerwünschten Arzneimittelreaktionen entsprechen den für sympathomimetische Amine charakteristischen Nebenwirkungen.
Störungen des Herz-Kreis/auf-Systems
Häufig Tachykardie, Palpitationen
Selten pektanginöse Beschwerden, Herzrhythmusstörungen, wie z. B.
Vorhofflimmern, supraventrikuläre Tachykardie und Extrasystolen Nicht bekannt Myokardischämie
Störungen der Skelettmuskulatur und des Bindegewebes Häufig tonische Muskelkrämpfe
Störungen des Nervensystems
Sehr häufig Tremor, Kopfschmerzen
Störungen der Haut und des Unterhautgewebes Häufig Urtikaria, Exantheme
Störungen des Verdauungstraktes Selten Übelkeit
Sehr selten Irritationen von Mund und Rachen, Sodbrennen
Psychische Störungen
Selten Schlaf- und Verhaltensstörungen wie Unruhe, Hyperaktivität und
Rastlosigkeit
Sehr selten atypische Psychosen bei Kindern
Störungen des Immunsystems
Sehr selten Überempfindlichkeitsreaktionen (z. B. Anaphylaxie, Quincke-Ödem,
Blutdruckabfall)
Störungen der Niere und der Harnwege Sehr selten Miktionsstörungen
Stoffwechsel und Ernährungsstörungen Häufig Hypokaliämie
Selten Laktatazidose
Nicht bekannt Bricanyl 0,5 mg kann zu metabolischen Veränderungen wie Hyperglykämie
führen; ein Anstieg des Blutspiegels von Insulin, freien Fettsäuren, Glycerol und Ketonkörpern ist möglich.
Beschwerden wie Übelkeit, Tremor, Palpitationen, Kopfschmerzen, Unruhegefühl und Muskelkrämpfe nehmen bei Fortführung der Therapie nach 1 - 2 Wochen meistens wieder ab.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome der Intoxikation
Im Falle einer Überdosierung treten die bereits bekannten Nebenwirkungen sehr schnell und ggf. in verstärktem Umfang in Erscheinung.
Typische Symptome sind: Kopfschmerzen, Tachykardie (Pulsbeschleunigung), Palpitationen (Herzklopfen), Arrhythmien, Ruhelosigkeit, Angstzustände, tonische Muskelkrämpfe, Schlafstörungen, Übelkeit, systolische Blutdrucksteigerung, Brustschmerzen und heftiger Tremor, insbesondere an den Händen, aber auch am ganzen Körper.
Ein Blutdruckabfall kann auftreten.
Laborbefunde
Hyperglykämie und Laktatazidose können auftreten (siehe Abschnitt 4.4). Beta-2-Agonisten können aufgrund einer Umverteilung des Kaliums eine Hypokaliämie verursachen.
Therapie von Intoxikationen
Die Behandlung nach betasympathomimetischer Überdosierung erfolgt hauptsächlich symptomatisch. Nachfolgend sind eine Reihe zu empfehlender Maßnahmen angeführt:
- Die kardialen Symptome können mit einem selektiven Betablocker behandelt werden, bei Asthmatikern beinhaltet dies jedoch das Risiko der Auslösung eines Bronchialmuskelkrampfes.
- Zur Überwachung der Arrhythmien ist EKG-Monitoring angezeigt.
- In schweren Fällen ist eine Überwachung des Blutzuckerspiegels, der Elektrolyte (z. B. SerumKaliumkonzentration) und des Säure-Basen-Status ratsam. Bei ausgeprägtem Blutdruckabfall sollte ein Plasmaexpander gegeben werden.
Pharmakologische Eigenschaften
5.
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Beta-2-Sympathomimetika, Terbutalin, ATC-Code: R03C C03
Das 3,5-Dihydroxyphenyl-Derivat Terbutalin ist ein direkt wirkendes Betasympathomimetikum mit vorwiegender Beta-2-Selektivität. Eine Stimulation der Beta-1-Rezeptoren kommt erst bei höheren Dosen zum Ausdruck.
Terbutalin verursacht eine Erschlaffung der glatten Muskulatur in den Bronchien und Blutgefäßen sowie eine Relaxation der Uterusmuskulatur. Terbutalin hemmt auch die Freisetzung von Mediatoren aus den Mastzellen.
Ferner ist eine Steigerung der mukoziliären Clearance im Bronchialsystem nachweisbar, wobei der Wirkmechanismus noch nicht eindeutig geklärt ist.
Diese Wirkungen werden über eine Aktivierung der Adenylatzyklase vermittelt, wobei es zu einer Anreicherung von zyklischem 3',5'-Adenosinmonophosphat (cAMP) kommt, welches seinerseits die kontraktilen Elemente der glatten Muskulatur hemmt.
Einfluss auf den Stoffwechsel von Lipiden und Zuckern (Lipolyse, Glykogenolyse und Hyperglykämie) sowie relative Hypokaliämie durch Erhöhung der K+-Aufnahme in die Skelettmuskulatur sind pharmakologische Effekte, die erst unter höheren Dosen zur Geltung kommen.
Die beta-2-sympathomimetische Wirkung von Terbutalin ist relativ stark bronchoselektiv, aber seine Wirkungen auf das Herz - wie Anstieg der Herzfrequenz, Steigerung der Kontraktilität (positiv inotroper und chronotroper Effekt) - sind durch direkte Wirkung auf Beta-1-Rezeptoren zu erklären. Die Abnahme des Atemwegswiderstandes bei Asthma tritt bei der oralen Anwendung nach ca. 20 -30 Minuten ein und bleibt bis zu ca. 6 Stunden bestehen. Der bronchodilatatorische Effekt korreliert sehr eng mit den Serumkonzentrationen von Terbutalin. Nach Inhalation von Terbutalin tritt die bronchodilatatorische Wirkung nach wenigen Minuten ein.
Bei Neugeborenen und Kleinkindern bis ca. 18 Monate ist die Wirkung nicht immer vorhanden.
Nach langzeitiger Anwendung von Terbutalin kann ein Verlust der Wirksamkeit eintreten (Tachyphylaxie).
Die Bioverfügbarkeit von Terbutalin bei der s.c.-Anwendung beträgt wie bei der i.v.-Anwendung 100 %.
5.2 Pharmakokinetische Eigenschaften
Bei s.c.-Anwendung werden nach ca. 25 Minuten maximale Plasmakonzentrationen erreicht. Sie betragen ca. 7,2 ng/ml.
Der Wirkeintritt erfolgt wenige Minuten nach Applikation und erreicht ein Maximum nach ca. 30 Minuten.
Die Wirkdauer beträgt 3 - 4 Stunden.
Die Plasmaproteinbindung ist gering und liegt bei 25 %. Eine Affinität gegenüber Erythrozyten ist beobachtet worden.
Terbutalin ist gegenüber inaktivierenden Enzymen wie COMT (Catechol-O-Methyltransferase) und MAO (Monoaminoxidase) resistent.
Die Ausscheidung erfolgt überwiegend über die Niere als Sulfatkonjugat. Nur ein kleiner Teil wird unverändert ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität Siehe Abschnitt 4.9.
Chronische Toxizität
Aus Langzeituntersuchungen an Maus, Ratte und Affe ergaben sich keine Hinweise auf toxische Effekte.
Reproduktionstoxizität
Die Untersuchungen an Mäusen und Ratten ergaben keine Hinweise auf Embryotoxizität und Teratogenität.
Kanzerogenität
Unter Langzeitgabe von sehr hohen Dosen an Ratten und Mäuse kommt es - wie auch bei anderen Betasympathomimetika - zur Ausbildung von gutartigen Leiomyomen und Leiomyosarkomen in Mesovarium und Uterus. Nach vorherrschender Meinung ist eine Übertragbarkeit auf den Menschen jedoch nicht gegeben.
Mutagenität
Untersuchungen zur Mutagenität ergaben keinen Hinweis auf ein genotoxisches Potenzial.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Natriumchlorid, Salzsäure 7 % zur pH-Wert-Einstellung, Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Bricanyl 0,5 mg sollte nicht mit alkalischen Lösungen, z. B. Lösungen mit einem pH-Wert > 7, vermischt werden.
6.3 Dauer der Haltbarkeit
Die Haltbarkeit von Bricanyl 0,5 mg beträgt 2 Jahre.
Dieses Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
Nur zur einmaligen Anwendung!
Restmengen nach Anbruch des Arzneimittels verwerfen!
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
Ampullen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
Glasampullen
Packungsgrößen:
10 Ampullen je 1 ml Injektionslösung [N 2]
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
AstraZeneca GmbH
22876 Wedel
Telefon: 0 41 03 / 70 80
Produktanfragen: 0800 22 88 660
Telefax: 0 41 03 / 708 32 93
E-Mail: azinfo@astrazeneca.com
8. Zulassungsnummer
6084327.00.00
Datum der Erteilung der Zulassung/Verlängerung der Zulassung
9.
Datum der Erteilung der Zulassung: 20.12.1999
Datum der letzten Verlängerung der Zulassung: 27.09.2011
10. Stand der Information
Juli 2015
11. Verkaufsabgrenzung
Verschreibungspflichtig