Bucain Hyperbar 5 Mg/Ml Injektionslösung
FI-912-10/15
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS Bucain® hyperbar 5 mg/ml Injektionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Bupivacainhydrochlorid 1 H2O
1 ml Injektionslösung enthält 5 mg Bupivacainhydrochlorid.
Sonstige Bestandteile mit bekannter Wirkung:
Glucose-Monohydrat, Natriumchlorid, Natriumhydroxid.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Spinalanästhesie bei Erwachsenen und Kindern aller Altersklassen.
4.2 Dosierung und Art der Anwendung
Dosierung
Grundsätzlich gilt, dass nur die kleinste Dosis verabreicht werden darf, mit der die gewünschte ausreichende Anästhesie erreicht wird. Die Dosierung ist entsprechend den Besonderheiten des Einzelfalles individuell vorzunehmen.
Soweit nicht anders verordnet, gelten folgende Dosierungsrichtlinien:
Die Angaben für die empfohlenen Dosen gelten für Erwachsene mit durchschnittlicher Körpergröße und -gewicht (ca. 70 kg) bei einmaliger Anwendung. 1 ml Bucain hyperbar 5 mg/ml enthält 5 mg Bupivacainhydrochlorid.
Dosierungsbeispiele:
|
Operationsgebiet |
Anästhesieniveau |
Bucain hyperbar 5 mg/ml in ml |
|
Anal-Bereich |
S 3 (Sattelblock) |
0,5 - 2,0 |
|
Untere Extremität ohne Blutsperre |
T 12 (tiefe Spinalanästhesie) |
1,0 - 2,5 |
|
Untere Extremität mit Blutsperre, Leistengegend, Hoden |
T 10 (mittelhohe Spinalanästhesie) |
1,5 - 3,0 |
|
Unterbauch, Oberbauchlaparatomien |
T 5 (hohe Spinalanästhesie) |
2,0 - 4,0 |
Die empfohlene Maximaldosis bei einzeitiger Anwendung beträgt 20 mg Bupivacainhydrochlorid, entsprechend 4 ml Bucain hyperbar 5 mg/ml.
Bei Patienten mit reduziertem Allgemeinzustand müssen grundsätzlich kleinere Dosen angewendet werden.
Für die Injektion am sitzenden Patienten werden obere Dosisbereiche empfohlen. Bei Seitenlage des Patienten, bei Halbseiten-Anästhesie, bei älteren Patienten sowie in der Schwangerschaft sind untere Dosisbereiche angezeigt.
Bei Patienten mit bestimmten Vorerkrankungen (Gefäßverschlüssen, Arteriosklerose oder Nervenschädigung bei Zuckerkrankheit) ist die Dosis ebenfalls um ein Drittel zu verringern, wenn eine Spinalanästhesie überhaupt indiziert ist.
Bei eingeschränkter Leber- oder Nierenfunktion können besonders bei wiederholter Anwendung erhöhte Plasmaspiegel auftreten. In diesen Fällen wird ebenfalls ein niedrigerer Dosisbereich empfohlen.
Kinder und Jugendliche
Neugeborene, Kleinkinder und Kinder bis zu 40 kg:
Bucain hyperbar 5 mg/ml darf bei Kindern angewendet werden. Einer der Unterschiede zwischen kleinen Kindern und Erwachsenen ist das relativ hohe Liquor-Volumen bei Kleinkindern und Neugeborenen, die daher im Vergleich zu Erwachsenen eine verhältnismäßig größere Dosis/kg benötigen, um die gleiche Höhe der Blockade zu erreichen.
Regionalanästhesie-Verfahren bei Kindern sollten von Ärzten durchgeführt werden, die über die entsprechenden Kenntnisse verfügen und die mit dieser Patientengruppe und der Technik vertraut sind.
Die in der Tabelle angegebenen Dosierungen sollten als Richtlinie für die Anwendung bei Kindern betrachtet werden. Individuelle Abweichungen können erforderlich sein. Hinsichtlich der Faktoren, die spezifische Blockadetechniken betreffen und für individuelle Patientenbedürfnisse sollten Fachbücher konsultiert werden.
Es soll die kleinste Dosis angewendet werden, mit der eine ausreichende Anästhesie erreicht wird.
|
Körpergewicht (kg) |
Dosis (mg/kg) |
|
<5 |
0,40-0,50 |
|
5 bis 15 |
0,30-0,40 |
|
15 bis 40 |
0,25-0,30 |
Tabelle: Dosierungsempfehlungen für Neugeborene, Kleinkinder und Kinder:
Art der Anwendung
Bucain hyperbar 5 mg/ml ist zur intrathekalen Injektion bestimmt.
Bucain hyperbar 5 mg/ml wird in einen Zwischenraum zwischen den Wirbeln L 2/L 3 und L 4/L 5 subarachnoidal injiziert.
Beim sitzenden Patienten sinkt die injizierte Lösung bevorzugt kaudal (in Steißrichtung), bei liegender Position wird die Ausbreitung des Anästhetikums durch Trendelenburg’sche Lagerung und umgekehrte Trendelenburg’sche Lagerung gesteuert. Die Position des Patienten bestimmt entsprechend die Ausbreitung nach kranial (in Richtung des Kopfes). Werden z.B. 3 ml Bucain hyperbar 5 mg/ml dem sitzenden Patienten bei L 3/L 4 injiziert, steigt das Anästhesieniveau bis T 10 - T 7; in liegender Position erreicht die Blockade T 7 -T 4.
Bei seitlicher Lagerung des Patienten kann im Bedarfsfall eine Halbseitenanästhesie erzielt werden. Nach ca. 10 - 30 Minuten ist Bucain hyperbar 5 mg/ml fixiert und die Ausbreitung der anästhetischen Wirkung beendet.
Wenn sich 10 Minuten nach der Injektion keine Zeichen eines spinalen Blocks einstellen, kann die Spinalanästhesie mit der Erstdosis wiederholt werden. Eine zweite Injektion mit der Erstdosis ist auch möglich zum Zeitpunkt des Abklingens der Wirkung (nach ca. 2 - 3 Stunden). Mehr als zwei Injektionen sollten unterbleiben.
Eine wiederholte Anwendung dieses Arzneimittels kann aufgrund einer Tachyphylaxie (rasche Toleranzentwicklung gegenüber dem Arzneimittel) zu Wirkungseinbußen führen.
Durch den Zusatz von Glucose ist die Dichte von Bucain hyperbar 5 mg/ml auf 1,018 g/ml bei 20 °C, entsprechend 1,013 g/ml bei 37 °C, eingestellt.
Die Injektionslösung ist nur zur einmaligen Anwendung bestimmt. Die Anwendung muss unmittelbar nach Öffnung der Ampulle erfolgen. Nicht verbrauchte Reste sind zu verwerfen.
Handhabung der One-point-cut- (OPC-) Glasampullen
Zunächst die Flüssigkeit aus dem Ampullenhals nach unten schütteln.
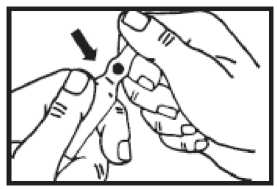
Die Sollbruchstelle befindet sich unterhalb der Markierung.
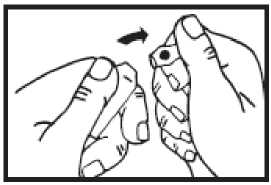
Den Ampullenhals von diesem Punkt wegbrechen.
4.3 Gegenanzeigen
Bucain hyperbar 5 mg/ml darf nicht angewendet werden,
- bei Überempfindlichkeit gegen den Wirkstoff, andere Lokalanästhetika vom Amid-Typ oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- bei schweren Störungen des Herz-Reizleitungssystems
- bei akut dekompensierter Herzinsuffizienz (akutes Versagen der Herzleistung)
- zur intravasalen Injektion (Einspritzen in ein Blutgefäß)
- bei natürlicher (vaginaler) Entbindung
Zusätzlich sind die speziellen Gegenanzeigen für die Spinalanästhesie zu beachten, wie z.B.
- nicht korrigierter Mangel an Blutvolumen
- erhebliche Störungen der Blutgerinnung
- erhöhter Hirndruck
- Infektion des zentralen Nervensystems
- Infektion im Punktionsgebiet
- pathologische anatomische Veränderungen
Die Injektion von Adrenalin-haltigen Bupivacainlösungen in die Bereiche von Endarterien (z.B. Blockade am Penis oder Oberst-Blockade) kann ischämische Gewebe-Nekrosen verursachen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Besondere Vorsicht bei der Anwendung von Bucain hyperbar 5 mg/ml ist erforderlich bei
- Nieren- oder Lebererkrankung
- Gefäßverschlüssen
- Arteriosklerose (Gefäßverkalkung)
- Nervenschädigung durch Zuckerkrankheit
- Injektion in ein entzündetes (infiziertes) Gebiet
Kinder
Für eine Epiduralanästhesie bei Kindern sollte die dem Alter und Gewicht entsprechende Dosis fraktioniert appliziert werden, da insbesondere eine Epiduralanästhesie in Brusthöhe zu schwerer Hypotonie und Atembeschwerden führen kann.
Ältere Menschen
Vornehmlich bei älteren Patienten kann ein plötzlicher Blutdruckabfall als Komplikation bei einer Spinalanästhesie auftreten.
Vorsichtsmaßnahmen
Zur Vermeidung von Nebenwirkungen sollten folgende Punkte beachtet werden:
- Bei Risikopatienten und bei Verwendung höherer Dosierungen (mehr als 25 % der maximalen Einzeldosis bei einzeitiger Gabe) intravenösen Zugang für Infusion anlegen (Volumensubstitution).
- Dosierung so niedrig wie möglich wählen.
- Korrekte Lagerung des Patienten beachten.
- Vor Injektion sorgfältig in zwei Ebenen aspirieren.
- Nicht in infizierte Bereiche injizieren.
- Injektion langsam vornehmen.
- Blutdruck, Puls und Pupillenweite kontrollieren.
- Allgemeine und spezielle Kontraindikationen sowie Wechselwirkungen mit anderen Mitteln beachten.
Vor der spinalen Injektion des Lokalanästhetikums ist darauf zu achten, dass das Instrumentarium zur Wiederbelebung, wie z.B. zur Freihaltung der Atemwege, zur Sauerstoffzufuhr und die Notfallmedikation zur Therapie toxischer Reaktionen sofort verfügbar sind.
Entsprechende Kenntnisse zur erfolgreichen Durchführung einer Spinalanästhesie werden als bekannt vorausgesetzt.
Es ist zu beachten, dass unter Behandlung mit Blutgerinnungshemmern (Antikoagulantien, wie z.B. Heparin), nichtsteroidalen Antirheumatika oder Plasmaersatzmitteln nicht nur eine versehentliche Gefäßverletzung im Rahmen der Schmerzbehandlung zu ernsthaften Blutungen führen kann, sondern dass allgemein mit einer erhöhten Blutungsneigung gerechnet werden muss. Gegebenenfalls sollten die Blutungszeit und die aktivierte partielle Thromboplastinzeit (aPTT) bestimmt, der Quick-Test durchgeführt und die
Thrombozytenzahl überprüft werden. Diese Untersuchungen sollten bei Risikopatienten auch im Falle einer Low-dose-Heparinprophylaxe (vorsorgliche Behandlung mit dem Blutgerinnungshemmer Heparin in niedriger Dosis) durchgeführt werden.
Eine Anästhesie bei gleichzeitiger Vorsorgetherapie zur Vermeidung von Thrombosen (Thromboseprophylaxe) mit niedermolekularem Heparin sollte nur unter besonderer Vorsicht durchgeführt werden.
Bei bestehender Behandlung mit nichtsteroidalen Antirheumatika (z.B. Acetylsalicylsäure) wird in den letzten fünf Tagen vor einer geplanten rückenmarksnahen Injektion eine Bestimmung der Blutungszeit als notwendig angesehen.
Hinweis
Die Durchführung der Spinalanästhesie bei Jugendlichen und Erwachsenen bis ca. 30 Jahre wird wegen der in dieser Altersgruppe häufig auftretenden postspinalen Kopfschmerzen nicht empfohlen.
Bucain hyperbar 5 mg/ml enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Ampulle.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Applikation von Bucain hyperbar 5 mg/ml und gefäßverengender Arzneimittel führt zu einer längeren Wirkdauer.
Die Wirkung nicht depolarisierender Muskelrelaxantien wird durch Bucain hyperbar 5 mg/ml verlängert.
Bei gleichzeitiger Anwendung von Aprindin und Bucain hyperbar 5 mg/ml ist eine Summation der Nebenwirkungen möglich. Aprindin hat aufgrund der chemischen Strukturähnlichkeit mit Lokalanästhetika ähnliche Nebenwirkungen.
Ein toxischer Synergismus wird für zentrale Analgetika und Ether beschrieben.
Kombinationen verschiedener Lokalanästhetika rufen additive Wirkungen am kardiovaskulären System und ZNS hervor.
4.6 Fertilität, Schwangerschaft und Stillzeit
Die Anwendung von Bupivacain in der Frühschwangerschaft sollte nur unter strengster Nutzen-/Risiko-Abschätzung erfolgen, da im Tierversuch fruchtschädigende Wirkungen beobachtet worden sind und mit einer Anwendung von Bupivacain am Menschen während der Frühschwangerschaft keine Erfahrungen vorliegen.
Als mögliche Komplikation des Einsatzes von Bupivacain in der Geburtshilfe ist das Auftreten einer arteriellen Hypotension bei der Mutter anzusehen.
Nach Gabe von Bupivacain unter der Geburt kann es zu neurophysiologischen Beeinträchtigungen des Neugeborenen kommen.
Im Zusammenhang mit einer Anwendung bei der Parazervikalblockade ist von fetalen Bradykardien und Todesfällen berichtet worden.
In der Geburtshilfe darf bei natürlicher Entbindung Bucain hyperbar 5 mg/ml nicht angewendet werden. Die geburtshilfliche Anwendung ist ausschließlich bei Sectio caesarea indiziert, da Bucain hyperbar 5 mg/ml eine starke motorische Blockade bewirkt. Bei vaginaler Entbindung sind grundsätzlich niedrigere Konzentrationen anzuwenden.
Nach geburtshilflicher Periduralanästhesie mit Bupivacain konnte bei fünf Frauen in einem Zeitraum von 2 bis 48 Stunden nach der Geburt kein Bupivacain in der Muttermilch nachgewiesen werden (Nachweisegrenze < 0,02 pg/ml, maximale maternale Serumspiegel von 0,45 ± 0,06 pg/ml).
Über die Auswirkungen einer Spinaianästhesie mit Bupivacain während der Stillzeit liegen keine Erkenntnisse hinsichtlich Sicherheit und Unbedenklichkeit vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nach einer Spinalanästhesie mit Bucain hyperbar 5 mg/ml darf der Patient nicht aktiv am Straßenverkehr teilnehmen oder Maschinen bedienen. Über den Zeitraum muss vom Arzt im Einzelfall entschieden werden. Der Patient sollte sich nur in Begleitung nach Hause begeben und keinen Alkohol zu sich nehmen.
4.8 Nebenwirkungen
Die möglichen Nebenwirkungen nach Anwendung von Bucain hyperbar 5 mg/ml entsprechen weitgehend denen anderer Lokalanästhetika vom Säureamid-Typ. Unerwünschte, systemische Wirkungen, die bei Überschreiten eines Blutplasmaspiegels von 1,2 - 2 pg Bupivacain/ml auftreten können, sind methodisch (bedingt durch die Art der Anwendung), pharmakodynamisch oder pharmakokinetisch bedingt und betreffen das Zentralnervensystem und das Herzkreislaufsystem.
a) Methodisch bedingt:
Infolge der Injektion zu großer Lösungsmengen.
Durch unbeabsichtigte Injektion in ein Blutgefäß.
Durch unsachgemäße Lagerung des Patienten.
Durch hohe Spinalanästhesie (massiver Blutdruckabfall).
b) Pharmakodynamisch bedingt:
In äußerst seltenen Fällen können allergische Reaktionen auftreten.
Nach einer Spinalanästhesie treten häufig Harnblasenfunktionsstörungen auf.
c) Pharmakokinetisch bedingt:
Als mögliche Ursache für Nebenwirkungen müssen auch eventuelle abnorme Resorptionsverhältnisse oder Störungen beim Abbau in der Leber oder bei der Ausscheidung durch die Niere in Betracht gezogen werden.
Kinder und Jugendliche
Nebenwirkungen bei Kindern sind mit denen bei Erwachsenen vergleichbar. Jedoch können bei Kindern die Frühsymptome einer Intoxikation mit einem Lokalanästhetikum möglicherweise nur schwer erkannt werden, wenn der Block während einer Sedierung oder Allgemeinnarkose gesetzt wird.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Die Zeichen einer Überdosierung lassen sich zwei qualitativ unterschiedlichen Symptomkomplexen zuordnen und unter Berücksichtigung der Intensitätsstärke gliedern:
a) Zentralnervöse Symptome Leichte Intoxikation:
Kribbeln in den Lippen und der Zunge, Taubheit im Mundbereich, Ohrensausen, metallischer Geschmack, Angst, Unruhe, Zittern, Muskelzuckungen, Erbrechen, Desorientiertheit.
Mittelschwere Intoxikation:
Sprachstörung, Benommenheit, Übelkeit, Erbrechen, Schwindel, Schläfrigkeit, Verwirrtheit, Zittern, choreiforme Bewegungen (bestimmte Form von Bewegungsunruhe), Krämpfe (tonisch-klonisch), weite Pupillenöffnung, beschleunigte Atmung.
Schwere Intoxikation:
Erbrechen (Erstickungsgefahr), Schließmuskellähmung, Muskeltonusverlust,
Reaktions- und Bewegungslosigkeit (Stupor), irreguläre Atmung, Atemstillstand, Koma, Tod.
b) Kardiovaskuläre Symptome Leichte Intoxikation:
Herzklopfen, erhöhter Blutdruck, beschleunigter Herzschlag, beschleunigte Atmung. Mittelschwere Intoxikation:
Beschleunigter Herzschlag, Herzrhythmusstörungen (Arrhythmie), Sauerstoffmangel, Blässe.
Schwere Intoxikation:
Starke Sauerstoffunterversorgung (schwere Zyanose), Herzrhythmusstörungen (verlangsamter Herzschlag, Blutdruckabfall, primäres Herzversagen, Kammerflimmern, Asystolie).
Es sind die folgenden Gegenmaßnahmen erforderlich:
- Sofortige Unterbrechung der Zufuhr von Bucain hyperbar 5 mg/ml.
- Freihalten der Atemwege.
- Zusätzlich Sauerstoff zuführen; falls notwendig mit reinem Sauerstoff assistiert oder kontrolliert beatmen (zunächst über Maske und mit Beatmungsbeutel, dann erst über einen Trachealtubus). Die Sauerstofftherapie darf nicht bereits bei Abklingen der Symptome, sondern erst dann abgesetzt werden, wenn alle Vitalfunktionen zur Norm zurückgekehrt sind.
- Sorgfältige Kontrolle von Blutdruck, Puls und Pupillenweite.
Weitere mögliche Gegenmaßnahmen sind:
- Bei einem akuten und bedrohlichen Blutdruckabfall sollte unverzüglich eine Flachlagerung des Patienten mit Hochlagerung der Beine erfolgen und ein BetaSympathomimetikum langsam intravenös injiziert werden (z.B. 10 bis 20 Tropfen einer Lösung von 1 mg Isoprenalin in 200 ml Glukoselösung).
Zusätzlich ist eine Volumensubstitution vorzunehmen (z.B. mit kristalloiden Lösungen).
- Bei erhöhtem Vagotonus (Bradykardie) wird Atropin (0,5 bis 1,0 mg i.v.) verabreicht. Bei Verdacht auf Herzstillstand sind die erforderlichen Maßnahmen durchzuführen.
- Konvulsionen werden mit kleinen, wiederholt verabreichten Dosen ultrakurz-wirkender Barbiturate (z.B. Thiopental-Natrium 25 bis 50 mg) oder mit Diazepam 5 bis 10 mg i.v.
behandelt; dabei werden die Dosen fraktioniert bis zum Zeitpunkt der sicheren Kontrolle verabreicht.
Grundsätzlich ist darauf hinzuweisen, dass in vielen Fällen bei Anzeichen von Krämpfen die obligate Sauerstoffbeatmung zur Behandlung ausreicht.
Bei anhaltenden Krämpfen werden Thiopental-Natrium (250 mg) und ein kurzwirksames Muskelrelaxans verabreicht und nach Intubation wird mit 100 % Sauerstoff beatmet.
Die Krampfschwellendosis kann beim Menschen individuell unterschiedlich sein. Als Untergrenze werden 2,2 p,g/ml Blutplasma angegeben.
Zentral wirkende Analeptika sind kontraindiziert bei Intoxikation durch Lokalanästhetika!
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lokalanästhetikum, Amid ATC-Code: N01BB01
Bupivacainhydrochlorid ist ein Lokalanästhetikum vom Säureamid-Typ mit raschem Wirkungseintritt und lang anhaltender reversibler Blockade vegetativer, sensorischer und motorischer Nervenfasern sowie der Erregungsleitung des Herzens. Es wird angenommen, dass die Wirkung durch Abdichten der Na+-Kanäle in der Nervenmembran verursacht wird. Bupivacainhydrochlorid-Injektionslösung hat einen pH-Wert von 4,5 - 6 und einen pKa-Wert von 8,1. Das Verhältnis von dissoziierter Form zu der lipidlöslichen Base wird durch den im Gewebe vorliegenden pH-Wert bestimmt.
Der Wirkstoff diffundiert zunächst durch die Nervenmembran zur Nervenfaser als basische Form, wirkt aber als Bupivacain-Kation erst nach Reprotonierung. Bei niedrigen pH-Werten, z.B. im entzündlich veränderten Gewebe, liegen nur geringe Anteile in der basischen Form vor, so dass keine ausreichende Anästhesie zustande kommen kann.
Die motorische Blockade bleibt nicht länger bestehen als die Analgesie.
5.2 Pharmakokinetische Eigenschaften
Bupivacain ist sehr lipophil (im Vergleich zu Mepivacain oder Lidocain) und hat einen pKa-Wert von 8,1. Es wird in hohem Maße an Plasmaproteine gebunden (92 bis 96 %). Die Plasma-Halbwertszeit bei Erwachsenen beträgt 1,5 bis 5,5 Stunden; die Plasma-Clearance ist 0,58 l/min. Nach Metabolisierung in der Leber, vorwiegend durch Hydrolysierung, werden die Stoffwechselprodukte (Säurekonjugate) renal ausgeschieden. Nur 5-6 % werden unverändert eliminiert.
Die Pharmakokinetik bei Kindern ist mit der bei Erwachsenen vergleichbar.
5.3 Präklinische Daten zur Sicherheit a) Akute Toxizität
Die Prüfung der akuten Toxizität von Bupivacain im Tierversuch ergab bei der Maus eine LD50 (i.v.) zwischen 6,4 mg/kg KG und 10,4 mg/kg KG. Bei der Ratte liegen die Werte zwischen 5,6 mg/kg KG und 6,0 mg/kg KG. Der Abstand zur therapeutischen Dosis (2 mg/kg KG) ist damit relativ gering.
Toxische ZNS-Reaktionen wurden bereits bei Plasmakonzentrationen von 2,2 pg Bupivacain/ml beobachtet, bei kontinuierlicher Infusion lagen die gemessenen Plasmaspiegel über 4 pg/ml.
b) Lokale Toxizität
Die Prüfung der lokalen Toxizität von Bupivacain bei verschiedenen Tierspezies hat eine hohe Gewebetoxizität ergeben, die sich jedoch als reversibel erwies.
c) Chronische / Subchronische Toxizität
Untersuchungen zur subchronischen Toxizität bei lokaler Applikation von Bupivacain beim Tier (Ratte) ergaben muskuläre Faseratrophien. Eine komplette Regeneration der Kontraktilität wurde jedoch beobachtet.
Untersuchungen zur chronischen Toxizität liegen nicht vor.
d) Mutagenes und tumorerzeugendes Potential
Eine ausreichende Mutagenitätsprüfung von Bupivacain liegt nicht vor. Eine vorläufige Untersuchung an Lymphozyten von Patienten, die mit Bupivacain behandelt wurden, verlief negativ.
Langzeituntersuchungen zum tumorerzeugenden Potential von Bupivacain wurden nicht durchgeführt.
e) Reproduktionstoxizität
Bupivacain passiert die Plazenta mittels einfacher Diffusion und erreicht auch im Feten pharmakologisch wirksame Konzentrationen.
Kontrollierte Studien über mögliche Effekte von Bupivacain auf den Embryo/Fetus während einer Exposition von Frauen in der Schwangerschaft liegen nicht vor.
Im Tierversuch sind bei Dosierungen, die dem fünf- bzw. neunfachen der Humandosis entsprechen bzw. einer Gesamtdosis von 400 mg, eine verminderte Überlebensrate der Nachkommen exponierter Ratten sowie embryoletale Effekte beim Kaninchen nachgewiesen worden.
Eine Studie an Rhesusaffen gab Hinweise auf eine veränderte postnatale Verhaltensentwicklung nach Bupivacain-Exposition zum Geburtszeitpunkt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Glucose-Monohydrat, Natriumchlorid, Natriumhydroxid (E 524), Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Bisher keine bekannt
6.3 Dauer der Haltbarkeit
4 Jahre
Die Injektionslösung ist nur zur einmaligen Anwendung bestimmt. Die Anwendung muss unmittelbar nach Öffnung der Ampulle erfolgen. Nicht verbrauchte Reste sind zu verwerfen.
Nur klare Lösungen in unversehrten Behältnissen zur Injektion verwenden!
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Farblose Glasampullen
Glasampullen zu 4 ml 5 Ampullen (N2)
10 Ampullen (N3)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
PUREN Pharma GmbH & Co. KG Willy-Brandt-Allee 2 81829 München Telefon: 089/558909-0 Telefax: 089/558909-240
8. ZULASSUNGSNUMMER
13640.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 06. Mai 1991
Datum der letzten Verlängerung der Zulassung: 12. April 2005
10. STAND DER INFORMATION
10.2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 10 von 10