Budes N 0,2 Mg/Dosis
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Budes® N 0,2 mg/Dosis Druckgasinhalation, Lösung
Wirkstoff: Budesonid
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Sprühstoß zu 75,8 mg enthält eine abgemessene Einzeldosis von 0,2 mg Budesonid. Dies entspricht einer aus dem Mundstück abgegebenen Menge von 0,19 mg.
Sonstige Bestandteile mit bekannter Wirkung:
• Ethanol
• (3-sn-Phosphatidyl)cholin (pflanzlichen Ursprungs [Soja])
Vollständige Auflistung der sonstigen Bestandteile siehe, Abschnitt 6.1.
3. DARREICHUNGSFORM
Druckgasinhalation, Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
• Behandlung eines persistierenden Asthma bronchiale, bei dem die Therapie mit inhalativ anzuwendendem Glukokortikoid indiziert ist.
• Behandlung einer mittelgradigen bis schweren chronisch obstruktiven Lungenerkrankung (Stadium IIb und III), bei der spirometrisch ein Ansprechen auf inhalativ anzuwendende Glukokortikoide nachgewiesen werden konnte.
Hinweis
Budes N ist nicht zur Behandlung von plötzlich auftretenden Atemnotanfällen (akuter Asthmaanfall oder Status asthmaticus) geeignet.
4.2 Dosierung und Art der Anwendung
Die Dosierung sollte in jedem Einzelfall sorgfältig auf die geringste noch effektive Dosis zur Kontrolle der Asthmasymptome eingestellt werden. Wird ein Patient von einem Inhalationssystem auf ein anderes umgestellt, sollte die Dosis erneut individuell bestimmt werden.
Es wird empfohlen, nach jeder Anwendung den Mund gut mit Wasser auszuspülen und danach das Spülwasser auszuspucken, um Heiserkeit, Reizungen des Rachens und Candida-Infektionen des Mund- und Rachenraums vorzubeugen und möglicherweise das Risiko systemischer Effekte zu mindern.
Die Erhaltungsdosis sollte auf die zur Asthmakontrolle niedrigste mögliche Dosis eingestellt werden.
Asthma
Budes N kann bei der Erhaltungstherapie von Asthma möglicherweise orale Glukokortikoide ersetzen oder deren Dosis signifikant reduzieren. Zu Beginn der Umstellung von oralen Steroiden auf Budes N sollte sich der Patient in einer relativ stabilen Phase befinden. Eine hohe Dosis Budes N sollte dann in Kombination mit dem vorher eingenommenem Steroid ungefähr 10 Tage lang gegeben werden. Danach wird die orale Steroiddosis schrittweise (z. B. um 2,5mg Prednisolon oder dessen Äquivalent jeden Monat) bis zur niedrigsten möglichen Dosis reduziert. In vielen Fällen ist es möglich, die orale Steroidgabe komplett durch Budes N zu ersetzen. Für weitere Informationen zum Absetzen von Kortikoiden siehe Abschnitt 4.4.
Kinder ab 6 Jahren:
Die übliche empfohlene Dosis beträgt 0,2-0,4 mg täglich, verteilt auf zwei Einzeldosen. Bei schweren Asthmafällen können bis zu 0,8 mg täglich, verteilt auf mehrere Einzeldosen, notwendig sein.
Aufgrund fehlender klinischer Erfahrung mit Kindern unter 6 Jahren sollte Budes N bei Patienten dieser Altersgruppe nicht angewendet werden.
Erwachsene und Jugendliche über 12 Jahre:
Die übliche empfohlene Dosierung beträgt 0,2-1,6 mg täglich, verteilt auf 2 Einzeldosen.
Die Patienten sollen über die korrekte Anwendung des Dosieraerosols, gemäß der Bedienungsanleitung, eingewiesen werden, um sicherzustellen, dass der Wirkstoff die betroffenen Gebiete in den Lungen erreicht.
Besondere Patientengruppen Eingeschränkte Nierenfunktion
Für die Anpassung der Dosis bei Patienten mit eingeschränkter Nierenfunktion liegen keine Daten vor. Basierend auf pharmakokinetischen Daten zu oralem Budesonid ist es unwahrscheinlich, dass sich bei solchen Patienten die systemische Exposition des Wirkstoffes klinisch signifikant verändert (siehe Abschnitt 5).
Eingeschränkte Leberfunktion
Für eine Anpassung der Dosis bei Patienten mit eingeschränkter Leberfunktion liegen keine Daten vor. Bei Patienten mit schwer eingeschränkter Leberfunktion sollte Budes N jedoch mit Vorsicht angewendet werden, weil Budesonid vorrangig über den Lebermetabolismus ausgeschieden wird. Basierend auf pharmakokinetischen Daten zu oralem Budesonid ist es unwahrscheinlich, dass sich bei Patienten mit leichter bis moderater Leberfunktionsstörung die systemische Exposition des Wirkstoffes klinisch signifikant verändert (siehe Abschnitt 5).
Ältere Patienten (über 65 Jahre)
Es gibt keine Hinweise, dass Patienten über 65 Jahre eine andere Dosis als jüngere erwachsene Patienten benötigen.
Art und Dauer der Anwendung
Budes N ist zur Inhalation vorgesehen.
Wird Budes N mehr als 3 Tage nicht angewendet, muss vor der nächsten Inhalation ein Sprühstoß in die Luft ausgelöst werden.
4.3 Gegenanzeigen
Budes N darf nicht angewendet werden bei
• Überempfindlichkeit gegen den Wirkstoff, Soja, Erdnuss oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• Patienten mit aktiver Lungentuberkulose
• Kindern unter 6 Jahren.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Budesonid ist nicht für die schnelle Linderung akuter Asthmaepisoden bestimmt, für die ein inhalierbarer, schnellwirkender Bronchodilatator erforderlich ist.
Den Patienten sollte geraten werden, im Falle einer Verschlechterung ihres Asthmas (zunehmend häufigere Anwendung eines schnellwirkenden, inhalierbaren Bronchodilatators oder anhaltende Atmungsprobleme) ihren Arzt aufzusuchen. Die Patientin/der Patient sollte neu beurteilt und die Notwendigkeit einer verstärkten entzündungshemmenden Therapie (Dosiserhöhung inhalierbarer oder oraler Kortikosteroide) in Betracht gezogen werden.
Längerfristige Behandlung mit hohen Dosen inhalativer Kortikosteroide, insbesondere mit höheren als den empfohlenen Dosen, kann sich in einer klinisch signifikanten Suppression der Nebennierenfunktion äußern. Diese Patienten können Anzeichen und Symptome einer Nebennierenrinden-Insuffizienz aufweisen, wenn sie schwerem Stress ausgesetzt werden. Eine zusätzliche Behandlung mit systemischen Kortikosteroiden sollte in Stresszeiten und bei elektiven Eingriffen in Erwägung gezogen werden.
Systemische Effekte
Inhalative Kortikosteroide können systemische Effekte hervorrufen, insbesondere wenn hohe Dosen über lange Zeiträume angewendet werden. Die Wahrscheinlichkeit, dass diese Effekte auftreten, ist wesentlich geringer als bei der Anwendung oraler Kortikosteroide. Mögliche systemische Wirkungen schließen Hyperadrenokortizismus/Cushing-Syndrom, cushingoide Merkmale, Hemmung der Nebennierenfunktion, Wachstumsverzögerung bei Kindern und Jugendlichen, Abnahme der Knochendichte, Katarakt, Glaukom und seltener eine Reihe von psychologischen oder Verhaltenseffekten einschließlich psychomotorische Hyperaktivität, Schlafstörungen, Angstgefühle, Depression oder Aggressivität (insbesondere bei Kindern) ein.
Die Dosierung sollte in jedem Einzelfalle sorgfältig auf die geringste noch effektive Dosis zur Kontrolle der Asthmasymptome eingestellt werden.
Eine herabgesetzte Leberfunktion beeinträchtigt die Eliminierung von Kortikosteroiden mit der Folge von niedrigeren Eliminationsraten und höherer systemischer Exposition. Mögliche systemische Nebenwirkungen sind zu beachten.
Begleitmedikationen
Eine gleichzeitige Behandlung mit Itraconazol, Ketoconazol, Ritonavir oder anderen potenten CYP3A4-Inhibitoren (z. B. einige Azol-Antimykotika, HIV-Protease-Inhibitoren und Macrolid-Antibiotika) soll vermieden werden (siehe Abschnitt 4.5). Falls dies nicht möglich ist, muss eine möglichst lange Zeitspanne zwischen den Anwendungen der interagierenden Arzneimittel liegen.
Begleiterkrankungen
Besondere Vorsicht ist notwendig bei Patienten mit stummer Lungentuberkulose, und bei Patienten mit Pilz- oder Virusinfektionen der Atemwege.
Während der Therapie mit inhalativen Kortikosteroiden kann eine Candida-Infektion im Mundraum auftreten. Diese Infektion kann die Behandlung mit einer geeigneten Antimykotika-Medikation erfordern, und bei manchen Patienten kann die Unterbrechung der Therapie notwendig sein (siehe auch Abschnitt 4.2).
Paradoxer Bronchospasmus
Wie bei anderen Inhalationstherapien können in seltenen Fällen paradoxe Bronchospasmen mit einer sofortigen Zunahme des Giemens nach Dosisgabe auftreten. Die Behandlung mit inhalativem Budesonid sollte dann sofort ausgesetzt, der Patient untersucht und falls notwendig eine alternative Therapie eingesetzt werden. In diesem Fall sollte sofort ein Bronchodilatator mit schnellem Wirkungseintritt inhaliert werden.
Effekte auf das Wachstum
Es wird empfohlen, die Körpergröße von Kindern, die unter einer längerfristigen Behandlung mit inhalativen Kortikosteroiden stehen, regelmäßig zu kontrollieren. Bei einer Wachstumsverzögerung sollte die Behandlung hinsichtlich einer Reduktion der inhalativen Kortikosteroiddosis überdacht werden. Der Nutzen der Kortikoidtherapie ist gegen das mögliche Risiko einer Wachstumshemmung sorgfältig abzuwägen. Zusätzlich sollte die Überweisung des Kindes bzw. Jugendlichen an einen Spezialisten für pädiatrische Pneumologie in Betracht gezogen werden.
Die Langzeit-Effekte dieser Wachstumsverzögerung in Verbindung mit inhalativen Kortikosteroiden sowie die Auswirkung auf die endgültige Erwachsenengröße sind nicht bekannt. Das Potenzial, das Größenwachstum nach Beenden der Therapie mit oral zu inhalierenden Kortikosteroiden aufzuholen, wurde nicht angemessen untersucht.
Vorsichtsmaßnahmen
Patienten, die mit einer Steroidbehandlung beginnen
Ein therapeutischer Effekt wird im Allgemeinen innerhalb von 10 Tagen erreicht. Bei Patienten mit übermäßiger Schleimproduktion in den Bronchien kann anfangs eine kurze (ca. 2 Wochen) zusätzliche Behandlung mit oralen Kortikosteroiden durchgeführt werden.
Patienten unter Steroidbehandlung
Bei einer Umstellung von oralen Steroiden auf Budes N sollte sich die Patientin/der Patient in einem relativ stabilen Zustand befinden. Ca. 10 Tage lang sollte eine hohe Dosis Budesonid in Kombination mit dem bisher verwendeten oralen Steroid verabreicht werden. Danach sollte die Dosis des oralen Steroids schrittweise (monatlich um z. B. 2,5 mg Prednisolon oder dem Äquivalent) auf die niedrigste mögliche Dosis reduziert werden. Die Behandlung mit zusätzlichen systemischen Kortikosteroiden oder Budesonid sollte nicht plötzlich abgebrochen werden.
Nach Umstellung können Symptome auftreten, die durch die vorhergehende systemische Gabe von Glukokortikoiden unterdrückt waren, wie z: B. allergischer Rhinitis, allergische Ekzeme, rheumatoide Beschwerden. Diese Symptome sollten mit geeigneten Arzneimitteln zusätzlich behandelt werden.
Besondere Vorsicht ist während der ersten Monate der Umstellung von systemischen Kortikosteroiden auf Budesonid angezeigt, um sicherzustellen, dass die adrenokortikale Reserve des Patienten ausreichend ist, um spezifischen kritischen Situationen wie Traumen, Operationen oder schweren Infektionen begegnen zu können.
Dieses Arzneimittel enthält 22,6 Vol.-% Alkohol.
Die Anwendung von Budes N kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die Metabolisierung von Budesonid wird hauptsächlich durch CYP3A4 katalysiert. Dieses Enzymsystem ist auch für den Großteil der First-Pass-Metabolisierung verantwortlich. Die gleichzeitige Gabe von bekannten Inhibitoren von CYP3A4 (u. a. Itraconazol, Ketoconazol, Ritonavir Nelfinavir, Amiodaron und Clarithromycin) kann zu einem deutlichen Anstieg der systemischen Budesonid-Konzentration führen (siehe Abschnitte 4.4). Eine gleichzeitige Behandlung mit potenten CYP3A4-Inhibitoren soll vermieden werden. Falls dies nicht möglich ist, muss eine möglichst lange Zeitspanne zwischen den Anwendungen der interagierenden Arzneimittel liegen und die Funktion der Nebennierenrinde muss überwacht werden. Eine Reduktion der Budesonid-Dosis kann ebenfalls in Erwägung gezogen werden (siehe Abschnitt 5.2). Bei gleichzeitiger Gabe von 0,2 mg Itraconazol einmal täglich und inhalativem Budesonid (Einzeldosis von 1,0 mg) liegen begrenzte Daten zu der Interaktion vor. Bei hochdosiertem inhalativem Budesonid weisen sie darauf hin, dass eine deutliche Zunahme der Plasmaspiegel (im Durchschnitt vierfach) auftreten kann.
Durch gleichzeitige Gabe von Substanzen, die das CYP3A4 stark induzieren (z. B. Rifampicin), wird die Metabolisierung von Budesonid verstärkt. Dadurch kann es zu einem Abfall der systemischen Budesonid-Konzentration kommen (siehe Abschnitt 5.2). Es ist nicht bekannt, ob die pulmonale Exposition beeinflusst wird.
Erhöhte Plasmakonzentrationen und verstärkte Wirkungen von Kortikosteroiden wurden bei Frauen beobachtet, die auch mit Östrogenen und kontrazeptiven Steroiden behandelt wurden; allerdings wurde kein Effekt bei Budesonid und gleichzeitiger Einnahme von einer niedrig dosierten Kombination oraler Kontrazeptiva beobachtet.
Weil die Nierenfunktion supprimiert sein kann, könnte ein ACTH-Stimulationstest für die Diagnose von Hypophyseninsuffizienz falsche Werte zeigen (niedrige Werte).
4.6 Fertilität, Schwangerschaft und Stillzeit
Daten aus einer großen prospektiven epidemiologischen Studie und von weltweiten postmarketing Erfahrungen zeigen, dass inhaliertes Budesonid während der Schwangerschaft keine Auswirkungen auf die Gesundheit des Fötus /Neugeborenen hat.
Während einer Schwangerschaft sollte Budesonid nur nach strenger Indikationsstellung, bei der der Nutzen des Arzneimittels für die Mutter gegen das mögliche Risiko für den Fötus abgewogen wird, angewandt werden.
Budesonid geht in die Muttermilch über. Bei therapeutischen Dosen werden allerdings keine Effekte auf den Säugling erwartet. Budesonid kann während der Stillzeit verwendet werden.
Die Erhaltungsbehandlung mit inhalativem Budesonid (0,2-0,4 mg zweimal täglich) bei asthmatischen, stillenden Frauen resultiert in einer vernachlässigbaren systemischen Exposition von Budesonid bei gestillten Kleinkindern.
In einer pharmakokinetischen Studie betrug die geschätzte Tagesdosis des Kleinkindes 0,3 % der maternalen Tagesdosis bei beiden Dosierungen. Die durchschnittliche Plasmakonzentration bei Kleinkindern wurde unter der Annahme vollständiger oraler Bioverfügbarkeit auf 1/600stel der beobachteten Konzentration im maternalen Plasma geschätzt. Die Konzentrationen von Budesonid in Plasmaproben von Kleinkindern lagen alle unterhalb der Quantifizierungsgrenze.
Basierend auf Daten zu inhalativem Budesonid und der Tatsache, dass Budesonid innerhalb der therapeutischen Dosisintervalle nach nasaler, inhalativer, oraler und rektaler Verabreichung lineare pharmakokinetische Eigenschaften aufweist, ist die erwartete Exposition des Säuglings bei therapeutischen Dosen von Budesonid niedrig.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Budes N hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
In Tabelle 1 sind gemäß den MedDRA-Organklassen die Nebenwirkungen aufgeführt und nach Häufigkeiten gruppiert.
Tabelle 1: Nebenwirkungen
|
Infektionen und parasitäre Erkrankungen | |
|
Häufig |
Candida-Infektionen im Mund- und Rachenraum |
|
Erkrankungen des Immunsystems | |
|
Selten |
Sofortige und verzögerte Überempfindlichkeitsreaktionen einschließlich Exanthem, Kontaktdermatitis, Urtikaria, Angioödeme, Juckreiz und anaphylaktische Reaktionen |
|
Endokrine Erkrankungen | |
|
Selten |
Anzeichen und Symptome von systemischen Kortikosteroideffekten, einschließlich Hemmung der Nebennierenfunktion, Wachstumsverzögerung*, Hyperadrenokortizismus, Cushing-Syndrom |
Nicht bekannt
Glaukom, Katarakt
Psychiatrische Erkrankungen
Selten Ruhelosigkeit, Nervosität, Depression,
Verhaltensveränderungen (vorwiegend bei Kindern)
|
Nicht bekannt |
Schlafstörungen, Angstgefühle, psychomotorische Hyperaktivität, Aggressivität |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
|
Häufig |
Husten, , Reizung des Rachens |
|
Selten |
Bronchospasmus, einschließlich paradoxer Bronchospasmus, Heiserkeit, Dysphonie |
|
Erkrankungen der Haut und des Unterhautzellgewebes | |
|
Selten |
Hämatom |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |
|
Selten |
Verringerung der Knochendichte |
* siehe Kinder und Jugendliche weiter unten
Patienten mit neu diagnostizierter COPD haben ein erhöhtes Risiko für eine Lungenentzündung zu Beginn einer Behandlung mit inhalativen Kortikosteroiden. Allerdings ergab die gewichtete Bewertung von 8 zusammengefassten klinischen Studien mit 4643 COPD-Patienten in Behandlung mit Budesonid und 3643 Patienten, die nicht für Behandlungen mit einem ICS (inhalatives Kortikosteroid) randomisiert wurden, kein erhöhtes Risiko für eine Lungenentzündung. Die Ergebnisse der ersten 7 dieser 8 Studien wurden als Metaanalyse publiziert.
Kinder und Jugendliche
Das Wachstum sollte aufgrund des Risikos für Wachstumsverzögerung bei Kindern und Jugendlichen wie in Abschnitt 4.4 beschrieben überwacht werden.
(3-sn-Phosphatidyl)cholin (pflanzlichen Ursprungs [Soja]) kann sehr selten allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3
D-53175 Bonn
Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Die akute Toxizität von Budesonid ist gering. Nach Inhalation größerer Mengen des Wirkstoffs über einen kurzen Zeitraum kann es zu einer Hemmung der Hypothalamus-Hypophysen-Nebennieren-Achse kommen. Spezielle Notfallmaßnahmen sind nicht erforderlich. Die Behandlung mit Budesonid sollte in der niedrigsten, zur wirksamen Kontrolle des Asthmas notwendigen Dosis weitergeführt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere inhalative Mittel bei obstruktiven Atemwegserkrankungen; Glukokortikoide
ATC Code: R03BA02
Budesonid ist ein Kortikosteroid mit lokaler Wirkung. Wie andere inhalative Glukokortikoide übt Budesonid seine pharmakologische Wirkung über die Interaktion mit intrazellulären Glukokortikoid-Rezeptoren aus. Die Produktion von vielen verschiedenen Zytokinen, Chemokinen, Enzymen und Zelladhäsionsmolekülen wird inhibiert. Der maximale Nutzen einer Behandlung mit Budesonid wird innerhalb von etwa 10 Tagen nach Behandlungsbeginn erreicht. Die regelmäßige Anwendung von Budesonid reduziert die chronische Entzündung der asthmatischen Lungen. Budesonid verbessert dabei die Lungenfunktion und Asthmasymptome, setzt die bronchiale Hyperreagibilität herab und beugt Asthma-Exazerbationen vor.
Einfluss auf den Plasmakortisol-Spiegel
Studien, in denen gesunde Probanden mit inhalativem Budesonid behandelt wurden, haben eine dosisabhängige Wirkung auf die Plasma- und Urinkortisolwerte gezeigt. ACTH-Tests beweisen, dass inhalatives Budesonid in den empfohlenen Dosierungen einen signifikant geringeren Einfluss auf die Nebennierenfunktion hat als Prednison 10 mg.
5.2 Pharmakokinetische Eigenschaften
Resorption
Der in die Lungen gelangte Anteil an Budesonid wird schnell und vollständig resorbiert. Die Spitzen-Konzentration wird innerhalb von 5-10 Minuten nach der Applikation erreicht. Die Lungendeposition beträgt ungefähr 25-30 % einer Einzeldosis. Nur 10-13 % des geschluckten Anteils einer inhalierten Dosis sind aufgrund einer signifikanten präsystemischen Metabolisierung in der Leber bioverfügbar. Die maximale Plasmakonzentration und das Profil der Fläche unter der Konzentrations-Zeit-Kurve erhöht sich linear zur Dosis.
Verteilung
Das Verteilungsvolumen von Budesonid beträgt ungefähr 3 l/kg. Die Plasmaproteinbindung beträgt im Mittel 85-90 %.
Budesonid geht in die Muttermilch über, das Verhältnis von Milch- zu Plasmakonzentration beträgt ungefähr 0,46. Die geschätzte Tagesdosis des Kleinkindes beträgt 0,3 % der
maternalen Tagesdosis, und die durchschnittliche Plasmakonzentration bei Kleinkindern wird auf 1/600stel der beobachteten Konzentration in maternalem Plasma geschätzt, selbst unter der Annahme vollständiger oraler Bioverfügbarkeit im Körper des Kleinkindes.
BiotransformationBudesonid wird in sehr hohem Maße (ca. 90 %) bei der ersten Leberpassage zu Metaboliten mit niedrigerer Glukokortikosteroidaktivität metabolisiert. Die Glukokortikosteroidaktivität derHauptmetaboliten 6-beta-Hydroxybudesonid und 16-alpha-Hydroxyprednisolon beträgt weniger als1 % der Budesonid-Aktivität. Damit sind systemische Bioverfügbarkeit und Toxizität begrenzt. Budesonid wird hauptsächlich über CYP3A4, eine Untergruppe des Cytochrom-P-450-Systems, metabolisiert.
Elimination. Die Metaboliten werden unverändert oder in konjugierter Form hauptsächlich über die Nieren ausgeschieden. Unverändertes Budesonid ist im Urin nicht nachgewiesen worden. Die systemische Clearance von Budesonid ist bei Erwachsenen hoch (ungefähr
1,2 l/min) und die terminale Plasmahalbwertszeit beträgt nach i.v.-Dosierung bei Erwachsenen durchschnittlich 2-3 Stunden.
Linearität
Bei klinisch relevanten Dosen ist die Pharmakokinetik von Budesonid dosisproportional. Besondere Patientengruppen
Ältere Patienten
Die Pharmakokinetik von Budesonid wurde bei älteren Patienten nicht untersucht. Die begrenzten Daten von Patienten über 65 Jahre weisen nicht auf einen signifikanten Unterschied zwischen der Pharmakokinetik bei älteren und jüngeren erwachsenen Patienten nach oraler und intravenöser Gabe von Budesonid hin.
Kinder und Jugendliche
Budesonid hat eine systemische Clearance von ungefähr 0,5 l/min bei asthmatischen Kindern im Alter von 4 bis 6 Jahren. Pro kg Körpergewicht haben Kinder eine Clearance, die ungefähr 50 %größer ist als die bei Erwachsenen. Die terminale Halbwertszeit von Budesonid nach Inhalation beträgt bei asthmatischen Kindern ungefähr 2,3 Stunden. Diese entspricht ungefähr der von gesunden Erwachsenen.Die Pharmakokinetik von Budesonid Dosieraerosolen wurde bei Kindern nicht untersucht.
Patienten mit eingeschränkter Leberfunktion
Die Pharmakokinetik von Budesonid wurde nicht bei Patienten mit eingeschränkter Leberfunktion untersucht. Es wurde jedoch berichtet, dass die systemische Verfügbarkeit von Budesonid bei Patienten mit Leberzirrhose nach oraler Verabreichung 2,5-fach höher lag als in der Kontrollgruppe der gesunden Probanden. Es wurde berichtet, dass eine leichte Beeinträchtigung der Leberfunktion die systemische Exposition wenig beeinflusst.
Patienten mit eingeschränkter Nierenfunktion
Die Pharmakokinetik von Budesonid wurde nicht bei Patienten mit eingeschränkter Nierenfunktion untersucht. Es wurde berichtet, dass nicht zu erwarten ist das die eingeschränkte Nierenfunktion einen Einfluss auf die Pharmakokinetik von oralem Budesonid hat. Metabolite von Budesonid werden über den Urin ausgeschieden und somit können Veränderungen das Risiko von Nebenwirkungen durch die Akkumulation von Metaboliten erhöhen. Bei einer schweren Nierenfunktionsstörung kann dies nicht ausgeschlossen werden.
5.3 Präklinische Daten zur Sicherheit
Präklinische Daten aus Toxizitätsstudien mit wiederholter Dosierung sowie Studien zur Hautsensibilisierung, Mutagenität und Karzinogenität mit Budesonid zeigen keine spezifische Gefährdung von Menschen bei den vorgesehenen therapeutischen Dosen.
Glukokortikosteroide, einschließlich Budesonid, lösten bei Tieren teratogene Effekte wie Gaumenspalten und Skelettmissbildungen aus. Ähnliche Effekte werden beim Menschen in therapeutischen Dosierungen als unwahrscheinlich angesehen.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
• Norfluran
• Ethanol 22,6 Vol.-% (entsprechend 11,4 mg pro Sprühstoß)
• (3-sn-Phosphatidyl)cholin (pflanzlichen Ursprungs [Soja])
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Zwischen + 2 °C und + 25 °C aufbewahren. Vor Hitze, direkter Sonnenbestrahlung und Frost schützen!
Behälter steht unter Druck! Nicht gegen Flammen oder auf glühende Gegenstände sprühen! Behälter auch nach dem Gebrauch nicht gewaltsam öffnen oder verbrennen!
6.5 Art und Inhalt des Behältnisses
Originalpackungen mit
• einem Druckbehältnis mit 18,2 g Lösung, entsprechend mind. 200 Sprühstößen.
• zwei Druckbehältnissen mit je 18,2 g Lösung, entsprechend mind. 2x 200 Sprühstößen (Doppelpackung).
• drei Druckbehältnissen mit je 18,2 g Lösung, entsprechend mind. 3x 200 Sprühstößen (Dreierpackung).
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Budes N darf nicht im Abwasser oder Haushaltsmüll entsorgt werden.
Anleitung zur Anwendung von Budes N
Budes N wird als Druckbehältnis mit Mundstück geliefert.
Bei neuen oder gebrauchten Druckbehältnissen, die 3 oder mehr Tage nicht verwendet wurden, sollte vor dem Gebrauch ein Sprühstoß in die Luft abgegeben werden, um eine einwandfreie Funktion zu gewährleisten.
Die Anwendung sollte möglichst im Sitzen oder Stehen erfolgen. Die Inhalation nicht überhastet vornehmen.
Anwendung
1. Die Schutzkappe vom Mundstück entfernen.
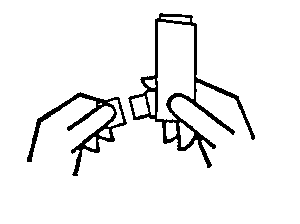
2. Langsam und so tief wie möglich ausatmen. Dabei nicht in das Mundstück hineinatmen.

3. Das Druckbehältnis, unabhängig von der Körperposition, in der inhaliert wird, mit dem Behälterboden nach oben halten. Das Mundstück vorsichtig zwischen den Zähnen platzieren und mit den Lippen umschließen. Den Kopf leicht zurückneigen.
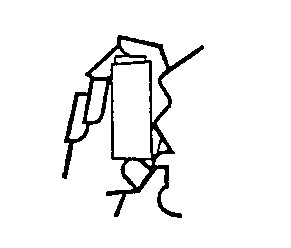
4. Langsam und tief durch den Mund einatmen und gleichzeitig auf den oberen Teil des Inhalators drücken, um einen Aerosolstoß freizusetzen.
5. Das Mundstück aus dem Mund nehmen. Den Atem so lange wie ohne Anstrengung möglich anhalten. Anschließend langsam durch die Nase ausatmen.
Falls ein weiterer Aerosolstoß inhaliert werden soll, den Inhalator etwa eine halbe Minute in aufrechter Position halten und anschließend die Schritte 2-5 wiederholen.
Falls unbeabsichtigt ein Teil des Gases vom oberen Teil des Inhalators oder seitlich aus dem Mund entweicht, sollte ein weiterer Aerosolstoß inhaliert werden.
Nach Gebrauch die Schutzkappe wieder aufsetzen.
Für Patienten mit schwächerem Händedruck kann es leichter sein, den Inhalator mit beiden Händen zu halten. Dazu wird der Inhalator mit beiden Zeigefingern von oben und beiden Daumen von unten fixiert.
Reinigung des Mundstückes
Um eine störungsfreie Funktion von Budes N zu gewährleisten, sollte das Mundstück regelmäßig (3- bis 4-mal pro Woche) gereinigt werden.
Ablagerungen können mit lauwarmem Wasser (evtl. mit Seifenzusatz) entfernt werden, nachdem das Druckbehältnis abgezogen wurde.
Anschließend das Mundstück gut abtrocknen und so aufstellen, dass es gut trocknen kann. Das Druckbehältnis erst wieder einsetzen und die Schutzkappe aufstecken, wenn das Mundstück vollständig trocken ist.
Hinweis
Um eine falsche Anwendung zu vermeiden, ist eine gründliche Einweisung des Patienten in den korrekten Gebrauch vorzunehmen. Kinder sollten unter der Aufsicht eines Erwachsenen inhalieren.
7. INHABER DER ZULASSUNG
Hexal AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMER
26057.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
14. Oktober 1996/20. November 2008
10. STAND DER INFORMATION
Juni 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig