Budesonid - 1 A Pharma 64 Mikrogramm/Sprühstoß Nasenspray, Suspension
F achinform ation
1. BEZEICHNUNG DER ARZNEIMITTEL
Budesonid - 1 A Pharma® 32 Mikrogramm/Sprühstoß Nasenspray, Suspension Budesonid - 1 A Pharma® 64 Mikrogramm/Sprühstoß Nasenspray, Suspension
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Der Wirkstoff ist Budesonid.
Budesonid - 1 A Pharma 32 Mikrogramm/Sprühstoß
Eine abgegebene (abgemessene) Dosis von 0,05 ml Nasenspray, Suspension enthält 32 Mikrogramm Budesonid.
Budesonid - 1 A Pharma 64 Mikrogramm/Sprühstoß
Eine abgegebene (abgemessene) Dosis von 0,05 ml Nasenspray, Suspension enthält 64 Mikrogramm Budesonid.
Sonstiger Bestandteil mit bekannter Wirkung: 0,06 mg Kaliumsorbat/0,05 ml Nasenspray, Suspension Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Nasenspray, Suspension
Weiße homogene Suspension.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
• Behandlung und Vorbeugung von Anzeichen und Symptomen der saisonalen und ganzjährigen allergischen Rhinitis
• Behandlung von Anzeichen und Symptomen von Nasenpolypen
4.2 Dosierung und Art der Anwendung Dosierung
Nur zur nasalen Anwendung.
Die Dosierung wird individuell festgelegt. Es sollte eine Dosisminderung bis zur niedrigsten Dosis erfolgen, mit der sich eine effektive Symptomkontrolle aufrechterhalten lässt.
Die Dauer der Behandlung mit Budesonid - 1 A Pharma sollte auf den Zeitraum des Allergenkontakts beschränkt werden und ist von der Natur und den Eigenschaften der Allergene abhängig. Der volle therapeutische Nutzen stellt sich nur bei regelmäßiger Anwendung ein.
Allergische Rhinitis Anfangsdosis
Erwachsene, Jugendliche und Kinder ab 6 Jahre
Die empfohlene Anfangsdosis von 256 Mikrogramm kann entweder 1-mal täglich am Morgen angewendet oder in 2 tägliche Gaben, morgens und abends, aufgeteilt werden.
Budesonid - 1 A Pharma 32 Mikrogramm/Sprühstoß 4 Sprühstöße in jedes Nasenloch 1-mal täglich am Morgen oder
2 Sprühstöße in jedes Nasenloch jeweils morgens und abends
Budesonid - 1 A Pharma 64 Mikrogramm/Sprühstoß 2 Sprühstöße in jedes Nasenloch 1-mal täglich am Morgen oder
1 Sprühstoß in jedes Nasenloch jeweils morgens und abends Kinder sollten unter Aufsicht von Erwachsenen behandelt werden.
Die Behandlung einer saisonalen allergischen Rhinitis sollte möglichst vor der Allergenexposition des Patienten eingeleitet werden.
Eine gleichzeitige Behandlung zur Linderung von allergisch bedingten Augenbeschwerden kann zuweilen erforderlich sein.
Erhaltungsdosis
Die gewünschte klinische Wirkung tritt innerhalb von 1-2 Wochen ein. Anschließend sollte die niedrigste Dosis gewählt werden, bei der der Patient beschwerdefrei bleibt.
Eine Dosis von mehr als 256 Mikrogramm geht nicht mit einer besseren Wirksamkeit einher. Nasenpolypen
Erwachsene, Jugendliche und Kinder ab 6 Jahre
Die empfohlene Anfangsdosis für die Behandlung von Nasenpolypen beträgt 256 Mikrogramm. Die Dosis kann entweder 1 -mal täglich am Morgen angewendet oder in 2 tägliche Gaben, morgens und abends, aufgeteilt werden.
Budesonid - 1 A Pharma 32 Mikrogramm/Sprühstoß 4 Sprühstöße in jedes Nasenloch 1-mal täglich am Morgen oder
2 Sprühstöße in jedes Nasenloch jeweils morgens und abends
Budesonid - 1 A Pharma 64 Mikrogramm/Sprühstoß 2 Sprühstöße in jedes Nasenloch 1-mal täglich am Morgen oder
1 Sprühstoß in jedes Nasenloch jeweils morgens und abends Kinder sollten unter Aufsicht von Erwachsenen behandelt werden.
Nachdem die gewünschte klinische Wirkung erzielt wurde, sollte die niedrigste Dosis gewählt werden, mit der sich die Symptome des Patienten wirksam kontrollieren lassen.
Art der Anwendung
1. Falls nötig, vorsichtig die Nase schnäuzen, um die Nasenlöcher zu reinigen.
2. Die Flasche schütteln (Abbildung 1). Schutzkappe abnehmen.
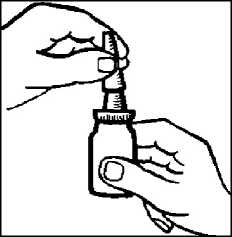
Abbildung 1
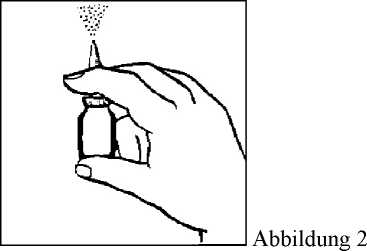
3. Halten Sie die Flasche wie in Abbildung 2 gezeigt. Bevor Sie Budesonid - 1 A Pharma zum 1. Mal anwenden, muss die Pumpvorrichtung befüllt (d. h. mit dem Arzneimittel gefüllt) werden. Hierfür die Pumpvorrichtung mehrmals betätigen (5-10-mal) und dabei in die Luft sprühen, bis ein gleichmäßiger Sprühnebel zu sehen ist. Die Befüllung der Pumpvorrichtung hält ungefähr 24 Stunden an. Falls die nächste Dosis erst nach Ablauf von 24 Stunden angewendet wird, muss die Pumpvorrichtung erneut befüllt (d. h. mit dem Arzneimittel gefüllt) werden. Wird Budesonid - 1 A Pharma in engeren Zeitabständen angewendet, reicht es aus, einen einzigen Sprühstoß in die Luft abzugeben.
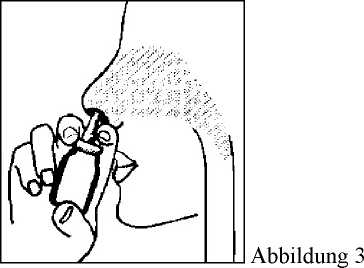
4. Die Spitze der Pumpvorrichtung, wie in Abbildung 3 gezeigt, in das Nasenloch einführen. 1-mal (oder je nach Anweisung Ihres Arztes auch mehrmals) sprühen. Denselben Vorgang im anderen Nasenloch wiederholen. Es ist nicht notwendig, während des Sprühens einzuatmen.
5. Die Pumpvorrichtung mit einem sauberen Tuch abwischen und die Schutzkappe wieder aufsetzen.
6. Die Flasche stehend lagern.
Reinigung von Budesonid - 1 A Pharma
Die Kunststoff-Pumpvorrichtung von Budesonid - 1 A Pharma sollte regelmäßig bzw. immer dann, wenn der Sprühnebel nicht mehr richtig austritt, gereinigt werden. In diesem Fall überprüfen Sie bitte zuerst, ob die Pumpvorrichtung mit dem Arzneimittel gefüllt ist (siehe oben). Falls die Pumpe nach dem Befüllen der Pumpvorrichtung noch immer nicht funktioniert, reinigen Sie die Pumpvorrichtung wie folgt:
• Die Kunststoff-Pumpvorrichtung mit einem sauberen Tuch abnehmen und mit warmem - nicht heißem - Wasser reinigen.
• Die Pumpvorrichtung gründlich abspülen, trocknen und wieder auf die Flasche setzen.
• Die Pumpvorrichtung niemals mit einer Nadel oder einem anderen scharfen Gegenstand reinigen.
• Nach der Reinigung muss die Pumpvorrichtung vor der Anwendung erneut befüllt (d. h. mit dem Arzneimittel gefüllt) werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Systemische Wirkungen sind bei Anwendung von nasalen Kortikosteroiden nicht auszuschließen, vor allem wenn über lange Zeiträume hohe Dosen angewendet werden. Die Wahrscheinlichkeit für das Auftreten
solcher Effekte ist wesentlich niedriger als bei der oralen Anwendung von Kortikosteroiden und kann von Patient zu Patient sowie zwischen den verschiedenen Kortikosteroid-Präparaten variieren. Mögliche systemische Effekte umfassen das Cushing-Syndrom, cushingoide Merkmale, eine Unterdrückung der Nebennierenfunktion, Wachstumsverzögerung bei Kindern und Jugendlichen, Katarakt, Glaukom und selten eine Reihe von psychischen oder Verhaltensstörungen einschließlich psychomotorische Überaktivität, Schlafstörungen, Angst, Depression oder Aggression (insbesondere bei Kindern).
Eine Behandlung mit nasalen Kortikosteroiden in höheren als den empfohlenen Dosen kann zu klinisch signifikanter Nebennierensuppression führen. Falls davon auszugehen ist, dass höhere als die empfohlenen Dosen angewendet werden, sollte während Stressphasen oder planbarer Operationen eine zusätzliche Gabe von systemischen Kortikosteroiden in Betracht gezogen werden.
Bei bakteriellen oder Pilzinfektionen der Nase sollte Budesonid - 1 A Pharma nur angewendet werden, wenn zugleich eine antibakterielle bzw. antimykotische Behandlung erfolgt.
Im Fall einer kontinuierlichen Langzeitbehandlung sollte die Nasenschleimhaut regelmäßig untersucht werden, z. B. alle 6 Monate.
Eine beeinträchtigte Leberfunktion besitzt Auswirkungen auf die Pharmakokinetik von Kortikosteroiden. Eine schwere Leberfunktionsstörung beeinflusst die Pharmakokinetik von oral appliziertem Budesonid im Sinne einer erhöhten systemischen Verfügbarkeit und verminderten Elimination. Dagegen fällt die intravenöse Pharmakokinetik von Budesonid bei gesunden Freiwilligen und Patienten mit Leberzirrhose ähnlich aus. Bei schwerer Leberfunktionsstörung sollte jedoch an potentielle systemische Effekte gedacht werden.
Budesonid - 1 A Pharma sollte nicht bei Patienten mit Nasenbluten oder bei Patienten mit Herpesinfektionen im Mund-, Nasen- oder Augenbereich angewendet werden.
Budesonid - 1 A Pharma sollte nicht bei Patienten mit Ulzerationen der Nase oder kurz nach einer Nasenoperation bzw. einem Nasentrauma angewendet werden, solange keine vollständige Heilung erfolgt ist.
Besondere Vorsicht ist notwendig bei Patienten mit aktiver oder inaktiver Lungentuberkulose und bei Patienten mit Pilz- oder Virusinfektionen der Atemwege.
Die Patienten sind darüber zu informieren, dass sich die volle Wirkung erst nach einigen Behandlungstagen einstellt. Daher sollte die Behandlung einer saisonalen Rhinitis möglichst vor der Exposition gegenüber Allergenen eingeleitet werden.
Dieses Arzneimittel enthält Kaliumsorbat und kann örtlich begrenzte Hautreizungen (z. B. Kontaktdermatitis) verursachen.
Kinder und Jugendliche
Die Langzeiteffekte nasaler Glukokortikoide bei Kindern sind nicht vollständig bekannt. Ärzte sollten das Wachstum von Kindern, die längerfristig Glukokortikosteroide einnehmen, unabhängig von der Art der Anwendung, engmaschig kontrollieren und den Nutzen der Glukokortikosteroid-Therapie gegen eine mögliche Verlangsamung des Wachstums abwägen.
Es liegen Berichte über Wachstumsverzögerungen bei Kindern vor, die mit nasalen Kortikosteroiden in zugelassener Dosierung behandelt wurden. Bei Kindern, die eine langfristige Behandlung mit nasalen Kortikosteroiden erhalten, sollte die Körpergröße regelmäßig kontrolliert werden. Falls das Wachstum verzögert ist, sollte die Therapie im Hinblick auf eine Dosisminderung des nasalen Kortikosteroids neu überdacht werden. Falls möglich, ist die niedrigste Dosis zu wählen, mit der sich eine effektive Symptomkontrolle aufrechterhalten lässt. Außerdem ist eine Überweisung des Patienten an einen Facharzt für Pädiatrie zu erwägen.
Wechsel der Art der Anwendung
Vorsicht ist geboten, wenn Patienten von systemischer Steroidbehandlung auf Budesonid - 1 A Pharma umgestellt werden und wenn es Gründe gibt, anzunehmen, dass deren Nebennierenfunktion eingeschränkt ist.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es sind keine Wechselwirkungen von Budesonid mit anderen Arzneimitteln zur Behandlung von Rhinitis beobachtet worden.
Die parallele Gabe von oralem Ketoconazol 200 mg 1-mal täglich und oralem Budesonid (Einzeldosis von 3 mg) erhöhte die Plasmakonzentration von Budesonid um durchschnittlich das 6-fache. Wurde Ketoconazol erst 12 Stunden nach Budesonid verabreicht, so waren die Plasmakonzentrationen von Budesonid im Mittel um das 3-fache erhöht. Über etwaige Wechselwirkungen nach Gabe von nasalem Budesonid stehen keine Informationen zur Verfügung, doch ist hier ebenfalls mit erhöhten Plasmakonzentrationen zu rechnen. Eine Kombination dieser Arzneimittel sollte vermieden werden, da es keine entsprechenden Dosisempfehlungen gibt. Wenn dies nicht möglich ist, sollte zwischen den jeweiligen Gaben der Arzneimittel ein möglichst langer Zeitabstand eingehalten werden. Eine Dosisminderung kann ebenfalls erwogen werden. Die gleichzeitige Anwendung von anderen potenten CYP3A4-Inhibitoren (z. B. Itraconazol, Ciclosporin und Troleandomycin) kann zu einem deutlichen Anstieg der Plasmakonzentrationen von Budesonid führen.
Erhöhte Plasmakonzentrationen und eine verbesserte Wirkung von Kortikosteroiden wurden bei Frauen beobachtet, die auch mit Östrogenen und kontrazeptiven Steroiden behandelt wurden; jedoch wurde kein Effekt bei Budesonid und gleichzeitiger Einnahme von niedrig dosierten oralen KombinationsKontrazeptiva beobachtet.
Da die Funktion der Nebennierenrinde unterdrückt werden kann, kann ein ACTH-Stimulationstest zur Diagnose einer Hypophyseninsuffizienz falsche Ergebnisse (niedrige Werte) zeigen.
4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
Ergebnisse aus prospektiven epidemiologischen Studien und aus weltweiten Erfahrungen nach der Markteinführung haben kein erhöhtes Risiko für angeborene Fehlbildungen durch die Anwendung von inhalativ oder intranasal angewendetem Budesonid während der frühen Schwangerschaft ergeben. Tierexperimentelle Studien haben Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Das potentielle Risiko für den Menschen ist nicht bekannt. Wie bei anderen Arzneimitteln muss bei der Verabreichung von Budesonid während der Schwangerschaft der Nutzen für die Mutter gegen die Risiken für den Fetus abgewogen werden.
Stillzeit
Budesonid geht in die Muttermilch über. Allerdings sind bei therapeutischen Dosierungen von Budesonid keine Auswirkungen auf den Säugling zu erwarten. Budesonid kann während der Stillzeit verwendet werden.
Die Erhaltungstherapie mit inhalativ angewendetem Budesonid (200 oder 400 ^g 2-mal täglich) bei stillenden Frauen mit Asthma führt zu einer vernachlässigbaren systemischen Budesonid-Exposition bei den gestillten Säuglingen.
In einer pharmakokinetischen Studie betrug die geschätzte tägliche Dosis beim Säugling 0,3 % der täglichen mütterlichen Dosis für beide Dosierungen, und die durchschnittliche Plasmakonzentration bei Säuglingen wurde auf 1/600stel der beobachteten Konzentrationen im mütterlichen Plasma geschätzt, unter der Annahme einer vollständigen oralen Bioverfügbarkeit beim Säugling. Die BudesonidKonzentrationen in Plasma-Proben von Säuglingen lagen unter der Bestimmungsgrenze.
Basierend auf Daten von inhalativ angewendetem Budesonid und der Tatsache, dass Budesonid lineare pharmakokinetische Eigenschaften innerhalb der therapeutischen Dosierungsintervalle nach nasaler, inhalativer, oraler und rektaler Verabreichung zeigt, wird die Exposition des Säuglings bei therapeutischen Budesonid-Dosen als gering eingeschätzt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Budesonid - 1 A Pharma hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Wenn Patienten von systemischen Kortikosteroiden (orale oder parenterale) auf Budesonid - 1 A Pharma umgestellt werden, können unerwünschte Symptome außerhalb des Nasenbereichs demaskiert werden, die zuvor durch die systemische Therapie unter Kontrolle waren, z. B. allergische Konjunktivitis oder Dermatitis. Diese sind bei Bedarf zusätzlich zu behandeln.
In seltenen Fällen können Anzeichen oder Symptome einer systemischen Glukokortikoid-Nebenwirkung bei der Behandlung mit nasalen Glukokortikoiden auftreten. Diese sind vermutlich abhängig von der Dosis, der Behandlungsdauer, gleichzeitiger oder früherer Kortikosteroid-Behandlung und der individuellen Empfindlichkeit.
Die Häufigkeit von Nebenwirkungen ist wie folgt definiert:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklasse |
Häufigkeit |
Nebenwirkung |
|
Erkrankungen des Immunsystems |
Gelegentlich |
sofortige oder verzögerte Überempfindlichkeitsreaktion (Urtikaria, Hautausschlag, Juckreiz, Dermatitis, Angioödem) |
|
Selten |
anaphylaktische Reaktion | |
|
Endokrine Erkrankungen |
Selten |
Anzeichen und Symptome von systemischen Kortikosteroid-Nebenwirkungen, einschließlich Nebennierensuppression und Wachstumsretardierung |
|
Erkrankungen des Nervensystems |
Selten |
Dysphonie |
|
Augenerkrankungen |
Selten |
Glaukom, Katarakt (bei Langzeitbehandlung) |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Häufig |
örtliche Symptome wie Reizung der Nasenschleimhaut, leicht blutiges Sekret, Epistaxis (unmittelbar nach der Anwendung) |
|
Selten |
Geschwüre in der Nase, Septumperforation | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Gelegentlich |
Muskelkrämpfe |
|
Selten |
Osteoporose (bei Langzeitbehandlung), Prellungen |
Kinder und Jugendliche
Es wurden bei Kindern, die intranasale Steroide erhielten, Wachstumsverzögerungen berichtet. Wegen der Gefahr von Wachstumsverzögerungen bei Kindern und Jugendlichen, sollte das Wachstum wie in Abschnitt 4.4 beschrieben, überwacht werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn
Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Eine akute Überdosierung von Budesonid - 1 A Pharma ist selbst dann unwahrscheinlich, wenn alle in der Flasche enthaltenen Sprühstöße auf einmal angewendet werden. Eine über einen längeren Zeitraum (Monate) erfolgende Applikation von höheren als den empfohlenen Dosen (siehe Abschnitt 4.2) kann zu einer Suppression der Hypothalamus-Hypophysen-Nebennierenrinden-Achse führen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Dekongestiva und andere Rhinologika zur topischen Anwendung,
Kortikosteroide
ATC-Code: R01AD05
Budesonid ist ein Glukokortikosteroid, das nach topischer Anwendung eine starke örtliche antiinflammatorische Wirkung auf die Nasenschleimhaut und nur schwache systemische Wirkungen besitzt.
Es wurde gezeigt, dass Kortikosteroide eine Vielzahl hemmender Wirkungen auf zahlreiche Zelltypen (z. B. Mastzellen, Eosinophile, Neutrophile, Makrophagen und Lymphozyten) sowie Mediatoren (z. B. Histamine, Eicosanoide, Leukotriene und Cytokine) haben, die bei allergischen Entzündungen beteiligt sind. Sie reduzieren auch Cytokine, Leukotriene und Chemokine (z. B. IL-1 bis IL-6, RANTES, TNF-a, IFN-y und GM-CSF), die durch inflammatorische Zellen freigesetzt werden.
Budesonid bindet an Glukokortikoid-Rezeptoren. Dies führt zu einem Komplex, der als Transkriptionsfaktor wirkt und entweder entzündungsfördernde Mediatoren herabreguliert oder entzündungshemmende Mediatoren hochreguliert. Es wird angenommen, dass etwa 10-100 steroidempfindliche Gene pro Zelle vorliegen.
Kinder und Jugendliche Klinische Wirksamkeit
Die klinische Wirksamkeit von Budesonid Nasenspray wurde bei mehreren Tausend Erwachsenen und Kindern beurteilt. Die meisten Studien wurden mit 1 -mal täglich, nasal angewendetem Budesonid in über das Pumpspray abgegebenen Dosen von 32-256 Mikrogramm durchgeführt. Beispiele repräsentativer Studien, die die Anwendung von Budesonid zur Behandlung von Kindern bei saisonaler und perennialer allergischer Rhinitis bewerten, sind unten aufgeführt. Der primäre Wirksamkeitsendpunkt war der kombinierte Nasalsymptom-Score (combined nasal symptom score [CNSS]) welcher die Summe aus einzelnen Scores zu 3 nasalen Symptomen (Verstopfung, Sekretfluss und Niesen, jeweils bewertet auf einer Skala von 0-3) darstellt.
Saisonale allergische Rhinitis
Eine 2-wöchige, randomisierte, doppelblinde, Placebo-kontrollierte Studie mit Parallelgruppen beurteilte die Wirksamkeit und Sicherheit von je 1-mal täglich angewendetem Budesonid Nasenspray 16, 32 und 64 Mikrogramm bei 400 Kindern (im Alter von 2-5 Jahren) mit allergischer Rhinitis (saisonal und perennial). Es gab eine deutliche Reduktion bezüglich der CNSS-Ausgangswerte in allen Behandlungsgruppen, einschließlich der Placebogruppe. Der Unterschied zwischen Budesonid Nasenspray und der Behandlung mit Placebo war statistisch nicht signifikant.
Perenniale allergische Rhinitis
Eine 6-wöchige, randomisierte, doppelblinde, Placebo-kontrollierte Studie mit Parallelgruppen beurteilte die Wirksamkeit und Sicherheit von 1-mal täglich angewendetem Budesonid Nasenspray 128 Mikrogramm bei 202 Kindern (im Alter von 6-16 Jahren) mit perennialer allergischer Rhinitis. Die primären Wirksamkeitsendpunkte waren der gemessene CNSS-Wert und der Wert des inspiratorischen Spitzenflusses (peak nasal inspiratory flow [PNIF]). Budesonid Nasenspray verbesserte sowohl den CNSS- als auch den PNIF-Wert statistisch signifikant gegenüber Placebo. Die Wirkung von Budesonid
Nasenspray trat 12 Stunden nach der 1. Dosierung in Bezug auf CNSS und 48 Stunden in Bezug auf PNIF ein.
Klinische Sicherheit
In einer randomisierten, doppelblinden Placebo-kontrollierten Studie zum Wachstum erhielten 229 vorpubertäre Kinder im Alter von 4-8 Jahren nach einer 6-monatigen Ausgangsperiode über einen Zeitraum von 12 Monaten entweder Budesonid Nasenspray 64 Mikrogramm 1-mal täglich oder Placebo. In dieser Studie war die Wachstumsgeschwindigkeit in der mit Budesonid Nasenspray und der mit Placebo behandelten Gruppe nach 12 Behandlungsmonaten ähnlich: Der mittlere Unterschied in der Wachstumsgeschwindigkeit (Placebo gegenüber Budesonid Nasenspray) betrug 0,27 cm/Jahr (95 % Konfidenz-Intervall: - 0,07-0,62).
Einfluss auf die Plasmakortisolkonzentration
Die Anwendung von empfohlenen Dosen von Budesonid Nasenspray führt nicht zu klinisch relevanten Veränderungen der basalen Plasmakortisolkonzentration oder der ACTH-Stimulation. Bei gesunden Probanden wurde nach einer kurzzeitigen Anwendung von Budesonid Nasenspray eine dosisabhängige Suppression der Plasmakortisol- und Urinkortisolkonzentration beobachtet.
5.2 Pharmakokinetische Eigenschaften Bioverfügbarkeit
Die systemische Verfügbarkeit von Budesonid Nasenspray bezogen auf einen Hub beträgt 33 %.
Bei Erwachsenen wird nach Anwendung von 256 Mikrogramm Budesonid Nasenspray innerhalb von 0,7 Stunden eine Plasmaspitzenkonzentration von 0,64 nmol/l erreicht.
Nach Applikation von 256 Mikrogramm Budesonid Nasenspray beträgt die Fläche unter der Kurve (AUC) 2,7 nmol*h/l bei Erwachsenen.
Verteilung
Das Verteilungsvolumen von Budesonid beträgt rund 3 l/kg. Die Plasmaproteinbindung beträgt im Mittel 85-90 %.
Biotransformation
Budesonid wird in sehr hohem Maße (90 %) bei der 1. Leberpassage zu Metaboliten mit niedrigerer Glukokortikosteroidaktivität biotransformiert.
Die Glukokortikosteroidaktivität der Hauptmetaboliten 6-beta-Hydroxybudesonid und 16-alpha-Hydroxyprednisolon beträgt weniger als 1 % der Budesonidaktivität. Budesonid wird hauptsächlich über CYP3A4, eine Untergruppe des Cytochrom-P-450-Systems, metabolisiert. Budesonid unterliegt keiner lokalen metabolischen Inaktivierung in der Nase.
Elimination
Die Metaboliten werden unverändert oder in konjugierter Form hauptsächlich über die Nieren ausgeschieden. Intaktes Budesonid ist im Urin nicht nachgewiesen worden. Die systemische Clearance von Budesonid ist hoch (bei Erwachsenen ungefähr 1,2 l/min) und die Plasmahalbwertszeit beträgt nach i.v.-Dosierung bei Erwachsenen durchschnittlich 2-3 Stunden.
Linearität
Bei klinisch relevanten Dosen ist die Kinetik von Budesonid dosisproportional.
Kinder und Jugendliche
Budesonid hat eine systemische Clearance von ungefähr 0,5 l/min bei asthmatischen Kindern im Alter von 4-6 Jahren. Pro kg Körpergewicht haben Kinder eine Clearance, die ungefähr 50 % größer ist als die bei Erwachsenen. Die terminale Halbwertszeit von Budesonid nach Inhalation beträgt bei asthmatischen Kindern ungefähr 2,3 Stunden. Diese entspricht ungefähr der von gesunden Erwachsenen. Die Fläche unter der Konzentration-Zeit-Kurve (AUC) beträgt bei Kindern 5,5 nmolh/l nach der Anwendung von 256 Mikrogramm Budesonid Nasenspray. Dies zeigt eine höhere systemische GlukokortikosteroidExposition bei Kindern als bei Erwachsenen. Bei klinisch empfohlenen Dosen ist die Pharmakokinetik
von Budesonid dosisproportional und die Plasma-Exposition korreliert mit dem Gewicht des Patienten. Deshalb sollte dies bei der Festlegung der Dosis für Kinder und Jugendliche in Betracht gezogen werden.
5.3 Präklinische Daten zur Sicherheit
Basierend auf Studien zur chronischen Toxizität, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten bei Gabe von therapeutischen Dosen keine besonderen Gefahren für den Menschen erkennen.
Glukokortikosteroide einschließlich Budesonid haben bei Tieren teratogene Wirkungen induziert, darunter Gaumenspalte und Skelettmissbildungen. Derartige Wirkungen beim Menschen sind unter therapeutischen Dosen unwahrscheinlich.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
• Ascorbinsäure
• mikrokristalline Cellulose - Carmellose-Natrium [89:11]
• Natriumedetat (Ph.Eur.)
• D-Glucose
• Kaliumsorbat (Ph.Eur.)
• Polysorbat 80
• Salzsäure 36 %
• gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
2 Jahre
Hinweis auf Haltbarkeit nach Anbruch
Nach Anbruch 3 Monate verwendbar.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern. Nicht einfrieren.
Für Lagerungshinweise nach dem ersten Öffnen siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Bernsteinfarbene Glasflasche Typ III mit passender Nasenspraypumpe aus Kunststoff und Nasenapplikator aus Polypropylen.
Packungsgrößen
1 x 120 Sprühstöße (1 x 6 ml bzw. 1 x 10 ml)
2 x 120 Sprühstöße (2 x 6 ml bzw. 2 x 10 ml)
3 x 120 Sprühstöße (3 x 6 ml bzw. 3 x 10 ml)
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen für die Beseitigung.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNGEN
1 A Pharma GmbH
Keltenring 1 + 3
82041 Oberhaching
Telefon: (089) 6138825-0
Telefax: (089) 6138825-65
E-Mail: medwiss@1apharma.com
8. ZULASSUNGSNUMMERN
Budesonid - 1 A Pharma 32 Mikrogramm/Sprühstoß
67870.00. 00
Budesonid - 1 A Pharma 64 Mikrogramm/Sprühstoß
67871.00. 00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN/VERLÄNGERUNG DER ZULASSUNGEN
Datum der Erteilung der Zulassungen: 11. September 2008 Datum der letzten Verlängerung der Zulassungen: 31. August 2012
10. STAND DER INFORMATION
Juni 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig