Canesten Extra Nagelset
1
Fachinformation
1

1. BEZEICHNUNG DES ARZNEIMITTELS
Canesten® Extra Nagelset Wirkstoffe: Bifonazol und Harnstoff
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: 1 g Salbe enthält 10 mg Bifonazol und 400 mg Harnstoff.
Sonstige Bestandteile: u.a. Wollwachs.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Salbe
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur nagelablösenden Behandlung bei Pilzinfektionen der Nägel an Händen und Füßen mit gleichzeitiger antimykotischer Wirkung.
4.2 Dosierung und Art der Anwendung
Aus der Tube wird 1 mal täglich so viel Salbe auf den bzw. die erkrankten Nägel aufgetragen, bis die Nagelfläche mit einer dünnen Schicht bedeckt ist. Die Beschaffenheit der Salbe ist sehr fest, um ein punktgenaues Auftragen ohne Zerlaufen zu ermöglichen. Deshalb muss die Tube kräftig gedrückt werden, um die gewünschte Menge auftragen zu können.
Die Finger- bzw. Zehennägel werden anschließend mit dem Pflaster für jeweils 24 Stunden okklusiv zugeklebt. Das Pflaster ist entsprechend der Größe des Nagels gegebenenfalls zu halbieren. Um die Klebefähigkeit des Pflasters zu erhalten, ist darauf zu achten, dass beim Aufkleben des Pflasters keine Salbe in den Spalt zwischen Haut und Klebefläche eindringt. Auch sollte die Klebefläche des Pflasters nicht mit den Fingern berührt werden.
Bei dem täglichen Verbandswechsel werden die Finger oder Zehen (bzw. die Hand oder der Fuß) ca. 10 Minuten in warmem Wasser gebadet und anschließend mit dem Spatel die aufgeweichte pilzinfizierte Nagelsubstanz entfernt. Nach dem Abtrocknen wird erneut Salbe aufgetragen und der Nagel mit dem Pflaster zugeklebt.
Die Behandlung mit der Salbe und dem Pflasterverband muss täglich sorgfältig und so lange durchgeführt werden, bis das Nagelbett glatt ist und sich keine aufgeweichte, pilzbefallene Nagelsubstanz mehr entfernen lässt. Dazu sind im Allgemeinen, je nach Ausmaß der Infektion und Nageldicke, 7 - 14 Tage erforderlich. Die Salbe wirkt nur auf kranke Nagelsubstanz, gesunde Teile bleiben unbeeinflusst.
Ein Abdecken der den Nagel umgebenden Hautfläche ist im Allgemeinen nicht erforderlich. Sollte dies in Ausnahmefällen wegen Reizung dennoch erforderlich sein, so ist auf die den Nagel umgebenden Hautränder z. B. Zinkpaste aufzutragen.
Nach der Entfernung infizierter Nagelbereiche sollte eine konsequente antimykotische Behandlung 1 mal täglich mit einer Bifonazol Creme über ca. 4 Wochen durchgeführt werden.
Ein dauerhafter Behandlungserfolg einer Nagelpilzerkrankung ist in hohem Maße von der sorgfältigen Ablösung der erkrankten Nagelteile und der anschließend konsequent durchzuführenden Behandlung mit einer Bifonazol Creme abhängig.
Falls nach 7 - 14 Tagen nicht alle erkrankten Nagelteile entfernt sind und das Nagelbett nicht glatt ist, sollte ein Arzt aufgesucht werden.
In schweren Fällen sollte die Behandlung durch eine systemische antimykotische Therapie ergänzt werden.
In den seltenen Fällen einer Pflasterallergie sind andere wasserfeste Pflaster bzw. Gummifingerlinge zu benutzen.
Umfangreiche Studien an Kindern wurden nicht durchgeführt. Aus der Gesamtschau der klinischen Datenlage ergeben sich keine Hinweise auf negative Auswirkungen bei Kindern.
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe Bifonazol und Harnstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Patienten, die Überempfindlichkeitsreaktionen gegenüber anderen Imidazol-Antimykotika (z. B. Econazol, Clotrimazol, Miconazol) in der Vorgeschichte aufweisen, dürfen Bifonazol-haltige Arzneimittel nur mit Vorsicht anwenden.
Die Salbe des Canesten Extra Nagelset nicht in die Augen bringen. Nicht einnehmen.
Canesten Extra Nagelset sollte bei Säuglingen und Kleinkindern nur unter ärztlicher Aufsicht angewendet werden. Eine orale Aufnahme sollte verhindert werden.
Wollwachs kann örtlich begrenzte Hautreaktionen (z.B. Kontaktdermatitis) hervorrufen.
Es kann zu Überempfindlichkeitsreaktionen auf das Pflaster (Pflasterallergie) kommen.
Patienten sollten ihren Arzt informieren, wenn keine Besserung eintritt.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Limitierte Daten deuten darauf hin, dass eine Wechselwirkung zwischen topisch appliziertem Bifonazol und Warfarin möglich ist, unter Anstieg des INR-Wertes. Bei gleichzeitiger Anwendung von Bifonazol und Warfarin sollte bei den Patienten daher eine entsprechende Kontrolle erfolgen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Es liegen keine hinreichenden Daten für die Anwendung von Bifonazol und Harnstoff (bzw. dem Canesten Extra Nagelset) bei Schwangeren vor. Tierexperimentelle Studien mit Bifonazol haben bei oraler Anwendung eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3.). Entsprechende tierexperimentelle Studien mit Harnstoff zeigen keinen direkten oder indirekten gesundheitsgefährdenden Effekt in Bezug auf die Reproduktionstoxizität (siehe Abschnitt 5.3). Das potentielle Risiko für den Menschen ist nicht bekannt. Da es sich bei Canesten Extra Nagelset um ein ausschließlich topisch angewendetes Arzneimittel handelt, ist ein Risiko jedoch nicht zu erwarten. Trotzdem sollte aus Vorsichtsgründen die Anwendung von Canesten Extra Nagelset während der Schwangerschaft nur nach sorgfältiger Nutzen-Risiko-Abschätzung erfolgen. Die Anwendung von Bifonazol und Harnstoff (bzw. dem Canesten Extra Nagelset) während des 1. Trimenon der Schwangerschaft sollte vermieden werden.
Es ist nicht bekannt, ob Bifonazol oder Harnstoff beim Menschen in die Muttermilch übergehen. Die zur Verfügung stehenden pharmakodynamischen / toxikologischen Daten vom Tier zeigten, dass Bifonazol / Metabolite in die Milch übergehen (für Details siehe Abschnitt 5.3). Aus Vorsichtsgründen sollte während der Anwendung von Canesten Extra Nagelset das Stillen unterbrochen werden.
Präklinische Studien mit Bifonazol geben keinen Hinweis, dass die männliche oder weibliche Fertilität beeinträchtigt wird (siehe Abschnitt 5.3).
Präklinische Sudien mit Harnstoff geben keinen Hinweis, dass ein Spermien-schädigendes Potential vorliegt (siehe Abschnitt 5.3). Informationen bzgl. möglicher Effekte von Harnstoff auf die Gebärfähigkeit liegen nicht vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Canesten Extra Nagelset hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
|
Sehr häufig: |
> 1/10 |
|
Häufig: |
> 1/100 bis 1/10 |
|
Gelegentlich: |
> 1/1.000 bis 1/100 |
|
Selten: |
> 1/10.000 bis 1/1.000 |
|
Sehr selten: |
< 1/10.000 |
|
Nicht bekannt: |
Häufigkeit aufgrund der verfügbaren Datenlage nicht abschätzbar |
Im Rahmen der Anwendung dieses Arzneimittels nach der Zulassung wurden die folgenden Nebenwirkungen identifiziert. Da diese freiwillig von Patientengruppen unbekannter Größe gemeldet wurden, ist eine Angabe der Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar.
Folgende Nebenwirkungen wurden im Nagelbereich (Nagel, Nagelrand, Nagelbett) nach Anwendung von Canesten Extra Nagelset beobachtet:
Erkrankungen der Haut und des Unterhautzellgewebes (Häufigkeit nicht bekannt): Hautirritation, Kontaktdermatitis, Mazeration, Hautabschuppung, Nagelfehlbildungen, Nagelverfärbungen, Erythem, Pruritus, Exanthem, Schmerzen am Verabreichungsort, Schmerzen in den Extremitäten.
Diese Nebenwirkungen sind nach Beendigung der Behandlung reversibel.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es wird kein akutes Intoxikationsrisiko gesehen, da eine Intoxikation nach einmaliger Applikation einer Überdosis auf die Haut (Anwendung auf einer großen Fläche unter resorptionsfördernden Bedingungen) oder versehentlicher oraler Einnahme unwahrscheinlich ist.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe:
Antimykotika zur topischen Anwendung, Imidazol- und Triazol-Derivate ATC-Code: D01AC60
Bifonazol ist ein Breitspektrum-Antimykotikum aus der Gruppe der Imidazol-Derivate mit Wirkung auf Dermatophyten, Hefen, Schimmelpilze und andere Pilze, wie Malassezia furfur; ferner wirkt es gegen Corynebacterium minutissimum. Die Wirkungsweise auf Dermatophyten (z.B. Trichophyton spp.) ist in vitro primär fungizid; auf Hefen primär fungistatisch.
Der Wirkstoff Bifonazol hemmt die Ergosterol-Biosynthese an zwei verschiedenen Teilschritten der Synthesekette. Dieser doppelte Wirkansatz unterscheidet Bifonazol von anderen Azol-Derivaten und anderen Antimykotika. Die Hemmung der Ergosterol-Biosynthese führt so zu Störungen im Aufbau und in der Funktion der Zytoplasmamembran. Ergosterol ist ein essenzieller Bestandteil der Zellmembran von Pilzen (siehe Abbildung).
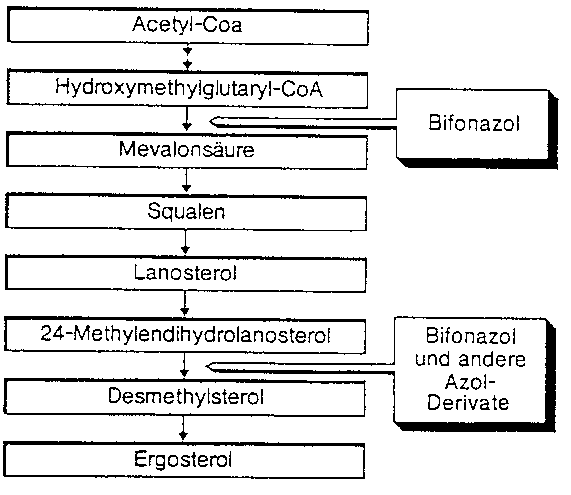
Mit der speziellen Zubereitung im Canesten Extra Nagelset wird das infizierte Nagelkeratin durch Harnstoff als Keratolytikum aufgeweicht. Dies führt zur unblutigen und schmerzfreien Ablösung der pilzbefallenen Nagelbereiche.
Die Kombination der beiden Wirkstoffe ist erforderlich zur Onycholyse durch den Harnstoff und zur Sanierung des Mykoseherds sowie des Umfelds, d. h. über den sichtbaren Infektionsherd hinaus.
Bifonazol zeigt eine günstige Resistenzlage. Primär resistente Varianten empfindlicher Pilzspezies sind selten. Untersuchungen ergaben bisher keinen Hinweis auf eine Entwicklung sekundärer Resistenz bei ursprünglich empfindlichen Pilzstämmen.
5.2 Pharmakokinetische Eigenschaften
Absorption
Nach Anwendung der Bifonazol-Harnstoff-Salbe lagen entsprechende Plasmakonzentrationen immer unterhalb der Nachweisgrenze von Bifonazol (d.h. < 1 ng/ml).
5.3 Präklinische Daten zur Sicherheit Bifonazol
Die präklinischen Daten zeigen keine besonderen Gefahren für den Menschen basierend auf konventionellen Studien zur Toxizität bei einmaliger Verabreichung und zur Genotoxizität (Mutagenität).
Auswirkungen auf die Leber (Enzyminduktion, Leberverfettung) wurden in Toxizitätsstudien bei wiederholter oraler Verabreichung, die über der maximalen Exposition beim Menschen lagen, beobachtet und haben damit geringe Relevanz für die klinische Anwendung.
Mit Bifonazol wurden keine Karzinogenitätsstudien durchgeführt.
In Reproduktionstoxikologischen Studien an Kaninchen führten orale Dosen von 30 mg/kg Körpergewicht zu Embryotoxizität einschließlich Letalität. An Ratten zeigten orale Dosen von bis zu 100 mg/kg Körpergewicht keine Embryotoxizität, jedoch führten solche oralen Dosen zu einer verzögerten Skelettentwicklung der Feten. Dieser fetale Effekt auf die Skelettentwicklung kann als ein sekundärer Effekt, aus der mütterlichen Toxizität (Reduktion des Körpergewichts) resultierend, betrachtet werden.
Aufgrund der geringen Absorption des Wirkstoffs über die Haut haben diese Ergebnisse wenig Relevanz für die klinische Anwendung.
Bifonazol passiert die Plazentaschranke bei Ratten. Eine Studie mit säugenden Ratten, die Bifonazol intravenös erhielten, zeigte, dass das Arzneimittel in die Milch abgeschieden wurde.
In oralen Dosen von bis zu 40 mg/kg Körpergewicht wurde keine Beeinträchtigung der männlichen oder weiblichen Fertilität bei Ratten beobachtet.
Harnstoff
Basierend auf den konventionellen Studien zur Toxizität bei einmaliger und wiederholter Gabe, zum kanzerogenen Potential und zur Reproduktions- und Entwicklungstoxizität lassen die präklinischen Daten mit Harnstoff keine besonderen Gefahren für den Menschen erkennen.
Studien zur Genotoxizität ergaben uneinheitliche Ergebnisse. Die in einigen Studien berichteten genotoxischen Effekte können die entspiralisierte DNS bei hohen, nichtphysiologischen Harnstoff-Konzentrationen betreffen. Diese Ergebnisse wurden mit einem deutlichen Überschreiten der maximalen humanen Exposition erzielt und haben daher eine geringe klinische Relevanz.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Wollwachs, gebleichtes Wachs und weißes Vaselin.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern!
Nach Anbruch der Tube ist die Salbe 3 Monate verwendbar!
6.5 Art und Inhalt des Behältnisses
1 Aluminiumtube mit 10 g Salbe, 15 wasserfeste Hygienepflaster, 1 Spatel Hinweis:
Die Hygienepflaster im Nagelset sind im Handel nicht erhältlich. Bei weiterem Bedarf sind wasserfeste Pflaster zu kaufen und entsprechend zuzuschneiden.
6.6 Besondere Vorsichtsmaßnahmen zur Beseitigung und besondere Hinweise zur Handhabung
Keine speziellen Hinweise zur Beseitigung.
Besondere Hinweise zur Handhabung siehe Abschnitt 4.2.
7. INHABER DER ZUZLASSUNG
Bayer Vital GmbH 51368 Leverkusen Deutschland
Telefon: (0214) 30 51 348 Telefax: (0214) 30 57 209 E-Mail-Adresse: bayer-vital@bayerhealthcare.com
8. ZULASSUNGSNUMMERN
8288.00.00
9 DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
17.08.1988 / 05.10.2004
10. STAND DER INFORMATION
Juni 2015
11. VERKAUFSABGRENZUNG
Apothekenpflichtig