Capros Akut 5 Mg Kapseln
Fachinformation
(Zusammenfassung der Merkmale des Arzneimittels / SPC)
1. BEZEICHNUNG DES ARZNEIMITTELS
Capros akut 5 mg Kapseln Capros akut 10 mg Kapseln Capros akut 20 mg Kapseln Capros akut 30 mg Kapseln
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Kapsel enthält 5 mg/10 mg/20 mg/30 mg Morphinsulfat, entsprechend 3,75 mg / 7,52 mg / 15,4 mg / 22,6 mg Morphin.
Sonstige Bestandteile mit bekannter Wirkung:
1 Kapsel Capros akut 5 mg / 10 mg / 20 mg / 30 mg enthält 19,3 mg / 38,5 mg / 77,0 mg /
115,5 mg Sucrose.
1 Kapsel Capros akut 10 mg / 20 mg enthält 0,1 mg Azorubin (E 122).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Hartkapseln
Capros akut 5 mg Kapseln sind durchsichtig hellblau, mit weißem Aufdruck „5 mg“ auf der Kapselhülle.
Capros akut 10 mg Kapseln sind durchsichtig rot, mit weißem Aufdruck „10 mg“ auf der Kapselhülle. Capros akut 20 mg Kapseln sind durchsichtig dunkelviolett, mit weißem Aufdruck „20 mg“ auf der Kapselhülle.
Capros akut 30 mg Kapseln sind durchsichtig dunkelgrün, mit weißem Aufdruck „30 mg“ auf der Kapselhülle.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Starke und stärkste Schmerzen.
Capros akut 5 mg Kapseln sind indiziert für Kinder ab 6 Jahren und Erwachsene.
Capros akut 10 mg Kapseln sind indiziert für Kinder ab 12 Jahren und Erwachsene.
Capros akut 20 mg / 30 mg Kapseln sind indiziert für Jugendliche ab 16 Jahren und Erwachsene.
4.2 Dosierung und Art der Anwendung
Dosierung
Die Dosierung von Capros akut Kapseln muss der Stärke der Schmerzen und der individuellen Empfindlichkeit des Patienten angepasst werden.
Capros akut 5 mg Kapseln sind für Kinder unter 6 Jahren nicht geeignet.
Capros akut 10 mg Kapseln sind für Kinder unter 12 Jahren nicht geeignet.
Capros akut 20 mg und 30 mg Kapseln sind für Kinder und Jugendliche unter 16 Jahren nicht geeignet.
Der empfohlene Bereich der Einzel- und Tagesdosen für Kinder und Erwachsene ist in folgenden Tabellen angegeben auf der Grundlage einer Einzelgabe von 0,2 bis 0,3 mg Morphinsulfat/kg Körpergewicht.
Für Kapseln 5 mg:
Capros 5 mg Kapseln sind für Kinder unter 6 Jahren nicht geeignet.
|
Alter bzw. Körpergewicht |
Einzeldosis |
Tagesgesamtdosis |
|
Kinder |
1-2 Kapseln |
6-12 Kapseln |
|
6-12 Jahre |
entsprechend 5-10 mg |
entsprechend 30-60 mg |
|
(20-40 kg) |
Morphinsulfat |
Morphinsulfat |
|
Jugendliche |
2-4 Kapseln |
12-24 Kapseln |
|
12-16 Jahre |
entsprechend 10-20 mg |
entsprechend 60-120 mg |
|
(40-50 kg) |
Morphinsulfat |
Morphinsulfat |
|
Jugendliche über |
2-12 Kapseln |
bis 72 Kapseln |
|
16 Jahre und Erwachsene |
entsprechend 10-60 mg |
entsprechend bis 360 mg |
|
Morphinsulfat |
Morphinsulfat |
Für Kapseln 10 mg:
Für Kinder über 6 aber unter 12 Jahren stehen Capros akut 5 mg Kapseln zur Verfügung
|
Alter bzw. Körpergewicht |
Einzeldosis |
Tagesgesamtdosis |
|
Jugendliche |
1-2 Kapseln entsprechend |
6-12 Kapseln entsprechend |
|
12-16 Jahre |
10-20 mg |
60-120 mg |
|
(40-50 kg) |
Morphinsulfat |
Morphinsulfat |
|
Jugendliche über 16 Jahre |
1-6 Kapseln entsprechend |
bis 36 Kapseln |
|
und Erwachsene |
10-60 mg |
entsprechend bis 360 mg |
|
Morphinsulfat |
Morphinsulfat |
Für Kapseln 20 mg:
Für Kinder und Jugendliche über 6 aber unter 12 Jahren stehen Capros akut 5 mg Kapseln zur Verfügung. Für Kinder über 12 aber unter 16 Jahren stehen Capros akut 5 mg und 10 mg Kapseln zur Verfügung.
|
Alter bzw. Körpergewicht |
Einzeldosis |
Tagesgesamtdosis |
|
Jugendliche über 16 Jahre und Erwachsene |
Max. 3 Kapseln entsprechend 10-60 mg Morphinsulfat |
bis 18 Kapseln entsprechend bis 360 mg Morphinsulfat |
Für Kapseln 30 mg:
Für Kinder und Jugendliche über 6 aber unter 12 Jahren stehen Capros akut 5 mg Kaspeln zur Verfügung. Für Kinder über 12 aber unter 16 Jahren stehen Capros akut 5 mg und 10 mg Kapseln zur Verfügung.
|
Alter bzw. Körpergewicht |
Einzeldosis |
Tagesgesamtdosis |
|
Jugendliche über 16 Jahre und Erwachsene |
Max. 2 Kapseln entsprechend max. 60 mg Morphinsulfat |
bis 12 Kapseln entsprechend bis 360 mg Morphinsulfat |
Die Einzeldosen können bei nachlassender Wirkung nach 4-6 Stunden wiederholt werden. Die maximalen Tagesdosen sollten das 4-6-Fache der Einzeldosen nicht überschreiten.
Sind höhere Tagesdosen erforderlich, sind bei der Anwendung andere entsprechend geeignete Wirkstoffstärken alternativ oder in Kombination mit Capros akut Kapseln einzubeziehen.
Leber- oder Nierenfunktionsstörungen
Bei Patienten mit Leber- oder Nierenfunktionsstörungen sowie bei Verdacht auf verzögerte MagenDarm-Passage sollen Capros akut Kapseln besonders vorsichtig dosiert werden.
Ältere Patienten
Patienten im höheren Lebensalter (im Regelfall ab 75 Jahren) und Patienten mit schlechtem körperlichem Allgemeinzustand können empfindlicher auf Morphin reagieren. Daher ist darauf zu achten, dass die Dosiseinstellung vorsichtiger erfolgt und/oder längere Dosisintervalle zu wählen sind. Ggf. ist auf geringere Wirkstoffstärken auszuweichen.
Besondere Hinweise zur Dosiseinstellung
Für eine Neueinstellung der Dosis kommen ggf. Darreichungsformen mit geringerem Wirkstoffgehalt zur Anwendung, eventuell auch zusätzlich zu einer bestehenden Therapie mit Retardtabletten. Grundsätzlich sollte eine ausreichend hohe Dosis gegeben werden und gleichzeitig die im Einzelfall kleinste schmerzlindernd wirksame Dosis angestrebt werden.
Bei der Behandlung chronischer Schmerzen ist der Dosierung nach einem festen Zeitplan der Vorzug zu geben.
Bei Patienten, die einer anderen zusätzlichen Schmerztherapie (z. B. Operation, Plexusblockade) unterzogen werden, ist nach der Maßnahme die Dosis neu einzustellen.
Art der Anwendung
Capros akut Kapseln sollten unzerkaut und ungeöffnet mit ausreichend Flüssigkeit - unabhängig von den Mahlzeiten - eingenommen werden.
Bei allen Patienten, die die Kapsel nicht schlucken können, kann der Inhalt der geöffneten Kapsel mit breiigen Speisen (Püree, Joghurt) oder über Sonden (Durchmesser > 16 FG) verabreicht werden. Die Mischung sollte spätestens 30 Minuten nach der Zubereitung gefolgt von 30-50 ml Wasser gegeben werden.
Falls keine geeigneten alternativen Darreichungsformen zur Verfügung stehen, muss bei Kindern unter 6 Jahren die Kapsel geöffnet werden, da das Risiko besteht, dass das Kind an der unzerteilten Kapsel erstickt. Die in diesem Abschnitt angegebenen Dosierungen sind zu beachten.
Über die Dauer der Behandlung entscheidet der Arzt in Abhängigkeit von den Schmerzbeschwerden. Capros akut Kapseln sollten auf keinen Fall länger als unbedingt notwendig angewendet werden. Wenn entsprechend Art und Schwere der Erkrankung eine länger dauernde Schmerzbehandlung mit Capros akut Kapseln erforderlich erscheint, sollte eine sorgfältige und in kurzen Abständen regelmäßige Überprüfung erfolgen (ggf. durch Anwendungspausen), ob und inwieweit ein medizinisches Erfordernis weiter besteht. Gegebenenfalls ist auf geeignetere Darreichungsformen auszuweichen. Bei chronischen Schmerzzuständen ist einem festen Dosierungsschema der Vorzug zu geben.
Da das Risiko des Auftretens von Entzugserscheinungen bei plötzlichem Behandlungsabbruch größer ist, sollte die Dosierung nach Absetzen der Behandlung schrittweise verringert werden.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• Ileus
• akutes Abdomen
• Capros akut Kapseln sind für Kinder unter 6 Jahren nicht geeignet (siehe Abschnitt 4.2).
• Capros akut 10/20/30 mg Kapseln sind für Kinder unter 12 Jahren nicht geeignet (siehe Abschnitt 4.2).
• Capros akut 20 mg und 30 mg Kapseln sind für Kinder und Jugendliche unter 16 Jahren nicht geeignet (siehe Abschnitt 4.2).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige ärztliche Überwachung und ggf. Dosisreduktion ist erforderlich bei:
• Abhängigkeit von Opioiden
• Bewusstseinsstörungen
• Krankheitszustände, bei denen eine Störung des Atemzentrums und der Atemfunktion vorliegt oder vermieden werden muss
• Cor pulmonale
• Zustände mit erhöhtem Hirndruck, wenn nicht eine Beatmung durchgeführt wird
• Hypotension bei Hypovolämie
• Prostatahyperplasie mit Restharnbildung (Gefahr der Blasenruptur durch Harnverhalten)
• Harnwegsverengungen oder Koliken der Harnwege
• Gallenwegserkrankungen
• obstruktiven und entzündlichen Darmerkrankungen
• Phäochromozytom
• Pankreatitis
• Hypothyreose
• epileptischen Anfallsleiden oder erhöhter Neigung zu Krampfanfällen.
Eine Atemdepression ist die bedeutsamste Gefährdung einer Opioidüberdosierung.
Die Anwendung von Morphin kann zur Entwicklung körperlicher Abhängigkeit führen. Das Absetzen nach wiederholter Anwendung oder Applikation eines Opiatantagonisten kann ein typisches Entzugsbild (Entzugssyndrom) auslösen.
Bei bestimmungsgemäßer Anwendung bei chronischen Schmerzpatienten ist das Risiko psychischer Abhängigkeit deutlich reduziert bzw. differenziert zu bewerten.
Capros akut Kapseln sind prä- und postoperativ wegen des gegenüber Nichtoperierten in der postoperativen Phase höheren Risikos eines Ileus oder einer Atemdepression nur mit Vorsicht anzuwenden.
Aufgrund der analgetischen Wirkung von Morphin können schwerwiegende intraabdominelle Komplikationen wie eine Darmperforation maskiert werden.
Bei bestehender Nebennierenrindeninsuffizienz (z. B. Morbus Addison) sollte die Plasmakortisolkonzentration kontrolliert und gegebenenfalls Kortikoide substituiert werden.
Capros akut Kapseln sind für Kinder unter 6 Jahren nicht geeignet. Sollte auf Grund der Nichtverfügbarkeit passender anderer Darreichungsformen und Dosierungen eine Kapsel Capros akut geöffnet und ein Teil des Inhalts verwendet werden, ist bei Kindern unter 1 Jahr folgendes zu beachten: Bei Kindern unter 1 Jahr dürfen Capros akut Kapseln nur mit besonderer Vorsicht angewendet werden, da eine erhöhte Empfindlichkeit für die beeinträchtigende Wirkung auf die Atemfunktion besteht.
Wegen der mutagenen Eigenschaften von Morphin sollte dieser Wirkstoff Männern und Frauen im zeugungs- bzw. gebärfähigen Alter nur dann verabreicht werden, wenn eine wirksame Verhütung sichergestellt ist (siehe Abschnitt 4.6)
Das in Capros akut 10 mg und 20 mg Kapseln enthaltene E 122 (Azorubin) kann allergische Reaktionen auslösen.
Die Anwendung von Capros akut Kapseln kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Patienten mit der seltenen hereditären Fructose-Intoleranz, Glucose-Galactose-Malabsorption oder Saccharase-Isomaltase-Mangel sollten Capros akut Kapseln nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen dieses Arzneimittels müssen beachtet werden:
Die gleichzeitige Anwendung von Morphin und anderen zentral dämpfend wirkenden Arzneimitteln wie Tranquilizer, Anästhetika, Hypnotika und Sedativa, Neuroleptika, Barbiturate, Antidepressiva, Antihistaminika/Antiemetika und anderer Opioide oder Alkohol kann zu einer Verstärkung der Nebenwirkungen von Morphin bei üblicher Dosierung führen. Dies betrifft insbesondere die Möglichkeit einer Atemdepression, Sedierung, Hypotonie oder auch eines Komas.
Arzneimittel mit anticholinerger Wirkung (z. B. Psychopharmaka, Antihistaminika, Antiemetika, Arzneimittel bei Morbus Parkinson) können anticholinerge Nebenwirkungen von Opioiden verstärken (z. B. Obstipation, Mundtrockenheit oder Störungen beim Wasserlassen).
Durch Cimetidin und andere den Leberstoffwechsel belastende Arzneimittel können durch Hemmung des Abbaus erhöhte Plasmakonzentrationen von Morphin auftreten.
Durch Morphin kann die Wirkung von Muskelrelaxantien verstärkt werden.
Bei Vorbehandlung von Patienten mit bestimmten Antidepressiva (MAO-Hemmstoffen) innerhalb der letzten 14 Tage vor der Opioid-Anwendung sind lebensbedrohende Wechselwirkungen auf Zentralnervensystem, Atmungs- und Kreislauffunktion mit Pethidin beobachtet worden. Dies ist auch mit Morphin nicht auszuschließen.
Bei gleichzeitiger Anwendung von Rifampicin kann es zu einer Abschwächung der Morphinwirkung kommen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Beim Menschen liegen keine ausreichenden Daten vor, die die Bewertung eines möglichen teratogenen Risikos erlauben würden. Über einen möglichen Zusammenhang mit einer erhöhten Häufigkeit von Leistenbrüchen wurde berichtet. Morphin passiert die Plazentaschranke. Untersuchungen an Tieren zeigten ein Schädigungspotential für die Nachkommen während der gesamten Dauer der Trächtigkeit (siehe Abschnitt 5.3). Morphin darf daher in der Schwangerschaft nur angewendet werden, wenn der Nutzen für die Mutter das Risiko für das Kind klar überwiegt. Wegen der mutagenen Eigenschaften von Morphin sollte es Männern und Frauen im zeugungs- und gebärfähigen Alter nur dann verabreicht werden, wenn eine wirksame Verhütung sichergestellt ist.
Bei Neugeborenen wurden Entzugserscheinungen nach längerer Morphinanwendung während der Schwangerschaft beschrieben.
Entbindung
Morphin kann die Dauer der Wehentätigkeit verlängern oder verkürzen. Neugeborene, deren Mütter während der Entbindung Opioidanalgetika erhalten, sollten auf Anzeichen einer Atemdepression oder eines Entzugssyndroms überwacht und gegebenenfalls mit einem spezifischen Opioidantagonisten behandelt werden.
Stillzeit
Morphin wird in die Muttermilch ausgeschieden und erreicht dort höhere Konzentrationen als im mütterlichen Plasma. Da beim Säugling klinisch relevante Konzentrationen erreicht werden können, ist vom Stillen abzuraten.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Morphin kann Aufmerksamkeit und Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt oder nicht mehr gegeben ist.
Dies ist insbesondere bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol oder der Einnahme von Beruhigungsmitteln zu erwarten.
Die Beurteilung der jeweils individuellen Situation ist durch den behandelnden Arzt vorzunehmen. Bei einer stabilen Therapie ist ein generelles Fahrverbot nicht zwingend erforderlich.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
|
Sehr häufig |
> 1/10 |
|
Häufig |
> 1/100 bis < 1/10 |
|
Gelegentlich |
> 1/1.000 bis < 1/100 |
|
Selten |
> 1/10.000 bis < 1/1.000 |
|
Sehr selten |
< 1/10.000 |
Nicht bekannt Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
|
Organklasse |
Häufigkeit |
|
Erkrankungen des Immunsystems |
Nicht bekannt: Anaphylaktische oder anaphylaktoide Reaktionen |
|
Endokrine Erkrankungen |
Sehr selten: Syndrom der inadäquaten ADH-Sekretion (SIADH; Leitsymptom: Hyponatriämie) |
|
Organklasse |
Häufigkeit |
|
Psychiatrische Erkrankungen |
Sehr häufig: Stimmungsveränderungen, meist Euphorie aber auch Dysphorie Häufig: Veränderungen der Aktiviertheit (meist Dämpfung, aber auch Steigerung oder Erregungszustände), Schlaflosigkeit und Veränderungen der kognitiven und sensorischen Leistungsfähigkeit (z. B. Denkstörungen, Wahrnehmungsstörungen/Halluzinationen, Verwirrtheit) Sehr selten: Abhängigkeit (siehe auch Abschnitt 4.4), Verminderung der Libido oder Potenzschwäche. |
|
Erkrankungen des Nervensystems |
Häufig: Kopfschmerzen, Schwindel Sehr selten: Tremor, unwillkürliches Muskelzucken, epileptische Krampfanfälle, Hyperalgesie oder Allodynie (dosisabhängig) Nicht bekannt: Sedierung von leichter Müdigkeit bis zur Benommenheit (dosisabhängig) |
|
Augenerkrankungen |
Häufig: Pupillenverengung Sehr selten: Verschwommenes Sehen, Doppeltsehen und Augenzittern |
|
Herzerkrankungen |
Gelegentlich: Klinisch bedeutsamer Abfall als auch Anstieg von Blutdruck und Herzfrequenz Nicht bekannt: Gesichtsrötungen, Herzklopfen, allgemeine Schwäche bis hin zum Ohnmachtsanfall, Herzversagen |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Selten: Bronchospasmen Sehr selten: Dyspnoe Nicht bekannt: Atemdämpfung (dosisabhängig), nicht-kardiogen bedingte Lungenödeme (bei intensivmedizinisch behandelten Patienten) |
|
Organklasse |
Häufigkeit |
|
Erkrankungen des Gastrointestinaltrakts |
Häufig: Verstopfung (bei Dauerbehandlung), Erbrechen (besonders zu Beginn der Behandlung), Appetitlosigkeit, Dyspepsie, Geschmacksveränderungen Selten: Erhöhung der Pankreasenzyme bzw. Pankreatitis Sehr selten: Darmverschluss, Bauchschmerzen Nicht bekannt: Übelkeit und Mundtrockenheit (beides dosisabhängig) |
|
Leber- und Gallenerkrankungen |
Selten: Gallenkoliken Sehr selten: Erhöhung leberspezifischer Enzyme |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Häufig: Schwitzen, Überempfindlichkeitsreaktionen wie Urticaria, Pruritus Sehr selten: Andere Hautausschläge wie Exantheme und periphere Ödeme (bilden sich nach Absetzen zurück) |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Sehr selten: Muskelkrämpfe, Muskelstarre |
|
Erkrankungen der Nieren und Harnwege |
Häufig: Störungen bei der Blasenentleerung Selten: Nierenkoliken |
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Sehr selten: Amenorrhoe |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Selten: Entzugserscheinungen Sehr selten: Asthenie, Unwohlsein, Schüttelfrost, Zahnveränderungen, wobei jedoch ein ursächlicher Zusammenhang zur Morphin-Therapie nicht hergestellt werden konnte Nicht bekannt: T oleranzentwicklung |
Das in Capros akut 10 mg und 20 mg Kapseln enthaltene E 122 (Azorubin) kann allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit.
Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome der Intoxikation
Da die Empfindlichkeit auf Morphin individuell stark schwankt, können Intoxikationserscheinungen beim Erwachsenen ab Einzeldosen auftreten, die einer subkutanen und intravenösen Gabe von ca.
30 mg entsprechen. Bei Karzinompatienten werden diese Werte oft überschritten, ohne gravierende Nebenwirkungen hervorzurufen.
Die Opiatvergiftung äußert sich durch die Trias: Miosis, Atemdepression und Koma: Die Pupillen sind zunächst stecknadelkopfgroß. Bei starker Hypoxie dilatieren sie jedoch. Die Atmung ist stark reduziert (bis auf 2-4 Atemzüge pro Minute). Der Patient wird zyanotisch.
Überdosierung mit Morphin führt zu Benommenheit und Stupor bis hin zum Koma. Der Blutdruck bleibt zunächst normal, fällt jedoch bei fortschreitender Intoxikation rapide ab. Anhaltender Blutdruckabfall kann in einen Schockzustand übergehen. Tachykardie, Bradykardie und Rhabdomyoloyse können auftreten. Die Körpertemperatur fällt ab. Die Skelettmuskulatur wird relaxiert, gelegentlich können, insbesondere bei Kindern, generalisierte Krämpfe auftreten. Der Tod tritt meist durch Ateminsuffizienz oder durch Komplikationen wie pulmonales Ödem ein.
Therapie von Intoxikationen
Bei bewusstlosen Patienten mit Atemstillstand sind Beatmung, Intubation und die intravenöse Gabe eines Opiatantagonisten (z. B. 0,4 mg Naloxon i.v.) angezeigt. Bei anhaltender Ateminsuffizienz muss die Einzeldosis 1-3-mal in dreiminütigen Abständen wiederholt werden, bis die Atemfrequenz normalisiert ist und der Patient auf Schmerzreize reagiert.
Strenge Überwachung (mind. 24 Stunden) ist notwendig, da die Wirkung des Opiatantagonisten kürzer ist als die des Morphins, so dass mit einem erneuten Auftreten der Ateminsuffizienz gerechnet werden muss.
Die Dosis des Opiatantagonisten beträgt bei Kindern pro Einzeldosis 0,01 mg pro kg Körpergewicht. Ferner können Maßnahmen zum Schutz vor Wärmeverlusten und zur Volumentherapie erforderlich sein.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Opioide, ATC-Code: N02AA01
Morphin ist ein Phenantren-Alkaloid aus Schlafmohn (Papaver somniferum) mit opiatagonistischen Eigenschaften. Es zeigt eine ausgeprägte Affinität zu p-Rezeptoren.
Zentrale Wirkungen
Morphin wirkt analgetisch, antitussiv, sedierend, tranquillisierend, atemdepressiv, miotisch, antidiuretisch, emetisch und antiemetisch (Späteffekt) und geringgradig blutdruck- und herzfrequenzsenkend.
Periphere Wirkungen
Obstipation, Kontraktion der Sphinkteren im Bereich der Gallenwege, Steigerung des Tonus der Hamblasenmuskulatur und des Blasenschließmuskels, Verzögerung der Magenentleerung durch Pyloruskonstriktion, Hautrötung, Urtikaria und Juckreiz durch Histaminfreisetzung sowie bei Asthmatikern Bronchospasmus, Beeinflussung der hypophysär-hypothalamischen Achse und damit Beeinflussung der Hormonwirkung von Kortikoiden, Sexualhormonen, Prolactin und antidiuretischem Hormon. Eine Manifestation klinischer Symptome aufgrund dieser Hormonveränderungen kann möglich sein.
Der Wirkungseintritt nach oraler Applikation erfolgt nach 30-90 Minuten. Die Wirkdauer beträgt ca. 4-6 Stunden und ist bei retardierter Wirkstofffreisetzung erheblich verlängert.
Der Wirkungseintritt nach intramuskulärer oder subkutaner Applikation erfolgt nach 15-30 Minuten, nach intravenöser Gabe in wenigen Minuten. Die Wirkdauer beträgt unabhängig von diesen Applikationsarten ca. 4-6 Stunden. Nach epiduraler und intrathekaler Gabe sind lokal begrenzte analgetische Wirkungen bereits nach wenigen Minuten nachweisbar. Die Wirkdauer beträgt bei epiduraler Anwendung ca. 12 Stunden und geht bei intrathekaler Gabe noch darüber hinaus.
In vitro- und Tierstudien zeigen unterschiedliche Effekte natürlicher Opioide, wie Morphin, auf Komponenten des Immunsystems. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
5.2 Pharmakokinetische Eigenschaften
Morphin wird nach oraler Applikation relativ rasch - vorwiegend aus dem oberen Dünndarm und geringfügig auch aus dem Magen - resorbiert. Die geringe absolute Bioverfügbarkeit (20%-40%) ist auf einen ausgeprägten first-pass-Effekt zurückzuführen.
Morphin wird zu ca. 20-35% an Plasmaproteine, bevorzugt an die Albuminfraktion, gebunden.
Das Verteilungsvolumen von Morphin wird mit 1,0-4,7 l/kg nach i.v. Einmalgabe von 4-10 mg angegeben. Hohe Gewebekonzentrationen findet man in der Leber, Niere, im Gastrointestinaltrakt und im Muskel. Morphin überwindet die Blut-Hirnschranke.
Morphin wird vorwiegend in der Leber, aber auch im Darmepithel metabolisiert. Der wesentliche Schritt ist die Glucuronidierung der phenolischen Hydroxylgruppe mittels der hepatischen UDP-Glukuronyltransferase und N-Demethylierung.
Hauptmetabolite sind vor allem Morphin-3-glucuronid und in geringerer Menge Morphin-6-glucuronid. Außerdem entstehen unter anderem Sulfatkonjugate sowie oxidative Stoffwechselprodukte wie Normorphin, Morphin-N-oxid und ein in 2-Stellung hydroxiliertes Morphin. Die Halbwertszeit der Glucuronide ist erheblich länger als die des freien Morphins. Das Morphin-6-glucuronid ist biologisch wirksam. Es ist möglich, dass eine verlängerte Wirkung bei Patienten mit Niereninsuffizienz auf diesen Metaboliten zurückzuführen ist.
Im Harn werden nach oraler oder parenteraler Applikation ca. 80% des verabreichten Morphins wiedergefünden (10% unverändertes Morphin, 4% Normorphin und 65% als Glucuronide, davon Morphin-3-glucuronid: Morphin-6-glucuronid (10 : 1). Die Eliminationshalbwertszeit von Morphin unterliegt großen interindividuellen Schwankungen. Sie liegt nach parenteraler Gabe durchschnittlich zwischen 1,7 und 4,5 Stunden, gelegentlich wurden auch Werte um 9 Stunden gefunden. Etwa 10% der Morphin-Glucuronide werden über die Galle mit den Faeces ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Bei fortgesetzter Anwendung von Morphin nimmt die Empfindlichkeit des ZNS gegenüber Morphin ab. Diese Gewöhnung kann so ausgeprägt sein, dass Dosen vertragen werden, die bei erstmaliger Anwendung infolge Atemdepression toxisch wirken. Aufgrund der euphorischen Wirkungskomponente des Morphins besteht Suchtgefahr (siehe auch Abschnitt 4.4).
Es liegen zur Mutagenität klar positive Befunde vor, die darauf hindeuten, dass Morphin klastogen wirkt und eine solche Wirkung auch auf Keimzellen ausübt. Daher ist Morphin als mutagen wirksame Substanz anzusehen; eine derartige Wirkung muss auch im Menschen angenommen werden.
Morphin sollte nur unter sicherem Konzeptionsschutz eingenommen werden.
Langzeituntersuchungen am Tier auf ein tumorerzeugendes Potential von Morphin liegen nicht vor.
Untersuchungen an Tieren zeigten ein Schädigungspotential für die Nachkommen während der gesamten Dauer der Trächtigkeit (ZNS-Missbildungen, Wachstumsretardierung, Testisatrophie, Veränderungen bei Neurotransmittersystemen und Verhaltensweisen, Abhängigkeit). Daneben hatte Morphin bei verschiedenen Tierspezies Auswirkungen auf das männliche Sexualverhalten und die weibliche Fertilität.
5.4 Bioverfügbarkeit
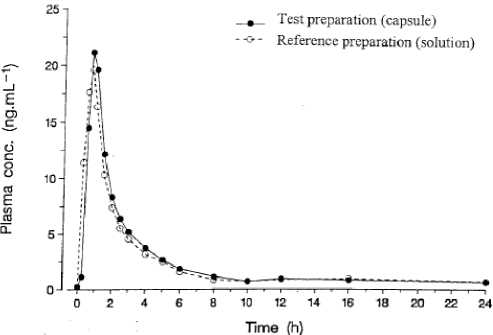
Eine im Jahr 1996-1997 durchgeführte vergleichende Bioverfügbarkeitsuntersuchung (offen, crossover) an 30 männlichen und weiblichen gesunden Probanden (18 bis 44 Jahre) ergab nach jeweils einmaliger Gabe von einer Kapsel (entsprechend 30 mg Morphinsulfat) im Vergleich zum
|
Referenzpräparat folgende Werte: | ||
|
Testpräparat |
Referenz | |
|
Cmax [ng/ml] (arithmetic) |
26,57 ± 9,42 |
24,19 ± 8,29 |
|
tmax [h] (median) |
0,75 |
0,50 |
|
min-max : 0,50-1,00 |
min-max : 0,25-1,00 | |
|
AUC, 0-<x>. [h ng/ml] (arithmetic) |
52,81 ± 15,25 |
48,73 ± 13,35 |
Angabe der Werte als Mittelwerte und Streubreite (Standardabweichung).
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm:
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Capros akut 5 mg Kapseln
Sucrose, Maisstärke, Hypromellose, Talkum
Kapselhülle: Gelatine, Farbstoff: E 132
Capros akut 10 mg Kapseln
Sucrose, Maisstärke, Hypromellose, Talkum,
Kaspelhülle: Gelatine, Farbstoff E 122
Capros akut 20 mg Kapseln
Sucrose, Maisstärke, Hypromellose, Talkum,
Kapselhülle: Gelatine, Farbstoffe: E 122, E 131
Capros akut 30 mg Kapseln
Sucrose, Maisstärke, Hypromellose, Talkum,
Kapselhülle: Gelatine, Farbstoffe: E 132, E 104
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Die Blisterpackung im Umkarton aufbewahren.
6.5 Art und Inhalt des Behältnisses
Blister mit Hartkapseln
OP mit 20 Kapseln OP mit 50 Kapseln OP mit 100 Kapseln
Es werden möglicherweise nicht alle Packungsgrößen ausgeboten.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG medac
Gesellschaft für klinische Spezialpräparate mbH
Theaterstr. 6
22880 Wedel
Tel.: (04103) 8006-0
Fax: (04103)8006-100
8. ZULASSUNGSNUMMERN
57759.00. 00
57760.00. 00
57761.00. 00
57762.00. 00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
04.01.2006 / 31.05.2011
10. STAND DER INFORMATION
April 2014
11. VERSCHREIBUNGSSTATUS/APOTHEKENPFLICHT
Verschreibungspflichtig entsprechend der Betäubungsmittelverschreibungsverordnung.
spc (DE) Capros akut 5/10/20/30 mg Kapseln
National version: 11.04.2014