Cefaclor Basics 250 Mg Ts
Fachinformation
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
1. Bezeichnung des Arzneimittels
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
2. Qualitative und quantitative Zusammensetzung
CEFACLOR BASICS 125 mg TS
1 Flasche (63 g Granulat zur Herstellung von 100 ml Suspension zum Einnehmen) enthält 2,622 g Cefaclor-1 H2O, entsprechend 2,5 g Cefaclor.
5 ml zubereitete Suspension enthalten 131,12 mg Cefaclor-1 H2O entsprechend 125 mg Cefaclor und 3 g Sucrose (0,25 BE).
CEFACLOR BASICS 250 mg TS
1 Flasche (63 g Granulat zur Herstellung von 100 ml Suspension zum Einnehmen) enthält 5,245 g Cefaclor-1 H2O, entsprechend 5 g Cefaclor.
5 ml zubereitete Suspension enthalten 262,25 mg Cefaclor-1 H2O, entsprechend 250 mg Cefaclor und 3 g Sucrose (0,25 BE).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. Darreichungsform
Granulat zur Herstellung einer Suspension zum Einnehmen
Pinkfarbenes Granulat aus homogenem Pulver, welches mit Wasser eine pinkfarbene Suspension mit Erdbeergeschmack bildet.
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Behandlung von akuten und chronischen Infektionen unterschiedlichen Schweregrades, die durch Cefaclorempfindliche Krankheitserreger verursacht werden und einer oralen Therapie zugänglich sind.
Dazu zählen:
• Infektionen der oberen und unteren Atemwege
• Infektionen des Hals-Nasen-Ohren-Bereichs, wie z.B. Otitis media, Sinusitis, Tonsillitis, Pharyngitis
• Infektionen der Niere und der ableitenden Harnwege
• Infektionen der Haut und der Weichteilgewebe
• Gonorrhoe
Die offiziellen Richtlinien für den angemessenen Gebrauch von antimikrobiellen Wirkstoffen sind bei der Anwendung von CEFACLOR BASICS zu berücksichtigen.
4.2 Dosierung, Art und Dauer der Anwendung
CEFACLOR BASICS 125 mg TS
Säuglinge und Kinder unter 6 Jahren
Soweit nicht anders verordnet, beträgt die Normaldosierung 30 mg Cefaclor/kg Körpergewicht/Tag, aufgeteilt in 3 Einzeldosen.
Bei schwereren Infektionen, Otitis media oder bei Infektionen durch weniger empfindliche Erreger sind unter Umständen 40 (- 50) mg Cefaclor/kg Körpergewicht/Tag erforderlich, bei Kindern bis zu 6 Jahren jedoch höchstens 1 g Cefaclor pro Tag. Bei Otitis media kann die Gesamttagesdosis in zwei Teilgaben alle 12 Stunden gegeben werden.
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
Bei leichten Infektionen, wie z.B. unkomplizierten Infektionen der ableitenden Harnwege, ist eine Dosierung von 20 mg Cefaclor/kg Körpergewicht/Tag in zwei bis drei Teilgaben alle 8 bzw. 12 Stunden ausreichend.
Kinder von 6 bis 10 Jahren
Soweit nicht anders verordnet, beträgt die Normaldosierung 3-mal täglich 250 mg Cefaclor, entsprechend 3-mal täglich 2 Messlöffel CEFACLOR BASICS 125 mg TS.
Bei schweren Infektionen, Otitis media oder Infektionen durch weniger empfindliche Erreger sind unter Umständen 4-mal täglich 250 mg Cefaclor (entsprechend 4-mal täglich 2 Messlöffel CEFACLOR BASICS 125 mg TS) erforderlich.
Bei Otitis media können auch 2-mal täglich 500 mg Cefaclor (entsprechend 2-mal 4 Messlöffel CEFACLOR BASICS 125 mg TS) genommen werden.
Bei leichten Infektionen, wie z.B. unkomplizierten Infektionen der ableitenden Harnwege, ist auch eine Dosierung von 2-mal täglich 250 mg Cefaclor, d.h. 2 Messlöffel CEFACLOR BASICS 125 mg TS jeweils morgens und abends gegeben, ausreichend.
Zur Orientierung kann folgende Tabelle dienen
|
125 mg Cefaclor/Messlöffel (5 ml) | |||
|
Alter des Kindes |
Normaldosierung |
höhere Dosierungen bei schwereren Infektionen und Mittelohrentzündung |
niedrigere Dosierungen bei leichteren Infektionen |
|
bis 6 Monate |
3 x täglich A Messlöffel |
4 x täglich A Messlöffel |
- |
|
6 Monate-1 Jahr |
4 x täglich A Messlöffel |
3 x täglich 1 Messlöffel |
- |
|
1-2 Jahre |
3 x täglich 1 Messlöffel |
4 x täglich 1 Messlöffel bzw. 2 x täglich 2 Messlöffel |
- |
|
3-5 Jahre |
morgens 2 Messlöffel mittags 1 Messlöffel abends 2 Messlöffel |
3 x täglich 2 Messlöffel |
- |
|
6-10 Jahre |
3 x täglich 2 Messlöffel |
4 x täglich 2 Messlöffel bzw. 2 x täglich 4 Messlöffel |
2 x täglich 2 Messlöffel (morgens und abends) |
Ältere Kinder/Jugendliche über 10 Jahre oder Erwachsene
Falls ältere Kinder/Jugendliche über 10 Jahre oder Erwachsene die Suspension einnehmen müssen, so beträgt die Normaldosierung 3-mal täglich 500 mg Cefaclor, entsprechend 3-mal 4 Messlöffel CEFACLOR BASICS 125 mg TS täglich.
Für schwerere Infektionen (wie Lungenentzündung) oder solche, die durch weniger empfindliche Erreger verursacht werden, kann die Dosis verdoppelt werden. In einzelnen Fällen wurden Erwachsenen Dosen bis zu 4 g Cefaclor täglich verabreicht, die gut vertragen wurden. Diese Dosis sollte nicht überschritten werden.
Bei leichten Infektionen, wie z.B. unkomplizierten Infektionen der ableitenden Harnwege, ist die Dosierung von 3-mal täglich 250 mg Cefaclor, entsprechend 3-mal täglich 2 Messlöffel CEFACLOR BASICS 125 mg TS ausreichend. Zur Behandlung der akuten gonorrhoischen Urethritis bei Männern und Frauen werden 3 g Cefaclor (entsprechend 24 Messlöffel CEFACLOR BASICS 125 mg TS), eventuell zusammen mit 1 g Probenecid, gegeben.
CEFACLOR BASICS 250 mg TS
Kinder unter 6 Jahren
Soweit nicht anders verordnet, beträgt die Normaldosierung 30 mg Cefaclor/kg Körpergewicht/Tag, aufgeteilt in 3 Einzeldosen.
Bei schwereren Infektionen, Otitis media oder bei Infektionen durch weniger empfindliche Erreger sind unter Umständen 40 (- 50) mg Cefaclor/kg Körpergewicht/Tag erforderlich, bei Kindern bis zu 6 Jahren jedoch höchstens 1 g Cefaclor pro Tag. Bei Otitis media kann die Gesamttagesdosis in zwei Teilgaben alle 12 Stunden gegeben werden.
Bei leichten Infektionen, wie z.B. unkomplizierten Infektionen der ableitenden Harnwege, ist eine Dosierung von 20 mg Cefaclor/kg Körpergewicht/Tag in zwei bis drei Teilgaben alle 8 bzw. 12 Stunden ausreichend.
Kinder von 6 bis 10 Jahren
Soweit nicht anders verordnet, beträgt die Normaldosierung 3-mal täglich 250 mg Cefaclor, entsprechend 3-mal täglich 1 Messlöffel CEFACLOR BASICS 250 mg TS.
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
Bei schweren Infektionen, Otitis media oder Infektionen durch weniger empfindliche Erreger sind unter Umständen 4-mal täglich 250 mg Cefaclor (entsprechend 4-mal täglich 1 Messlöffel) erforderlich.
Bei Otitis media können auch 2-mal täglich 500 mg Cefaclor (entsprechend 2-mal 2 Messlöffel CEFACLOR BASICS 250 mg TS) genommen werden.
Bei leichten Infektionen wie z.B. unkomplizierten Infektionen der ableitenden Harnwege ist auch eine Dosierung von 2-mal täglich 250 mg Cefaclor, d.h. 1 Messlöffel jeweils morgens und abends gegeben, ausreichend.
Zur Orientierung kann folgende Tabelle dienen
|
250 mg Cefaclor/Messlöffel (5 ml). | |||
|
Alter des Kindes |
Normaldosierung |
höhere Dosierungen bei schwereren Infektionen und Mittelohrentzündung |
niedrigere Dosierung bei leichteren Infektionen |
|
1-2 Jahre |
3 x täglich A Messlöffel |
4 x täglich A Messlöffel bzw. 2 x täglich 1 Messlöffel | |
|
3-5 Jahre |
morgens 1 Messlöffel mittags A Messlöffel abends 1 Messlöffel |
3 x täglich 1 Messlöffel | |
|
6-10 Jahre |
3 x täglich 1 Messlöffel |
4 x täglich 1 Messlöffel bzw. 2 x täglich 2 Messlöffel |
2 x täglich1 Messlöffel (morgens und abends) |
Ältere Kinder/Jugendliche über 10 Jahre oder Erwachsene
Falls ältere Kinder/Jugendliche über 10 Jahre oder Erwachsene die Suspension einnehmen müssen, so beträgt die Normaldosierung 3-mal täglich 500 mg Cefaclor, entsprechend 3-mal 2 Messlöffel CEFACLOR BASICS 250 mg TS täglich.
Für schwerere Infektionen (wie Lungenentzündung) oder solche, die durch weniger empfindliche Erreger verursacht werden, kann die Dosis verdoppelt werden. In einzelnen Fällen wurden Erwachsenen Dosen bis zu 4 g täglich verabreicht, die gut vertragen wurden. Diese Dosis sollte nicht überschritten werden.
Bei leichten Infektionen, wie z.B. unkomplizierten Infektionen der ableitenden Harnwege, ist die Dosierung von 3-mal täglich 250 mg Cefaclor (entsprechend 3-mal täglich 1 Messlöffel CEFACLOR BASICS 250 mg TS) täglich ausreichend.
Zur Behandlung der akuten gonorrhoischen Urethritis bei Männern und Frauen werden 3 g Cefaclor (entsprechend 12 Messlöffel) CEFACLOR BASICS 250 mg TS, eventuell zusammen mit 1 g Probenecid gegeben.
Patienten mit eingeschränkter Nierenfunktion
CEFACLOR BASICS kann auch bei eingeschränkter Nierenfunktion ohne Dosierungsanpassung verabreicht werden. Hämodialyse verkürzt die Serumhalbwertszeit um 25-30 %. Bei Patienten, die regelmäßig hämodialysiert werden, sollte vor der Dialyse eine Initialdosis von 250 mg bis zu 1 g gegeben werden. Die Erhaltungsdosis in der Zeit zwischen zwei Dialysen entspricht der oben angegebenen Dosierung.
Herstellung der Suspension
1. Öffnen des kindersicheren Verschlusses durch Niederdrücken und gleichzeitiges Linksdrehen.
2. Kaltes Leitungswasser bis zur Ringmarkierung einfüllen. Die Ringmarkierung ist deutlich auf dem Flaschenkörper sichtbar.
3. Flasche verschließen und kräftig schütteln.
4. Nachdem sich der auftretende Schaum abgesetzt hat, erneut mit Wasser bis zur Ringmarkierung auffüllen und kräftig schütteln.
5. Dieser Vorgang wird wiederholt, bis die Suspension das Niveau der Ringmarkierung erreicht hat.
6. Die Suspension ist nun gebrauchsfertig.
Alternativ können einmalig 62 ml Leitungswasser in die Flasche gegeben werden. Die Flasche verschließen und kräftig schütteln.
CEFACLOR BASICS ist nach der Herstellung der Suspension im Kühlschrank (nicht über 8 °C) zu lagern. So ist die Suspension 14 Tage haltbar.
Art der Anwendung
Einnahme:
CEFACLOR BASICS kann auch während der Mahlzeiten eingenommen werden.
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
Flasche vor jeder Einnahme kräftig schütteln. Zum Abmessen der richtigen Dosis beiliegenden Messlöffel benutzen. Dauer der Anwendung
CEFACLOR BASICS soll in der Regel 7-(10) Tage lang eingenommen werden, mindestens bis 2-3 Tage nach Abklingen der Krankheitserscheinungen.
Bei der Behandlung von Nebenhöhlenentzündungen und von Infektionen mit beta-hämolysierenden Streptokokken ist aus Vorsorglichkeit eine Therapiedauer von mindestens 10 Tagen angezeigt.
Bei schweren Magen-Darm-Störungen mit Erbrechen und Durchfall ist die orale Anwendung von Cefaclor nicht angebracht, da eine ausreichende Resorption nicht gewährleistet ist.
4.3 Gegenanzeigen
Bei erwiesener Überempfindlichkeit gegen den Wirkstoff Cefaclor, andere Cephalosporine oder einen der in Abschnitt
6.1 genannten sonstigen Bestandteile darf CEFACLOR BASICS nicht angewendet werden.
Vorbekannte Überempfindlichkeitsreaktionen vom Soforttyp oder schwere Überempfindlichkeitsreaktionen, Anaphylaxie gegen Penicilline oder andere Betalaktam-Antibiotika.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Allergische Reaktionen
Besondere Vorsicht bei der Anwendung von CEFACLOR BASICS ist bei Patienten mit jeglicher Überempfindlichkeit gegen Penicillin und andere Betalaktam-Antibiotika erforderlich, da eine Parallelallergie bestehen kann (zu Gegenanzeigen bei bekannten Überempfindlichkeitsreaktionen siehe Abschnitt 4.3). CEFACLOR BASICS sollten mit Vorsicht bei Patienten angewendet werden, die jede Form einer Allergie, besonders gegenüber Arzneimitteln, gezeigt haben.
Bei Patienten mit allergischer Reaktionsbereitschaft sonstiger Art (z.B. Heuschnupfen oder Asthma bronchiale) sollte CEFACLOR BASICS ebenfalls mit besonderer Vorsicht angewendet werden, da in diesen Fällen das Risiko für schwerwiegende Überempfindlichkeitsreaktionen erhöht ist.
Bei Auftreten von schweren akuten Überempfindlichkeitsreaktionen, z.B. Anaphylaxie (siehe Abschnitt 4.8) muss die Behandlung mit CEFACLOR BASICS sofort abgebrochen werden und die erforderlichen Notfallmaßnahmen müssen eingeleitet werden.
Pseudomembranöse Kolitis
Bei schweren und anhaltenden Durchfällen ist an eine pseudomembranöse Kolitis zu denken, die lebensbedrohlich sein kann. Fälle von Antibiotika assoziierter Kolitis wurden bis zu 10 Wochen nach Therapieende berichtet. Deshalb ist in diesen Fällen CEFACLOR BASICS sofort abzusetzen und eine geeignete Therapie einzuleiten. Peristaltik-hemmende Mittel sind kontraindiziert.
Breitbandantibiotika sollten mit Vorsicht an Patienten mit gastrointestinalen Erkrankungen (besonders Kolitis) in der Anamnese verschrieben werden.
Eingeschränkte Nierenfunktion
CEFACLOR BASICS sollte mit Vorsicht bei Vorliegen einer deutlichen Nierenfunktionsstörung angewendet werden. Die Halbwertszeit bei anurischen Patienten beträgt 2,3-2,8 Stunden (bei nierengesunden Patienten 0,6-0,9 Stunden). Dosisanpassungen können für Patienten mit mittelschwerer bis schwerer Niereninsuffizienz notwendig sein. Die klinischen Erfahrungen unter diesen Bedingungen sind begrenzt. Daher sollte eine sorgfältige klinische Überwachung und Laboruntersuchungen in Betracht gezogen werden.
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
Verminderte Wirksamkeit von Arzneimitteln
Die Anwendung von CEFACLOR BASICS kann zu Erbrechen und Durchfall führen (siehe Abschnitt 4.8). In diesem Fall kann die Wirksamkeit dieses und/oder anderer eingenommener Arzneimittel (wie z.B. oraler Kontrazeptiva) beeinträchtigt werden.
Langfristige oder wiederholte Anwendung von Cefaclor kann zu einer Superinfektion führen (siehe Abschnitt 4.8). Wenn dies während der Behandlung auftritt, sollten entsprechende Maßnahmen ergriffen werden.
Eine Kreuzsensibilisierung und eine Kreuzresistenz können zwischen Penicillinen und Cephalosporinen bestehen.
Patienten mit der seltenen, hereditären Fructose-Intoleranz, Glucose-Galactose-Malabsorption oder Saccharase-Isomaltase-Mangel sollten CEFACLOR BASICS nicht einnehmen.
Hinweis für Diabetiker:
5 ml der zubereiteten Suspension (1 Messlöffel) enthalten 3 g Sucrose (entsprechend 0,25 BE).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Cefaclor/andere Antibiotika
CEFACLOR BASICS sollte möglichst nicht mit bakteriostatisch wirkenden Antibiotika (wie z.B. Chloramphenicol, Erythromycin, Sulfonamide oder Tetrazykline) kombiniert werden, da die Wirkung von CEFACLOR BASICS vermindert werden kann.
Cefaclor/Probenecid
Die zusätzliche Gabe von Probenecid hemmt die Ausscheidung von Cefaclor durch die Niere und führt dadurch zu höheren und länger anhaltenden Cefaclor-Blutspiegeln.
Cefaclor/blutgerinnungshemmende Arzneimittel
In Einzelfällen wurden bei Patienten, die gleichzeitig Cefaclor und Antikoagulantien vom Cumarin-Typ erhielten, verlängerte Prothrombinzeiten mit oder ohne Blutung berichtet. Die Gerinnungswerte sollten sorgfältig überwacht werden. Gegebenenfalls ist eine Dosisanpassung vorzunehmen.
Einfluss auf labordiagnostische Untersuchungen
Nichtenzymatische Methoden zur Harnzuckerbestimmung können gestört sein (positives Resultat). Daher ist der Harnzucker unter der Therapie mit CEFACLOR BASICS enzymatisch zu bestimmen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Beobachtungen am Menschen haben bisher keinen Hinweis auf Schädigung des im Mutterleib befindlichen Kindes ergeben. Tierexperimentelle Studien haben keine fruchtschädigende Wirkung erkennen lassen. Dennoch sollte Cefaclor während der Schwangerschaft, besonders in den ersten 3 Monaten, nur nach strenger Indikationsstellung eingenommen werden.
Dies gilt auch für die Einnahme während der Stillzeit, da Cefaclor in geringen Mengen in die Muttermilch übergeht. Beim mit Muttermilch ernährten Säugling kann es zu Sensibilisierung sowie Veränderung der Darmflora mit Durchfällen und zu einer Sprosspilzbesiedlung kommen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nach bisherigen Erfahrungen hat Cefaclor im Allgemeinen keinen Einfluss auf Konzentrations- und Reaktionsfähigkeit. Durch das Auftreten von Nebenwirkungen (siehe Abschnitt 4.8) kann jedoch das Reaktionsvermögen verändert und die Fähigkeit zur aktiven Teilnahme am Straßenverkehr und zum Bedienen von Maschinen beeinträchtigt werden.
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
4.8 Nebenwirkungen
a) Zusammenfassung des Sicherheitsprofils
Folgende Nebenwirkungen können schwerwiegend sein und erfordern eine sofortige Behandlung:
• Pseudomembranöse Kolitis (siehe Abschnitt 4.4)
• schwere akute Überempfindlichkeitsreaktionen: Gesichtsödem, Zungenschwellung, innere Kehlkopfschwellung mit Einengung der Luftwege, Asthenie, Herzjagen, Luftnot (Atemnot), Parästhesien, Synkopen, Blutdruckabfall oder Vasodilatation bis hin zu bedrohlichem Schock. Diese Reaktionen traten teilweise schon nach Erstanwendung auf (siehe Abschnitt 4.4).
• schwere Hautreaktionen, wie z.B. Stevens-Johnson-Syndrom, exfoliative Dermatitis, Lyell-Syndrom, mit lebensbedrohlichen Allgemeinreaktionen
• Serumkrankheitsähnliche Reaktionen (multiforme Erytheme oder oben genannte Hauterscheinungen, begleitet von Gelenkbeschwerden mit und ohne Fieber), jedoch nur sehr selten kombiniert mit Lymphadenopathie und Proteinurie und ohne Nachweis zirkulierender Antikörper. Im Allgemeinen treten diese Erscheinungen während oder nach einer zweiten Behandlung mit CEFACLOR BASICS auf (häufiger bei Kindern als bei Erwachsenen) und klingen wenige Tage nach Absetzen des Arzneimittels wieder ab (siehe Abschnitt c).
• Eine erhöhte Neigung zu Krampfanfällen kann wie bei anderen Cephalosporinen nicht ausgeschlossen werden, besonders bei Patienten mit Nierenfunktionsstörungen, wenn die Dosis nicht angepasst wurde. Sollten Krampfanfälle im Zusammenhang mit der Antibiotikatherapie auftreten, ist das Arzneimittel abzusetzen und ggf. eine krampflösende Therapie einzuleiten.
b) Tabellarische Liste der Nebenwirkungen
|
Systemor ganklasse |
Häufig (> 1/100 bis < 1/10) |
Gelegentlich (> 1/1.000 bis < 1/100) |
Selten (> 1/10.000 bis < 1/1.000) |
Sehr selten (< 1/10.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Infektionen und parasitäre Erkrankungen |
Superinfektion* | ||||
|
Erkrankungen des Blutes und des Lymphsystems |
Thrombozytopenie, Neutropenie**, Agranulozytose, aplasti-sche oder hämolytische Anämie |
Eosinophilie**, Lymphozytose**, Leukopenie** | |||
|
Erkrankungen des Immunsystems |
allergische Hautreaktio nen* |
schwere akute Über-empfindlichkeitsreak-tionen*1 schwere Hautreaktionen (z.B. Stevens-JohnsonSyndrom, exfoliative Dermatitis Lyell-Syndrom)2 | |||
|
Psychiatrische Erkankungen** |
Schlaflosigkeit, Somnolenz, Nervosität, Agitiertheit, Verwirrtheit, Halluzinationen, Schwindelgefühl |
Kopfschmerzen | |||
|
Erkrankungen des Nervensystems |
Krampfanfall2 | ||||
|
Herzerkrankun gen |
Bluthochdruck | ||||
|
Erkrankungen des Gastrointes-tinaltraks |
abdominale Beschwer den* |
Pseudomembranöse Kolitis1, Zahnverfärbungen | |||
|
Leber- und Galle- |
Transaminasen |
Leberfunktionsstö- |
Hepatitis, Cho- |
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
|
Systemor ganklasse |
Häufig (> 1/100 bis < 1/10) |
Gelegentlich (> 1/1.000 bis < 1/100) |
Selten (> 1/10.000 bis < 1/1.000) |
Sehr selten (< 1/10.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
nerkrankungen |
und/oder alkalische Phosphatase im Serum erhöht** |
rungen |
lestase mit Ikterus | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
siehe Nebenwirkungen unter „Erkrankungen des Immunsystems“ | ||||
|
Erkrankungen der Nieren und Harnwege |
Interstitielle Nephritis**, Anstieg von Blutharnstoff und Kreatinin |
Proteinurie | |||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Genitalpruritus, Vaginitis, vaginale Candidose | ||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Fieber | ||||
|
Untersuchungen |
verlängerte Blutgerinnungszeiten, positiver Coombs-Test | ||||
* siehe Abschnitt c
** Diese Erscheinungen bilden sich nach Beendigung der Behandlung wieder zurück.
1 siehe Abschnitt 4.4
2 siehe Abschnitt a
c) Beschreibung ausgewählter Nebenwirkungen
Langfristige oder wiederholte Anwendung von Cefaclor kann zu einer Superinfektion und Besiedelung mit Cefaclorresistenten Keimen oder Sprosspilzen führen.
Als allergische Hautreaktionen können Rash, Juckreiz, urtikarielles Exanthem, makulopapulöse, morbilliforme Exantheme auftreten. Diese Reaktionen klingen in der Regel nach Beendigung der Therapie ab.
Abdominale Beschwerden können Übelkeit, Erbrechen, Appetitlosigkeit, Bauchschmerzen, weiche Stühle oder Durchfall umfassen. Die Beschwerden sind meist leichter Natur und klingen häufig während, sonst nach Absetzen der Therapie ab.
Anaphylaktische Reaktionen können häufig bei Patienten mit einer Penicillinallergie in der Anamnese auftreten.
Bei Auftreten einer anaphylaktischen Reaktion müssen die Behandlung mit CEFACLOR BASICS sofort abgebrochen und die üblichen entsprechenden Notfallmaßnahmen (z.B. Gabe von Antihistaminika, Kortikosteroiden, Sympathomimetika und ggf. Beatmung) eingeleitet werden.
Toxische Nephropathie, Kolitis und Nierenfunktionsstörungen sind bei anderen Beta-Lactam-Antibiotika beobachtet worden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen.
Deutschland
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de
4.9 Überdosierung
Cefaclor ist von geringer Toxizität. Auch hohe Dosen, über längere Zeit verabreicht, werden gut vertragen. Berichte über Vergiftungsfälle mit Cefaclor liegen nicht vor.
Schwerwiegende Unverträglichkeitserscheinungen wurden nicht mitgeteilt, wenn die Tagesdosen nicht mehr als um das 5-fache überschritten wurden (bei Erwachsenen sind das ca. 15 g und bei Kindern 250 mg Cefaclor pro kg Körpergewicht). Ein spezifisches Antidot gibt es nicht.
Über die Wirksamkeit einer forcierten Diurese, Peritoneal- oder Hämodialyse sowie Hämoperfusion über Aktivkohle gibt es keine ausreichenden Untersuchungen, die eine Anwendung empfehlen könnten.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe
Cefaclor ist ein Betalaktam-Antibiotikum aus der Gruppe der Cephalosporine.
ATC-Code: J01DC04 Wirkungsweise
Der Wirkungsmechanismus von Cefaclor beruht auf einer Hemmung der bakteriellen Zellwandsynthese (in der Wachstumsphase) durch Blockade der Penicillin-bindenden Proteine (PBPs) wie z.B. der Transpeptidasen. Hieraus resultiert eine bakterizide Wirkung.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik
Die Wirksamkeit hängt im Wesentlichen von der Zeitdauer ab, während der der Wirkstoffspiegel oberhalb der minimalen Hemmkonzentration (MHK) des Erregers liegt.
Resistenzmechanismen
Eine Resistenz gegenüber Cefaclor kann auf folgenden Mechanismen beruhen:
• Inaktivierung durch Betalaktamasen: Cefaclor besitzt eine weitgehende Stabilität gegenüber Penicillinasen Gram-positiver Bakterien, allerdings nur eine geringe Stabilität gegenüber plasmidkodierten Betalaktamasen (z.B. TEM, SHV), Betalaktamasen mit erweitertem Spektrum (sog. extended spectrum betalactamases, ESBLs) sowie chromosomal kodierten Betalaktamasen vom AmpC-Typ.
• Reduzierte Affinität von PBPs gegenüber Cefaclor: Die erworbene Resistenz bei Pneumokokken und anderen Streptokokken beruht auf Modifikationen vorhandener PBPs als Folge einer Mutation. Für die Resistenz bei Me-thicillin (Oxacillin)-resistenten Staphylokokken hingegen ist die Bildung eines zusätzlichen PBPs mit verminderter Affinität gegenüber Cefaclor verantwortlich.
• Unzureichende Penetration von Cefaclor durch die äußere Zellwand kann bei Gram-negativen Bakterien dazu führen, dass die PBPs nicht ausreichend gehemmt werden.
• Durch Effluxpumpen kann Cefaclor aktiv aus der Zelle transportiert werden.
Eine partielle oder vollständige Kreuzresistenz von Cefaclor besteht mit anderen Cephalosporinen und Penicillinen.
Grenzwerte
Die Testung von Cefaclor erfolgt unter Benutzung der üblichen Verdünnungsreihe. Folgende minimale Hemmkonzentrationen für sensible und resistente Keime wurden festgelegt:
EUCAST (European Committee on Antimicrobial Susceptibility Testing) Grenzwerte
|
Erreger |
Sensibel |
Resistent |
|
Staphylococcus spp.1 |
1 |
1 |
|
Streptococcus spp. (Gruppen A, B, C, G)2 |
2 |
2 |
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
|
Streptococcus pneumoniae |
< 0,03 mg/l |
> 0,5 mg/l |
1 Für Staphylococcus spp. wird das Testergebnis von Oxacillin bzw. Cefoxitin übernommen. Methicillin (Oxacillin)-resistente Staphylokokken werden unabhängig vom Testergebnis als resistent gewertet.
2 Für Streptococcus spp. (Gruppen A, B, C, D) wird das Testergebnis von Penicillin G übernommen.
Prävalenz der erworbenen Resistenz in Deutschland
Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit variieren. Deshalb sind -insbesondere für die adäquate Behandlung schwerer Infektionen - lokale Informationen über die Resistenzsituation erforderlich. Falls auf Grund der lokalen Resistenzsituation die Wirksamkeit von Cefaclor in Frage gestellt ist, sollte eine Therapieberatung durch Experten angestrebt werden. Insbesondere bei schwerwiegenden Infektionen oder bei Therapieversagen ist eine mikrobiologische Diagnose mit dem Nachweis des Erregers und dessen Empfindlichkeit gegenüber Cefaclor anzustreben.
Prävalenz der erworbenen Resistenz in Deutschland auf der Basis von Daten der letzen 5 Jahre aus nationalen Resistenzüberwachungsprojekten und -studien (Stand: Januar 2015):
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
Bei Säuglingen und Kindern wurden nach Gabe von 10 mg/kg bzw. von 15 mg/kg auf nüchternen Magen Serumspitzenkonzentrationen von etwa 10,8 mg/l bzw. 13,1 mg/l gemessen. Bei Cefaclor-Gabe über einen Zeitraum von 10 Tagen kommt es zu keiner Akkumulation des Antibiotikums.
Gleichzeitige Nahrungsaufnahme beeinflusst das Ausmaß der Resorption (AUC) nicht, jedoch deren Geschwindigkeit, so dass tmax vergrößert und Cmax um 30 % niedriger ist.
4-6 Stunden nach der Einnahme ist im Plasma in der Regel keine aktive Substanz mehr nachweisbar.
Verteilung
Cefaclor verteilt sich in verschiedene Gewebe und Körperflüssigkeiten. Hohe Konzentrationen werden z.B. in der Prostata und in der Galle erreicht.
Die Bindung an Serumproteine beträgt etwa 25 %.
In der folgenden Tabelle sind Cefaclor-Konzentrationen in Geweben und Körperflüssigkeiten des Menschen aufgeführt. Die angegebenen Konzentrationsbereiche umfassen die Ergebnisse verschiedener Untersucher zu unterschiedlichen Zeiten nach der Einnahme.
|
Gewebe/Körperflüssigkeit |
Dosis (mg) |
Konzentrationen (ug/ml oder g) |
|
Sputum |
500 u. 3 x 500 |
0 - 3 |
|
Gaumenmandel |
500 u. 3 x 500 |
6 - 8 |
|
1000 |
2,8 | |
|
Interstitielle Flüssigkeit |
500 |
0,625 - 1,7 |
|
1000 |
1,45 - 3,3 | |
|
Eiter |
500 |
0,4 |
|
Cutis |
1000 |
2,8 |
|
Fascie |
1000 |
1,5 |
|
Corticalis |
1000 |
1,9 |
|
Prostata |
500 |
0,24 - 1,94 |
|
Galle |
1000 |
5,9 - 12,1 |
|
Muttermilch |
500 |
0,35 - 0,64 |
|
Amnionflüssigkeit |
500 |
1,3 - 3,63 |
Metabolismus und Ausscheidung
Cefaclor ist in Lösung chemisch instabil. Es zerfällt z.B. spontan in Körperflüssigkeiten wie im Urin. Das Ausmaß der echten metabolischen Clearance ist daher schwer abzuschätzen. Wenn überhaupt vorhanden, ist der metabolisierte Anteil unter den Zerfallsprodukten sehr gering.
Die Exkretion erfolgt überwiegend renal. In den ersten 8 Stunden nach Einnahme werden 50-70 % einer Dosis als mikrobiologisch aktive Substanz im Urin wiedergefunden und bis zu 30 % als inaktive Zerfallsprodukte.
Von radioaktiv markiertem Cefaclor wurden 92 % im Urin und 4 % in den Faeces wiedergefunden.
Die Plasmahalbwertszeit beträgt im Mittel 45 Minuten (Bereich: 29-60 Min). Sie ist dosisabhängig, d.h. nach Gabe höherer Einzeldosen (z.B. 500 mg bzw. 1000 mg) wurden etwas längere Halbwertszeiten ermittelt als nach niedrigeren Einzeldosen. Bei Patienten mit eingeschränkter Nierenfunktion ist die Serumhalbwertszeit verlängert. Es kommt jedoch dadurch bei 3-mal täglicher Einnahme nicht zur Kumulation. Bei anurischen Patienten beträgt die Serumhalbwertszeit von Cefaclor bis 3,5 Stunden.
Cefaclor ist hämodialysierbar. Hämodialyse verkürzt die Serumhalbwertszeit um 25-30 %. Das scheinbare Verteilungsvolumen beträgt etwa 26 l. Die renale Clearance des Cefaclors liegt bei 188 bis 230 ml/min und die totale Clearance liegt bei 370 bis 455 ml/min.
Ergebnisse pharmakokinetischer Untersuchungen bei Kindern weichen nur unwesentlich von denen bei Erwachsenen ab. Die Halbwertszeiten, zum Beispiel, liegen in der gleichen Größenordnung.
Bioverfügbarkeit
CEFACLOR BASICS 125 mg TS
Eine im Jahr 1993 durchgeführte Bioverfügbarkeitsuntersuchung an 24 männlichen Probanden ergab im Vergleich zum Referenzpräparat:
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
|
Testpräparat |
Referenzpräparat | |
|
Maximale Plasmakonzentrtation (cmax) |
15,6 |
16,9 |
|
[pg/ml] |
(1,27) |
(1,23) |
|
Zeitpunkt der maximalen Plasmakon- |
0,67 |
0,70 |
|
zentration (tmax) [h] |
(1,49) |
(1,42) |
|
Fläche unter der Konzentations-Zeit- |
18,9 |
19,5 |
|
Kurve (AUCq.„) [ng-h/ml] |
(1,13) |
(1,13) |
Angabe der Werte als geometrische Mittelwerte und Streubreiten (Standardabweichung).
Mittlere Plasmaspiegelverläufe (arithmetische Mittelwerte) im Vergleich zu einem Referenzpräparat in einem Konzentra-tions-Zeit-Diagramm:
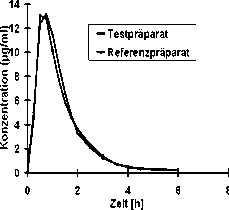
CEFACLOR BASICS 250 mg TS
Eine im Jahr 1993 durchgeführte Bioverfügbarkeitsuntersuchung an 24 männlichen Probanden ergab im Vergleich zum Referenzpräparat:
|
Testpräparat |
Referenzpräparat | |
|
maximale Plasmakonz. (cmax) [pg/ml] |
14,8 |
16,8 |
|
(1,34) |
(1,17) | |
|
Zeitpunkt der maximalen Plasmakon- |
0,65 |
0,60 |
|
zentration (tmax) [h] |
(1,46) |
(1,32) |
|
Fläche unter der Konzentrations-Zeit- |
20,1 |
20,2 |
|
Kurve (AUCq.„) [ng-h/ml] |
(1,16) |
(1,14) |
Angabe der Werte als geometrische Mittelwerte und Streubreiten (Standardabweichung)
Mittlere Plasmaspiegelverläufe (arithmetische Mittelwerte) im Vergleich zu einem Referenzpräparat in einem Konzentra-tions-Zeit-Diagramm:

5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
siehe Punkt 4.9 Überdosierung
b) Chronische Toxizität/subchronische Toxizität
Ratten und Hunden wurden 1 Jahr lang Cefaclor-Dosen bis zu 675 mg/kg bzw. 400 mg/kg oral gegeben. Dabei wurden keine Veränderungen beobachtet, die auf eine Toxizität der Substanz hinweisen.
c) Mutagenes und tumorerzeugendes Potential
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
Cefaclor wurde bezüglich mutagener Wirkungen nicht geprüft. Langzeituntersuchungen am Tier zum tumorerzeugenden Potential liegen nicht vor.
d) Reproduktionstoxizität
Cefaclor passiert die Plazentaschranke und geht in geringen Mengen in die Muttermilch über. Beim mit Muttermilch ernährten Säugling ist die Möglichkeit einer Sensibilisierung, einer Veränderung der Darmflora mit Durchfällen und einer Sprosspilzbesiedlung von Schleimhäuten nicht auszuschließen.
Teratogenitätsstudien wurden mit Ratten und Mäusen durchgeführt. Fertilitäts- und Reproduktionsstudien wurden mit Ratten durchgeführt. In diesen Untersuchungen wurden keine teratogenen Wirkungen oder Schädigungen der Fortpflanzungsfähigkeit festgestellt.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Sucrose
Simeticon-Emulsion 30 %
Xanthangummi
Carboxymethylstärke-Natrium
Natriumsalz,
Natriumdodecylsulfat
Erdbeer-Aroma
Erythrosin-Aluminiumsalz (E127)
6.2 Inkompatibilitäten Nicht zutreffend
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Die zubereitete Suspension ist im Kühlschrank (nicht über 8 °C) aufzubewahren. So ist die Suspension 14 Tage haltbar. Nicht verwendete Reste müssen vernichtet werden.
6.5 Art und Inhalt des Behältnisses
CEFACLOR BASICS 125 mg TS
1 Flasche mit 63 g Granulat zur Zubereitung von 100 ml Suspension CEFACLOR BASICS 250 mg TS
1 Flasche mit 63 g Granulat zur Zubereitung von 100 ml Suspension
2 Flaschen (2x1) mit je 63 g Granulat zur Zubereitung von 100 ml Suspension
6.6 Besondere Vorsichtmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
7. Inhaber der Zulassung
Basics GmbH Hemmelrather Weg 201 51377 Leverkusen Tel.: 0214-40399-0 Fax: 0214-40399-199 E-Mail: info@ranbaxy.de Internet: www.basics.de
8. Zulassungsnummern
24625.00.00
CEFACLOR BASICS 125 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen CEFACLOR BASICS 250 mg TS
Granulat zur Herstellung einer Suspension zum Einnehmen
24625.01.00
9. Datum der Zulassungen/Verlängerung der Zulassungen
13.06.1994/14.04.2004
10. Stand der Information
Januar 2016
11. Verkaufsabg renzung
Verschreibungspflichtig
V03-00
Üblicherweise empfindliche Spezies_
Aerobe Gram-positive Mikroorganismen_
Staphylococcus aureus (Methicillin-sensibel)1 2_
Staphylococcus saprophyticus°2_
Streptococcus agalactiae_
Streptococcus pyogenes_
Spezies, bei denen erworbene Resistenzen ein Problem bei der Anwendung darstellen können
Aerobe Gram-positive Mikroorganismen_
Staphylococcus aureus32 _
Staphylococcus epidermidis 2_
Staphylococcus haemolyticus+2
Staphylococcus hominis 2 _
Streptococcus pneumoniae$
Aerobe Gram-negative Mikroorganismen_
Escherichia coli_
Klebsiella pneumoniae_
Proteus mirabilis_
Von Natur aus resistente Spezies_
Aerobe Gram-positive Mikroorganismen_
Enterococcus spp._
Staphylococcus aureus (Methicillin-resistent)_
Streptococcus pneumoniae (Penicillin-intermediär und -resistent)
Aerobe Gram-negative Mikroorganismen
Enterobacter cloacae Haemophilus influenzae Legionella pneumophila Moraxella catarrhalis Pseudomonas aeruginosa
Andere Mikroorganismen_
Chlamydia spp.
Chlamydophila spp.
Mycoplasma spp.
Seite 13 von 13
° Bei Veröffentlichung der Tabelle lagen keine aktuellen Daten vor. In der Primärliteratur, Standardwerken und Therapieempfehlungen wird von einer Empfindlichkeit ausgegangen.
$ Die natürliche Empfindlichkeit der meisten Isolate liegt im intermediären Bereich.
+ In mindestens einer Region liegt die Resistenzrate bei über 50 %.
3 Im ambulanten Bereich liegt die Resistenzrate bei < 10 %.
Hohe Dosierung erforderlich.
5.2 Pharmakokinetische Eigenschaften
Cefaclor wird zu mindestens 75 % bis über 92 % überwiegend aus dem oberen Dünndarm resorbiert. Nach nüchterner Einnahme einer einzelnen Dosis von 250 mg, 500 mg bzw. 1000 mg Cefaclor werden Plasmaspitzenkonzentrationen von ca. 7, 15 bzw. 26 mg/l nach 60 Minuten erreicht.