Cetirizin Aristo Bei Allergien
F achinformation
1. Bezeichnung des Arzneimittels
Cetirizin Aristo® bei Allergien, 10 mg Filmtabletten
2. Qualitative und quantitative Zusammensetzung
1 Filmtablette enthält 10 mg Cetirizindihydrochlorid.
Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat Jede Filmtablette enthält 77,71 mg Lactose.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. Darreichungsform
Filmtabletten:
weiß, rund, beidseitig gewölbt mit einseitiger Bruchkerbe Die Tablette kann in gleiche Dosen geteilt werden.
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Behandlung von Krankheitssymptomen bei allergischen Erkrankungen wie
- chronischer Nesselsucht (Urtikaria) mit Beschwerden wie z.B. Juckreiz, Quaddelbildung,
Rötung der Haut
- chronischem allergischem Schnupfen
- Juckreiz bei chronischer Nesselsucht (Urtikaria) und bei atopischer Dermatitis
- (Neurodermitis) mit Beschwerden wie Rötung der Haut
- Heuschnupfen mit Beschwerden wie z. B. Niesen, Nasenlaufen, Nasenjucken, Nasenverstopfung, Rötung bzw. Jucken der Augen sowie Tränenfluss
- asthmoide Zustände allergischer Herkunft als unterstützende Maßnahme zur Unterdrückung entsprechender Beschwerden
4.2 Dosierung und Art der Anwendung
Dosierung
Jugendliche ab 12 Jahre und Erwachsene 1 Filmtablette Cetirizin Aristo® täglich, vorzugsweise am Abend.
Die Dosis kann bei Erwachsenen zur unterstützenden Behandlung asthmoider Zustände allergischer Herkunft auf 2 Filmtabletten Cetirizin Aristo® erhöht werden, vorzugsweise verteilt auf je 1 Filmtablette morgens und abends.
Kinder von 6 bis 12 Jahren
Kinder von 6-12 Jahren erhalten eine dem Körpergewicht angepasste Dosierung:
- Körpergewicht weniger als 30 kg: V Filmtablette pro Tag
- Körpergewicht mehr als 30 kg: 1 Filmtablette pro Tag; eine Verteilung auf zwei Einzelgaben (je V Filmtablette morgens und abends) ist in Einzelfällen möglich.
Ältere Patienten
Die Daten deuten nicht daraufhin, dass die Dosis bei älteren Menschen - soweit die Nierenfunktion unauffällig ist - reduziert werden muss.
Patienten mit mittelschwerer bis schwerer Niereninsuffizienz
Daten, die das Wirksamkeits-/Sicherheits-Verhältnis belegen, liegen für Patienten mit Niereninsuffizienz nicht vor. Da Cetirizin hauptsächlich über die Nieren ausgeschieden wird (siehe Abschnitt 5.2), muss in Fällen, in denen keine alternative Behandlung angewendet werden kann, das Dosisintervall individuell der Nierenfunktion entsprechend angepasst werden. Die Dosisanpassung sollte gemäß der folgenden Tabelle vorgenommen werden. Bei der Anwendung dieser Tabelle zur Dosisanpassung muss der Wert der Kreatinin-Clearance (CLcr) des Patienten in ml/min abgeschätzt werden. Die CLcr in ml/min kann aus der SerumKreatinin-Konzentration (mg/dl) nach folgender Formel bestimmt werden:
[140 - Alter (Jahre)] x Gewicht (kg) , ^ „
CLrr = ------(x 0,85 bei Frauen)
72 x Serum - Kreatinin (mg/dl)
Dosisanpassung bei Patienten mit eingeschränkter Nierenfunktion
|
Gruppe |
Kreatinin-Clearance (ml/min) |
Dosis und Einnahmehäufigkeit |
|
Normal |
>80 |
10 mg einmal täglich |
|
Leicht |
50-79 |
10 mg einmal täglich |
|
Mäßig |
30-49 |
5 mg einmal täglich |
|
Schwer |
<30 |
5 mg einmal alle zwei Tage |
|
Terminale NiereninsuffizienzDialysepflichtige Patienten |
<10 |
Kontraindiziert |
Bei Kindern mit eingeschränkter Nierenfunktion muss die Dosis unter Berücksichtigung der renalen Clearance, des Alters und des Körpergewichts individuell an den Patienten angepasst werden.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit ausschließlich eingeschränkter Leberfunktion ist keine Dosisanpassung erforderlich.
Patienten mit gleichzeitig eingeschränkter Leber- und Nierenfunktion
Eine Dosisanpassung wird empfohlen (siehe zuvor bei Patienten mit mittelschwerer bis schwerer Niereninsuffizienz).
Art und Dauer der Anwendung
Die Filmtabletten sollen unzerkaut mit Flüssigkeit vorzugsweise am Abend eingenommen werden.
Bei der unterstützenden Behandlung asthmoider Zustände allergischer Herkunft mit 2 Filmtabletten täglich sollte 1 Filmtablette am Morgen und 1 Filmtablette am Abend eingenommen werden.
Die Einnahme von Cetirizin Aristo® kann unabhängig von den Mahlzeiten erfolgen.
Die Behandlungszeit richtet sich nach Art, Dauer und Verlauf der Beschwerden und wird vom Arzt bestimmt. Bei Heuschnupfen sind im Allgemeinen 3-6 Wochen - bei kurzfristiger Pollenbelastung auch nur 1 Woche - ausreichend. Bei der unterstützenden Behandlung von asthmoiden Zuständen allergischer Herkunft liegen Erfahrungen bis zu 6 Monaten vor. Bei chronischer Nesselsucht und chronischem allergischem Schnupfen liegen bisher über die Anwendung von Cetirizin Aristo® Erfahrungen bis zu 1 Jahr vor.
Die Anwendungsdauer für Kinder ab 6 Jahre beträgt 2-4 Wochen, bei kurzfristiger Allergenbelastung kann auch 1 Woche ausreichend sein. Über die Anwendung von Cetirizin Aristo® bei atopischer Dermatitis liegen bisher Erfahrungen bis zu 18 Monaten vor.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff, einen der in Abschnitt 6.1 genannten sonstigen Bestandteile, Hydroxyzin oder andere Piperazin-Derivate.
- Patienten mit schwerer Niereninsuffizienz mit einer Kreatinin-Clearance unter 10 ml/min sowie
- während der Stillzeit (siehe Abschnitt 4.6 „Fertilität, Schwangerschaft und Stillzeit”)
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei therapeutischen Dosierungen wurden im Zusammenhang mit Alkohol (bei einem Alkoholblutspiegel von 0,5 g/l) keine klinisch signifikanten Wechselwirkungen festgestellt. Dennoch ist bei gleichzeitiger Einnahme mit Alkohol Vorsicht geboten.
Vorsicht ist bei Patienten mit Epilepsie und bei Patienten mit Krampfneigung angezeigt.
Antihistaminika wirken hemmend auf Allergietests der Haut. Daher ist vor Durchführung eines Allergietests eine dreitägige Auswaschphase erforderlich.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Cetirizin Aristo® nicht einnehmen.
Kinder und Jugendliche
Die Anwendung der Filmtabletten wird bei Kindern unter 6 Jahren nicht empfohlen, da diese Formulierung keine geeignete Dosisanpassung ermöglicht.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Auf Grund der Pharmakokinetik, Pharmakodynamik und des Verträglichkeitsprofils von Cetirizin sind keine Wechselwirkungen mit diesem Antihistaminikum zu erwarten. Tatsächlich wurden weder pharmakodynamische noch signifikante pharmakokinetische Wechselwirkungen in durchgeführten Interaktionsstudien berichtet, insbesondere nicht mit Pseudoephedrin und Theophyllin (400 mg/Tag).
Die gleichzeitige Einnahme von 20 mg Cetirizindihydrochlorid und 400 mg Cimetidin hat keinen Einfluss auf die Hautreaktion, ausgelöst durch eine Histamininjektion, verglichen mit der Einnahme von Cetirizindihydrochlorid allein. Auch wurde die Cetirizin-Plasmakonzentration durch gleichzeitige Cimetidin Einnahme nicht beeinflusst.
Untersuchungen an Probanden, die 5 mg Diazepam und 10 mg Cetirizindihydrochlorid gleichzeitig einnahmen, brachten bei 15 von 16 Messgrößen keinen Hinweis auf eine Wechselwirkung zwischen Cetirizindihydrochlorid und Diazepam im Hinblick auf die physiologischen Funktionen.
Das Ausmaß der Resorption von Cetirizin wird durch Nahrungsaufnahme nicht vermindert, obwohl die Resorptionsgeschwindigkeit herabgesetzt ist.
Auch wenn Untersuchungen zeigen, dass die Wirkung von Alkohol (Blutalkoholgehalt von 0,8 Promille) nicht verstärkt wird, sollten Cetirizin Aristo® nicht zusammen mit Alkohol eingenommen werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen nur sehr begrenzte klinische Daten zur Anwendung von Cetirizin bei Schwangeren vor. Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Wirkungen auf die Schwangerschaft, embryonale/fetale Entwicklung, Entbindung oder postnatale Entwicklung schließen. Die Anwendung von Cetirizin Aristo® in der Schwangerschaft sollte vorsichtshalber vermieden werden.
Stillzeit
Cetirizin geht in die Muttermilch über. In Abhängigkeit vom Zeitpunkt der Probennahme bzw. vom Zeitpunkt nach der Verabreichung entspricht die Konzentration in der Muttermilch 25 bis 90 % der im Plasma gemessenen Konzentration. Daher darf Cetirizin Aristo® von stillenden Müttern nicht eingenommen werden.
Fertilität
Die Fertilität männlicher und weiblicher Mäuse war bei einer Dosierung oberhalb von 16 mg/kg Körpergewicht (entspricht dem 120-fachen der therapeutischen Dosis) geringfügig beeinträchtigt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Objektive Messungen der Fahrtüchtigkeit, Schlaflatenz und Leistung am Fließband haben bei der empfohlenen Dosis von 10 mg Cetirizin keine klinisch relevanten Wirkungen gezeigt.
Daher sollten Patienten, die Autofahren wollen, potentiell gefährliche Arbeiten durchführen
oder Maschinen bedienen, die empfohlene Dosis nicht überschreiten und die individuelle Reaktion auf das
Arzneimittel abwarten.
Bei empfindlichen Patienten kann die gleichzeitige Einnahme mit Alkohol oder zentral dämpfenden Mitteln zu einer zusätzlichen Reduktion der Aufmerksamkeit und einer Leistungsbeeinträchtigung führen.
4.8 Nebenwirkungen
In klinischen Studien wurde gezeigt, dass Cetirizin in der empfohlenen Dosis nur geringe Nebenwirkungen auf das zentrale Nervensystem hat, einschließlich Schläfrigkeit, Fatigue, Schwindel und Kopfschmerzen. In einigen Fällen wurde eine paradoxe Stimulierung des zentralen Nervensystems beobachtet.
Obwohl Cetirizin ein selektiver peripherer H1-Rezeptorantagonist und relativ frei von anticholinergen Wirkungen ist, wurden Einzelfälle von Miktionsbeschwerden, Akkommodationsstörungen der Augen und Mundtrockenheit gemeldet.
Es wurden Fälle von abnormer Leberfunktion mit erhöhten Leberenzymen sowie erhöhten Bilirubinwerten berichtet. In den meisten Fällen kam es nach Beendigung der Cetirizindihydrochlorid-Behandlung zu einem spontanen Rückgang dieser Erscheinungen.
Klinische Studien
Sicherheitsdaten liegen für mehr als 3200 Probanden vor, bei denen Cetirizin angewendet wurde und die an doppelblinden kontrollierten klinischen Studien zum Vergleich von Cetirizin mit Placebo oder anderen Antihistaminika in der empfohlenen Dosis (10 mg Cetirizin täglich) teilnahmen. Bei Zusammenfassung dieser Daten wurden in den placebo-kontrollierten Studien die folgende Inzidenz von Nebenwirkungen für Cetirizin 10 mg mit einer Häufigkeit von 1,0 % oder mehr berichtet:
|
Nebenwirkung (WHO-ART) |
Cetirizin 10 mg (n = 3260) |
Placebo (n = 3061) |
|
Körper als Ganzes - allgemeine Störungen Müdigkeit |
1,63 % |
0,95 % |
|
Erkrankungen des zentralen und peripheren Nervensystems Schwindel |
1,10 % |
0,98 % |
|
Kopfschmerzen |
7,42 % |
8,07 % |
|
Erkrankungen des Gastrointestinaltraktes Abdominalschmerzen |
0,98 % |
1,08 % |
|
Mundtrockenheit |
2,09 % |
0,82 % |
|
Übelkeit |
1,07 % |
1,14 % |
|
Psychische Erkrankungen Schläfrigkeit |
9,63 % |
5,00 % |
|
Erkrankungen der Atemwege Pharyngitis |
1,29 % |
1,34 % |
Obwohl statistisch mit größerer Häufigkeit als unter Placebo aufgetreten, war Schläfrigkeit in den meisten Fällen leicht bis mittelschwer ausgeprägt. Wie auch in anderen Studien haben objektive Untersuchungen nachgewiesen, dass mit der empfohlenen Tagesdosis bei gesunden jungen Probanden die normalen Alltagstätigkeiten unbeeinträchtigt bleiben.
Unerwünschte Arzneimittelreaktionen mit Häufigkeiten von 1 % oder mehr bei Kindern im Alter von 6 Monaten bis 12 Jahren in placebo-kontrollierten klinischen Studien waren:
|
Nebenwirkung (WHO-ART) |
Cetirizin (n =1656) |
Placebo (n =1294) |
|
Erkrankungen des Gastrointestinaltraktes Diarrhöe |
1,0 % |
0,6 % |
|
Psychiatrische Erkrankungen Schläfrigkeit |
1,8 % |
1,4 % |
|
Erkrankungen der Atemwege Rhinitis |
1,4 % |
1,1 % |
|
Körper als Ganzes - allgemeine Störungen Müdigkeit |
1,0 % |
0,3 % |
Erfahrungen seit Markteinführung
Neben den Nebenwirkungen, die im Rahmen klinischer Studien gemeldet wurden und oben aufgeführt sind, wurde über folgende Nebenwirkungen seit Markteinführung berichtet.
Die Nebenwirkungen, die seit Markteinführung berichtet wurden, sind nach Organklassen (MedDRA-System) und Häufigkeiten geordnet aufgeführt.
Die Häufigkeitsangaben werden wie folgt definiert: Sehr häufig: (>1/10); häufig: (>1/100 bis <1/10); gelegentlich: (>1/1.000 bis <1/100); selten: (>1/10.000 bis <1/1.000); sehr selten: (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Erkrankungen des Blutes und des Lymphsystems:
Sehr selten: Thrombozytopenie
Erkrankungen des Immunsystems:
Selten: Überempfindlichkeit Sehr selten: anaphylaktischer Schock
Psychiatrische Erkrankungen: Gelegentlich: Agitiertheit
Selten: Aggression, Verwirrtheit, Depression, Halluzinationen, Schlaflosigkeit Sehr selten: Tics
Erkrankungen des Nervensystems:
Gelegentlich: Parästhesie Selten: Konvulsionen
Sehr selten: Dysgeusie, Synkope, Tremor, Dystonie, Dyskinesie Nicht bekannt: Amnesie, Gedächtnisstörungen
Augenerkrankungen:
Sehr selten: Akkommodationsstörungen, verschwommenes Sehen, Okulogyration
Herzerkrankungen:
Selten: Tachykardie
Erkrankungen des Gastrointestinaltraktes:
Häufig: Diarrhöe
Leber- und Gallenerkrankungen:
Selten: auffällige Leberfunktion (Hepatitis, erhöhte Werte für Transaminasen, alkalische Phosphatase, y-GT und Bilirubin)
Erkrankungen der Haut und des Unterhautzellgewebes:
Gelegentlich: Pruritus, Ausschlag Selten: Urtikaria
Sehr selten: Quincke-Ödem, fixes Arzneimittelexanthem
Erkrankungen der Nieren und Harnwege:
Sehr selten: Dysurie, Enuresis
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Gelegentlich: Asthenie, Unwohlsein Selten: Ödeme
Untersuchungen:
Selten: Gewichtszunahme
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger- Allee 3, D-53175 Bonn, Website: www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Symptome
Die Symptome, die nach einer Cetirizin-Überdosierung beobachtet wurden, stehen meist in Zusammenhang mit ZNS-Wirkungen oder Wirkungen, die auf einen anticholinergen Effekt deuten könnten.
Nach Einnahme von mindestens dem Fünffachen der empfohlenen Tagesdosis wurden als Nebenwirkungen gemeldet: Verwirrtheit, Diarrhöe, Schwindel, Müdigkeit, Kopfschmerzen, Unwohlsein, Mydriasis, Pruritus, Ruhelosigkeit, Sedierung, Schläfrigkeit, Stupor, Tachykardie, Tremor und Harnretention.
Behandlung
Es gibt kein bekanntes spezifisches Antidot gegen Cetirizin.
Bei einer Überdosierung wird eine symptomatische oder unterstützende Behandlung empfohlen. Kurze Zeit nach Auftreten einer Überdosierung kann auch eine Magenspülung erwogen werden.
Cetirizin wird durch eine Dialyse nur unvollständig entfernt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiallergikum ATC-Code: R06AE07
Cetirizindihydrochlorid, der Wirkstoff von Cetirizin Aristo®, ist ein Antiallergikum mit ausgeprägter und selektiver antihistaminischer (H1 blockierender) Aktivität.
Cetirizindihydrochlorid verhindert das Auftreten oder die Auswirkungen von Mediatoren allergischer Reaktionen (Prostaglandin D2 und Histamin) und hat bei atopischen Patienten einen antagonistischen Effekt auf die Migration der Eosinophilen. Die selektive Wirkung auf die ^-Rezeptoren ist langanhaltend.
Die periphere antiallergische Aktivität von Cetirizindihydrochlorid wurde durch folgende Untersuchungen demonstriert:
- Inhibition der endogenen Histaminfreisetzung nach Stimulation durch die Substanz 48/80 (Histaminliberator)
- weitgehende Verhinderung der kutanen allergischen Sofortreaktion nach Injektion von Pollen oder VIP (vasoaktives intestinales Polypeptid)
- Unterdrückung der ödematösen Hautreaktion durch die Substanz P (Neuropeptid) während der allergischen Reaktion sowie der nasalen allergischen Sofortreaktion durch Instillation eines Allergens
- signifikante Wirkung auf die pseudo-allergische Reaktion durch Protein A (Staphylokokkenprotein) in der Haut
- Das Verhältnis zwischen der kutanen Anti-H1-Wirkung und der Besetzung der cerebralen H1-Rezeptoren - die als bedeutsam für die Auslösung zentraler Wirkungen angesehen werden - ist bei Cetirizindihydrochlorid besonders günstig.
5.2 Pharmakokinetische Eigenschaften
Cetirizindihydrochlorid wird nach oraler Gabe schnell und gut resorbiert. Maximale Plasmaspiegel sind bereits nach 40-60 Minuten nachweisbar. Die Ausscheidung erfolgt zu 70 % über die Nieren, hauptsächlich in unveränderter Form.
Bei Niereninsuffizienz kommt es zu einer langsameren Ausscheidung des Wirkstoffs.
Bioverfügbarkeit
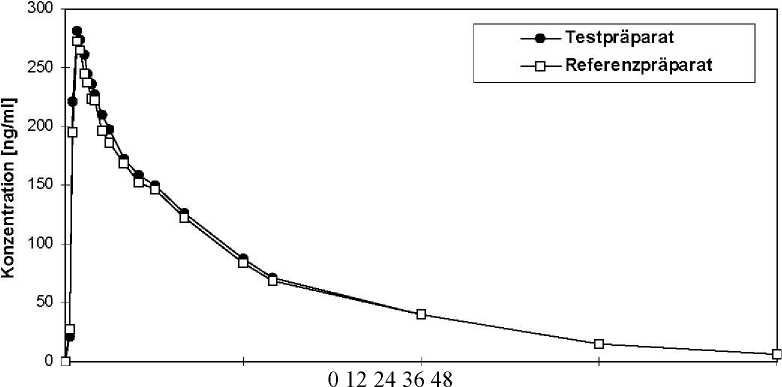
Eine im Jahr 1999 durchgeführte vergleichende Bioverfügbarkeitsuntersuchung (offen, cross-over, randomisiert) an 29 gesunden männlichen Probanden (18-44 Jahre) ergab nach Einmalgabe im Vergleich zum Referenzpräparat:
Testpräparat Referenzpräparat cmax [ng/ml] 323,03 ± 58,25 303,20 ± 40,03 maximale Plasmakonzentration tmax [h] 0,91 ± 0,39 0,98 ± 0,37
Zeitpunkt der maximalen Plasmakonzentration AUC0-® [ng/ml*h] 3095,23 ± 711,11 3005,83 ± 585,80 Fläche unter der Konzentrations-Zeit-Kurve
Angabe der Werte als Mittelwerte und Streubreite (Standardabweichung)
Mittlere Plasmaspiegelverläufe von Cetirizin im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
Zeit [h]
5.3 Präklinische Daten zur Sicherheit
Chronische Toxizität
Untersuchungen zur chronischen Toxizität bei verschiedenen Tierspezies haben für den Menschen keine relevanten Risiken ergeben.
Mutagenität
Das mutagene Potential von Cetirizindihydrochlorid wurde mit mehreren Methoden in vitro und in vivo untersucht. Bei allen Untersuchungen führte Cetirizindihydrochlorid nicht zu einer signifikanten Zunahme der Mutation.
Kanzerogenität
Langzeitstudien an Ratten und Mäusen ergaben keinen für den Menschen relevanten Hinweis auf ein tumorerzeugendes Potential von Cetirizin.
Reproduktionstoxizität
Die Fertilität männlicher und weiblicher Mäuse war bei einer Dosierung oberhalb von 16 mg/kg Körpergewicht (entspricht dem 120-fachen der therapeutischen Dosis) geringfügig beeinträchtigt. Embryotoxizitätsstudien an drei Tierspezies (Ratte, Maus, Kaninchen) und peri-postnatale Untersuchungen an Mäusen ergaben keine Hinweise auf ein teratogenes Potential, embryotoxische Wirkungen oder Störungen der Fetal-und Postnatalentwicklung unterhalb des maternaltoxischen Dosisbereichs.
Cetirizin durchdringt die Plazenta. Bei Ratten- und Kaninchenfeten wurden niedrigere Konzentrationen als im mütterlichen Plasma gemessen. Ein geringer Übergang in die Muttermilch wurde beim Hund nachgewiesen (Konzentrationsverhältnis Milch:
Plasma = 0,34; ca. 3 % der Dosis werden über die Milch ausgeschieden).
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat Macrogol 4000 Mikrokristalline Cellulose
Hypromellose
Hochdisperses Siliciumdioxid Magnesiumstearat (Ph.Eur.)
Farbstoff :Titandioxid (E 171)
6.2 Inkompatibilitäten
Inkompatibilitäten sind bisher nicht bekannt.
6.3 Dauer der Haltbarkeit
3 Jahre
Das Arzneimittel soll nach Ablauf des auf der Packung angegebenen Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses PV C/Aluminium-Blister
Originalpackungen mit 7, 10, 20 (N1), 30; 50 (N2); 100 (N3) Filmtabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. Inhaber der Zulassung
Aristo Pharma GmbH Wallenroder Str. 8-10 13435 Berlin
Tel.: + 49 30 - 71094 - 4200 Fax: + 49 30 - 71094 - 4250
8. Zulassungsnummer
53327.00.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
Darum der Erteilung der Zulassung: 02. Juli 2002 Datum der letzten Verlängerung der Zulassung: 29.05.2008
10. Stand der Information
Februar 2014
11. Verkaufsabgrenzung
Apothekenpflichtig
10