Cetirizin Zentiva 10 Mg Filmtabletten
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Cetirizin Zentiva® 10 mg Filmtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Filmtablette enthält 10 mg Cetirizindihydrochlorid.
Sonstiger Bestandteil: 1 Filmtablette enthält 73,4 mg Lactose-Monohydrat.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtablette.
Aussehen der Filmtabletten: Weiße bis cremefarbene, längliche Filmtablette mit Bruchkerbe auf der einen Seite. Die Tablette kann in gleiche Dosen geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Bei Erwachsenen und Kindern ab sechs Jahren:
- zur Linderung von nasalen und okularen Symptomen bei saisonaler und perennialer allergischer Rhinitis,
- zur Linderung von Symtomen bei chronischer idiopathischer Urtikaria.
4.2 Dosierung und Art der Anwendung
Kinder von sechs bis zwölf Jahren: 5 mg zweimal täglich (*A Tablette zweimal täglich).
Erwachsene und Jugendliche ab zwölf Jahren: 10 mg einmal täglich (1 Tablette).
Die Tabletten sollten unzerkaut mit einem Glas Flüssigkeit eingenommen werden.
Ältere Menschen: Die Daten deuten nicht daraufhin, dass die Dosis bei älteren Menschen - soweit die Nierenfunktion unauffällig ist - reduziert werden muss.
Patienten mit mittelschwerer bis schwerer Niereninsuffizienz: Daten, die das Wirksamkeits-/Sicherheitsverhältnis belegen, liegen für Patienten mit Niereninsuffizienz nicht vor. Da Cetirizin hauptsächlich über die Niere ausgeschieden wird (siehe Abschnitt 5.2), muss in Fällen, in denen keine alternative Behandlung angewendet werden kann, das Dosisintervall individuell der Nierenfunktion entsprechend angepasst werden. Die Dosisanpassung sollte gemäß der folgenden Tabelle vorgenommen werden. Bei der Anwendung dieser Tabelle zur Dosisanpassung muss der Wert der Kreatinin-Clearance (CLKR) des Patienten in ml/min abgeschätzt werden. Die CLKR in ml/min kann aus der Serumkreatininkonzentration (mg/dl) nach folgender Formel bestimmt werden:
CLKR
1140 - Alter (Jahre)! x Gewicht (kg) 72 x Serumkreatinin (mg/dl)
(x 0,85 bei Frauen)
Dosisanpassung bei Patienten mit eingeschränkter Nierenfunktion:
|
Gruppe |
Kreatinin-Clearance (ml/min) |
Dosis und Einnahmehäufigkeit |
|
normal |
> 80 |
10 mg einmal täglich |
|
leicht |
50-79 |
10 mg einmal täglich |
|
mäßig |
30-49 |
5 mg einmal täglich |
|
schwer |
< 30 |
5 mg einmal alle zwei Tage |
|
terminale Niereninsuffizienz dialysepflichtige Patienten |
< 10 |
kontraindiziert |
Bei Kindern mit eingeschränkter Nierenfunktion muss die Dosis unter Berücksichtung der renalen Clearance, des Alters und des Körpergewichts individuell an den Patienten angepasst werden.
Patienten mit eingeschränkter Leberfunktion: Bei Patienten mit ausschließlich eingeschränkter Leberfunktion ist keine Dosisanpassung erforderlich.
Patienten mit gleichzeitig eingeschränkter Leber- und Nierenfunktion: Eine Anpassung der Dosierung wird empfohlen (siehe zuvor bei Patienten mit mittelschwerer bis schwerer Niereninsuffizienz).
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff, einen der in Abschnitt 6.1 genannten sonstigen Bestandteile, Hydroxyzin oder andere Piperazin-Derivate.
Patienten mit schwerer Niereninsuffizienz mit einer Kreatinin-Clearance unter 10 ml/min.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei therapeutischen Dosierungen wurden im Zusammenhang mit Alkohol (bei einem Alkoholblutspiegel von 0,5 g/l) keine klinisch signifikanten Wechselwirkungen festgestellt. Dennoch ist bei gleichzeitiger Einnahme mit Alkohol Vorsicht geboten.
Vorsicht ist geboten bei Patienten mit einer Prädisposition für Harnverhalt (z. B. Läsion des Rückenmarks, Prostatahyperplasie), da Cetirizin das Risiko eines Harnverhaltes erhöhen kann.
Vorsicht ist bei Patienten mit Epilepsie und bei Patienten mit Krampfneigung angezeigt.
Antihistaminika wirken hemmend auf Allergietests der Haut. Daher ist vor Durchführung eines Allergietests eine dreitägige Auswaschphase erforderlich.
Kinder und Jugendliche
Die Anwendung der Filmtabletten ist bei Kindern unter sechs Jahren nicht empfohlen, da diese Formulierung keine geeignete Dosisanpassung ermöglicht.
Cetirizin Zentiva 10 mg Filmtabletten enthalten Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Cetirizin Zentiva 10 mg Filmtabletten nicht einnehmen.
4.5. Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Auf Grund der Pharmakokinetik, Pharmakodynamik und des Verträglichkeitsprofils von Cetirizin sind keine Wechselwirkungen mit diesem Antihistaminikum zu erwarten. Tatsächlich wurden weder pharmakodynamische noch signifikante pharmakokinetische Wechselwirkungen in durchgeführten Interaktionsstudien berichtet, insbesondere nicht mit Pseudoephedrin und Theophyllin (400 mg/Tag).
Das Ausmaß der Resorption von Cetirizin wird durch Nahrungsaufnahme nicht vermindert, obwohl die Resorptionsgeschwindigkeit herabgesetzt ist.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen nur sehr begrenzte klinische Daten zur Anwendung von Cetirizin bei Schwangeren vor. Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Wirkungen auf die Schwangerschaft, embryonale/fetale Entwicklung, Entbindung oder postnatale Entwicklung schließen. Bei der Anwendung in der Schwangerschaft ist Vorsicht geboten.
Stillzeit
Cetirizin wird in die Muttermilch ausgeschieden und erreicht dort Konzentrationen, die 25-90 % der mütterlichen Plasmakonzentration entsprechen, abhängig vom Zeitpunkt der Probennahme nach Anwendung des Präparates. Aus diesem Grund sollte Cetirizin Zentiva 10 mg Filmtabletten nur mit Vorsicht für stillende Frauen verschrieben werden.
Fertilität
Keine Daten verfügbar.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Objektive Messungen der Fahrtüchtigkeit, Schlaflatenz und Leistung am Fließband haben bei der empfohlenen Dosis von 10 mg Cetirizin keine klinisch relevanten Wirkungen gezeigt.
Daher sollten Patienten, die Autofahren wollen, ohne sicheren Halt arbeiten oder Maschinen bedienen, die empfohlene Dosis nicht überschreiten und die individuelle Reaktion auf das Arzneimittel abwarten. Bei empfindlichen Patienten kann die gleichzeitige Einnahme mit Alkohol oder zentral dämpfenden Mitteln zu einer zusätzlichen Reduktion der Aufmerksamkeit und einer Leistungsbeeinträchtigung führen.
4.8 Nebenwirkungen
In klinischen Studien wurde gezeigt, dass Cetirizin in der empfohlenen Dosis nur geringe Nebenwirkungen auf das zentrale Nervensystem hat, einschließlich Schläfrigkeit, Müdigkeit, Schwindel und Kopfschmerzen. In einigen Fällen wurde eine paradoxe Stimulierung des zentralen Nervensystems beobachtet.
Obwohl Cetirizin ein selektiver peripherer Hj-Rezeptorantagonist und relativ frei von anticholinergen Wirkungen ist, wurden Einzelfälle von Miktionsbeschwerden, Akkommodationsstörungen der Augen und Mundtrockenheit gemeldet.
Es wurden Fälle von abnormer Leberfunktion mit erhöhten Leberenzymen sowie erhöhten Bilirubinwerten berichtet. In den meisten Fällen kam es nach Beendigung der Cetirizindihydrochlorid-Behandlung zu einem spontanen Rückgang dieser Erscheinungen.
a) Klinische Studien
Sicherheitsdaten liegen für mehr als 3.200 Probanden vor, bei denen Cetirizin angewendet wurde und die an doppelblinden, kontrollierten klinischen Studien zum Vergleich von Cetirizin mit Placebo oder anderen Antihistaminika in der empfohlenen Dosis (10 mg Cetirizin täglich) teilnahmen.
Bei Zusammenfassung dieser Daten wurde in den placebokontrollierten Studien die folgende Inzidenz von Nebenwirkungen für Cetirizin 10 mg mit einer Häufigkeit von 1,0 % oder mehr berichtet:
|
Nebenwirkung (WHO-ART) |
Cetirizin 10 mg (n = 3.260) |
Placebo (n = 3.061) |
|
Körper als Ganzes - allgemeine Störungen |
1,63 % |
0,95 % |
|
Müdigkeit | ||
|
Erkrankungen des zentralen und peripheren Nervensystems Schwindel |
1,10 % |
0,98 % |
|
Kopfschmerzen |
7,42 % |
8,07 % |
|
Erkrankungen des Gastrointestinaltraktes Abdominal schmerzen |
0,98 % |
1,08 % |
|
Mundtrockenheit |
2,09 % |
0,82 % |
|
Übelkeit |
1,07 % |
1,14 % |
|
Psychiatrische Erkrankungen Schläfrigkeit |
9,63 % |
5,00 % |
|
Erkrankungen der Atemwege Pharyngitis |
1,29 % |
1,34 % |
Obwohl statistisch mit größerer Häufigkeit als unter Placebo aufgetreten, war Schläfrigkeit in den meisten Fällen leicht bis mittelschwer ausgeprägt. Wie auch in anderen Studien haben objektive Untersuchungen nachgewiesen, dass mit der empfohlenen Tagesdosis bei gesunden, jungen Probanden die normalen Alltagstätigkeiten unbeeinträchtigt bleiben.
Unerwünschte Arzneimittelreaktionen mit Häufigkeiten von 1 % oder mehr bei Kindern im Alter von sechs Monaten bis zwölf Jahren in placebokontrollierten, klinischen Studien waren:
|
Nebenwirkung (WHO-ART) |
Cetirizin (n = 1.656) |
Placebo (n = 1.294) |
|
Erkrankungen des Gastrointestinaltraktes Diarrhö |
1,0 % |
0,6 % |
|
Psychiatrische Erkrankungen Schläfrigkeit |
1,8 % |
1, 4 % |
|
Erkrankungen der Atemwege Rhinitis |
1,4 % |
1,1 % |
|
Körper als Ganzes - allgemeine Störungen Müdigkeit |
1,0 % |
0,3 % |
b) Erfahrungen seit der Markteinführung
Neben den Nebenwirkungen, die im Rahmen klinischer Studien gemeldet wurden und oben aufgeführt sind, wurde über folgende Nebenwirkungen seit Markteinführung berichtet. Die Nebenwirkungen werden gemäß der MedDRA nach dem Organklassensystem beschrieben, und die Häufigkeit wird auf Grund der Erfahrungen nach der Markteinführung ermittelt.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zu Grunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Blutes und des Lymphsystems Sehr selten: Thrombozytopenie.
Erkrankungen des Immunsystems Selten: Überempfindlichkeit.
Sehr selten: anaphylaktischer Schock.
Stoffwechsel- und Ernährungsstörungen Häufigkeit nicht bekannt: gesteigerter Appetit.
Psychiatrische Erkrankungen Gelegentlich: Agitiertheit.
Selten: Aggression, Verwirrtheit, Depression, Halluzinationen, Schlaflosigkeit.
Sehr selten: Tics.
Häufigkeit nicht bekannt: Suizidgedanken.
Erkrankungen des Nervensystems Gelegentlich: Parästhesie.
Selten: Konvulsionen.
Sehr selten: Dysgeusie, Synkope, Tremor, Dystonie, Dyskinesie.
Häufigkeit nicht bekannt: Amnesie, Gedächtnisstörungen.
Augenerkrankungen
Sehr selten: Akkommodationsstörungen, verschwommenes Sehen, Okulogyration.
Erkrankungen des Ohrs und des Labyrinths Häufigkeit nicht bekannt: Vertigo.
Herzerkrankungen Selten: Tachykardie.
Erkrankungen des Gastrointestinaltraktes Gelegentlich: Diarrhö.
Leber- und Gallenerkrankungen
Selten: auffällige Leberfunktion (erhöhte Werte für Transaminasen, alkalische Phosphatase, y-GT und Bilirubin).
Erkrankungen der Haut und des Unterhautzellgewebes Gelegentlich: Pruritus, Ausschlag.
Selten: Urtikaria.
Sehr selten: Quincke-Ödem, fixes Arzneimittelexanthem.
Erkrankungen der Nieren und Harnwege Sehr selten: Dysurie, Enuresis.
Häufigkeit nicht bekannt: Harnverhalt.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Gelegentlich: Asthenie, Unwohlsein.
Selten: Ödeme.
Untersuchungen Selten: Gewichtszunahme.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
a) Symptome
Die Symptome, die nach einer Cetirizin-Überdosierung beobachtet wurden, stehen meist in Zusammenhang mit ZNS-Wirkungen oder Wirkungen, die auf einen anticholinergen Effekt deuten könnten.
Nach Einnahme von mindestens dem Fünffachen der empfohlenen Tagesdosis wurden als Nebenwirkungen gemeldet: Verwirrtheit, Diarrhö, Schwindel, Müdigkeit, Kopfschmerzen, Unwohlsein, Mydriasis, Pruritus, Ruhelosigkeit, Sedierung, Schläfrigkeit, Stupor, Tachykardie, Tremor und Harnretention.
b) Behandlung
Es gibt kein bekanntes spezifisches Antidot gegen Cetirizin.
Bei einer Überdosierung wird eine symptomatische oder unterstützende Behandlung empfohlen. Kurze Zeit nach Auftreten einer Überdosierung kann auch eine Magenspülung erwogen werden. Cetirizin wird durch eine Dialyse nur unvollständig entfernt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Piperazin-Derivate, Cetirizin,
ATC-Code: R06A E07.
Cetirizin, beim Menschen ein Metabolit von Hydroxyzin, ist ein wirksamer und selektiv peripherer H1-Rezeptorantagonist. /«-v/Yro-Rezeptorbindungsstudien haben keine messbare Affinität zu anderen als den H1-Rezeptoren ergeben.
Zusätzlich zu seinen antihistaminischen Wirkungen wurden für Cetirizin antiallergische Aktivitäten beobachtet: Eine Dosis von 10 mg, ein- oder zweimal täglich, hemmt die späte Rekrutierungphase von Eosinophilen in der Haut und Bindehaut von atopischen Personen nach Allergenexposition.
In Studien an gesunden Probanden wurde gezeigt, dass Cetirizin in Dosierungen von 5 und 10 mg die Quaddel- und Erythembildung stark hemmt, die durch sehr hohe in die Haut eingebrachte Konzentrationen von Histamin provoziert wurde. Ein Zusammenhang zur Wirksamkeit konnte jedoch nicht hergestellt werden.
In einer 35-tägigen Studie an Kindern im Alter von fünf bis zwölf Jahren wurde keine Gewöhnung an die antihistaminische Wirkung (Unterdrückung der Quaddel- und Erythembildung) von Cetirizin festgestellt. Wenn eine Behandlung mit Cetirizin nach wiederholter Gabe abgesetzt wird, erlangt die Haut die normale Reaktivität gegenüber Histamin innerhalb von 3 Tagen zurück.
In einer sechswöchigen placebokontrollierten Studie an 186 Patienten mit allergischer Rhinitis und gleichzeitig leichtem bis mittelschwerem Asthma führten 10 mg Cetirizin einmal täglich zu einer Verbesserung der Rhinitissymptome ohne eine Veränderung der Lungenfunktion. Diese Studie unterstützt die Sicherheit der Anwendung von Cetirizin bei allergischen Patienten mit leichtem bis mittelschwerem Asthma.
In einer placebokontrollierten Studie wurde Cetirizin in der hohen Tagsdosis von 60 mg über sieben Tage verabreicht und löste keine statistisch signifikante Verlängerung des QT-Intervalls aus.
In der empfohlenen Dosis bessert Cetirizin nachweislich die Lebensqualität von Patienten mit perennialer und saisonaler allergischer Rhinitis.
5.2 Pharmakokinetische Eigenschaften
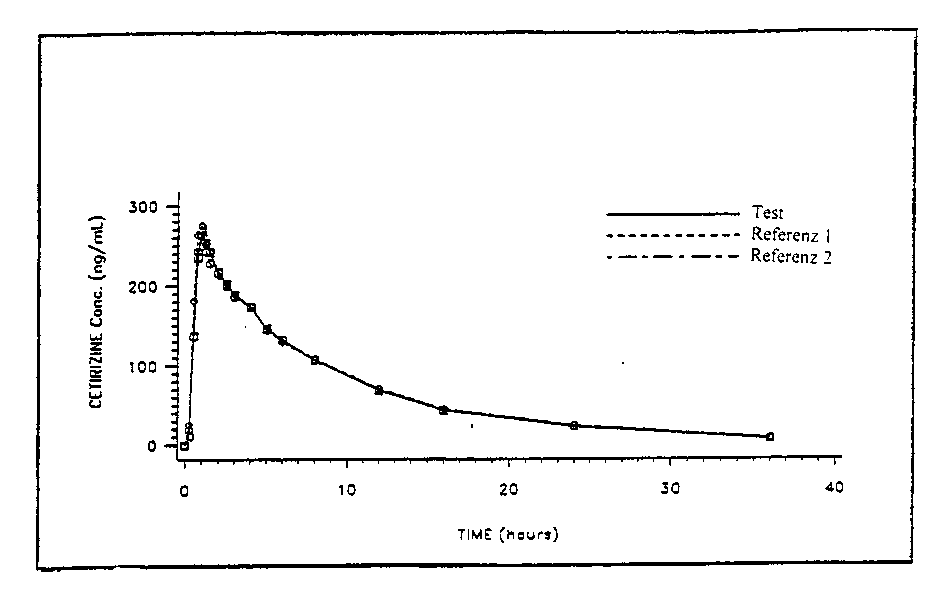
Die maximalen Plasmakonzentrationen im Steady State betragen etwa 300 ng/ml und werden innerhalb von 1,0 ± 0,5 Stunde erreicht. Bei Dosen von 10 mg täglich über zehn Tage wurde keine Anreichung von Cetirizin beobachtet. Die Verteilung der pharmakokinetischen Parameter wie die maximale Plasmakonzentration (Cmax) und die Fläche unter der Kurve (AUC) ist bei menschlichen Probanden unimodal.
Das Ausmaß der Resorption von Cetirizin wird durch Nahrung nicht verringert, obwohl die Resorptionsgeschwindigkeit niedriger ist.
Die Bioverfügbarkeit von Cetirizin als Lösung, Kapsel oder Tablette ist vergleichbar.
Das scheinbare Verteilungsvolumen beträgt 0,50 l/kg. Die Plasmaproteinbindung von Cetirizin beträgt 93 ± 0,3 %. Cetirizin verändert die Proteinbindung von Warfarin nicht.
Cetirizin unterliegt keinem ausgeprägten First-Pass-Effekt. Etwa zwei Drittel der Dosis werden unverändert mit dem Harn ausgeschieden. Die terminale Halbwertszeit beträgt in etwa 10 Stunden.
Cetirizin hat über den Bereich von 5 bis 60 mg eine lineare Kinetik.
Besondere Patientengruppen
Ältere Menschen: Nach einer oralen Einzelgabe von 10 mg Cetirizin an 16 ältere Patienten stieg die Halbwertszeit im Vergleich zu gesunden Probanden um etwa 50 % an und die Clearance nahm um 40 % ab. Die Abnahme der Cetirizin-Clearance bei diesen älteren Probanden stand anscheinend in Zusammenhang mit ihrer reduzierten Nierenfunktion.
Kinder, Säuglinge und Kleinkinder: Die Halbwertszeit von Cetirizin betrug bei Kindern von sechs bis zwölf Jahren etwa 6 Stunden und bei Kindern von zwei bis sechs Jahren 5 Stunden. Bei Säuglingen und Kleinkindern zwischen sechs und 24 Monaten ist sie auf 3,1 Stunden reduziert.
Patienten mit eingeschränkter Nierenfunktion: Die Pharmakokinetik der Substanz war bei Patienten mit leichter Beeinträchtigung (Kreatinin-Clearance größer als 40 ml/min) und gesunden Probanden vergleichbar. Bei Patienten mit mittelschwer eingeschränkter Nierenfunktion war im Vergleich zu gesunden Probanden die Halbwertszeit um das Dreifache erhöht und die Clearance um 70 % reduziert. Bei Hämodialyse-Patienten (Kreatinin-Clearance unter 7 ml/min) wurde nach einer oralen Einzelgabe von 10 mg Cetirizin im Vergleich zu gesunden Probanden eine dreifache Erhöhung der Halbwertszeit und eine 70%ige Reduzierung der Clearance beobachtet. Cetirizin war nur in geringem Ausmaß hämodialysierbar. Bei Patienten mit mittelschwer bis schwer eingeschränkter Nierenfunktion ist eine Dosisanpassung erforderlich (siehe Abschnitt 4.2).
Patienten mit eingeschränkter Leberfunktion: Bei Patienten mit chronischen Leberkrankheiten (hepatozellulärer, cholestatischer und biliärer Zirrhose) war nach einer Einzeldosis von 10 oder 20 mg Cetirizin im Vergleich zu gesunden Probanden die Halbwertszeit um 50 % verlängert, zusammen mit einer 40%igen Reduzierung der Clearance.
Eine Dosisanpassung ist bei eingeschränkter Leberfunktion nur bei gleichzeitiger Einschränkung der Nierenfunktion erforderlich.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Reproduktionstoxizität, Genotoxizität und zum kanzerogenen Potenzial lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
PHARMAZEUTISCHE ANGABEN
6.
6.1 Liste der sonstigen Bestandteile
Kem: Lactose-Monohydrat,
Maisstärke,
Povidon 30,
Magnesiumstearat (Ph. Eur.).
Filmüberzug: Hypromellose 2910/5 (E 464),
Macrogol 6000,
Talkum,
Titandioxid (E 171),
Simeticon-Emulsion SE 4 (bestehend aus gereinigtem Wasser, Simeticon, Methylcellulose, Sorbinsäure [Ph. Eur.]).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Packung: PVC/PVDC-Aluminium-Blisterpackung in einer Faltschachtel.
Packungsgrößen: 7, 20, 50 und 100 Tabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Zentiva Pharma GmbH 65927 Frankfurt am Main
Mitvertrieb
Winthrop Arzneimittel GmbH
65927 Frankfurt am Main Telefon: (01 80) 2 02 00 101
Telefax: (01 80) 2 02 00 111
8. ZULASSUNGSNUMMER
52530.00.00
DATUM DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
9.
10. Januar 2002
10. STAND DER INFORMATION
Februar 2014
11. VERKAUFSABGRENZUNG Apothekenpflichtig. 1
Mat.-Nr.: 330997 9
0,06 €/Anruf (dt. Festnetz); max. 0,42 €/min (Mobilfunk).