Cin 100Mg
Fachinformation
1. Bezeichnung des Arzneimittels
CIN 100 mg, magensaftresistente Weichkapseln CIN 300 mg, magensaftresistente Weichkapseln
2. Qualitative und quantitative Zusammensetzung
Wirkstoff:
CIN 100 mg:
Eine magensaftresistente Weichkapsel enthält 100 mg Cineol.
CIN 300 mg:
Eine magensaftresistente Weichkapsel enthält 300 mg Cineol.
Sonstige Bestandteile mit bekannter Wirkung: Sorbitol
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Magensaftresistente Weichkapseln
CIN 100 mg: Naturfarbene, ovale Weichgelatinekapseln.
CIN 300 mg: Naturfarbene, längliche Weichgelatinekapseln.
4. Klinische Angaben
4.1 Anwendungsgebiete
Unterstützendes Arzneimittel zur Schleimlösung bei Erkältungskrankheiten der oberen Atemwege
Zur Kurzzeitanwendung (max. eine Woche): Begleitende Behandlungsmaßnahme bei Erkältungskrankheiten der oberen Atemwege.
4.2 Dosierung und Art der Anwendung
Dosierung
Soweit nicht anders verordnet, nehmen Erwachsene und Kinder über 12 Jahren bis zum Abklingen der Beschwerden 3-4 x täglich 2 magensaftresistente Weichkapseln CIN 100 mg (entsprechend 600 - 800 mg Cineol) oder 3 x täglich 1 magensaftresistente Weichkapsel CIN 300 mg (entsprechend 900 mg Cineol) ein.
Kinder
CIN 100 mg und CIN 300 mg sind kontraindiziert bei Kindern unter 12 Jahren ( s. Abschnitt 4.3).
Art der Anwendung
CIN 100/300 mg soll unzerkaut mit reichlich nicht warmer Flüssigkeit (z.B. einem Glas Wasser) möglichst eine halbe Stunde vor dem Essen eingenommen werden.
Die Anwendung soll als Kurzzeitanwendung (max. 1 Woche) erfolgen.
4.3 Gegenanzeigen
CIN 100/300 mg darf nicht angewendet werden:
- bei bekannter Überempfindlichkeit gegen den Wirkstoff Cineol oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
- bei Kindern unter 12 Jahren, da keine ausreichenden Erfahrungen vorliegen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
CIN 100 mg und CIN 300 mg enthalten u.a. Sorbitol. Patienten mit der seltenen hereditären Fructose-Intoleranz sollten CIN 100/300 mg nicht einnehmen.
4.5. Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die hepatische Metabolisierung von Cineol erfolgt über das P450 Isoenzym CYP 3A4. Es kann daher nicht ausgeschlossen werden, dass andere Arzneimittel die Metabolisierung von Cineol schwächen oder beschleunigen.
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
Aufgrund von Untersuchungen bestehen gegen den Einsatz von CIN 100/300 mg während der Schwangerschaft keine Bedenken. Aus allgemeinen Sicherheitserwägungen sollte die Anwendung von CIN 100/300 mg im ersten Schwangerschaftsdrittel unterbleiben.
Stillzeit
Aufgrund von Untersuchungen bestehen gegen den Einsatz von CIN 100/300 mg während der Stillzeit keine Bedenken. Aufgrund der lipophilen Eigenschaften des Wirkstoffs Cineol ist anzunehmen, dass er auch in der Muttermilch in geringen Konzentrationen vorliegt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig
Gelegentlich
Selten
Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(<1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Gastrointestinaltrakts:
Gelegentlich: Magen-Darmbeschwerden (Übelkeit, Durchfall) Selten:Schluckbeschwerden
Erkrankungen des Immunsystems:
Selten: Überempfindlichkeitsreaktionen (Gesichtsödem, Juckreiz, Atemnot, Husten)
Bei den ersten Anzeichen einer Überempfindlichkeitsreaktion darf CIN 100/300 mg nicht nochmals eingenommen werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
a) Symptome einer Überdosierung
Speziell zu Cineol liegen keine Erkenntnisse vor.
Vergiftungen mit hohen Dosen Eukalyptusöl undefinierten Reinheitsgrades (mittlere tödliche Dosis bei oraler Anwendung 20 g) führten zu zentralnervösen Störungen wie Trübung des Bewusstseins, Müdigkeit, Schwäche der Extremitäten, Miosis und in schweren Fällen zu Koma und Atemstörungen.
b) Therapiemaßnahmen bei Überdosierung:
Wegen der raschen Ausscheidung der Substanz ist mit schnellem Abklingen der Symptome und Restitutio ad integrum zu rechnen.
Die weiteren Möglichkeiten zur Behandlung einer Vergiftung mit CIN 100/300 mg richten sich nach dem Ausmaß und Verlauf sowie den Krankheitszeichen.
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Expektorantien ATC-Code: R05CA25
Cineol ist der Hauptbestandteil des Eukalyptusöls.
Tierexperimentell wurde für Cineol im Bereich therapeutisch eventuell noch erreichbarer Konzentrationen eine Stimulation der Bronchialsekretion gezeigt. Im Bereich therapeutischer Dosierungen wird die mucociliare Clearance um ca. 10 % gesteigert. Die therapeutische Relevanz dieser Befunde ist nicht erwiesen.
Aus den vorliegenden Studien ergibt sich, dass die Medikation mit Cineol als subjektiv angenehm empfunden werden kann. Eine therapeutische Wirksamkeit im Sinne einer objektivierbaren Verbesserung des Krankheitszustandes ist nicht belegt.
5.2 Pharmakokinetische Eigenschaften
Metabolisierung
Zum Metabolismus von Cineol liegen tierexperimentelle, in vitro- und in vivo-Studien vor. Die Metabolisierung erfolgt über das Cytochrom P450 Isoenzym CYP 3A4 zu 2a-Hydroxy-1,8-Cineol und 3a-Hydroxy-1,8-Cineol.
Resorption
Nach enteraler Resorption erfolgt die Ausscheidung zum Teil über die Lungen, der überwiegende Teil wird renal ausgeschieden.
Bei oraler Applikation werden ca. 10 % der Dosis resorbiert.
Bioverfügbarkeit
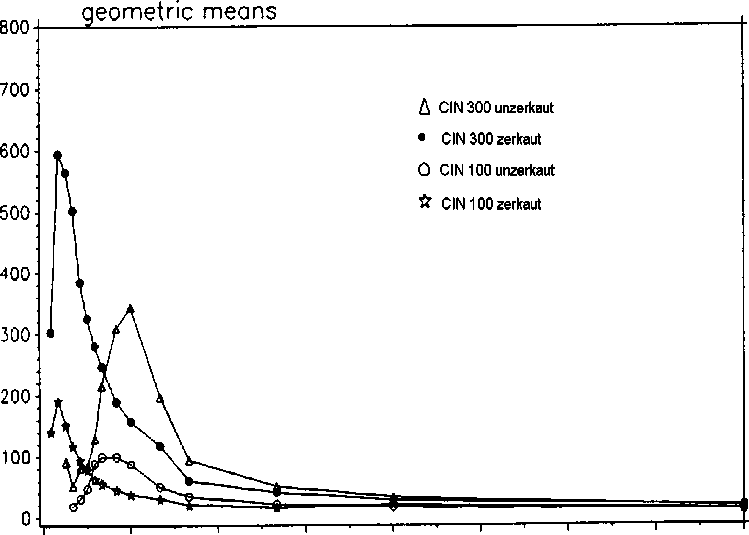
Eine im Jahr 1994 durchgeführte Bioverfügbarkeitsuntersuchung an 20 Probanden ergab im Vergleich zum Referenzpräparat:
|
CIN 100 (unzerkaut) |
Referenzpräparat 100 mg (zerkaut) |
CIN 300 (unzerkaut) |
Referenzpräparat 300 mg (zerkaut) | |
|
maximale Plasmakonzentration (Cmax) ng /ml: |
153,74 ± 1,89 |
245,24 ± 1,83 |
438,48 ± 1,48 |
733,62 ± 1,99 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) h: |
2,441 ± 1,466 |
0,489 ± 1,493 |
2,680 ± 1,232 |
0,578 ± 1,519 |
|
Fläche unter der Konzentrations-ZeitKurve (AUC) ng x h / ml: |
483,38 ± 1,902 |
503,74 ± 1,743 |
1753,5 ± 1,544 |
1834,7 ± 1,870 |
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
Concentration (ng/mL)
0 3 6 9 12 15 18 21 24
Time (h)
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Die orale LD50 beträgt bei Ratten 2480 mg/kg Körpergewicht. Toxizitätszeichen
waren Depression der vitalen Funktionen und Koma, Spättodesfälle traten nicht auf.
In 4-Wochen-Toxizitätsstudien an Ratten und Mäusen mit oralen Dosen bis zu 1200 mg Cineol/kg Körpergewicht und Tag wurde keine spezifische kumulative Organtoxizität festgestellt.
Beim Menschen äußern sich akute Vergiftungen in zentralnervösen Störungen. In seltenen Fällen führt die Einatmung konzentrierter Dämpfe ätherischer Öle bei Säuglingen und Kleinkindern zum Atemstillstand vermutlich infolge Glottiskrampf.
Hierzu liegen im Zusammenhang mit Cineol bisher keine Hinweise vor.
b) Chronische Toxizität
Hierzu liegen keine ausreichenden Untersuchungen vor.
c) Mutagenes und tumorerzeugendes Potential
In-vitro- und In-vivo-Experimente ergaben keine Hinweise auf ein mutagenes Potential. Cineol ist unzureichend bezüglich einer mutagenen Wirkung untersucht.
Im Mäuse-Hauttumor-Promotionstest ergab sich für unverdünntes Eukalyptusöl ein sehr geringes tumorpromovierendes Potential. Ein Kanzerogenitäts-Kurzzeittest verlief negativ. Langzeituntersuchungen zur Kanzerogenität von Cineol liegen nicht vor.
d) Reproduktionstoxizität
Reproduktionstoxikologische Untersuchungen an Ratten ergaben keine Hinweise auf embryotoxische oder teratogene Wirkungen.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Mittelkettige Triglyceride; Gelatine; Glycerol; Hypromelloseacetatsuccinat; Triethyl-citrat; Lösung von partiell dehydratisiertem Sorbitol (Ph. Eur.); Natriumdodecylsulfat; Talkum; Dextrin; Glycyrrhizinsäure, Ammoniumsalz
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
CIN 100/300 mg ist 4 Jahre bei Temperaturen nicht über 25 °C haltbar.
Das Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C und in der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
Originalpackung mit 20 magensaftresistenten Weichkapseln Originalpackung mit 50 magensaftresistenten Weichkapseln Originalpackung mit 100 magensaftresistenten Weichkapseln Anstaltspackung mit 200 magensaftresistenten Weichkapseln
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
G. Pohl-Boskamp GmbH & Co. KG
Kieler Str. 11
25551 Hohenlockstedt
Telefon: (0 48 26) 59 0
Telefax: (0 48 26) 59 109
E-Mail: info@pohl-boskamp.de
Internet: www.pohl-boskamp.de
8. Zulassungsnummern
CIN 100 mg: Zul.-Nr. 15066.01.00 CIN 300 mg: Zul.-Nr. 15066.00.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
24. Oktober 1995
10. Stand der Information
11/2013
11. Verschreibungsstatus / Apothekenpflicht
Apothekenpflichtig