Cisatracurium Noridem 2 Mg/Ml Injektionslösung/Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml Injektionslösung/Infusionslösung enthält 2 mg Cisatracurium (als Cisatracuriumbesilat).
1 Ampulle mit 2,5 ml enthält 5 mg Cisatracurium.
1 Ampulle mit 5 ml enthält 10 mg Cisatracurium.
1 Ampulle mit 10 ml enthält 20 mg Cisatracurium.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung/Infusionslösung
Farblose bis blass-gelbe oder grünlich-gelbe Lösung.
4.1 Anwendungsgebiete
Cisatracurium Noridem ist ein mittellang wirkender, nicht-depolarisierender neuromuskulärer Blocker zur intravenösen Anwendung.
Cisatracurium Noridem ist indiziert bei operativen und anderen Eingriffen sowie in der Intensivmedizin bei Erwachsenen und Kindern ab einem Alter von 1 Monat. Cisatracurium Noridem kann als Muskelrelaxans begleitend bei der allgemeinen Anästhesie oder Sedierung auf Intensivstationen und zur Erleichterung der endotrachealen Intubation und mechanischen Beatmung eingesetzt werden.
Cisatracurium Noridem sollte nur von oder unter der Aufsicht von Anästhesisten oder anderen Ärzten verabreicht werden, die mit der Anwendung und der Wirkung von neuromuskulären Blockern vertraut sind. Vorrichtungen zur endotrachealen Intubation und Aufrechterhaltung der Lungenbeatmung und adäquate arterielle Oxygenierung müssen zur Verfügung stehen.
Cisatracurium darf weder mit Propofol-Injektionsemulsion noch mit alkalischen Lösungen wie Thiopental-Natrium in derselben Spritze oder gleichzeitig durch dieselbe Nadel verabreicht werden (siehe Abschnitt 6.2).
Cisatracurium Noridem enthält kein Konservierungsmittel und ist nur zur einmaligen Anwendung bestimmt.
Hinweis zur Überwachung der Patienten
Wie bei anderen neuromuskulären Blockern, ist bei der Anwendung von Cisatracurium die Überwachung der neuromuskulären Funktion empfohlen, um die Dosierung individuell anzupassen.
Anwendung als intravenöse Bolusinjektion
Dosierung bei Erwachsenen
Tracheale Intubation. Die empfohlene Intubationsdosis von Cisatracurium bei Erwachsenen beträgt 0,15 mg/kg (Körpergewicht). Diese Dosis zeigte gute bis ausgezeichnete Ergebnisse bei der endotrachealen Intubation 120 Sekunden nach der Verabreichung von Cisatracurium nach der Einleitung der Anästhesie mit Propofol.
Höhere Dosen verkürzen die Zeit des Wirkungseintritts der neuromuskulären Blockade.
Die nachstehende Tabelle fasst die durchschnittlichen pharmakodynamischen Daten bei der Verabreichung von Cisatracurium bei einer Dosis von 0,1 bis 0,4 mg/kg (Körpergewicht) bei gesunden erwachsenen Patienten bei einer Opioid- (Thiopental/Fentanyl/Midazolam) oder Propofol-Anästhesie zusammen.
|
Initialdosis Cisatracurium /kg KG |
Art der Narkose |
Zeitspanne bis zu einer 90 %igen T1*-Suppression (min) |
Zeitspanne bis zu einer maximalen T1*-Suppression (min) |
Zeitspanne bis zu einer 25 %igen T1*-Spontanerholung (min) |
|
0,1 |
Opioid |
3,4 |
4,8 |
45 |
|
0,15 |
Propofol |
2,6 |
3,5 |
55 |
|
0,2 |
Opioid |
2,4 |
2,9 |
65 |
|
0,4 |
Opioid |
1,5 |
1,9 |
91 |
* T1 Einzelreizantwort sowie die erste Komponente der Train-of-Four-Reaktion des M. Adductor pollicis, gefolgt von einer supramaximalen elektrischen Stimulation des Ulnarnervs.
Enfluran- oder Isofluran-Anästhesie kann die klinische Wirkungsdauer einer anfänglichen Dosis von Cisatracurium um bis zu 15% verlängern.
Erhaltungsdosis. Die neuromuskuläre Blockade kann mit Erhaltungsdosen von Cisatracurium verlängert werden. Eine Dosis von 0,03 mg/kg (Körpergewicht) bewirkt ca. 20 Minuten zusätzliche klinisch effektive neuromuskuläre Blockade während einer Opioid- oder Propofol-Anästhesie.
Wiederholte Erhaltungsdosen führen nicht zu einer progressiven Verlängerung der Wirkung.
Spontanerholung. Sobald die spontane Erholung von der neuromuskulären Blockade eingesetzt hat, ist die Rate von der verabreichten Cisatracurium-Dosis unabhängig. Bei einer Opioid- oder Propofol-Anästhesie betragen die medianen Zeiten für eine Erholung von 25 auf 75% und von 5 auf 95% ca. 13 bzw. 30 Minuten.
Aufhebung. Die neuromuskuläre Blockade nach der Verabreichung von Cisatracurium ist mit Standarddosen von Cholinesterasehemmern leicht aufzuheben. Die mittleren Erholungszeiten von 25 auf 75% bis zur vollen klinischen Erholung (T4:Ti-Ratio £0,7) betragen ca. 4 bzw. 9 Minuten nach der Verabreichung des Antagonisten bei einer durchschnittlichen T1 Erholung von 10%.
Dosierung bei Kindern und Jugendlichen
Endotracheale Intubation (Kinder von 1 Monat bis 12 Jahre): Wie bei
Erwachsenen beträgt die empfohlene Intubationsdosis von Cisatracurium 0,15 mg/kg (Körpergewicht), schnell verabreicht über 5 bis 10 Sekunden. Diese Dosis zeigt gute bis ausgezeichnete Ergebnisse für eine endotracheale Intubation 120 Sekunden nach der Injektion von Cisatracurium. Die pharmakodynamischen Daten für diese Dosis werden in der folgenden Tabelle präsentiert.
Die Anwendung von Cisatracurium wurde bezüglich der Intubation in den ASA-Klassen III-IV bei pädiatrischen Patienten nicht untersucht. Über die Anwendung von Cisatracurium Noridem bei pädiatrischen Patienten unter 2 Jahren, die einer langwierigen oder großen Operation unterzogen wurden, liegen begrenzte Daten vor.
Bei Kindern im Alter von 1 Monat bis 12 Jahren zeigt Cisatracurium Noridem eine kürzere klinische Wirkungsdauer und ein schnelleres Spontanerholungsprofil als bei Erwachsenen unter ähnlichen AnästhesieBedingungen. Im pharmakodynamischen Profil wurden zwischen den Altersgruppen 1 bis 11 Monate und 1 bis 12 Jahren kleine Unterschiede beobachtet, die in den folgenden Tabellen zusammengefasst werden.
Säuglinge im Alter von 1 bis 11 Monaten
|
Initialdosis Cisatracurium mg/kg KG |
Art der Narkose |
Zeitspanne bis zu einer 90 %igen T1*-Suppression (min) |
Zeitspanne bis zu einer maximalen T1*-Suppression (min) |
Zeitspanne bis zu einer 25 %igen T1*-Spontanerholung (min) |
|
0,15 |
Halothan |
1,4 |
2,0 |
52 |
|
0,15 |
Opioid |
1,4 |
1,9 |
47 |
Kleinkinder und Kinder im Alter von 1 bis 12 Jahren
|
Initialdosis Cisatracurium mg/kg KG |
Art der Narkose |
Zeitspanne bis zu einer 90 %igen T1*-Suppression (min) |
Zeitspanne bis zu einer maximalen T1*-Suppression (min) |
Zeitspanne bis zu einer 25 %igen T1*-Spontanerholung (min) |
|
0,08 |
Halothan |
2,3 |
3,0 |
43 |
|
0,1 |
Opioid |
2,6 |
3,6 |
38 |
Wenn Cisatracurium für die Intubation nicht erforderlich ist: Es kann eine geringere Dosis als 0,15 mg/kg verabreicht werden.
Pharmakodynamische Daten für Dosen von 0,08 und 0,1 mg/kg KG bei Kindern von 2 bis 12 Jahren sind in der folgenden Tabelle zusammengefasst:
|
Initialdosis Cisatra-curium mg/kg KG |
Art der Narkose |
Zeitspanne bis zu einer 90 %igen T1*-Suppression (min) |
Zeitspanne bis zu einer maximalen T1*-Suppression (min) |
Zeitspanne bis zu einer 25 %igen T1*-Spontanerholung (min) |
|
0,08 |
Halothan |
1,7 |
2,5 |
31 |
|
0,1 |
Opioid |
1,7 |
2,8 |
28 |
Die Anwendung von Cisatracurium nach Suxamethonium wurde bei Kindern und Jugendlichen nicht untersucht (siehe Abschnitt 4.5).
Erwartungsgemäß verlängert Halothan die klinische Wirkungsdauer einer Cisatracurium-Dosis um bis zu 20%. Über die Anwendung von Cisatracurium bei Kindern bei einer Anästhesie mit anderen halogenierten Fluorkohlenwasserstoff-Anästhetika liegen keine Informationen vor, jedoch wird erwartet, dass auch diese Mittel die klinische Wirkungsdauer einer Cisatracurium-Dosis verlängern.
Erhaltung (Kinder von 2 bis 12 Jahre). Die neuromuskuläre Blockade kann mit Erhaltungsdosen von Cisatracurium Noridem verlängert werden. Bei Kindern von 2 bis 12 Jahren bietet eine Dosis von 0,02 mg/kg (Körpergewicht) ca. 9 Minuten zusätzliche klinisch effektive neuromuskuläre Blockadewirkung während der Anästhesie mit Halothan. Weitere Erhaltungsdosen führen nicht zu einer progressiven Verlängerung der Wirkung.
Für eine spezifische Empfehlung für die Erhaltungsdosis bei Kindern unter 2 Jahren liegen keine ausreichenden Daten vor.
Sehr begrenzte Daten aus klinischen Studien mit Kindern unter 2 Jahren deuten jedoch daraufhin, dass eine Erhaltungsdosis von 0,03 mg/kg die klinische Wirkungsdauer während einer Opioid-Anästhesie um bis 25 Minuten verlängern kann.
Spontane Erholung. Sobald die Erholung von der neuromuskulären Blockade eingesetzt hat, ist die Rate von der verabreichten Cisatracurium-Dosis unabhängig. Bei einer Opioid- oder Halothan-Anästhesie betragen die medianen Zeiten von 25 auf 75% und von 5 auf 95% Erholung ca. 11 bzw. 28 Minuten.
Aufhebung. Die neuromuskuläre Blockade nach der Verabreichung von Cisatracurium ist mit Standarddosen von Cholinesterasehemmern leicht aufzuheben. Die mittleren Erholungszeiten von 25 auf 75% und bis zur vollen klinischen Erholung (T4:Ti-Ratio ^0,7) betragen ca. 2 bzw. 5 Minuten nach der Verabreichung des Antagonisten bei einer durchschnittlichen T1 Erholung von 13%.
Anwendung als intravenöse Infusion
Dosierung bei Erwachsenen und Kindern von 2 bis 12 Jahren
Die Erhaltung der neuromuskulären Blockade kann durch eine Cisatracurium-Infusion erreicht werden. Eine anfängliche Infusionsrate von 3 Mikrogramm/kg (Körpergewicht)/min (0,18 mg/kg/h) wird zur Wiederherstellung von 89 bis 99% der ^-Unterdrückung nach Nachweis der spontanen Erholung empfohlen. Nach einer anfänglichen Stabilisierung der neuromuskulären Blockade sollte eine Infusionsrate von 1 bis 2 Mikrogramm/kg (Körpergewicht)/min (0,06 bis 0,12 mg/kg/h) angemessen sein, um die Blockade aufrecht zu erhalten.
Die Reduktion der Infusionsrate um bis zu 40% kann erforderlich sein, wenn Cisatracurium während einer Isofluran- oder Enfluran-Anästhesie verabreicht wird (siehe Abschnitt 4.5).
Die Infusionsrate hängt von der Cisatracurium-Konzentration in der Infusionslösung, dem gewünschten neuromuskulären Blockadegrad und dem Gewicht des Patienten ab. Die folgende Tabelle bietet Richtwerte für die Verabreichung von unverdünntem Cisatracurium Noridem.
Infusionsrate von Cisatracurium Injektionslösung/Infusionslösung (2 mg/ml)
|
Gewicht des Patienten (kg) |
Infusionsrate bei Dosen (^g/kg/min) von |
Infusionsrate | |||
|
(kg) |
1,0 |
1,5 |
2,0 |
3,0 | |
|
20 |
0,6 |
0,9 |
1,2 |
1,8 |
ml/h |
|
70 |
2,1 |
3,2 |
4,2 |
6,3 |
ml/h |
|
100 |
3,0 |
4,5 |
6,0 |
9,0 |
ml/h |
Die Dauerinfusion von Cisatracurium mit einer konstanten Infusionsrate geht nicht mit einer progressiven Zu- oder Abnahme der neuromuskulären Blockadewirkung einher.
Nach Beenden der Cisatracurium-Infusion erfolgt eine spontane Erholung von der neuromuskulären Blockade mit einer vergleichbaren Geschwindigkeit wie bei einer einmaligen Bolusinjektion.
Dosierung bei Neugeborenen (unter 1 Monat)
Die Anwendung von Cisatracurium bei Neugeborenen wird nicht empfohlen, da für diese Patientengruppe keine Untersuchungen vorliegen.
Dosierung bei älteren Patienten
Für ältere Patienten ist keine Dosisanpassung erforderlich. Bei diesen Patienten hat Cisatracurium ein ähnliches pharmakodynamisches Profil wie bei jungen Erwachsenen, jedoch kann - wie bei anderen neuromuskulären Blockern - der Wirkungseintritt geringfügig langsamer einsetzen.
Dosierung bei Patienten mit Nierenfunktionsstörungen
Für Patienten mit Niereninsuffizienz ist keine Dosisanpassung erforderlich.
Bei diesen Patienten hat Cisatracurium ein ähnliches pharmakodynamisches Profil wie bei Patienten mit normaler Nierenfunktion, jedoch kann der Wirkungseintritt geringfügig langsamer einsetzen.
Dosierung bei Patienten mit Leberfunktionsstörungen
Für Patienten mit Lebererkrankungen im Endstadium ist keine Dosisanpassung erforderlich. Bei diesen Patienten hat Cisatracurium ein ähnliches pharmakodynamisches Profil wie bei Patienten mit normaler Leberfunktion, jedoch kann der Wirkungseintritt geringfügig schneller einsetzen.
Dosierung bei Patienten mit kardiovaskulären Erkrankungen
Bei Verabreichung durch eine schnelle Bolusinjektion (über 5 bis 10 Sekunden) an erwachsene Patienten mit schweren kardiovaskulären Erkrankungen (New York Heart Association Klasse I-III), die einer Koronararterien-Bypass-Operation unterzogen wurden, ging Cisatracurium bei allen untersuchten Dosen nicht mit klinisch signifikanten kardiovaskulären Wirkungen einher (bis einschließlich 0,4 mg/kg (8x ED95). Über Dosen über 0,3 mg/kg aus dieser Patientengruppe liegen jedoch begrenzte Daten vor.
Cisatracurium wurde nicht bei Kindern untersucht, die einer Herzoperation unterzogen wurden.
Dosierung bei Intensivpatienten
Cisatracurium kann Intensivpatienten durch Bolusinjektion und/oder Infusion verabreicht werden.
Eine anfängliche Infusionsrate von Cisatracurium von 3 Mikrogramm/kg (Körpergewicht)/min (0,18 mg/kg/h) wird bei erwachsenen Intensivpatienten empfohlen. Die erforderliche Dosis kann von Patient zu Patient deutlich variieren und mit der Zeit zu- oder abnehmen. Die durchschnittliche Infusionsrate lag in klinischen Studien bei 3 Mikrogramm/kg/min [von 0,5 bis 10,2 Mikrogramm/kg (Körpergewicht)/min (von 0,03 bis 0,6 mg/kg/h)].
Die mediane Zeit für eine vollständige spontane Erholung nach einer Langzeitinfusion (bis zu 6 Tagen) von Cisatracurium bei Intensivpatienten lag bei ungefähr 50 Minuten.
Das Erholungsprofil nach Cisatracurium-Infusionen bei Intensivpatienten ist von der Infusionsdauer unabhängig.
FI 4.3 Gegenanzeigen
Cisatracurium Noridem ist kontraindiziert bei Patienten mit Überempfindlichkeit gegenüber Cisatracurium, Atracurium oder Benzolsulfonsäure.
FK 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Produktspezifische Hinweise
Cisatracurium paralysiert die Atemmuskeln sowie andere Skelettmuskeln, es wirkt sich jedoch nach bisherigen Kenntnissen nicht auf das Bewusstsein oder das Schmerzempfinden aus. Cisatracurium sollte nur von oder unter der Aufsicht von Anästhesisten oder anderen Ärzten verabreicht werden, die mit der Anwendung und Wirkung von neuromuskulären Blockern vertraut sind. Es sollten Vorrichtungen zur endotrachealen Intubation und zur Aufrechterhaltung der Atmung und adäquaten arteriellen Oxygenierung zur Verfügung stehen.
Es ist Vorsicht geboten, wenn Cisatracurium Patienten verabreicht wird, die eine Überempfindlichkeit gegenüber anderen neuromuskulären Blocker gezeigt haben, da über eine hohe Kreuzsensitivität (über 50%) zwischen neuromuskulären Blockern berichtet wurde (siehe Abschnitt 4.3).
Cisatracurium hat keine signifikanten vagolytischen oder ganglienblockierende Eigenschaften. Folglich hat Cisatracurium keine klinisch signifikante Wirkung auf die Herzfrequenz und wirkt der durch Anästhetika oder Vagusstimulation bedingten Bradykardie während des chirurgischen Eingriffs nicht entgegen.
Patienten mit Myasthenia gravis und anderen Formen neuromuskulärer Erkrankungen zeigten deutlich erhöhte Sensitivität gegenüber nicht-depolarisierenden Muskelrelaxantien. Bei diesen Patienten empfiehlt sich eine anfängliche Dosis von max. 0,02 mg/kg Cisatracurium.
Schwere Störungen des Säure/Base- oder Elektrolythaushalts können die Sensibilität von Patienten gegenüber neuromuskulären Blockern erhöhen oder herabsetzen.
Informationen über die Anwendung von Cisatracurium bei Neugeborenen im Alter von unter einem Monat liegen nicht vor, da keine Studien mit dieser Patientengruppe durchgeführt wurden.
Cisatracurium wurde bei Patienten mit maligner Hyperthermie nicht untersucht. Studien mit für maligne Hyperthermie anfälligen Schweinen zeigten, dass Cisatracurium dieses Syndrom nicht auslöst.
Es liegen keine Studien über Cisatracurium mit Patienten vor, die einer Operation mit induzierter Hyperthermie (25°C bis 28°C) unterzogen wurden. Wie bei anderen neuromuskulären Blockern wird erwartet, dass die für die
Erhaltung einer angemessenen chirurgischen Relaxation erforderliche Infusionsrate signifikant reduziert werden kann.
Cisatracurium wurde bei Patienten mit Verbrennungen nicht untersucht; wie bei anderen nicht-depolarisierenden neuromuskulären Blockern muss jedoch die Möglichkeit eines höheren Dosisbedarfs und einer verkürzten Wirkungsdauer erwogen werden, wenn solchen Patienten eine Cisatracurium-Infusion verabreicht wird.
Cisatracurium Noridem ist hypoton und darf nicht in die Infusionsleitung einer Bluttransfusion eingebracht werden.
Intensivpatienten:
Bei Verabreichung von hohen Dosen an Labortiere wurde Laudanosin, ein Metabolit von Cisatracurium und Atracurium, mit vorübergehender Hypotonie und bei einigen Tierspezies mit zerebralen exzitatorischen Wirkungen in Verbindung gebracht. Bei den empfindlichsten Tierspezies traten diese Wirkungen bei Laudanosin-Plasmakonzentrationen auf, die ähnlich den Konzentrationen waren, die bei einigen Intensivpatienten nach einer längeren Atracurium-Infusion beobachtet wurden.
Übereinstimmend mit der geringeren Infusionsrate von Cisatracurium liegen die Laudanosin-Plasmakonzentrationen bei ca. einem Drittel im Vergleich zu den Konzentrationen nach einer Atracurium-Infusion.
Es liegen sehr wenige Berichte über Krampfanfälle bei Intensivpatienten vor, die Atracurium und andere Mittel erhielten. Diese Patienten litten häufig an einer oder mehreren Erkrankungen, die Krämpfe prädisponierten (z. B. Schädel-Hirn-Trauma, hypoxische Enzephalopathie, zerebrales Ödem, virale Enzephalitis, Urämie). Ein kausaler Zusammenhang mit Laudanosin wurde nicht nachgewiesen.
FM 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Viele Arzneimittel zeigten eine Auswirkung auf das Ausmaß bzw. die Dauer der Wirkung von nicht-depolarisierenden neuromuskulären Blockern, einschließlich der nachstehenden:
Verstärkung der Wirkung:
Durch Anästhetika wie Enfluran, Isofluran, Halothan (siehe Abschnitt 4.2) und Ketamin, durch andere nicht-depolarisierende neuromuskuläre Blocker oder durch andere Arzneimittel wie Antobiotika (z. B. Aminoglycoside, Polymyxine, Spectinomycin, Tetracyclin, Lincomycin und Clindamycin), Antiarrythmika (z. B. Propranolol, Kalziumkanalblocker, Lidocain, Procainamid und Quinidin), Diuretika, (z. B. Furosemid und möglicherweise Thiazide, Mannitol und Acetazolamid), Magnesium- und Lithium-Salze und Ganglienblocker (Trimetaphan, Hexamethonium).
Eine verminderte Wirkung zeigte sich nach vorheriger langfristiger Anwendung von Phenytoin oder Carbamazepin.
Die vorherige Verabreichung von Suxamethonium hatte keine Auswirkung auf die Dauer der neuromuskulären Blockade nach Boslusdosen von Cisatracurium Noridem oder auf die erforderliche Infusionsrate.
Die Verabreichung von Suxamethonium zur Verlängerung der Wirkung von nicht-depolarisierenden neuromuskulären Blockern kann zu einer verlängerten und komplexen Blockade führen, die unter Umständen mit Cholinesterasehemmern schwer reversibel ist.
Selten können bestimmte Arzneimittel eine latente Myasthenia gravis verschlimmern oder aufdecken oder ein Myasthenie-Syndrom induzieren; das Ergebnis kann eine erhöhte Sensibilität gegenüber nicht-depolarisierenden neuromuskulären Blockern sein. Solche Arzneimittel umfassen verschiedene Antibiotika, Betablocker, (Propranolol, Oxprenolol), Antiarrythmika (Procainamid, Quinidin), Antirheumatika (Chloroquin, D-Penicillamin), Trimetaphan, Chlorpromazin, Steroide, Phenytoin und Lithium.
Die Behandlung mit Anticholinesterasen, die üblicherweise zur Behandlung von Alzheimer eingesetzt werden, z.B. Donepezil, kann die Dauer und das Ausmaß der neuromuskulären Blockade mit Cisatracurium verringern.
FL 4.6 Fertilität, Schwangerschaft und Stillzeit
Es liegen keine hinreichenden Daten zur Anwendung von Cisatracurium bei schwangeren Frauen vor. Studien an Tieren zu Auswirkungen auf die Schwangerschaft, auf die embryonale/foetale Entwicklung, auf die Geburt und auf die postnatale Entwicklung sind unzureichend (siehe Abschnitt 5.3). Das mögliche Risiko für den Menschen ist nicht bekannt.
Cisatracurium Noridem sollte nicht während der Schwangerschaft angewendet werden.
Es ist nicht bekannt, ob Cisatracurium oder seine Metaboliten in die Muttermilch übergehen.
FQ 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Diesbezügliche Vorsichtsmaßnahmen sind bei der Anwendung von Cisatracurium Noridem nicht relevant. Cisatracurium Noridem wird immer in Kombination mit einem Allgemeinanästhetikum verwendet und daher gelten die üblichen Vorsichtsmaßnahmen nach Allgemeinnarkose.
FJ 4.8 Nebenwirkungen
Um die Häufigkeit der Nebenwirkungen, die sehr häufig bis gelegentlich auftreten, zu bestimmen, wurden Daten aus gepoolten, internen klinischen Prüfungen verwendet.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt: Sehr häufig > 1/10, häufig > 1/100 bis < 1/10, gelegentlich > 1/1000 bis < 1/100, selten > 1/10.000 bis < 1/1000, sehr selten < 1/10.000, nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Daten aus klinischen Prüfungen
|
Herzerkrankungen | |
|
Häufig |
Bradykardie |
|
Gefäßerkrankungen | |
|
Häufig |
Hypotonie |
|
Gelegentlich |
Hautrötung (Flush) |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
|
Gelegentlich |
Bronchospasmus |
|
Erkrankungen der Haut und des Unterhautzellgewebes | |
|
Gelegentlich |
Hautausschlag |
|
Erkrankungen des Immunsystems | |
|
Sehr selten |
Anaphylaktische Reaktionen Anaphylaktische Reaktionen unterschiedlichen Schweregrades wurden nach der Verabreichung von neuromuskulären Blockern beobachtet. Sehr selten wurden schwere anaphylaktische Reaktionen bei Patienten berichtet, die Cisatracurium zusammen mit einem oder mehreren Anästhetika erhielten. |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |
|
Sehr selten |
Myopathie, Muskelschwäche Es liegen einige Berichte über Muskelschwäche bzw. Myopathie nach einer längeren Anwendung von Muskel-Relaxanzien bei schwer kranken Patienten auf der Intensivstation vor. Die meisten Patienten erhielten gleichzeitig Corticosteroide. Vorkommnisse dieser Art wurden selten in Verbindung mit Cisatracurium berichtet, eine kausale Beziehung wurde nicht nachgewiesen. |
FO 4.9 Überdosierung
Symptome und Anzeichen
Hauptmerkmale einer Überdosierung mit Cisatracurium sind langanhaltende Muskellähmungen und ihre Folgen.
Behandlung
Es ist sehr wichtig, die pulmonale Ventilation und die arterielle Oxygenierung bis zur Wiederherstellung einer angemessenen Spontanatmung aufrechtzuerhalten. Eine tiefe Sedierung ist erforderlich, da das Bewusstsein von Cisatracurium nicht beeinträchtigt wird. Sobald Anzeichen einer spontanen Erholung auftreten, kann die Erholung durch Gabe von Cholinesterasehemmern beschleunigt werden.
FF 5. PHARMAKOLOGISCHE EIGENSCHAFTEN
F1 5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Muskelrelaxantien, peripher wirkende Mittel; andere quartäre Ammoniumverbindungen ATC-Code: M03A C11.
Cisatracurium ist ein mittellang wirkendes, nicht-depolarisierendes Benzylisoquinolin-Muskel-Relaxans.
Klinische Studien am Menschen lassen darauf schließen, dass Cisatracurium bis zur 8 fachen ED95 nicht zu einer dosisabhängigen Histaminfreisetzung führt.
Wirkmechanismus
Cisatracurium bindet an die cholinergischen Rezeptoren auf der motorischen Endplatte, um der Wirkung von Acetylcholin entgegenzuwirken, was zu einer kompetitiven Blockade neuromuskulärer Transmission führt. Diese Wirkung ist durch Cholinesterasehemmern wie Neostigmine oder Edrophonium leicht reversibel.
Die ED95 (erforderliche Dosis, um eine 95% Depression der Zuckungsreaktion des M. adductor pollicis bei Stimulation des Ulnarnervs zu bewirken) von Cisatracurium wird auf 0,05 mg/kg Körpergewicht während einer Opioid-basierten Anästhesie (Thiopental/Fentanyl/Midazolam) geschätzt.
Die ED95 von Cisatracurium beträgt bei Kindern während einer Halothan-Anästhesie 0,04 mg/kg.
F2 5.2 Pharmakokinetische Eigenschaften
Cisatracurium wird im Körper bei physiologischem pH und Körpertemperatur durch Hofmann-Elimination (ein chemischer Prozess)zu Laudanosin und den monoquaternären Acrylatmetaboliten abgebaut. Das monoquaternäre Acrylat wird durch nicht-spezifische Plasmaesterase zu einem monoquaternalen Alkoholmetaboliten hydrolysiert. Die Elimination von Cisatracurium ist weitgehend organunabhängig, jedoch sind die Leber und die Nieren die primären Ausscheidungswege dieses Metaboliten.
Diese Metaboliten haben keine neuromuskuläre Blockadewirkung.
Die nicht-kompartimentären pharmakokinetischen Eigenschaften von Cisatracurium sind im untersuchten Umfang unabhängig von der Dosis (0,1 bis 0,2 mg/kg, z.B. 2 bis 4 x ED95).
Populationskinetische Modelle bestätigen und erweitern diese Ergebnisse auf bis zu 0,4 mg/kg (8 x ED95). Die pharmakokinetischen Parameter nach Dosen von 0,1 und 0,2 mg/kg Cisatracurium, die an gesunde Chirurgie-Patienten verabreicht wurden, werden in den nachstehenden Tabellen zusammengefasst:
|
Parameter |
Bereich der Mittelwerte |
|
Clearance |
4,7 bis 5,7 ml/min/kg |
|
Verteilungsvolumen im Steady State |
121 bis 161 ml/kg |
|
Eliminationshalbwertszeit |
22 bis 29 min |
Pharmakokinetische Eigenschaften bei älteren Patienten
Es gibt keine klinisch wichtigen Unterschiede in den pharmakokinetischen Eigenschaften von Cisatracurium bei älteren und jungen erwachsenen Patienten. Das Erholungsprofil ist ebenfalls unverändert.
Pharmakokinetische Eigenschaften bei Patienten mit Nieren- oder Leberfunktionsstörungen
Es gibt keine klinisch wichtigen Unterschiede in den pharmakokinetischen Eigenschaften von Cisatracurium bei Patienten mit Leber- und Nierenerkrankungen im fortgeschrittenen Stadium und bei gesunden erwachsenen Patienten. Ihre Erholungsprofile sind ebenfalls unverändert.
Pharmakokinetische Eigenschaften während der Infusion
Die pharmakokinetischen Eigenschaften von Cisatracurium nach Infusionen sind ähnlich den Eigenschaften nach einer Einmal-Bolusinjektion. Das Erholungsprofil ist unabhängig nach einer Cisatracurium-Infusion von der Infusionsdauer und ist ähnlich dem Profil nach einer Einmal-Bolusinjektion.
Pharmakokinetische Eigenschaften bei Intensivpatienten
Die pharmakokinetischen Eigenschaften von Cisatracurium bei Intensivpatienten, die Infusionen über einen längeren Zeitraum erhalten, sind ähnlich den Eigenschaften bei gesunden erwachsenen Chirurgie-Patienten, die Infusionen oder eine Einmal-Bolusinjektion erhalten. Das Erholungsprofil nach Cisatracurium-Infusionen bei Intensivpatienten ist von der Infusionsdauer unabhängig.
Die Konzentrationen der Metaboliten sind bei Intensivpatienten mit abnormer Nieren-bzw. Leberfunktion höher (Siehe Abschnitt 4.4). Diese Metaboliten tragen nicht zur neuromuskulären Blockade bei.
F3 5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Aussagekräftige Studien zur akuten Toxizität konnten mit Cisatracurium nicht durchgeführt werden.
Hinsichtlich der Toxizitätssymptome siehe Abschnitt „Überdosierung“. Subakute Toxizität
Studien mit wiederholter Anwendung von Cisatracurium für drei Wochen bei Hunden und Affen lieferten keinen Hinweis auf eine Cisatracurium-spezifische Toxizität.
Mutagenität
Cisatracurium war in einem mikrobiellen /n-v/tro-Mutagenitätstest in Konzentrationen bis zu 5000 ^g/Platte nicht mutagen.
/n-vivo wurden in einer zytogenetischen Studie an der Ratte keine signifikanten Chromosomenabnormitäten bei subkutanen Dosen von bis zu 4 mg/kg beobachtet.
In einem /n-v/tro-Mutagenitätstest an Maus-Lymphomzellen war Cisatracurium in Konzentrationen von 40 ^g/ml und höher mutagen.
Ein einzelner positiver mutagener Befund für ein Arzneimittel, das nur selten und/oder kurzzeitig angewendet wird, ist von fragwürdiger klinischer Relevanz.
Kanzerogenität
Studien zur Kanzerogenität wurden nicht durchgeführt.
Reproduktionstoxizität
Fertilitätsstudien wurden nicht durchgeführt. Reproduktionsstudien an Ratten haben keinen negativen Einfluss von Cisatracurium auf die Foetalentwicklung gezeigt.
Lokale Verträglichkeit
Die Ergebnisse einer intraarteriellen Studie an Kaninchen zeigten dass die Cisatracurium-Injektion gut vertragen wird. Es wurden keine arzneimittelbedingten Veränderungen beobachtet.
FR 6. PHARMAZEUTISCHE ANGABEN
F7 6.1 Liste der sonstigen Bestandteile
Benzolsulfonsäure (zur pH-Wert-Einstellung) Wasser für Injektionszwecke
FS 6.2 Inkompatibilitäten
Das Arzneimittel darf, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
Da Cisatracurium nur in sauren Lösungen stabil ist, darf es nicht mit alkalischen Lösungen, z. B. Thiopental-Natrium in derselben Spritze gemischt oder durch dieselbe Nadel verabreicht werden.
Cisatracurium ist nicht kompatibel mit Ketorolac, Trometamol oder Propofol-Injektionsemulsion.
FT 6.3 Dauer der Haltbarkeit
Haltbarkeit vor Verdünnung: 2 Jahre.
Die chemische und physikalische Stabilität der gebrauchsfertigen Zubereitung wurde für mindestens 24 Stunden bei 5°C und bei 25°C nachgewiesen (siehe Abschnitt 6.6).
Aus mikrobiologischer Sicht sollte die gebrauchsfertige Zubereitung sofort verwendet werden. Wenn die gebrauchsfertige Zubereitung nicht sofort eingesetzt wird, ist der Anwender für Dauer und die Bedingungen der Aufbewahrung verantwortlich. Sofern die Herstellung der gebrauchsfertigen Zubereitung nicht unter kontrollierten und validierten aseptischen Bedingungen erfolgt, ist diese nicht länger als 24 Stunden bei 2°C bis 8°C aufzubewahren.
FX 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2°C-8°C).
Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Verdünnung des Arzneimittels, siehe Abschnitt 6.3.
FY 6.5 Art und Inhalt des Behältnisses
2,5 ml, 5 ml und 10 ml Ampullen aus farblosem Glas (Typ I). Packungen mit 1 und 5 Ampullen.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
F4 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Das Arzneimittel ist nur zum Einmalgebrauch bestimmt.
Nur klare, farblose bis leicht gelbliche oder gelblich-grünliche Lösungen dürfen verwendet werden.
Das Arzneimittel muss vor der Anwendung visuell geprüft werden; wenn sich das Aussehen verändert hat oder das Behältnis beschädigt ist, muss das Arzneimittel verworfen werden.
Nach Verdünnung auf Konzentrationen zwischen 0,1 mg und 1 mg Cisatracurium/ml ist Cisatracurium Noridem für mindestens 24 Stunden bei 5°C und bei 25 °C physikalisch und chemisch in folgenden Lösungen stabil (bei Aufbewahrung in Behältnissen aus Polypropylen):
Natriumchlorid-Lösung 9 mg/ml (0,9 %)
Glucose-Lösung 50 mg/ml (5 %)
Natriumchlorid-Lösung 18 mg/ml (0,18 %) und Glucose-Lösung 40 mg/ml (4
%)
Natriumchlorid-Lösung 45 mg/ml (0,45 %) und Glucose-Lösung 25 mg/ml (2,5 %)
Da das Arzneimittel keine Konservierungsstoffe enthält, sollte die Verdünnung direkt vor der Anwendung vorgenommen werden, oder aber die verdünnte Lösung wie unter Abschnitt 6.3 beschrieben, aufbewahrt werden.
Cisatracurium ist mit folgenden häufig perioperativ eingesetzten Arzneimitteln kompatibel, wenn es unter Bedingungen gemischt wurde, die eine Gabe in eine laufende intravenöse Infusion über ein Y-förmiges Verbindungsstück simulierten:
Fentanylcitrat und Midazolamhydrochlorid.
Wenn andere Arzneimittel durch dieselbe Verweilnadel oder -kanüle verabreicht werden wie Cisatracurium, wird empfohlen, dass jedes Arzneimittel mit einer adäquaten Menge einer geeigneten Infusionslösung ausgespült wird, z. B. Natriumchlorid-Lösung 9 mg/ml (0,9 %).
Wenn Cisatracurium in eine kleine Vene injiziert wird, sollte es, wie bei anderen intravenös verabreichten Arzneimitteln, mit einer geeigneten Infusionslösung z. B. Natriumchlorid-Lösung 9 mg/ml (0,9 %), durch die Vene gespült werden.
Anleitung zum Öffnen der Ampulle
Die Ampullen sind mit dem OPC-(One Point Cut) System ausgestattet und müssen entsprechend den folgenden Anweisungen geöffnet werden:
Halten Sie den unteren Teil der Ampulle in der Hand, wie in Abbildung 1 gezeigt.
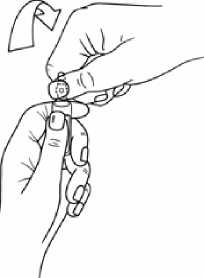
Legen Sie den Daumen der anderen Hand auf den farbigen Punkt auf die Ampullenspitze und brechen Sie die Ampullenspitze ab, wie in Abbildung 2 gezeigt.
Abbildung 1:
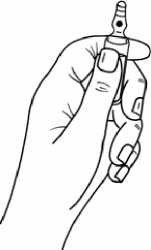
Abbildung 2:
FZ 7. INHABER DER ZULASSUNG
Noridem Enterprises Ltd.
Evagorou & Makariou, Mitsi Building 3, Suite 115
1065 Nicosia
Zypern
Mitvertrieb:
DEMO Pharmaceuticals GmbH Airport Business Center Am Söldnermoos 17 D-85399 Hallbergmoos Tel: 0811/555455-0
F5 8. ZULASSUNGSNUMMER
87286.00.00
F6 9. DATUM DER ERTEILUNG DER ZULASSUNG
28.10.2013
]
Februar 2014
F11 11. VERKAUFSABGRENZUNG
Verschreibungspflichtig