Clotrimazol Aristo 2% Vaginalcreme
F achinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Clotrimazol Aristo® 1 % Vaginalcreme Clotrimazol Aristo® 2 % Vaginalcreme
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Clotrimazol Aristo® 1 % Vaginalcreme 1 g Creme enthält 0,01 g Clotrimazol
Clotrimazol Aristo® 2 % Vaginalcreme 1 g Creme enthält 0,02 g Clotrimazol
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Vaginalcreme
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Entzündung der Scheide und Ausfluss bedingt durch Pilze - meist Candida - sowie Superinfektionen mit Clotrimazol-empfindlichen Bakterien.
4.2 Dosierung, Art und Dauer der Anwendung
Dosierung
Clotrimazol Aristo® 1 % Vaginalcreme
An 6 aufeinanderfolgenden Tagen 1-mal täglich abends 1 Applikatorfüllung (ca. 5 g) möglichst tief in die Vagina applizieren.
Eine Behandlung dauert 6 Tage. Falls erforderlich, kann eine zweite Behandlung über 6 Tage durchgeführt werden.
Clotrimazol Aristo® 2 % Vaginalcreme
An 3 aufeinanderfolgenden Tagen 1-mal täglich abends 1 Applikatorfüllung (ca. 5 g) möglichst tief in die Vagina applizieren.
Eine Behandlung dauert 3 Tage. Falls erforderlich, kann eine zweite Behandlung über 3 Tage durchgeführt werden.
Bei der Festlegung der Behandlungstage auf den Menstruationszyklus achten.
Bei gleichzeitiger Infektion der Schamlippen und angrenzender Bereiche kann zusätzlich eine lokale Behandlung notwendig sein. Zur Vermeidung einer Reinfektion ist gegebenenfalls bei entsprechendem Beschwerdebild die gleichzeitige Behandlung des Partners erforderlich.
Art der Anwendung
Clotrimazol Aristo® Vaginalcreme wird am besten in Rückenlage bei leicht angezogenen Beinen möglichst tief in die Scheide eingeführt.
(s. Gebrauchsanleitung für den Applikator).
Anwendung der Vaginalcreme mit dem Einmal-Applikator:
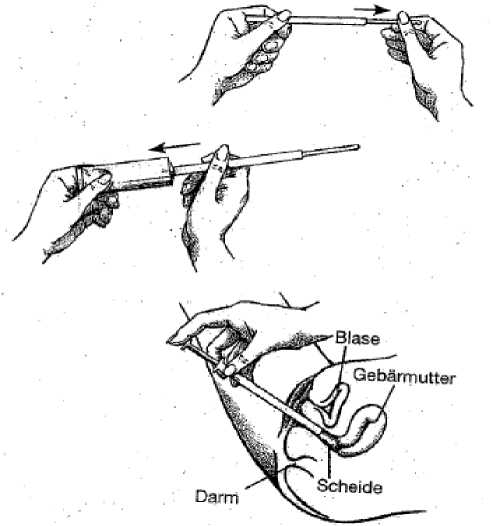
1. Tube öffnen und Einmal-Applikator aufschrauben.
2. Durch vorsichtiges Drücken der Tube wird der Einmal-Applikator so lange gefüllt, bis der Kolben bis zum Anschlag herausgedrückt ist.
3. Einmal-Applikator von der Tube schrauben. Möglichst tief in die Scheide einführen (am besten in Rückenlage) und durch Druck auf den Kolben den Applikator entleeren.
4. Entfernen Sie den Einmal-Applikator nach Gebrauch und werfen Sie ihn weg.
Für jede Anwendung ist ein neuer Einmal-Applikator zu nehmen, welcher nach dem Gebrauch weggeworfen wird.
Bei gleichzeitiger Infektion der Schamlippen und angrenzender Bereiche bzw. Entzündungen von Eichel und Vorhaut des Partners durch Pilze sowie zur Vermeidung einer Wiederinfektion sollte bei den Partnern eine zusätzliche lokale Behandlung mit den dafür vorgesehenen Anwendungsformen erfolgen.
Dauer der Anwendung
Clotrimazol Aristo® 1 % Vaginalcreme wird an 6 aufeinanderfolgenden Tagen angewendet. Falls erforderlich, kann eine zweite Behandlung über 6 Tage durchgeführt werden.
Falls die äußeren Anzeichen der Erkrankung (z. B. Ausfluss, Juckreiz) nach Beendigung der 6-tägigen Behandlung nicht vollständig abgeklungen sind, darf eine Weiterbehandlung nur nach Rücksprache mit dem behandelnden Arzt erfolgen.
Clotrimazol Aristo® 2 % Vaginalcreme wird an 3 aufeinanderfolgenden Tagen angewendet. Falls erforderlich, kann eine zweite Behandlung über 3 Tage durchgeführt werden.
Falls die äußeren Anzeichen der Erkrankung (z. B. Ausfluss, Juckreiz) nach Beendigung der 3-tägigen Behandlung nicht vollständig abgeklungen sind, darf eine Weiterbehandlung nur nach Rücksprache mit dem behandelnden Arzt erfolgen.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Bei bekannter Überempfindlichkeit gegen Cetylstearylalkohol empfiehlt es sich, anstelle der Vaginalcreme eine cetylstearylalkoholfreie Darreichungsform (z. B. Vaginaltabletten) zu verwenden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Clotrimazol Aristo® darf bei Patientinnen unter 18 Jahren sowie bei Patientinnen mit Ersterkrankung nur nach ärztlicher Verordnung angewendet werden, da Ausfluss und Entzündungen der Scheide verschiedene Ursachen haben können. Diese können grundsätzlich nur ärztlich diagnostiziert werden.
Bei geichzeitiger Anwendung von Clotrimazol Aristo® und Kondomen kann es zu einer Verminderung der Reißfestigkeit und damit zur Beeinträchtigung der Sicherheit von Kondomen kommen.
Cetylstearylalkohol kann örtlich begrenzt Hautreizungen (z. B. Kontaktdermatitis) hervorrufen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Clotrimazol vermindert die Wirksamkeit von Amphotericin und anderen Polyenantibiotika (Nystatin, Natamycin).
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Clotrimazol sollte aus Vorsicht nicht vaginal im 1. Trimenon der Schwangerschaft angewendet werden.
Als Ergebnis einer epidemiologischen Studie an Schwangeren ergibt sich der begründete Verdacht, dass Clotrimazol (Imidazole) bei vaginaler Anwendung im ersten Trimester der Schwangerschaft eine Steigerung der Abortrate hervorrufen kann. Entsprechende Untersuchungen für das 2. und 3. Trimester liegen nicht vor. Die Anwendung von Clotrimazol sollte daher mit der gebotenen Vorsicht erfolgen, da epidemiologische Studien, die ein Fehlbildungsrisiko für den Menschen bei topischer Anwendung (dermal/vaginal) ausschließen, nicht vorliegen.
Auf eine Sanierung der Geburtswege sollte insbesondere in den letzten 4-6 Wochen der Schwangerschaft geachtet werden.
Während der Schwangerschaft sollte die Behandlung mit der Vaginalcreme durch den Arzt erfolgen oder mit Vaginaltabletten durchgeführt werden, da diese ohne Applikator anwendbar sind.
Stillzeit
Es ist nicht bekannt, ob Clotrimazol in die Muttermilch ausgeschieden wird.
Fertilität
Aus den vorliegenden präklinischen Daten zur Sicherheit lassen sich keine Hinweise auf Beeinträchtigung der Fertilität ableiten.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Clotrimazol Aristo® hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (>1/10)
Häufig (>1/100 bis < 1/10)
Gelegentlich (>1/1.000 bis <1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich können Hautirritationen mit Rötung, Stechen und Brennen auftreten.
Bei Überempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe wie Cetylstearylalkohol sind allergische Reaktionen möglich.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Berichte über Vergiftungsfälle mit Clotrimazol liegen nicht vor. Es existiert kein spezielles Antidot.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Imidazol-Derivat, Breitspektrum-Antimykotikum ATC-Code: G01AF02
5.2 Pharmakokinetische Eigenschaften
Die antimykotische Wirkung von Clotrimazol beruht auf einer Hemmung der Biosynthese des Ergosterins. Dieses Steroid ist ein wesentlicher Bestandteil der Zellmembranen.
Clotrimazol ist gegen praktisch alle klinisch relevanten Pilzarten (Dermatophyten, Hefen, Schimmelpilze) wirksam.
In vitro wurde auch eine Wirksamkeit gegen Trichomonaden und grampositive Bakterien nachgewiesen.
Primär resistente Stämme von Candida albicans und Trichophyton scheinen nicht vorzukommen. Während der Therapie wurde bisher nur ganz vereinzelt Resistenzbildung beobachtet.
Es besteht auch keine Kreuzresistenz mit Flucytosin, Griseofulvin und Polyenantibiotika (z. B. Amphotericin B, Nystatin)
Wegen des Wirkungsmechanismus der Polyenantibiotika (Komplexbildung mit den Steroiden der Zellmembran) wird aber ein antagonistischer Effekt bei Kombination dieser Antimykotika mit Clotrimazol diskutiert.
5.3 Präklinische Daten zur Sicherheit
Bei lokaler Anwendung sind keine toxischen Wirkungen zu erwarten.
Systemische Toxizität Akute Toxizität
Die akute Toxizität ausgedrückt als LD50 (oral) beträgt:
Maus und Ratte: Kaninchen: Katze und Hund:
700 - 900 mg/kg Körpergewicht 1000 - 2000 mg/kg Körpergewicht 1000 - 2000 mg/kg Körpergewicht
Chronische Toxizität
Die längerfristige Verabreichung hoher oraler Dosen an Ratten, Hunden und Affen verursachte Veränderungen an Leber und Nebennieren. Es kam zu einer dosisabhängigen Leberhypertrophie (Zellhypertrophie und Zunahme des Gesamtgewichts) aufgrund einer mikrosomalen Enzyminduktion in den Hepatozyten. Anzeichen einer intrahepatischen Cholestase oder pathologischer Veränderungen wurden bei Hunden und Affen nicht beobachtet; lediglich bei Ratten traten in hohen Dosierungen und aufgrund der besonderen Sensibilität gegenüber Clotrimazol degenerative Veränderungen der Hepatozyten auf.
Die funktionelle Hypertrophie war nach Therapieende rasch reversibel.
Die Verdickungen der Nebennierenrinde waren bedingt durch verstärkte Fetteinlagerungen in die Zona reticularis und fasciculata; eine Schädigung des Parenchyms wurde nicht beobachtet. Auch diese Veränderungen waren nach Absetzen reversibel, hielten jedoch länger an als die Leberveränderungen.
Mutagenes und tumorerzeugendes Potential
Die vorliegende Mutagenitätsprüfung ist negativ, reicht für eine abschließende Bewertung aber nicht aus.
Untersuchungen am Tier auf ein tumorerzeugendes Potential von Clotrimazol liegen nicht vor.
Reproduktionstoxikologie
Reproduktionstoxikologische Untersuchungen wurden an Mäusen, Ratten und Kaninchen mit oralen Gaben bis zu 200 mg/kg KG durchgeführt.
In Versuchen an Ratten mit vaginaler Applikation von 100 mg/kg KG zeigte Clotrimazol keinen Einfluss auf die Fertilität und war weder embryotoxisch noch teratogen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Sorbitanstearat; Polysorbat 60; Cetylpalmitat (Ph.Eur.); Octyldodecanol (Ph.Eur.); Cetylstearylalkohol (Ph.Eur.); Benzylalkohol, gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 lA Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Aluminiumtuben mit Schraubverschluss und transparente Kunststoff-Applikatoren.
Clotrimazol Aristo® 1 % Vaginalcreme 35 g Creme und 6 Applikatoren (N3)
Clotrimazol Aristo® 2 % Vaginalcreme 20 g Creme und 3 Applikatoren (N2)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Aristo Pharma GmbH Wallenroder Straße 8 - 10 13435 Berlin Tel.: +49 30 71094-4200 Fax: +49 30 71094-4250
8. ZULASSUNGSNUMMERN
Clotrimazol Aristo® 1 % Vaginalcreme
8437.00. 00
Clotrimazol Aristo® 2 % Vaginalcreme
8438.00. 00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
20.06.1986/25.06.2001
10. Stand der Information
November 2014
11. Verkaufsabgrenzung
Clotrimazol Aristo® 1 % Vaginalcreme Verschreibungspflichtig
Clotrimazol Aristo® 2 % Vaginalcreme Apothekenpflichtig
6