Colifin 1 Mio. I.e. Pulver Zur Herstellung Einer Lösung Für Einen Vernebler
1. BEZEICHNUNG DES ARZNEIMITTELS
ColiFin 1 Mio. I.E., Pulver zur Herstellung einer Lösung für einen Vernebler
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede 10mlFlasche enthält 1 Mio. I.E. entsprechend 80 mg Colistimethat-Natrium.
3. DARREICHUNGSFORM
Pulver zur Herstellung einer Lösung für einen Vernebler Weißes Pulver
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
ColiFin ist bei erwachsenen Patienten und Kindern mit zystischer Fibrose zur Behandlung chronischer pulmonaler Infekte indiziert, die durch Pseudomonas aeruginosa verursacht werden (siehe Abschnitt 5.1).
Die offiziellen Richtlinien zur sachgemäßen Anwendung von Antibiotika sind zu beachten.
4.2 Dosierung und Art der Anwendung
Es wird empfohlen, Colistimethatnatrium (CMS) unter der Aufsicht von Ärzten anzuwenden, die über angemessene Erfahrung mit seiner Anwendung verfügen.
Dosierung
Die Dosierung sollte an den Schweregrad der Erkrankung und das klinische Ansprechen angepasst werden.
Empfohlene Dosierungsbereiche:
Anwendung per Inhalation
Erwachsene, Jugendliche und Kinder > 2 Jahre
1-2 Mio. IE zwei- bis dreimal täglich (max. 6 Mio. IE/Tag)
Kinder unter 2 Jahren
0,5-1 Mio. IE zweimal täglich (max. 2 Mio. IE/Tag)
Die einschlägigen klinischen Richtlinien zu Therapieschemata einschließlich der Behandlungsdauer, der Häufigkeit der Anwendung sowie der gleichzeitigen Anwendung anderer Antibiotika sind einzuhalten.
Ältere Patienten
Eine Dosierungsanpassung wird nicht für notwendig erachtet.
Eingeschränkte Nierenfunktion
Eine Dosierungsanpassung wird nicht für notwendig erachtet, jedoch ist bei Patienten mit eingeschränkter Nierenfunktion Vorsicht geboten (siehe Abschnitte 4.4 und 5.2).
Eingeschränkte Leberfunktion
Eine Dosierungsanpassung wird nicht für notwendig erachtet.
Art der Anwendung Zur Inhalation.
Bei Früh- und Neugeborenen ist besondere Vorsicht geboten, da in dieser Patientenpopulation die Nierenfunktion nur unzureichend entwickelt ist.
Für die Anwendung bei Kindern unter 2 Jahren wird der PARI LC Sprint Baby (Düsenaufsatz rot) mit Maske empfohlen.
Der Inhalt einer ColiFin-Flasche mit 1 Mio. I.E. sollte in 3 ml isotonischer Kochsalzlösung gelöst werden.
Für Hinweise zur Verdünnung des Produkts vor der Anwendung siehe Abschnitt 6.6.Kenndaten (Näherung) der Wirkstoffabgabe für ColiFin 1 Mio. I.E. gelöst in 3 ml isotonischer Kochsalzlösung. Ergebnisse von in-vitro (in-vivo) Untersuchungen mit verschiedenen Verneblersystemen (min-max).
|
Verneblersystem |
PARI LC SPRINT® mit PARI Boy® S Kompressor |
eFlow®rapid Vernebler |
|
Wirkstoffabgabe gesamt |
25 mg CMN (22.1 - 27.2) |
27 mg CMN (19.9 - 30.5) |
|
Feinteilchengröße < 5 pm |
15 mg CMN (12.7 - 16.8) |
18 mg CMN (13.0 - 20.8) |
|
Wirkstoffabgabe pro Minute |
4.6 mg CMN/min (4.3 - 5.0) |
7.0 mg CMN/min (5.2 - 7.7) |
|
Medianer aerodynamischer Massendurchmesser |
3.8 pm (3.3 -4.3) |
4.1 pm (4.0 - 4.4) |
|
Geometrische Standardabweichung |
2.2 |
1.6 |
80 mg Colistimethat-Natrium entsprechen 1 Mio. I.E.
• Die Vernebelungszeit kann bei Verwendung des eFlow rapid Verneblers im Lauf von 60 Verneblerzyklen von ca. 3 Minuten auf ca. 4,5 Minuten ansteigen.
• Der Vernebler muss während des Betriebs horizontal gehalten werden.
• Der Patient sollte während der Inhalation aufrecht sitzen. Während der Inhalation sollte das normale Atmungsmuster ohne Unterbrechung beibehalten werden.
• Der Vernebler muss unter Beachtung der Gebrauchsanweisung des benutzten Verneblers nach Gebrauch gereinigt und desinfiziert werden.
In wässriger Lösung wird Colistimethatnatrium zu dem Wirkstoff Colistin hydrolysiert.
Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung rekonstituierter Lösungen siehe Abschnitt 6.6.
Weitere Therapien sollten gegebenenfalls in der vom Arzt verordneten Reihenfolge angewendet werden.
Tabelle zur Dosisumrechnung:
In der EU darf die verordnete und angewendete Dosis von Colistimethatnatrium (CMS) ausschließlich in Internationalen Einheiten (IE) angegeben werden. Auf dem Produktetikett ist die Anzahl IE pro Durchstechflasche angegeben.
Aufgrund der in Bezug auf die Wirkstärke unterschiedlich angegebenen Dosierungen ist es zu Verwechslungen und Medikationsfehlern gekommen. In den USA und anderen Ländern wird die Dosis in Milligramm der Colistinbasen-Aktivität (mg CBA) angegeben.
Die folgende Umrechnungstabelle dient zur Information. Die darin enthaltenen Angaben sind nur ungefähre Nominalwerte.
CMS-Umrechnungstabelle
|
Wirkstärke |
« CMS-Masse (mg)* | |
|
IE |
~ mg CBA | |
|
12.500 |
0,4 |
1 |
|
150.000 |
5 |
12 |
|
1.000.000 |
34 |
80 |
|
4.500.000 |
150 |
360 |
|
9.000.000 |
300 |
720 |
Nominale Wirkstärke des Arzneimittels = 12.500 IE/mg
4.3 Gegenanzeigen
Überempfindlichkeit gegen Colistimethat-Natrium (Colistin) oder Polymyxin B Myasthenia gravis:
Colistimethat-Natrium kann die an präsynaptischen neuromuskulären Verbindungen freigesetzte Acetylcholin-Menge verringern und darf daher nicht bei Patienten mit Myasthenia gravis angewendet werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei Inhalation von Antibiotika können Husten und Bronchospasmen auftreten.
Die Gabe der ersten Dosis sollte unter Aufsicht von medizinisch erfahrenem Personal erfolgen. Es wird empfohlen, vor der Inhalation möglichst routinemäßig einen Bronchodilator anzuwenden, insbesondere wenn dies zum Regime des betreffenden Patienten gehört. Die forcierte Einsekundenkapazität (FEV1) sollte vor und nach der Inhalation gemessen werden. Wenn bei einem Patienten ohne vorherigen Bronchodilator Hinweise auf Colistimethat-Natrium-induzierte Bronchialobstruktionen auftreten, sollte der Test mit einem Bronchodilator bei einer anderen Anwendung wiederholt werden. Eine bronchiale Hyperreaktivität in Anwesenheit eines Bronchodilators kann auf eine allergische Reaktion hinweisen. In diesem Falle sollte die Anwendung von ColiFin beendet werden. Auftretende Bronchospasmen sollten wie medizinisch angezeigt behandelt werden.
Bei fortgesetzter Anwendung von Colistimethat-Natrium kann sich eine bronchiale Hyperreaktivität entwickeln, daher sollte die forcierte Einsekunden-kapazität (FEV1) vor und nach der Inhalation regelmäßig bei klinischen Untersuchungen gemessen werden.
Im Falle einer Überempfindlichkeit auf die empfohlenen Dosen und Volumina sollten durch Hinzufügen von 1 - 3 ml isotonischer Kochsalzlösung zu den empfohlenen Dosisstärken und Volumina verdünntere Lösungen verwendet werden.
Porphyrie-Patienten sollten mit extremer Vorsicht behandelt werden, da Colistimethat-Natrium eine Exazerbation der Porphyrie verursachen kann
Beim Überschreiten der empfohlenen parenteralen Dosis können nephrotoxische und neurotoxische Wirkungen auftreten. Das Risiko ist wegen der geringen Bioverfügbarkeit bei inhalativer Gabe reduziert, jedoch sollte ColiFin bei Patienten mit eingeschränkter Nierenfunktion nur unter Vorsicht angewendet werden (siehe Abschnitt 4.2). Neurotoxische Reaktionen und die Nierenfunktion sollten überwacht werden.
Eingeschränkte Nierenfunktion
Colistimethat-Natrium wird über die Nieren ausgeschieden und ist bei hohen Serumkonzentrationen nephrotoxisch, was während der Inhalationstherapie unwahrscheinlich ist. Jedoch werden Bestimmungen der Serumkonzentrationen insbesondere bei Patienten mit eingeschränkter Nierenfunktion empfohlen.
Resistenzbildung
Bei Anwendung von Colistimethat-Natriumg wurde in mukoiden Pseudomonas aeruginosa Keimen Resistenzbildung gegen Colistimethat-Natrium beobachtet. Ein Empfindlichkeitstest sollte durchgeführt werden bei Langzeitpatienten, im Rahmen von regelmäßigen Kontrollvisiten und immer bei Auftreten von Exazerbationen (siehe Abschnitt 5.1).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die Anwendung von Colistimethat-Natrium zusammen mit potenziell neurotoxischen und/oder nephrotoxischen Arzneimitteln (z. B. Cephalosporine, Aminoglykoside, Cyclosporin) einschließlich der Arzneimittel zur i.v.- oder i.m.-Anwendung sollte vermieden werden.
Werden Inhalationsnarkotika (z. B. Ether, Halothan), Muskelrelaxanzien und Aminoglykoside zusammen mit ColiFin angewendet, sollte aufgrund prolongierter Effekte durch Inhalationsnarkotika sorgfältig auf neurotoxische Reaktionen geachtet werden.
Colistimethat-Natrium kann die Freisetzung von Acetylcholin beeinflussen. Nicht-depolarisierende Muskelrelaxanzien sollten bei Patienten die ColiFin erhalten unter extremer Vorsicht angewendet werden, da deren Wirkung prolongiert sein kann.
4.6 Fertilität, Schwangerschaft und Stillzeit
Es liegen keine dokumentierten Erfahrungen mit der Anwendung von Colistimethat-Natrium an Schwangeren vor. Einzeldosisstudien mit Schwangeren zeigen, dass Colistimethat-Natrium die Plazenta passiert; es besteht das Risiko einer fötalen Toxizität, wenn schwangere Patienten wiederholt behandelt werden. Zur Auswirkung von Colistimethat-Natrium auf Reproduktion und Entwicklung liegen keine ausreichenden Tierstudien vor (siehe Abschnitt 5.3). Colistimethat-Natrium sollte nicht in der Schwangerschaft angewendet werden, außer wenn der Nutzen für die Mutter das potenzielle Risiko für den Fötus überwiegt.
Colistimethat-Natrium geht in die Muttermilch über. Die Anwendung von Colistimethat-Natrium sollte in der Stillzeit nur bei zwingender Indikation erfolgen und wenn der Nutzen für die Mutter das potenzielle Risiko für das Kind überwiegt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
ColiFin hat einen mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Während der Behandlung mit Colistimethat-Natrium können sich neurotoxische Effekte bemerkbar machen, dabei können Schwindel, Verwirrtheit oder visuelle Störungen auftreten. Die Patienten sollten davor gewarnt werden, am Verkehr teilzunehmen oder Maschinen zu bedienen, falls diese Wirkungen auftreten.
4.8 Nebenwirkungen
Die häufigsten Nebenwirkungen nach der Vernebelung von Colistimethat-Natrium sind Husten und Bronchospasmen bei ungefähr 10 % der Patienten. Bei i.v.- oder i.m.- Injektion wurden bei bis zu 27 % der Patienten mit zystischer Fibrose neurologische Zwischenfalle berichtet.
Tabellarische Aufstellung der Nebenwirkungen
Die Nebenwirkungen in Tabelle 1 sind entsprechend der Systemorganklassen des MedDRA aufgeführt. Innerhalb jeder Systemorganklasse sind die Nebenwirkungen in der Reihenfolge ihrer Häufigkeit angegeben mit Angabe der häufigsten Nebenwirkungen zuerst. Darüber hinaus ist für jede Nebenwirkung die entsprechende Kategorie der Häufigkeit auf der Grundlage der folgenden Konvention (CIOMS III) angegeben:
Sehr häufig (0/10); häufig (0/100 bis <1/10); gelegentlich (01/1.000 bis <1/100); selten (01/10.000 bis <1/1.000); sehr selten (<1/10.000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Die Wahrscheinlichkeit von Nebenwirkungen kann von Alter, Nierenfunktion und Krankheitszustand des Patienten abhängen.
Tabelle 1 Nebenwirkungen
|
Nebenwirkungen |
Häufigkeit |
|
Erkrankungen der Atemwege, des Brustraums und | |
|
Mediastinums | |
|
Pharyngolaryngeale Schmerzen |
Sehr häufig |
|
pharyngo-laryngeale Beschwerden |
Sehr häufig |
|
Husten |
Sehr häufig |
|
Dyspnoe |
Sehr häufig |
|
Pfeifatmung |
Sehr häufig |
|
Kurzatmigkeit |
Sehr häufig |
|
verringerte forcierte Ein-sekundenkapazität, |
Sehr häufig |
|
Apnoe |
Sehr häufig |
|
Psychiatrische Erkrankungen | |
|
Verwirrtheit, |
Nicht bekannt |
|
Psychosen |
Nicht bekannt |
|
Erkrankungen des Nervensystems | |
|
Parästhesie |
Nicht bekannt |
|
Dysarthrie |
Nicht bekannt |
|
Dysbalance des autonomen Nervensystems |
Nicht bekannt |
|
Augenerkrankungen | |
|
Sehstörungen |
Nicht bekannt |
|
Erkrankungen des Ohrs und des Labyrinths | |
|
Drehschwindel |
Nicht bekannt |
|
Erkrankungen der Nieren und Harnwege | |
|
Nierenversagen |
Nicht bekannt |
Bei Patienten mit stark eingeschränkter Nierenfunktion können bei höheren Dosierungen Nebenwirkungen auftreten, die von der intra-venösen Anwendung her bekannt sind.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome:
Eine Überdosierung kann zu Muskelschwäche, Apnoe und Atemstillstand führen, außerdem zu akutem Nierenversagen, das durch eine verminderte Urinausscheidung und erhöhte Serumkonzentrationen von BUN und Kreatinin charakterisiert ist.
Ein spezifisches Antidot ist nicht bekannt.
Behandlung:
Eine Überdosierung sollte supportiv behandelt werden und Maßnahmen zur Eliminationsförderung von Colistin, z. B. Mannitoldiurese, ausgedehnte Hämodialyse oder peritoneale Dialyse ergriffen werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Sonstige antibakterielle Wirkstoffe, Polymyxine, ATC-Code: J01X B01.
Wirkungsweise
Colistimethat-Natrium ist ein zyklisches Polypeptidantibiotikum, das aus Bacillus polymyxa subsp. Colistinus gewonnen wird. Polymyxin-Antibiotika sind kationische Wirkstoffe, die über eine Schädigung der Zellmembran wirken. Die resultierenden physiologischen Wirkungen sind für das Bakterium tödlich. Polymyxine wirken selektiv auf gramnegative Bakterien mit hydrophober äußerer Membran.
Grenzwerte (Breakpoints)
Empfindlich(S) < 4 mg/l resistent (R) > 8 mg/l Resistenz
Resistente Bakterien sind charakterisiert durch eine Modifikation der negativen Phosphatgruppen des Lipopolysaccharids, die durch Aminoarabinose oder Ethanolamin ersetzt sind. Bei von Natur aus resistenten gramnegativen Bakterien wie Proteus mirabilis und Burkholderia cepacia sind die Lipidphosphate vollständig durch Ethanolamin oder Aminoarabinose ersetzt.
Die Häufigkeit der erworbenen Resistenz von mukoidem Pseudomonas aeruginosa wird mit ungefähr 3 % angegeben. Bei langzeitbehandelten Patienten sollte ein Empfindlichkeitstest durchgeführt werden.
Kreuzresistenz
Für Colistimethat-Natrium und Polymyxin B ist von einer Kreuzresistenz auszugehen. Der Wirkmechanismus der Polymyxine unterscheidet sich von anderen Antibiotika. Daher ist nicht zu erwarten, dass eine allein durch den oben beschriebenen Mechanismus entstandene Colistin- und Polymyxin-Resistenz zu Resistenzen gegenüber anderen Antibiotikaklassen führt.
Empfindlichkeit
Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit variieren. Deshalb sind - insbesondere für die adäquate Behandlung schwerer Infektionen - lokale Informationen über die Resistenzsituation wünschenswert. Sollte aufgrund der lokalen Prävalenz der Resistenz die Anwendung des Wirkstoffes zumindest bei einigen Infektionen bedenklich erscheinen, sollte eine Beratung durch Experten angestrebt werden.
Üblicherweise empfindliche Spezies
Pseudomonas aeruginosa
Spezies, bei denen die erworbene Resistenz ein Problem bei der Anwendung darstellen könnte
Enterobacter species Klebsiella species
Von Natur aus resistente Mikroorganismen Brucella species
Burkholderia cepacia und verwandte Spezies.
Neisseria species Proteus species Providencia species Serratia species
Anaerobe
Alle grampositiven Organismen
In der Vergangenheit wurde Colistimethat-Natrium mit den Verneblern PARI LC PLUS und PARI LC STAR® vernebelt. In-vitro Tests verglichen diese Jet-Vernebler mit dem eFlow®rapid hinsichtlich der Vernebelung von 1 Mio. I.E. Colistimethat-Natrium, gelöst in 3 ml isotonischer Kochsalzlösung.
Vernebler:
eFlow®rapid PARI LC PLUS® PARI LC STAR®
Gesamte Wirkstoff- 26,6 0,62 26,0 Q0,33 27,5 Q2,06
abgabe [mg D95% KI]
Wirkstoffabgabe 7,0 D0,39 4,3 D0,14 3,2 D0,27
pro Minute [mg/min D95% KI]
5.2 Pharmakokinetische Eigenschaften
Resorption
Die Resorption im Gastrointestinaltrakt ist vernachlässigbar.
Bei vernebelter Aufnahme zeigte sich eine variable Resorption, die von der Aerosoltröpfchengröße, dem Verneblersystem und dem Lungenstatus abhängt. Studien mit Probanden und mit Patienten mit verschiedenen Infektionen ergaben Serumspiegel zwischen 0 mg/l und potenziell therapeutische Konzentrationen von 4 mg/l und höher. Eine mögliche systemische Resorption sollte daher stets berücksichtigt werden, wenn Patienten eine Inhalations-behandlung erhalten.
Verteilung
Nach der Verabreichung von 7,5 mg/kg/Tag an Patienten mit zystischer Fibrose, aufgeteilt in mehrere Dosen, als 30-minütige intravenöse Infusionen bis hin zum Steady-State, wurdec max mit 23±6 mg/l und cmin nach 8 Stunden mit 4,5±4 mg/l bestimmt. In einer anderen Studie mit den gleichen Patienten, die 2 Millionen Einheiten alle 8 Stunden über 12 Tage hinweg erhielten, betrugen cmax 12,9 mg/l (5,7 - 29,6 mg/l) und cmin 2,76 mg/l (1,0 - 6,2 mg/l). Bei Probanden wurden 10 Minuten nach einer Bolusinjektion von 150 mg (ca. 2 Mio. I.E.) Serumspitzenwerte von 18 mg/l beobachtet.
Die Proteinbindung ist gering. Polymyxine persistieren in Leber, Niere, Gehirn, Herz und Muskulatur. Eine Studie mit Patienten mit zystischer Fibrose ergab ein Verteilungsvolumen im Steady State von 0,09 l/kg.
Biotransformation
Colistimethat-Natrium wird in vivo in die Base umgewandelt. Da 80 % der Dosis unverändert im Urin ausgeschieden werden und keine biliäre Exkretion erfolgt, wird angenommen, dass die verbleibende aktive Substanz im Gewebe aktiv ist. Der Mechanismus ist unbekannt.
Elimination
Nach parenteraler Gabe erfolgt die Exkretion hauptsächlich über die Niere. 40 % der parenteralen Dosis werden innerhalb von 8 Stunden im Urin ausgeschieden und ungefähr 80 % innerhalb von 24 Stunden. Colistimethat-Natrium wird größtenteils über den Urin ausgeschieden, daher ist zur Vermeidung einer Akkumulation bei eingeschränkter Nierenfunktion eine Dosisreduktion erforderlich. Siehe hierzu die Tabelle in Abschnitt 4.2.
Bei intravenöser Gabe beträgt die Eliminationshalbwertszeit bei erwachsenen Probanden ungefähr 1,5 Stunden. In einer Studie mit Patienten mit zystischer Fibrose und einer 30-minütigen Infusion betrug die Eliminationshalbwertszeit 3,4 ± 1,4 Stunden.
Die Elimination von Colistimethat-Natrium nach Inhalation wurde nicht untersucht. In einer Studie mit Patienten mit zystischer Fibrose war bei zweimal täglicher Inhalation von 1 Mio. I.E. über 3 Monate kein Colistimethat-Natrium im Urin nachweisbar.
Die Kinetik von Colistimethat-Natrium bei normaler Nierenfunktion scheint bei Kindern und Erwachsenen einschließlich ältereren Personen ähnlich zu sein. Zum Einsatz bei Neugeborenen liegen begrenzt Daten vor. Danach sind die Neugeborenenkinetiken mit denen von Kindern und Erwachsenen vergleichbar, jedoch sind höhere Serumspitzenkonzentrationen und längere Halbwertszeiten bei diesen Patienten möglich; die Serumspiegel sollten überwacht werden.
Serumkonzentrationen und Pharmakokinetik von 5 Patienten nach inhaliertem Colistimethat-Natrium
Parameter 160 mg (Ungefähr 2 Mio. I.E.) vernebeltes
Colistimethat-Natrium
AUC0-4 (h/mg/L) 165.9 ± 76.5
|
Cmax (mg/L) |
0.051 ± 0.0244 |
|
Tmax (h) |
1.9 ± 1.2 |
|
Ka (h-1 ) |
3.0 ± 1.8 |
|
H (h) |
10.4 ± 3.6 |
|
Kl/F |
0.27 ± 0.15 |
5.3 Präklinische Daten zur Sicherheit
Daten zum genotoxischen Potenzial sind begrenzt verfügbar, Daten zum kanzerogenen Potenzial von Colistimethat-Natrium liegen nicht vor. Colistimethat-Natrium kann in vitro chromosomale Aberrationen in humanen Lymphozyten induzieren. Diese Wirkung hängt möglicherweise mit der ebenfalls beobachteten Verringerung des mitotischen Index zusammen.
Untersuchungen zur Reproduktionstoxizität erbrachten keine Hinweise auf teratogene Eigenschaften. Colistimethat-Natrium führte jedoch beim Kaninchen nach intramuskulärer Gabe während der Organogenese zu Talipes varus bei 2,6 % bzw. 2,9 % der Föten nach Dosen von 4,15 bzw. 9,3 mg/kg. Dies entspricht dem 0,5 bzw. 1,2 fachen der maximalen täglichen Dosis beim Menschen. Außerdem war die Resorption bei 9,3 mg/kg erhöht.
Es liegen keine weiteren medizinisch relevanten präklinischen Daten zur Sicherheit vor. Die auf Patientenexposition basierenden Sicherheitsdaten sind in anderen Abschnitten dieser Fachinformation aufgeführt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Keine
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
3 Jahre
Rekonstituierte Lösungen:
ColiFin kann nach Rekonstitution mit 0,9 %iger Kochsalzlösung 24 Stunden lang bei Temperaturen unter 25°C gelagert werden. Wegen des Risikos der mikrobiellen Kontamination der rekonstituierten Lösung sollte die Lagerung nicht länger als 24 Stunden erfolgen.
Die Herstellerangaben zum vorschriftsgemäßen Gebrauch des für die ColiFin-Lösung verwendeten Verneblers sollten beachtet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern. Flaschen im Umkarton aufbewahren, um den Inhalt vor Licht zur schützen. Zu den Lagerungsbedingungen des zubereiteten Arzneimittels siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
ColiFin 1 Mio. I.E.: ungefärbte 10 ml Flaschen aus Glas mit roten Abreißkappen
Packungsgrößen:
• Box enthält 8 Packungen mit je 7 Flaschen (56 Flaschen).
Plus 2 Boxen INQUA® NaCl 0,9% zur Inhalation mit je 30 Flaschen a 3ml (60 Flaschen)
Plus eFlow®rapid Vernebler
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Die benötigte Dosis ColiFin sollte in einer entsprechenden Menge steriler Kochsalzlösung durch leichtes Umschwenken gelöst werden. Starkes Schütteln sollte wegen übermäßiger Schaumbildung vermieden werden. Die entstehende Lösung sollte klar sein und unter Sorgfalt in den Arzneimittelbehälter des Verneblers überführt werden. Weitere Angaben zu Handhabung und Gebrauch sind der Bedienungsanweisung des Verneblers zu entnehmen.
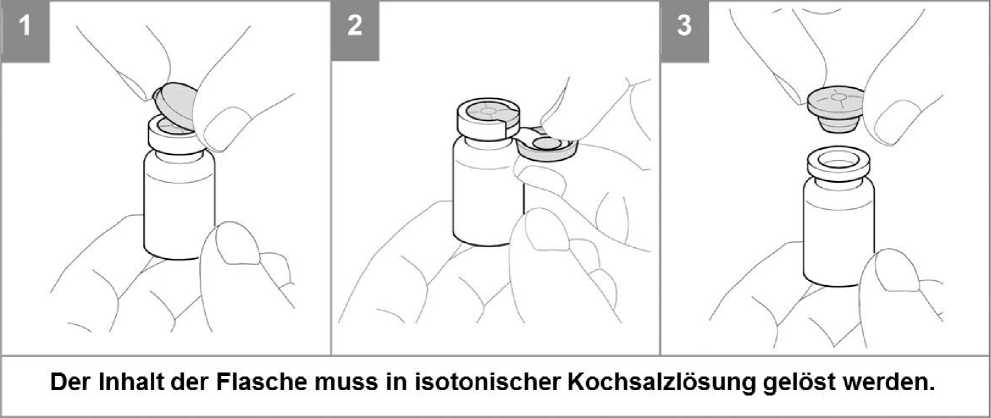
• Die Vernebelung sollte in einem gut belüfteten Raum erfolgen.
• Die Lösung ist zum einmaligen Gebrauch bestimmt. Verbleibende Lösungen müssen verworfen werden.
• Für weitergehende Geräteinformationen sollte die Bedienungsanweisung des Verneblers beachtet werden.
• Siehe Abschnitt 4.2 für Hinweise zur Verdünnung des Produktes vor der Anwendung. Die rekonstituierte Lösung sollte klar sein.
7. INHABER DER ZULASSUNG
11
PARI Pharma GmbH Moosstr. 3 82319 Starnberg Deutschland
8. ZULASSUNGSNUMMER Zul. Nr. 73869.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/ERNEUERUNG DER ZULASSUNG 26. Juli 2010
10. STAND DER INFORMATION
03/2015
11. VERSCHREIBUNGSPFLICHT/APOTHEKENPFLICHT
Verschreibungspflichtig
Version 5.0
12