Cotazym 30.000
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels)
1. BEZEICHNUNG DES ARZNEIMITTELS Cotazym 30.000
Magensaftresistente Hartkapseln
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Pankreas-Pulver vom Schwein
1 magensaftresistente Hartkapsel enthält:
310,8 - 398,8 mg Pankreas-Pulver vom Schwein entsprechend Lipase 30.000 Ph.Eur.-Einheiten/Kapsel
Amylase mind. 21.750 Ph.Eur.-Einheiten/Kapsel
Protease mind. 1.275 Ph.Eur.-Einheiten/Kapsel
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Magensaftresistente Hartkapsel
Cotazym 30.000 ist als weiße Hartkapsel erhältlich.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Störungen der exokrinen Pankreasfunktion, die mit einer Maldigestion einhergehen.
4.2 Dosierung und Art der Anwendung
Die Behandlung mit Cotazym 30.000 richtet sich auf das Ziel, ein normales Körpergewicht zu erreichen bzw. zu halten und die Stuhlgangshäufigkeit bzw. -beschaffenheit zu normalisieren.
Dosierung
Die Dosierung richtet sich in jedem Fall nach dem Schweregrad der Pankreasinsuffizienz. Als allgemeine Richtdosis wird ein Lipaseanteil pro Mahlzeit von 20.000-40.000 Ph.Eur.-Einheiten empfohlen:
1 Hartkapsel Cotazym 30.000
(entsprechend 30.000 Ph.Eur.-Einheiten Lipase pro Mahlzeit)
Die erforderliche Dosis kann auch darüber liegen. Eine Erhöhung der Dosis sollte nur unter ärztlicher Kontrolle erfolgen und an der Verbesserung der Symptome (z.B. Steatorrhoe, Bauchschmerzen) ausgerichtet sein.
Eine tägliche Enzymdosis von 15.000-20.000 Einheiten Lipase pro kg Körpergewicht sollte nicht überschritten werden.
Art der Anwendung
Cotazym 30.000 wird unzerkaut mit reichlich Flüssigkeit (Wasser, Saft) während der Mahlzeiten eingenommen. Dabei ist darauf zu achten, Cotazym 30.000 unzerkaut zu schlucken, da Cotazym 30.000 beim Zerkauen in der Wirksamkeit vermindert werden kann und die enthaltenen Enzyme bei der Freisetzung in der Mundhöhle dort die Schleimhaut schädigen können. Es wird empfohlen, reichlich Flüssigkeit (Wasser, Saft) nachzutrinken.
Die Dauer der Anwendung von Cotazym 30.000 richtet sich nach dem Krankheitsbild und wird vom Arzt bestimmt.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff, Schweinefleisch oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Während einer akuten Pankreatitis und bei akuten Schüben einer chronischen Pankreatitis sollte Cotazym 30.000 nicht eingenommen werden. Dagegen kann die Einnahme des Arzneimittels während der diätetischen Aufbauphase beim Abklingen eines akuten Entzündungsschubes dann sinnvoll sein, wenn eine Verdauungsstörung noch oder weiterhin besteht.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Durch Inhalation von Pankreas-Pulver vom Schwein können allergische Reaktionen ausgelöst werden.
Cotazym 30.000 enthält aktive Enzyme, die bei Freisetzung in der Mundhöhle, z.B. durch Zerkauen, zu Schleimhautschädigungen (z.B. Ulzerationen der Mundschleimhaut) führen können. Es ist deshalb darauf zu achten, dass Cotazym 30.000 unzerkaut geschluckt wird.
Intestinale Obstruktionen sind bekannte Komplikationen bei Patienten mit Mukoviszidose. Bei Vorliegen von darmverschlussähnlichen Krankheitszeichen sollte daher auch die Möglichkeit von Darmverengungen in Betracht gezogen werden.
Bei Patienten mit Pankreasinsuffizienz sollten regelmäßige Kontrollen des Folsäure-Status oder eine Folsäuresubstitution erfolgen, insbesondere dann, wenn Pankreasenzyme zusammen mit Bikarbonat (oder Cimetidin) eingenommen wird.
Patienten, die an Diabetes mellitus leiden und daher Antidiabetika einnehmen, die zur Gruppe der Glukosidase-Inhibitoren gehören, sollten diese Arzneimittel nicht gleichzeitig mit Cotazym 30.000, sondern zeitlich versetzt einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die Wirksamkeit von Pankreas-Pulver kann durch die gleichzeitige Einnahme von Kalzium- oder Magnesium-Antazida herabgesetzt werden.
Pankreas-Pulver scheint die Resorption von Eisensalzen und oralen Eisenergänzungen (z.B. Polysaccharid-Eisen-Komplexe) herabzusetzen. Obwohl die klinische Bedeutung unbekannt ist, litten bis zu 30 % der Patienten mit Mukoviszidose, die langfristig mit Pankreasenzymen substituiert wurden, an Eisenmangel. Diese Interaktion sollte bei anämischen Patienten in Betracht gezogen werden, die unter Pankreasenzymtherapie trotz Eisensubstitution keine Verbesserung ihrer Anämie erreichen.
Pankreasenzympräparate mit amylolytischer Aktivität können die pharmakologische Wirksamkeit von bestimmten Antidiabetika wie alpha-Glukosidase-Inhibitoren (z.B. Acarbose oder Miglitol) bei gleichzeitiger Gabe herabsetzen. Diese Arzneimittel sollten nicht gleichzeitig mit Cotazym 30.000 eingenommen werden. Die Einhaltung eines zeitlichen Abstandes zwischen der Einnahme von Pankreasenzymen und alpha-Glukosidase-Inhibitoren wird empfohlen.
Pankreas-Pulver behindert die Resorption von Folsäure. Patienten mit Pankreasinsuffizienz sollten sorgfältig im Hinblick auf ihren Folsäure-Status überwacht werden, insbesondere dann, wenn sie Pankreasenzyme zusammen mit Bikarbonat (bzw. mit Cimetidin) einnehmen.
4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
Cotazym 30.000 kann nach entsprechender Nutzen/Risikoabwägung durch den behandelnden Arzt in der Schwangerschaft eingenommen werden.
Stillzeit
Cotazym 30.000 kann nach entsprechender Nutzen/Risikoabwägung durch den behandelnden Arzt in der Stillzeit eingenommen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Cotazym 30.000 hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (>1/10)
Häufig (>1/100 bis <1/10)
Gelegentlich (>1/1.000 bis <1/100)
Selten (>1/10.000 bis <1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Sehr selten sind Nebenwirkungen nach Einnahme von Pankreas-Pulver wie folgt beschrieben worden:
Erkrankungen der Haut und des Unterhautzellgewebes
Perianale Reizzustände; allergische Hauterscheinungen wie Pruritus, Erythem, Exanthem, Urtikaria
Erkrankungen der Atemwege, des Brustraumes und Mediastinums
Bronchospasmus, Asthma, Dyspnoe
Erkrankungen des Gastrointestinaltrakts
Magen-Darm-Unverträglichkeit wie Drücken, Sodbrennen, Schmerzen, Völlegefühl, Meteorismus, Übelkeit, Brechreiz; Stomatitis bei Kindern, Blutungen im Gastrointestinaltrakt (Neugeborene), allergische Reaktionen des Verdauungstraktes
Nach Gaben hoher Dosen von Pankreatinpräparaten sind bei Patienten mit einer Mukoviszidose in Einzelfällen die Bildung von Strikturen der Ileocaecalregion und des Colon ascendens beschrieben worden. Diese Verengungen können unter Umständen zu einem Ileus führen.
Bei Patienten mit Mukoviszidose kann vor allem unter der Einnahme hoher Dosen von PankreasPulver eine erhöhte Harnsäureausscheidung im Urin auftreten. Daher sollte bei diesen Patienten die
Hamsäureausscheidung im Urin kontrolliert werden, um die Bildung von Hamsäuresteinen zu vermeiden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es wurden keine Fälle von Überdosierung berichtet.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Digestionsmittel, Multienzyme ATC-Code: A09AA02
Cotazym 30.000 enthält ein Pankreas-Pulver vom Schwein, in dem neben den exkretorischen Pankreasenzymen Lipase, Alpha-Amylase, Trypsin und Chymotrypsin auch andere Enzyme enthalten sind. Außerdem enthält Pankreas-Pulver vom Schwein weitere Begleitstoffe ohne enzymatische Aktivität.
Die digestive Potenz wird bestimmt von der Aktivität der Enzyme sowie der galenischen Form. Entscheidend ist die enzymatische Aktivität der Lipase sowie auch der Anteil an Trypsin, während die amylolytische Aktivität nur bei der Therapie der Mukoviszidose von Bedeutung ist, da bei chronischer Pankreatitis die Aufspaltung der Nahrungspolysaccharide noch ungestört abläuft.
Die Pankreaslipase spaltet aus einem Triacylglyceridmolekül die Fettsäuren in Stellung 1 und 3 ab. Die hierdurch entstehenden freien Fettsäuren und 2-Monoglyceride werden hauptsächlich vom oberen Dünndarm unter Zuhilfenahme der Gallensäure schnell aufgenommen. Die tierische Pankreaslipase ist ähnlich wie die menschliche Lipase säureinstabil, so dass ihre lipolytische Aktivität bei einem pH kleiner als 4 zunehmend irreversibel inaktiviert wird.
Trypsin wird aus Trypsinogen autokatalytisch oder durch Dünndarmenterokinase aktiviert und spaltet als Endopeptidase Peptidbindungen, an denen Lysin und Arginin beteiligt sind. Auf Grund neuerer Untersuchungen wird für das Trypsin eine Feedback-Hemmung der stimulierten Pankreassekretion durch aktives Trypsin im oberen Dünndarm angenommen. Auf diesen Effekt wird die in einigen Studien beschriebene schmerzstillende Wirkung von Pankreatin-Präparaten zurückgeführt. Die Alpha-Amylase spaltet als Endoamylase glukosehaltige Polysaccharide sehr schnell auf, so dass ihre Aktivität auch bei krankheitsbedingt erheblich verminderter sekretorischer Aktivität der Bauchspeicheldrüse in der Regel noch ausreicht.
Zur Erhaltung der lipolytischen Aktivität ist bei Patienten mit intaktem Magen und physiologischer Säuresekretion ein Schutz vor der Magensäure während der Magenpassage durch besondere galenische Zubereitung notwendig. Das galenische Prinzip von Cotazym 30.000 gewährleistet eine optimale Nutzung der enzymatischen Aktivitäten des Pankreas-Pulvers vom Schwein für die Verdauung der Nahrung. Die magensaftresistenten Pellets, die alle Pankreasenzyme enthalten, sind in leicht lösliche Gelatinekapseln eingeschlossen. Die Kapseln lösen sich pH-unabhängig schnell auf und vermischen sich gleichmäßig mit dem Chymus. So kann mit Eintritt des Nahrungsbreies in das Duodenum der Abbau der Pellets genauso wie beim physiologischen Verdauungsprozess beginnen. Die Enzymfreigabe aus den Pellets erfolgt wegen ihrer großen Oberfläche rasch und setzt bei einem pH von 5,5 ein.
Aufgrund der galenischen Zubereitung von Cotazym 30.000 werden Aktivitätsverluste bei stark saurem pH im Magen vermieden.
5.2 Pharmakokinetische Eigenschaften
Pankreas-Pulver wird nicht vom Gastrointestinaltrakt aufgenommen, sondern mit dem Stuhl ausgeschieden, wobei der größte Teil durch die Verdauungssäfte oder bakteriell abgebaut und denaturiert wird. Als Proteine werden die Pankreasenzyme im Darm hauptsächlich durch Autolyse bzw. Proteolyse inaktiviert und verdaut.
Bioverfügbarkeit
In-vitro-Untersuchungen zur Säurestabilität von Cotazym Pellets weisen nach einer 120-minütigen Belastung bei pH 1 und 4 eine lipolytische Aktivität im Bereich von 98-105 % der unbelasteten Probe auf. Die Ergebnisse dokumentieren, dass während der gastralen Phase praktisch kein Enzym freigesetzt wird. Eine Freisetzung des Leitenzyms Lipase bei diesem für den Mageninhalt typischen pH-Wert würde unweigerlich zum Verlust der Enzymaktivität führen. Die Pellets sind aber säurestabil.
Die folgende Abbildung zeigt, dass durch die Erhöhung des pH-Wertes nach der Pyloruspassage auf pH 5,5 und höher eine rasche Freisetzung der Enzyme (hier nur für das Leitenzym Lipase dargestellt) stattfindet. Somit stehen die Enzyme nur im schwach sauren Milieu des Duodenums für die Verdauung der Nahrung zur Verfügung. Während die Enzymfreisetzung bei pH 6 bereits nach 15 Minuten Maximalwerte erreicht, erfolgt die Enzymfreisetzung bei pH 5,5 leicht verzögert.
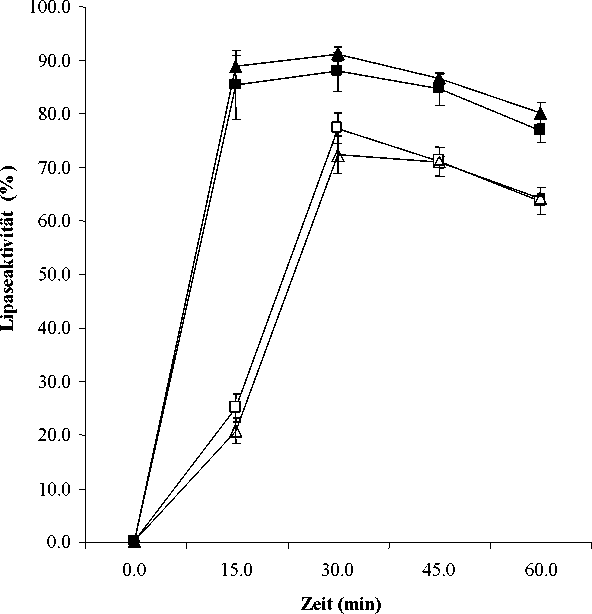
Abbildung 1: Freisetzungsmuster des Leitenzyms Lipase aus zwei Chargen von Cotazym Pellets bei pH 5,5 und pH 6,0 (Mittelwerte und Standardabweichung bei n = 6)
■ Cotazym Charge A pH 6
■ Cotazym Charge A pH 5,5 Cotazym Charge B pH 6 Cotazym Charge B pH 5,5
5.3 Präklinische Daten zur Sicherheit
Präklinische Untersuchungen wurden nicht durchgeführt. Systemisch toxische Wirkungen für Pankreas-Pulver vom Schwein sind nicht zu erwarten.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Methacrylsäure-Ethylacrylat-Copolymer-( 1:1)-Dispersion
Triethylcitrat
Talkum
Simeticon-Emulsion
Gelatine
Natriumdodecylsulfat Farbstoff: Titandioxid E 171
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
Cotazym 30.000 ist sechs Monate nach Anbruch der Glasflasche haltbar.
Das Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 25°C lagern.
Die Glasflasche fest verschlossen halten, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
Braune Glasflasche mit weißem Kunststoffverschluss.
Packungen mit 50, 100, 200 (2x100) und 500 (5x100) Hartkapseln.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Nordmark Arzneimittel GmbH & Co. KG Pinnauallee 4 25436 Uetersen
Mitvertrieb:
CHEPLAPHARM Arzneimittel GmbH (alleiniger Inverkehrbringer)
Bahnhofstr. 1a
17498 Mesekenhagen
Telefon: 03834/8539-0
Telefax: 03834/8539-398
E-Mail: info@cheplapharm.com
www.cheplapharm .com
8. ZULASSUNGSNUMMER
6528238.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 25. November 2005
10. STAND DER INFORMATION
Februar 2015
11. VERKAUFSABGRENZUNG
Apothekenpflichtig
Seite 7 von 7