Cromohexal Kombi
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
CromoHEXAL Kombi, 20 mg/ml Augentropfen und Nasenspray, Lösung
Wirkstoff: Natriumcromoglicat (Ph.Eur.)
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Augentropfen
1 ml Augentropfen enthält 20 mg Natriumcromoglicat (Ph.Eur.). Nasenspray
1 Sprühstoß zu 0,14 ml enthält 2,8 mg Natriumcromoglicat (Ph.Eur.). Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Augentropfen
Augentropfen
Nasenspray Nasenspray, Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur symptomatischen Behandlung bei ganzjähriger allergischer Rhinitis oder saisonaler allergischer Rhinitis verbunden mit allergisch bedingter, akuter oder chronischer Konjunktivitis, z. B. Heuschnupfen-Bindehautentzündung, (Kerato-) Konjunktivitis vernalis.
4.2 Dosierung und Art der Anwendung
Dosierung
Augentropfen
Erwachsene und Kinder tropfen in der Regel 2-mal täglich je 1 Tropfen in den unteren Bindehautsack des betroffenen Auges ein.
Die Tagesdosis kann durch Erhöhung der Applikationshäufigkeit auf 4-mal täglich je 1 Tropfen verdoppelt werden.
Nasenspray
Die Höhe der Dosierung wird bestimmt durch den individuellen Sensibilisierungsgrad und die Stärke der Allergen-Exposition.
Erwachsene und Kinder geben bis zu 4-mal täglich je 1 Sprühstoß in jede Nasenöffnung.
Die Tagesdosis kann bei Bedarf erhöht werden, die Applikationshäufigkeit sollte 6-mal täglich je 1 Sprühstoß in jede Nasenöffnung nicht überschreiten.
Art und Dauer der Anwendung
Um einen optimalen Therapieeffekt zu erzielen, ist eine ausführliche Unterweisung des Patienten im Gebrauch von CromoHEXAL Kombi erforderlich.
Dauer der Anwendung
CromoHEXAL Kombi ist zur Dauertherapie geeignet. Die regelmäßige tägliche Applikation ist erforderlich, da CromoHEXAL Kombi keinen Soforteffekt hat. CromoHEXAL Kombi ist nur zur Prophylaxe geeignet. Daher soll die Behandlung nach Abklingen der Beschwerden solange fortgeführt werden, wie der Patient den Allergenen (Pollen, Hausstaub, Schimmelpilzsporen, Nahrungsmittelallergene) ausgesetzt ist.
Der Therapieeffekt ist regelmäßig zu kontrollieren. Die Dosierungsintervalle können aber auch nach Erreichen der therapeutischen Wirkung verlängert werden, solange die Symptomfreiheit aufrecht erhalten wird.
Art der Anwendung Augentropfen
Die Augentropfen in den Bindehautsack des Auges eintropfen. Dazu Kopf leicht nach hinten beugen, nach oben blicken und das Unterlid etwas vom Auge abziehen. Durch Druck auf das Fläschchen einen Tropfen in den unteren Bindehautsack tropfen. Die Tropföffnung nicht mit dem Auge in Berührung bringen. Nach dem Eintropfen langsam das Auge schließen. Das Fläschchen nach dem Gebrauch sofort verschließen.
Nasenspray
Vor Gebrauch Schutzkappe abnehmen.
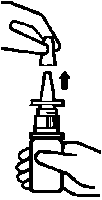
Wichtig: Vor der ersten Anwendung muss der Sprühmechanismus mehrmals betätigt werden, bis ein feiner, gleichmäßiger Sprühnebel aus der Sprühöffnung austritt. Das Nasenspray ist dann für jede weitere Anwendung gebrauchsfertig.
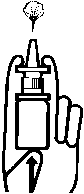
Die Sprühöffnung wird in ein Nasenloch eingeführt und jeweils einmal pro Nasenloch gesprüht. Nach dem Gebrauch wird die Sprühöffnung gesäubert und die Schutzkappe wieder aufgesteckt.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
Auch schon bei Verdacht auf eine allergische Reaktionslage gegen CromoHEXAL Kombi ist eine Reexposition unbedingt zu vermeiden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Augentropfen
Bei Entzündungen, auch bei allergischer Bindehautentzündung, ist vom Augenarzt festzustellen, ob trotz der Beschwerden Kontaktlinsen getragen werden dürfen.
Wenn das Tragen von Kontaktlinsen zulässig ist, ist Folgendes zu beachten: Benzalkoniumchlorid kann Irritationen am Auge hervorrufen. Der Kontakt mit weichen Kontaktlinsen ist zu vermeiden. Benzalkoniumchlorid kann zur Verfärbung weicher Kontaktlinsen führen. Kontaktlinsen sind vor der Anwendung zu entfernen und frühestens 15 Minuten nach der Anwendung wieder einzusetzen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es sind keine Wechselwirkungen bekannt.
4.6 Schwangerschaft und Stillzeit Schwangerschaft
Anhaltspunkte für eine fruchtschädigende Wirkung von Natriumcromoglicat liegen sowohl aus Tierstudien (siehe Abschnitt 5.3 „Präklinische Daten zur Sicherheit“) als auch aus den bisherigen Erfahrungen am Menschen nicht vor. Dennoch sollte CromoHEXAL Kombi aus grundsätzlichen Erwägungen während der Schwangerschaft nur nach sorgfältiger Nutzen-Risiko-Abwägung angewendet werden.
Stillzeit
Es ist nicht bekannt, ob Natriumcromoglicat in die Muttermilch übergeht. Daher sollte CromoHEXAL Kombi während der Stillzeit nur nach sorgfältiger Nutzen-Risiko-Abwägung angewendet werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Augentropfen beeinflussen unmittelbar nach der Anwendung für wenige Minuten die Sehleistung. Bevor der Patient am Straßenverkehr teilnimmt, ohne sicheren Halt arbeitet oder Maschinen bedient, soll abgewartet werden, bis die Beeinträchtigung des Sehvermögens durch Schleiersehen vorübergegangen ist.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Augentropfen
Gelegentlich treten lokale Irritationen wie Augenbrennen, Fremdkörpergefühl, Chemosis und konjunktivale Hyperämie auf.
Sehr selten wurden Fälle von Hornhautkalzifizierungen unter der Therapie mit phosphathaltigen Augentropfen bei Patienten mit ausgeprägten Hornhautdefekten berichtet.
Nasenspray
Respirationstrakt
Gelegentlich: Irritation der Nasenschleimhaut, Niesen Sehr selten: Nasenbluten, Husten, Heiserkeit
Generalisierte Störungen Selten: Kopfschmerzen
Sehr selten: Überempfindlichkeitsreaktionen, teils schwere generalisierte anaphylaktische Reaktionen (Juckreiz, Dyspnoe, Bronchospasmen, Angioödem, Larynxödem)
Sonstige Störungen Selten: Geschmacksstörungen
Sehr selten: Schleimhautulzerationen, Zungenschwellung
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Bisher sind keine Symptome nach Überdosierungen von Natriumcromoglicat beschrieben.
IO io
. PHARMAKOLOGISCHE EIGENSCHAFTEN .1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiallergikum ATC-Code: S01G X01 (Augentropfen), R01A C01 (Nasenspray)
Tierexperimente und In-vitro-Studien haben gezeigt, dass Natriumcromoglicat in der Lage ist, nach Antigen-Exposition die Degranulation sensibilisierter Mastzellen und damit die Freisetzung von Entzündungsmediatoren zu hemmen. Bei den Mediatoren handelt es sich um biologische Effektormoleküle, die in den Zellen bereits präformiert vorliegen (z. B. Histamin, Kinine, eosinophiler chemotaktischer Faktor [ECF], neutrophiler chemotaktischer Faktor [NCF]), oder die auf Provokation hin aus Arachidonsäure-haltigen Membranstrukturen der Zellen neu synthetisiert werden (z. B. Prostaglandine, Leukotriene).
Diese mastzellstabilisierende Wirkung wurde auch beim Menschen bei durch Antigen induziertem, IgE-vermitteltem Bronchospasmus und bei der allergischen Rhinitis gesehen.
Die allergische Sofortreaktion wird insbesondere mit Histamin in Verbindung gebracht. Prostaglandine und Leukotriene sind an der verzögerten Reaktion beteiligt. Durch die chemotaktischen Mediatoren ECF, NCF und LTB4, kommt es zu entzündlichen Spätreaktionen. Natriumcromoglicat wirkt aber auch bei nicht primär immunologisch vermittelten Mechanismen wie z. B. Anstrengungsasthma und SO2-induziertem Asthma.
Neben anderen postulierten Wirkmechanismen hat Natriumcromoglicat auch kalziumantagonistische Wirkungen. Natriumcromoglicat blockiert den mit dem IgE-Rezeptor gekoppelten Kalziumkanal und hemmt dadurch den über diesen Rezeptor vermittelten Einstrom von Kalzium in die Mastzelle und somit die Degranulation der Mastzelle. Natriumcromoglicat wird hierbei spezifisch an ein Natriumcromoglicat-Bindungsprotein gebunden, welches Teil des durch den IgE-Rezeptor kontrollierten Kalziumkanals ist.
Dieser Wirkmechanismus trifft für alle Schleimhäute (z. B. Bronchien, Nase, Auge, Darm) gleichermaßen zu.
5.2 Pharmakokinetische Eigenschaften
Nach intranasaler Gabe von Natriumcromoglicat werden weniger als 7 %, nach oraler Gabe nur etwa 1 % der verabreichten Dosis systemisch resorbiert. Die Eliminationshalbwertszeit beträgt etwa 80 Minuten.
Natriumcromoglicat ist wenig lipidlöslich und deshalb nicht in der Lage, die meisten biologischen Membranen, wie z. B. die Blut-Hirn-Schranke, zu durchdringen.
Ein bestimmter kontinuierlicher Wirkstoffspiegel von Natriumcromoglicat im Blut ist für das Erreichen und Aufrechterhalten eines optimalen Therapieeffekts nicht erforderlich. Maßgebend für den therapeutischen Effekt von Natriumcromoglicat ist ausschließlich die nach lokaler Applikation am jeweiligen Erfolgsorgan erreichte Konzentration.
Natriumcromoglicat wird nicht metabolisiert. Die Elimination erfolgt zu etwa gleichen Teilen biliär und renal.
5.3 Präklinische Daten zur Sicherheit
Chronische Toxizität
Untersuchungen zur chronischen Toxizität wurden an Ratten mit s.c.-Applikation durchgeführt. Bei extrem hohen Dosierungen traten schwere Nierenschädigungen in Form von tubulären Degenerationen im proximalen Teil der Henle'schen Schleife auf.
Untersuchungen bei Inhalationsapplikation an verschiedenen Tierspezies (Ratte, Meerschweinchen, Affe und Hund) mit einer Dauer bis zu 6 Monaten ergaben keine Hinweise auf Schädigungen, die durch Natriumcromoglicat verursacht wurden.
Mutagenes und tumorerzeugendes Potential
In-vitro- und In-vivo-Untersuchungen zum genotoxischen Potential von Natriumcromoglicat verliefen negativ.
Langzeituntersuchungen an verschiedenen Tierspezies ergaben keine Hinweise auf ein tumorerzeugendes Potential.
Reproduktionstoxizität
Reproduktionstoxikologische Studien an Kaninchen, Ratten und Mäusen ergaben keine Anhaltspunkte für einen teratogenen oder sonstigen embryotoxischen Effekt von Natriumcromoglicat. Die Fertilität männlicher und weiblicher Ratten, der Graviditätsverlauf sowie die peri- und postnatale Entwicklung der Feten blieben unbeeinflusst.
In Untersuchungen an Affen fand man, dass nach i.v.-Applikation 0,08 % der Dosis diaplazentar den Feten erreichte und nur 0,001 % der applizierten Dosis in der Milch ausgeschieden wurde.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Augentropfen
• Benzalkoniumchlorid
• Natriumchlorid
• Natriumdihydrogenphosphat-Dihydrat
• Natriumedetat (Ph.Eur.)
• Natriummonohydrogenphosphat-Dodecahydrat (Ph.Eur.)
• Sorbitol-Lösung 70 % (nicht kristallisierend) (Ph.Eur.)
• Wasser für Injektionszwecke
Nasenspray
• Hyetellose
• Natriumchlorid
• Natriumdihydrogenphospat-Dihydrat
• Natriumedetat (Ph.Eur.)
• Natriumhydroxidlösung 10 %
• Natriummonohydrogenphosphat-Dodecahydrat (Ph.Eur.)
• Sorbitol (Ph.Eur.)
• Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
3 Jahre
Hinweis auf Haltbarkeit nach Anbruch
Die Augentropfen sind nach Anbruch 6 Wochen verwendbar.
Das Nasenspray ist nach Anbruch 6 Wochen verwendbar.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Packung mit
10 ml Augentropfen und 15 ml Nasenspray, Lösung
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen
7. INHABER DER ZULASSUNG
Hexal AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMER
48600.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung 27. April 2004
Datum der letzten Verlängerung der Zulassungen 26. März 2013
10. STAND DER INFORMATION
Juni 2014
11. VERKAUFSABGRENZUNG
Apothekenpflichtig