Curosurf 240
F A C H I N F O R M A T I O N
1. BEZEICHNUNG DES ARZNEIMITTELS
Curosurf® 120 mg Curosurf® 240 mg
Suspension zur endotracheopulmonalen Instillation.
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Curosurf® ist ein natürlicher Surfactant, der aus Schweinelungen gewonnen wird und fast ausschließlich polare Lipide, speziell Phosphatidylcholin und die spezifisch niedermolekularen hydrophoben Proteine SP-B und SP-C enthält.
Curosurf® 120 mg:
1 Einzeldosisbehältnis mit 1,5 ml Suspension enthält:
Phospholipidfraktion aus Schweinelunge 120 mg, entsprechend 111 mg Gesamtphospholipide und 1,4 mg niedrigmolekulare hydrophobe Proteine.
Curosurf® 240 mg:
1 Einzeldosisbehältnis mit 3 ml Suspension enthält:
Phospholipidfraktion aus Schweinelunge 240 mg, entsprechend 222 mg Gesamtphospholipide und 2,7 mg niedrigmolekulare hydrophobe Proteine.
Zusammensetzung pro ml Suspension: Phospholipidfraktion aus der Schweinelunge 80 mg/ml, äquivalent ca. 74 mg/ml der Gesamtphospholipide und 0,9 mg/ml niedrigmolekulare hydrophobe Proteine.
Sonstige Bestandteile:
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Suspension zur endotracheopulmonalen Instillation .
Eine weiße bis gelbe, sterile Suspension in Einzeldosisbehältnis zur endotracheopulmonalen Anwendung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Curosurf® wird angewendet bei Frühgeborenen mit einem Geburtsgewicht von mindestens 700 g zur Therapie der Frühphase des Atemnotsyndroms (RDS).
4.2 Dosierung und Art der Anwendung
Die Behandlung mit Curosurf® sollte sobald wie möglich nach der RDS-Diagnose beginnen. Stand: Oktober 2016 Seite 1 von 12
Curosurf® darf nur stationär von Ärzten angewendet werden, die in der Betreuung und Wiederbelebung von Frühgeborenen ausgebildet und erfahren sind. Adäquate Beatmungs- und Überwachungseinrichtungen für Frühgeborene mit RDS müssen zur Verfügung stehen.
Dosierung:
Soweit nicht anders verordnet, wird eine Initialdosis von 200 mg/kg Körpergewicht (KG) so schnell wie möglich nach der Diagnose RDS empfohlen.
Folgedosen von je 100 mg/kg Körpergewicht (1,25 ml/kg) können in Abständen von ca. 12 Stunden verabreicht werden, falls anzunehmen ist, dass ein RDS die Ursache eines unveränderten oder sich verschlechternden respiratorischen Zustand des Kindes ist (maximale Gesamtdosis 300-400 mg/kg).
Art der Anwendung:
Zur intratrachealen oder intrabronchialen Instillation.
Hinweise zur Aufbereitung des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
Das Einzeldosisbehältnis sollte vor Gebrauch auf Raumtemperatur erwärmt, z. B. indem das Produkt für einige Minuten in der Hand gehalten wird, und leicht umgeschwenkt werden, um eine einheitliche Suspension zu erhalten.
Curosurf® kann verabreicht werden:
a. durch Trennung des Kindes vom Respirator
Nach kurzfristiger Trennung des Kindes vom Respirator werden 2,5 ml/kg (200 mg/kg) Suspension als Einzelbolus direkt in die untere Trachea über die Trachealsonde instilliert. Nach ca. einminütiger druckkontrollierter manueller Beatmung wird das Kind wieder an den Respirator angeschlossen mit der gleichen Respirator-Einstellung wie vor der Verabreichung. Gegebenenfalls erforderliche weitere Dosen (1,25 ml/kg) können auf dieselbe Weise verabreicht werden.
oder
b. ohne Trennung des Kindes vom Respirator
Instillation von 2,5 ml/kg (200 mg/kg) Suspension, als Einzelbolus, direkt in die untere Trachea durch Einführen eines Katheters durch den Absaugport und in die Trachealsonde. Gegebenenfalls erforderliche weitere Dosen (1,25 ml/kg) können auf dieselbe Weise verabreicht werden.
c. INtubation SURfactant Extubation - INSURE
Stand: Oktober 2016
Es gibt eine dritte Möglichkeit der Verabreichung von Curosurf® durch eine Trachealsonde im Kreißsaal vor Beginn der maschinellen Beatmung - in diesem Fall wird eine manuelle Beatmungsmethode angewendet. Die Extubation mit nachfolgendem Übergang auf CPAP kann dabei entweder im Kreißsaal oder nach Ankunft in der Neugeborenenstation durchgeführt werden.
d. Wenig Invasive Surfactant-Verabreichung mittels eines dünnen Katheters (LISA = Less Invasive Surfactant Administration)
Bei spontan atmenden Frühgeborenen kann Curosurf® alternativ mittels des sog. LISA-Verfahrens verabreicht werden. Die Dosierung entspricht den Angaben unter a. und b. Ein Katheter mit kleinem Durchmesser wird unter Visualisierung der Stimmbänder mittels Laryngoskopie direkt in die untere Trachea des Kindes platziert. Die CPAP-Beatmung stellt dabei die kontinuierliche spontane Atmung sicher. Curosurf® wird als Einzelbolus über 0,5 bis 3 Minuten instilliert. Nach der Instillation wird der Katheter sofort entfernt. Die CPAP-Beatmung sollte während der gesamten Verabreichung beibehalten werden.
Für die Surfactant-Verabreichung sollten dünne, für diesen Zweck CE-zertifizierte Katheter verwendet werden.
Besondere Patientengruppen
Leber- oder Nierenfunktionsstörungen
Die Sicherheit und Wirksamkeit von Curosurf® bei Patienten mit Leber- oder Nierenfunktionsstörungen sind nicht untersucht worden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. Erfahrungen bei Frühgeborenen mit Atemstörungen infolge von Aspirationssyndromen liegen bisher nicht vor.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Vor der Curosurf®-Gabe sollte eine Stabilisierung der Vitalfunktionen des Frühgeborenen erreicht sein. Für die optimale Wirkung von Curosurf® sind die Korrekturen von Azidose, Hypotension, Anämie, Hypoglykämie und Hypothermie Voraussetzung.
Curosurf® wird endotracheopulmonal verabreicht bei Kindern, deren Herzfrequenz und arterielle
Sauerstoffkonzentration oder Sauerstoffsättigung kontinuierlich überwacht wird, wie es in Neugeborenenabteilungen üblicherweise durchgeführt werden kann.
Bei einem Reflux sollte die Curosurf® -Gabe abgebrochen und, falls erforderlich, der maximale Inspirationsdruck am Respirator in begrenztem Maße solange erhöht werden, bis die Trachealsonde wieder frei ist.
Bei Kindern, bei denen es während oder kurz nach der Verabreichung zu einer deutlichen Beeinträchtigung der Beatmung kommt, ist die Trachealsonde möglicherweise mit Schleim verstopft, insbesondere wenn bereits vor der Verabreichung auffallend viel Lungensekret vorhanden war. Das Absaugen des Sekrets von Kindern vor der Verabreichung von Curosurf® kann die Wahrscheinlichkeit für Verstopfungen der Trachealsonde mit Schleim verringern.
Stand: Oktober 2016
Wenn Verdacht auf eine Verstopfung der Trachealsonde besteht und das Absaugen die Verstopfung nicht beseitigen kann, sollte die Trachealsonde unverzüglich ersetzt werden.
Ein Absaugen der Trachealsekrete für die Dauer von mindestens 6 Stunden nach der Verabreichung wird nicht empfohlen, außer wenn ein lebensbedrohlicher Zustand vorliegt.
Beim Auftreten von Bradykardie, Hypotonie und verminderter Sauerstoffsättigung (siehe Abschnitt 4.8) sollte die Curosurf®-Gabe abgebrochen und geeignete Maßnahmen zur Normalisierung der Herzfrequenz in Erwägung gezogen und gegebenenfalls ergriffen werden. Nach Stabilisierung kann die Behandlung unter geeigneter Überwachung der Vitalfunktionen fortgesetzt werden.
Nach der Curosurf® -Gabe kann sich die Lungenausdehnung (Lungencompliance) sehr schnell verbessern, was eine sofortige Reduktion des maschinellen inspiratorischen Beatmungsdrucks (PIP) erfordert. Die Verbesserung der Lungenfunktion kann zu einem sehr schnellen Anstieg der arteriellen Sauerstoffkonzentration führen. Um eine Hyperoxie zu vermeiden, muss die inspiratorische Sauerstoffkonzentration entsprechend gesenkt werden.
Um angemessene Blutoxygenierungswerte aufrecht zu halten, ist neben regelmäßigen Blutgasanalysen auch eine kontinuierliche Kontrolle des transkutanen PaO2 oder der Sauerstoffsättigung ratsam.
Zur Fortsetzung der Behandlung kann auch eine nCPAP (nasal continuous positive airway pressure)- Atemunterstützung eingesetzt werden, allerdings nur auf Stationen, die für die Durchführung dieser Technik ausgerüstet sind.
Mit Surfactant behandelte Kinder sollten sorgfältig auf Anzeichen einer Infektion überwacht werden. Bei den frühesten Anzeichen einer Infektion sollte das Kind sofort eine geeignete Antibiotikumtherapie erhalten.
Bei unbefriedigendem Ansprechen auf die Behandlung mit Curosurf® oder einem schnellen Rückfall ist es ratsam, vor Verabreichung der nächsten Dosis an die Möglichkeit anderer Komplikationen der Unreife zu denken, wie ein persistierender Ductus arteriosus Botalli oder andere Lungenerkrankungen wie eine Pneumonie.
Es ist zu erwarten, dass die Surfactant-Gabe die Schwere des RDS vermindert; es ist jedoch nicht zu erwarten, dass die Mortalität und Morbidität bei Frühgeburten vollständig reduziert wird, da Frühgeborene im Zusammenhang mit ihrer Unreife noch andere Komplikationen aufweisen. Einem Bericht zufolge kam es nach Curosurf®-Gabe zu einer vorübergehenden Depression der hirnelektrischen Aktivität von 2 bis 10 Minuten Dauer. Dies wurde jedoch nur in einer Studie beobachtet, und die Auswirkungen sind unklar.
Bei Verabreichung von Curosurf® mittels des LISA-Verfahrens ist über eine Zunahme von Bradykardien, Apnoen und reduzierter Sauerstoffsättigung berichtet worden. Diese Nebenwirkungen sind von kurzer Dauer, haben keine Konsequenzen für die Verabreichung und sind einfach zu behandeln. Sind diese Nebenwirkungen als schwerwiegend einzustufen, sollte die Surfactantgabe beendet und die Komplikationen behandelt werden.
Neugeborene nach länger als drei Wochen zurückliegendem Blasensprung der Mutter sprechen möglicherweise nicht optimal auf Curosurf® an.
Stand: Oktober 2016
Zu anderen Initialdosen als 100 oder 200 mg/kg, zu Gaben in kürzeren Abständen als 12 Stunden oder zum Beginn der Curosurf® -Gabe mehr als 15 Stunden nach Diagnose des RDS liegen keine Informationen vor.
Eine Therapie mit Curosurf® jenseits einer Grenze von 48 Stunden nach Stellung der Diagnose eines RDS verspricht im Allgemeinen keinen Erfolg mehr.
Die Curosurf® -Gabe bei Frühgeborenen mit schwerer Hypotonie wurde nicht untersucht.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt
4.6 Fertilität, Schwangerschaft und Stillzeit
Nicht zutreffend.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
Die unten aufgeführten Nebenwirkungen wurden während der durchgeführten klinischen Studien beobachtet und aus den Erfahrungen nach Produkteinführung abgeleitet. Sie werden nach dem Organklassensystem nach MedDrA angegeben.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Organklasse |
Nebenwirkung |
Häufigkeit |
|
Infektionen und parasitäre Erkrankungen |
Sepsis |
Gelegentlich |
|
Erkrankungen des Nervensystems |
Intrakranielle Blutungen |
Gelegentlich |
|
Herzerkrankungen |
Bradykardie |
Selten |
|
Gefäßerkrankungen |
Hypotonie |
Selten |
|
Erkrankungen der Atemwege, des Brustraums und des Mediastinums |
Bronchopulmonale Dysplasie |
Selten |
|
Pneumothorax |
Gelegentlich | |
|
Pulmonale Blutungen |
Selten | |
|
Hyperoxie |
Nicht bekannt | |
|
Neonatale Cyanose |
Nicht bekannt | |
|
Apnoe |
Nicht bekannt | |
|
Untersuchungen |
Erniedrigte |
Selten |
Stand: Oktober 2016
|
Sauerstoffsättigung | ||
|
Abnormes Elektroenzephalogramm |
Nicht bekannt | |
|
Verletzung, Vergiftung, durch Eingriffe bedingte Komplikationen |
Komplikation bei endotrachealer Intubation |
Nicht bekannt |
Apnoe und Sepsis können als Folge der Unreife der Neugeborenen auftreten.
Das Auftreten intrakranieller Blutungen nach der Curosurf®-Verabreichung wurde mit der Verringerung des mittleren arteriellen Blutdrucks und der frühen Peaks des arteriellen Sauerstoffdrucks (PaO2) in Verbindung gebracht. Hohe PaO2-Peaks sind zu vermeiden, indem nach der Verabreichung umgehend die Beatmung und die Konzentration des zugeführten O2 angepasst wird.
In den bisher durchgeführten klinischen Studien wurde eine höhere Inzidenz eines persistierenden Ductus arteriosus Botalli bei den mit Curosurf® behandelten Neugeborenen beobachtet (wie auch bei anderen Surfactants).
Eine Bildung von Antikörpern gegen die Proteinkomponenten von Curosurf® wurde beobachtet, jedoch konnte keine klinische Relevanz festgestellt werden.
Frühgeborene zeigten ein erhöhtes Auftreten zerebraler Blutungen und zerebraler Ischämien, die sich als periventrikuläre Leukomalazie und in hämodynamischen Anomalien äußerten, wie zum Beispiel ein persistierender Ductus arteriosus Botalli und die persistierende fetale Blutzirkulation neben der intensivmedizinischen Versorgung. Diese Neugeborenen haben ebenso ein erhöhtes Infektionsrisiko, zum Beispiel für Pneumonie und Bakteriämie (Septikämie). Krämpfe können ebenfalls in der perinatalen Zeit auftreten. Frühgeborene entwickeln häufig hämatologische Probleme und Störungen im Elektrolythaushalt, die sich bei schweren Erkrankungen und mechanischer Beatmung verschlimmern können. Um die Darstellung der frühgeburtlichen Komplikationen zu vervollständigen, werden folgende Erkrankungen genannt, die mit der Schwere der Erkrankung und der mechanischen Beatmung direkt in Verbindung gebracht werden: Pneumothorax, interstitielles Lungenemphysem und pulmonale Blutungen. Der längere Einsatz hoher Sauerstoffkonzentrationen und mechanischer Beatmung werden mit der Entstehung von bronchopulmonaler Dysplasie und frühgeburtlicher Retinopathie in Verbindung gebracht.
LISA-V erfahren
In klinischen Studien wurde eine Zunahme einiger kurzzeitiger und milder Nebenwirkungen ohne Konsequenzen für die Verabreichung in der LISA-Gruppe im Vergleich zur Kontroll-Gruppe mit der Standard-Therapie beobachtet, insbesondere: erniedrigte Sauerstoffsättigung (57,4 % in der LISA-Gruppe vs. 26,6 % in der Kontroll-Gruppe), Apnoe (21,8 % vs. 12,8 %), Bradykardie (11,9 % vs. 2,8%), Schaum vor dem Mund (21,8 % vs. 2,8%), Husten (7,9 % vs. 0,9 %), Würgen (6,9 % vs. 1,8 %) und Niesen (5 % vs. 0). Diese Unterschiede zwischen den beiden Gruppen können mit dem selteneren Einsatz von Sedativa in der LISA-Gruppe im Vergleich zur Standard-Therapie-Gruppe begründet werden. Die Mehrzahl dieser unerwünschten Ereignisse ließ sich einfach behandeln.
Während einer forschungsinitiierten klinischen Vergleichsstudie (NINSAPP) wurden einige Fälle von nekrotisierender Enterokolitis, die eines operativen Eingriffs bedurften (8,4 % in der
LISA-Gruppe und 3,8 % in der Gruppe mit Standard-Verabreichung mit Intubation und maschineller Beatmung), und fokaler Darmperforationen, die eines operativen Eingriffs bedurften (11,2 % in der LISA-Gruppe und 10,6 % in der Kontroll-Gruppe) berichtet. Die Unterschiede zwischen den beiden Gruppen waren nicht statistisch signifikant. Bei diesen unerwünschten Ereignissen kann es sich sowohl um frühgeburtliche Komplikationen als auch um Folgen anderer Behandlungen dieser Frühgeborener handeln.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bisher liegen keine Berichte über eine Überdosierung nach Curosurf®-Gabe vor. Im unwahrscheinlichen Fall einer unabsichtlichen Überdosierung und nur wenn eindeutige klinische Wirkungen auf die Atmung, Beatmung oder Oxygenierung des Kindes vorliegen, sollte soviel Suspension wie möglich abgesaugt werden und das Kind eine unterstützende Behandlung erhalten; dabei ist besondere Aufmerksamkeit auf den Flüssigkeits- und Elektrolythaushalt zu richten.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Grenzflächenaktive Phospholipide (Surfactant).
ATC Code: R07AA02
Wirkmechanismus
Lungensurfactant ist eine Wirkstoffzubereitung mit vorwiegend Phospholipiden und spezifischen Proteinen, welche die innere Oberfläche der Alveolen auskleidet und die Oberflächenspannung in der Lunge zu reduzieren vermag.
Die Oberflächenspannung mindernde Aktivität von Surfactant stabilisiert die Alveolen und vermeidet einen Alveolenkollaps am Ende der Exspirationsphase, so dass ein adäquater Gasaustausch während des Atmungszyklus gewährleistet wird.
In vitro senkt Curosurf® die minimale Oberflächenspannung auf < 4 mN/m, gemessen mittels Wilhelmy Balance Systems.
Stand: Oktober 2016
Ein Mangel an Surfactant, gleich aus welchem Grunde, führt zu einem schweren Atemversagen, das bei Frühgeborenen als Atemnotsyndrom (RDS) oder hyaline Membranerkrankung (HMD) bekannt ist. RDS ist die Hauptursache der akuten Frühgeborenensterblichkeit und -erkrankung und kann zu respiratorischen und neurologischen Folgeschäden führen.
Curosurf® wurde entwickelt, um den Mangel an endogen produziertem Lungensurfactant durch die intratracheale Verabreichung von exogenem Surfactant zu beheben.
Die Oberflächeneigenschaften von Curosurf® begünstigen seine uniforme Verteilung in der Lunge und seine Ausbreitung an der alveolaren Grenzfläche. Die physiologische und therapeutische Wirkung von Curosurf® bei Surfactant-Mangel wurde in verschiedenen Tierversuchen ausführlich dokumentiert.
Pharmakodynamik
Bei unreifen Kaninchenföten bewirkte die Gabe von Curosurf® eine deutliche Verbesserung der Lungenentfaltung. Bei frühgeborenen Kaninchen, die mit 100 % Sauerstoff beatmet wurden, sah man im Vergleich zu den Kontrolltieren eine ausgeprägte Verbesserung des Atemzugvolumens und der Lungencompliance nach Verabreichung von Curosurf® über eine Trachealkanüle. Die Behandlung von frühgeborenen Kaninchen mit Curosurf® - bei Beibehaltung eines standardisierten Atemzugvolumens von ungefähr 10 ml/kg KG - erhöhte die Lungencompliance auf mit reifen Neugeborenentieren vergleichbare Werte.
Klinische Wirksamkeit und Sicherheit
Bei Kindern mit RDS und einem Geburtsgewicht zwischen 600 und 2000 g sowie einem Therapiebeginn bis spätestens 48 Stunden nach Stellung der Diagnose belegen große internationale Studien die therapeutische Wirksamkeit von Curosurf®. Mit Curosurf® behandelte Frühgeborene (Einzeldosis 200 mg/kg KG bzw. 2,5 ml/kg KG) zeigten eine rasche und ausgeprägte Verbesserung der Oxygenierung, verbunden mit einer Erhöhung des arteriellen Sauerstoffpartialdrucks (PaO2), des Quotienten arterieller Sauerstoffpartialdruck zu inspiratorischer Sauerstoffkonzentration (PaO2/FiO2) und des Verhältnisses von arteriellem zu alveolarem Sauerstoffpartialdruck (a/APO2) und mit einer Reduzierung der inspiratorischen Sauerstoffkonzentration (FiO2). Die Mortalität und Inzidenz schwerer Lungenkomplikationen wurde durch Curosurf® gesenkt. Die Gabe einer 2. oder 3. Dosis von 100 mg/kg führte zu einer weiteren Reduktion von Mortalität und Pneumothorax-Inzidenz.
In einer klinischen Vergleichsstudie (NINSAPP) wurden die Anwendungsmethoden von Curosurf® bei zwei Gruppen von Frühgeborenen mit RDS und einem Gestationsalter zwischen 23 und 27 Wochen miteinander verglichen: das LISA-Verfahren (N=108) mit dem StandardVerfahren (Intubation, Administration, maschinelle Beatmung; N=105). Das LISA-Verfahren war dem Standard-Verfahren in Bezug auf den primären Endpunkt (Überleben ohne Bronchopulmonale Dysplasie im Gestationsalter von 36 Wochen) nicht unterlegen. In Bezug auf die sekundären Endpunkte Erhöhung der Überlebensrate ohne schwere Komplikationen und Reduktion der Häufigkeit anderer Morbiditäten im Zusammenhang mit der Frühgeburtlichkeit war das LISA-Verfahren dem Standard-Verfahren überlegen. Die Notwendigkeit der maschinellen Beatmung war in der LISA-Gruppe signifikant reduziert.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach intratrachealer Gabe verbleibt Curosurf® bei neugeborenen Kaninchen hauptsächlich in der Lunge mit einer Halbwertszeit des 14C-markierten Dipalmitoylphosphatidylcholins von 67
Stand: Oktober 2016
Stunden. 48 Stunden nach Gabe können im Serum und in anderen Organen als der Lunge lediglich Spuren von Surfactant-Lipiden gefunden werden.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Die intratracheale Verabreichung von Curosurf® (200 mg/kg) rief bei gesunden, d. h. nicht surfactantdefizienten Ratten, Mäusen, Meerschweinchen, Hunden und Kaninchen vereinzelt respiratorische Symptome hervor, die auf eine übermäßige Volumenbelastung der Atemwege durch die Flüssigkeit zurückgeführt werden können.
Nach intraperitonealer Applikation verursachte Curosurf® ab 1000 mg/kg bei Maus und Ratte eine Piloarrektion und Hypoaktivität.
Stand: Oktober 2016
Toxizität bei wiederholter Gabe
Bei intraperitonealer Applikation von Curosurf® (600 mg/kg/die) über 4 Wochen an der Ratte kam es in der Leber zum Auftreten von minimaler bis moderater zentrilobulärer Hepatozyten-Vakuolisierung und zu vakuolärer Degeneration, was nach intraperitonealer Gabe von hohen Lipiddosen zu erwarten ist. Am Injektionsort kam es zu akuter Entzündung und zur Fibrose.
Tests auf das allergene Potenzial von Curosurf® am Meerschweinchen verliefen negativ. Kanzerogenität
Untersuchungen zum kanzerogenen Potenzial von Curosurf® wurden nicht durchgeführt. Mutagenität
Untersuchungen zur Mutagenität von Curosurf® verliefen negativ.
Reproduktionstoxizität
Untersuchungen zur Reproduktionstoxizität von Curosurf® wurden nicht durchgeführt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumchlorid, Natriumhydrogencarbonat (für die pH-Wert-Einstellung), Wasser für Inj ektionszwecke.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Curosurf® ist 18 Monate haltbar. Die angegebene Dauer der Haltbarkeit bezieht sich auf das ungeöffnete und korrekt gelagerte Produkt.
Nach Anbruch sind eventuell in dem Einzeldosisbehältnis verbleibende Reste zu verwerfen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Kühl lagern und transportieren (2 °C - 8 °C).
Kühlkettenpflichtig!
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Ungeöffnete, nicht benutzte Einzeldosisbehältnisse, die auf Raumtemperatur erwärmt wurden, können innerhalb von 24 Stunden für den anschließenden Gebrauch wieder im Kühlschrank gelagert werden.
Nicht häufiger als 1x auf Raumtemperatur erwärmen und anschließend wieder im Kühlschrank lagern.
6.5 Art und Inhalt des Behältnisses
Einzeldosisbehältnis aus farblosem, transparentem Glas zu 10 ml, mit Chlorobutyl-Gummistopfen verschlossen und einem Flip-Off-Plastik-Aluminium-Verschluss.
Stand: Oktober 2016
Packungsgrößen
Curosurf® 120 mg:
1 Einzeldosisbehältnis mit 1,5 ml Suspension.
Curosurf® 240 mg:
1 Einzeldosisbehältnis mit 3 ml Suspension.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Vor Gebrauch sollte das Einzeldosisbehältnis auf Raumtemperatur erwärmt und vorsichtig und leicht umgeschwenkt werden, um eine homogene Suspension zu erhalten.
Die Suspension sollte mit einer sterilen Kanüle und Spritze aus dem Einzeldosisbehältnis entnommen werden.
Um die Suspension zu entnehmen, befolgen Sie sorgfältig die folgende Anleitung:
1) Lokalisieren Sie die Nut (FLIP 'b UP) auf der farbigen Plastikkappe.
2) Heben Sie die Nut an und ziehen Sie sie hoch.
3) Ziehen Sie die Plastikkappe mit dem Aluminiumverschluss nach unten.
4) und 5) Entfernen Sie den gesamten Aluminiumring.
6) und 7) Entfernen Sie den Gummistopfen, um den Inhalt zu entnehmen.
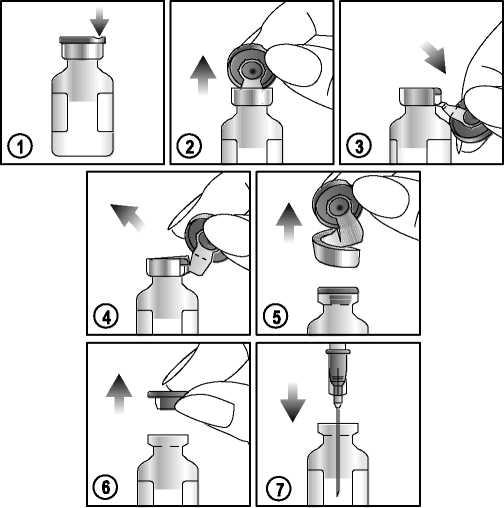
Nur für den einmaligen Gebrauch bestimmt. Nach Anbruch sind eventuell in dem Einzeldosisbehältnis verbleibende Reste zu verwerfen. Unbenutzte Suspension nicht für den späteren Gebrauch aufbewahren.
Stand: Oktober 2016
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
Chiesi GmbH
Gasstraße 6
22761 Hamburg
Tel.: 040 89724-0
Fax: 040 89724-212
E-Mail: info.de@chiesi.com
8. ZULASSUNGSNUMMER(N)
Curosurf8 120 mg: 29016.00.00 Curosurf® 240 mg: 29016.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung 08. Oktober 1993 Datum der letzten Verlängerung der Zulassung 01.März 2010
10. STAND DER INFORMATION
Oktober 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Stand: Oktober 2016
Seite 12 von 12
SmPC(V4.0)2016-10