Decortin 50 Mg Tabletten
1. BEZEICHNUNG DER ARZNEIMITTELS
Decortin® 5 mg Tabletten Decortin® 20 mg Tabletten Decortin® 50 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Prednison
Decortin 5 mg Tabletten:
1 Tablette enthält 5 mg Prednison.
Decortin 20 mg Tabletten:
1 Tablette enthält 20 mg Prednison.
Decortin 50 mg Tabletten:
1 Tablette enthält 50 mg Prednison.
Sonstige Bestandteile: Enthält Lactose. Siehe Abschnitt 4.4 Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Decortin 5 mg Tabletten: weiße, runde Tablette mit Teilungsrille und Prägung auf der Tablettenoberseite „EM 18“.
Decortin 20 mg Tabletten: weiße, runde Tablette mit Kreuzbruchrille und Prägung auf der Tablettenoberseite „EM 76“.
Decortin 50 mg Tabletten: weiße, runde Tablette mit Kreuzbruchrille und Prägung auf der Tablettenoberseite „EM 29“.
Die Tablette kann in gleiche Hälften (5mg) bzw. gleiche Viertel (20mg/50mg) geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Decortin 5 mg /20 mg /50 mg Tabletten sind angezeigt zur Behandlung von Erkrankungen, die einer systemischen Therapie mit Glucocorticoiden bedürfen. Hierzu gehören je nach Erscheinungsform und Schweregrad (Dosierungsschemata (DS: a bis d) s. Abschnitt 4.2. Dosierung):
Decortin wird angewendet bei Erwachsenen, Kindern aller Altersgruppen und Jugendlichen.
Substitutionstherapie:
- Nebennierenrinden-Insuffizienz jeglicher Genese (z.B. M. Addison, adrenogenitales Syndrom, Adrenalektomie, ACTH-Mangel) jenseits des Wachstumsalters (Mittel der ersten Wahl sind Hydrocortison und Cortison)
- Stresszustände nach langfristiger Corticoidtherapie
Rheumatologie:
- aktive Phasen von Systemvaskulitiden:
- Panarteriitis nodosa (DS: a, b, bei positiver Hepatitis-B-Serologie Behandlungsdauer auf zwei Wochen begrenzt)
- Riesenzellarteriitis, Polymyalgia rheumatica (DS: c)
- Arteriitis temporalis (DS: a, bei akutem Visusverlust initial hochdosierte intravenöse Stoßtherapie mit Glucocorticoiden und Dauertherapie unter Kontrolle der BSG)
- Wegener‘sche-Granulomatose: Induktionstherapie (DS: a-b) in Kombination mit Methotrexat (leichtere Verlaufsformen ohne Nierenbeteiligung) oder nach dem Fauci-Schema (schwere Verlaufsformen mit Nieren und/oder Lungenbeteiligung), Remissionserhaltung: (DS: d, ausschleichend) in Kombination mit Immunsuppressiva
- Churg-Strauss-Syndrom: Initialtherapie (DS: a-b), bei Organmanifestationen und schweren Verläufen in Kombination mit Immunsuppressiva, Remissionserhaltung (DS: d)
- aktive Phasen von rheumatischen Systemerkrankungen (DS: a, b):
- systemischer Lupus erythematodes
- Polymyositis/Polychondritis chronica atrophicans
- Mischkollagenosen
- aktive rheumatoide Arthritis (DS: a bis d) mit schweren progredienten Verlaufsformen, z. B. destruierend verlaufende Formen (DS: a) und/oder extraartikulären Manifestationen (DS: b)
- andere entzündlich-rheumatische Arthritiden, sofern die Schwere des Krankheitsbildes es erfordert und nicht-steroidale Antirheumatika (NSARs) nicht angewandt werden können:
- Spondarthritiden (Spondylitis ankylosans mit Beteiligung peripherer Gelenke (DS: b, c), Arthritis psoriatica (DS: c, d), enteropathische Arthropathie mit hoher Entzündungsaktivität (DS: a)
- Reaktive Arthritiden (DS: c)
- Arthritis bei Sarkoidose (DS: b initial)
- Karditis bei rheumatischem Fieber, bei schweren Fällen über 2-3 Monate (DS: a)
- Juvenile idiopathische Arthritis mit schwerer systemischer Verlaufsform (Still-Syndrom) oder mit lokal nicht beeinflussbarer Iridozyklitis (DS: a)
Pneumonologie:
- Asthma bronchiale (DS: c bis a), gleichzeitig empfiehlt sich die Verabreichung von Bronchodilatatoren
- akute Exacerbation einer COPD (DS: b), empfohlene Therapiedauer bis zu 10 Tage
- interstitielle Lungenerkrankungen wie akute Alveolitis (DS: b), Lungenfibrose (DS: b), Bronchiolitis obliterans organisierende Pneumonie (BOOP) (DS: b ausschleichend), ggf. in Kombination mit Immunsuppressiva, chronische eosinophile Pneumonie (DS: b ausschleichend), zur Langzeittherapie chronischer Formen der Sarkoidose in den Stadien II und III (bei Atemnot, Husten und Verschlechterung der Lungenfunktionswerte) (DS: b)
- Prophylaxe des Atemnotsyndroms bei Frühgeborenen (DS: b, zweimalig)
Erkrankungen der oberen Luftwege:
- schwere Verlaufsformen von Pollinosis und Rhinitis allergica, nach Versagen intranasal verabreichter Glucocorticoide (DS: c)
- akute Kehlkopf- und Luftröhrenstenosen: Quincke-Ödem, obstruktive Laryngitis subglottica (Pseudo-Krupp) (DS: b bis a)
Dermatologie:
Erkrankungen der Haut und Schleimhäute, die aufgrund ihres Schweregrades und/oder Ausdehnung bzw. Systembeteiligung nicht oder nicht ausreichend mit topischen Glucocorticoiden behandelt werden können. Dazu gehören:
- allergische, pseudoallergische und infektallergische Erkrankungen: z.B. akute Urtikaria, anaphylaktoide Reaktionen, Arzneimittelexantheme, Erythema exsudativum multiforme, toxische epidermale Nekrolyse (Lyell-Syndrom), Pustulosis acuta generalisata, Erythema nodosum, akute febrile neutrophile Dermatose (Sweet-Syndrom), allergisches Kontaktekzem (DS: b bis a)
- Ekzemerkrankungen: z.B. atopisches Ekzem, Kontaktekzeme, mikrobielles (nummuläres) Ekzem (DS: b bis a)
- granulomatöse Erkrankungen: z.B. Sarkoidose, Cheilitis granulomatosa (monosymptomatisches Melkersson-Rosenthal-Syndrom) (DS: b bis a)
- bullöse Dermatosen: z.B. Pemphigus vulgaris, bullöses Pemphigoid, benignes Schleimhautpemphigoid, IgA-lineare Dermatose (DS: b bis a)
- Vaskulitiden: z.B. Vasculitis allergica, Polyarteriitis nodosa (DS: b bis a)
- Autoimmunerkrankungen: z. B. Dermatomyositis, systemische Sklerodermie (indurative Phase), chronisch discoider und subakut cutaner Lupus erythematodes (DS: b bis a)
- Schwangerschaftsdermatosen (s.a. Punkt 4.6): z.B. Herpes gestationis, Impetigo herpetiformis (DS: d bis a)
- Erythemato-squamöse Dermatosen: z.B. Psoriasis pustulosa, Pityriasis rubra pilaris, Parapsoriasis-Gruppe (DS: c bis a)
- Erythrodermien, auch bei Sezary-Syndrom (DS: c bis a)
- andere Erkrankungen: z.B. Jarisch-Herxheimer-Reaktion bei Penicillinbehandlung der Lues, schnell und verdrängend wachsendes kavernöses Hämangiom, Morbus Beh?et, Pyoderma gangraenosum, Eosinophile Fasciitis, Lichen ruber exanthematicus, Epidermolysis bullosa hereditaria (DS: c bis a)
Hämatologie/Onkologie:
- Autoimmunhämolytische Anämie (DS: c bis a), Idiopathische Thrombozytopenische Purpura (Morbus Werlhof) (DS: a), akute intermittierende Thrombozytopenie (DS: a)
- akute lymphoblastische Leukämie, Morbus Hodgkin, Non-Hodgkin-Lymphome, chronische lymphatische Leukämie, Morbus Waldenström, multiples Myelom (DS: e)
- Hyperkalzämie bei malignen Grunderkrankungen (DS: c bis a)
- Prophylaxe und Therapie von Zytostatika-induziertem Erbrechen (DS: b bis a), Anwendung im Rahmen antiemetischer Schemata
- Palliativtherapie maligner Erkrankungen
Hinweis: Prednison kann zur Symptomlinderung, z. B. bei Inappetenz, Anorexie und allgemeiner Schwäche bei fortgeschrittenen malignen Erkrankungen nach Ausschöpfung spezifischer Therapiemöglichkeiten angewendet werden. Einzelheiten sind der aktuellen Fachliteratur zu entnehmen.
Neurologie (DS: a):
- Myasthenia gravis (Mittel der l. Wahl ist Azathioprin)
- chronisches Guillain-Barre-Syndrom
- Tolosa-Hunt-Syndrom
- Polyneuropathie bei monoklonaler Gammopathie
- Multiple Sklerose (zum oralen Ausschleichen nach hochdosierter parenteraler
Glucocorticoidgabe im Rahmen eines akuten Schubes)
- BNS-Krämpfe
Infektologie:
- toxische Zustände im Rahmen schwerer Infektionskrankheiten (in Verbindung mit Antibiotika/Chemotherapie), z. B. tuberkulöse Meningitis (DS: b), schwere Verlaufsform einer Lungentuberkulose (DS: b)
Augenkrankheiten (DS: b bis a):
- bei Systemerkrankungen mit Augenbeteiligung und bei immunologischen Prozessen in der Orbita und im Auge: Optikusneuropathie (z.B. Riesenzellarteriitis, anteriore ischämische Optikusneuropathie (AION), traumatische Optikusneuropathie), Morbus Beh?et, Sarkoidose, endokrine Orbitopathie, Pseudotumor der Orbita, Transplantatabstoßung und bei bestimmten Uveitiden wie Harada-Erkrankung und sympathischer Ophthalmie
- bei folgenden Erkrankungen ist die systemische Gabe nur nach erfolgloser lokaler Behandlung indiziert: Skleritis, Episkleritis, Keratitiden, chronische Zyklitis, Uveitis, allergische Konjunktivitis, Alkaliverätzungen, in Verbindung mit antimikrobieller Therapie bei autoimmunologischer oder Syphilis-assoziierter interstitieller Keratitis, bei stromaler Herpes simplex-Keratitis nur bei intaktem Hornhautepithel und regelmäßiger augenärztlicher Kontrolle
Gastroenterologie/Hepatologie:
- Colitis ulcerosa (DS: b bis c)
- Morbus Crohn (DS: b)
- Autoimmunhepatitis (DS: b)
- Ösophagusverätzung (DS: a)
Nephrologie:
- Minimal Change Glomerulonephritis (DS: a)
- Extrakapillär-proliferative Glomerulonephritis (rapid progressive Glomerulonephritis) (DS: hochdosierte Stoßtherapie, in der Regel in Kombination mit Zytostatika), bei Goodpasture-Syndrom Abbau und Beendigung der Behandlung, bei allen anderen Formen langfristige Fortführung der Therapie (DS: d)
- idiopathische retroperitoneale Fibrose (DS: b)
4.2 Dosierung und Art der Anwendung
Dosierung
Die Höhe der Dosierung ist abhängig von der Art und Schwere der Erkrankung und vom individuellen Ansprechen des Patienten. Im Allgemeinen werden relativ hohe Initialdosen angewendet, die bei akuten schweren Verlaufsformen deutlich höher sein müssen als bei chronischen Erkrankungen. Je nach klinischer Symptomatik und Ansprechverhalten kann unterschiedlich schnell auf eine möglichst niedrige Erhaltungsdosis (im Allgemeinen zwischen 5 und 15 mg Prednison täglich) reduziert werden. Speziell bei chronischen Erkrankungen ist oft eine Langzeitbehandlung mit niedrigen Erhaltungsdosen erforderlich.
Soweit nicht anders verordnet, gelten folgende Dosierungsempfehlungen:
Substitutionstherapie (jenseits des Wachstumsalters)
5 bis 7,5 mg Prednison/Tag, verteilt auf zwei Einzeldosen (morgens und mittags, bei adrenogenitalem Syndrom morgens und abends). Die Abenddosis beim adrenogenitalen Syndrom soll den nächtlichen ACTH-Anstieg vermindern und damit einer Nebennierenrinden-Hyperplasie entgegenwirken. Erforderlichenfalls zusätzliche Gabe eines Mineralocorticoids (Fludrocortison). Bei besonderen körperlichen Belastungen (z.B. Trauma, Operation), interkurrenten Infekten usw. kann eine Dosiserhöhung um das 2-3fache, bei extremen Belastungen (z.B. Geburt) bis zum 10fachen notwendig werden.
Stresszustände nach langfristiger Glucocorticoid-Therapie: frühzeitig bis zu 50 mg Prednison/Tag. Dosisabbau über mehrere Tage.
Pharmakotherapie
Die folgenden Tabellen geben unter Verweis auf die aktuelle Fachliteratur eine Übersicht über die allgemeinen Dosierungsrichtlinien:
|
Dosierung |
Dosis in mg /Tag |
Dosis in mg / kg KG /Tag |
|
a) Hohe |
80 - 100 (250) |
1,0 - 3,0 |
|
b) Mittlere |
40 - 80 |
0,5 - 1,0 |
|
c) Niedrige |
10 - 40 |
0,25 - 0,5 |
|
d) Sehr niedrige |
1,5 - 7,5 (10) |
./. |
|
e) Kombinationschemotherapie siehe Dosierungsschema „e“ (DS: e) | ||
Im Allgemeinen wird die gesamte Tagesdosis frühmorgens zwischen 6.00 und 8.00 Uhr eingenommen (zirkadiane Therapie). Hohe Tagesdosen können in Abhängigkeit von der Erkrankung jedoch auch auf 2-4, mittlere Tagesdosen auf 2-3 Einzelgaben verteilt werden.
Kinder
|
Dosierung |
Dosis in mg / kg KG /Tag |
|
Hohe Dosierung |
2 - 3 |
|
Mittlere Dosierung |
1 - 2 |
|
Erhaltungsdosis |
0,25 |
Bei Kindern (im Wachstumsalter) sollte die Therapie möglichst alternierend oder intermittierend erfolgen. In besonderen Fällen (z.B. BNS-Krämpfe), kann von dieser Empfehlung abgewichen werden.
Dosisreduktion
Nach Eintritt der klinisch erwünschten Wirkung und in Abhängigkeit von der Grunderkrankung wird mit der Dosisreduktion begonnen. Bei Verteilung der Tagesdosis auf mehrere Einzeldosen wird zunächst die abendliche Dosis, dann die etwaige Mittagsdosis reduziert. Die Dosis wird zunächst in etwas größeren Schritten, ab ca. 30 mg/Tag in kleineren Stufen reduziert. Die klinische Situation entscheidet über den völligen Dosisabbau oder die Notwendigkeit einer Erhaltungsdosis. Unter Beobachtung der Krankheitsaktivität können für die Dosisreduktion die folgenden Schritte als Orientierung dienen:
|
über 30 mg/Tag |
Reduktion um |
10 |
mg |
alle |
2 - 5 Tage, |
|
bei 30 bis 15 mg/Tag |
Reduktion um |
5 |
mg |
jede Woche, | |
|
bei 15 bis 10 mg/Tag |
Reduktion um |
2,5 |
mg |
alle |
1 - 2 Wochen, |
|
bei 10 bis 6 mg/Tag |
Reduktion um |
1 |
mg |
alle |
2 - 4 Wochen, |
|
unter 6 mg/Tag |
Reduktion um |
0,5 |
mg |
alle |
4 - 8 Wochen |
Hohe und höchste Dosen, die über wenige Tage gegeben wurden, können in Abhängigkeit von der Grunderkrankung und dem klinischen Ansprechen ohne Ausschleichen abgesetzt werden.
Dosierungsschema „e“ (DS: e)
Die Therapie im Rahmen von Kombinationschemotherapien in onkologischen Anwendungsgebieten sollte sich an den aktuell gültigen Protokollen orientieren. Hierbei erfolgt in der Regel die Prednisongabe in einer Einmaldosis ohne erforderliches Ausschleichen zum Therapieende. Unter Verweis auf die Fachliteratur sind hier die jeweiligen Prednisondosierungen etablierter Chemotherapieprotokolle exemplarisch genannt:
- Non-Hodgkin-Lymphome: CHOP-Schema, Prednison 100 mg /m2, Tag 1-5; COP-Schema, Prednison 100 mg/m2, Tag 1-5.
- Chronisch lymphatische Leukämie: Knospe-Schema,
Prednison 75/50/25 mg, Tag 1-3.
- Morbus Hodgkin: COPP-ABVD-Schema, Prednison 40 mg /m2, Tag 1-14.
- Multiples Myelom: Alexanian-Schema, Prednison 2 mg /kg KG, Tag 1-4.
Art der Anwendung
Die Tabletten werden zu oder nach dem Essen, vornehmlich nach dem Frühstück, unzerkaut mit ausreichend Flüssigkeit eingenommen.
Bei der Pharmakotherapie mit Decortin ist zu prüfen, ob eine alternierende Gabe des Arzneimittels möglich ist. In Abhängigkeit von der zu behandelnden Grunderkrankung wird, sobald ein befriedigendes Behandlungsergebnis erreicht ist, die Dosis bis zur erforderlich erachteten Erhaltungsdosis reduziert oder beendet, gegebenenfalls unter Kontrolle des adrenalen Regelkreises.
Bei Hypothyreose oder bei Leberzirrhose können vergleichsweise niedrige Dosierungen ausreichen bzw. kann eine Dosisreduktion erforderlich sein.
Für die verschiedenen Dosierungen steht Decortin in Tabletten zu 5 mg, 20 mg und
50 mg zur Verfügung. Teilungsrillen bzw. Kreuzbruchrillen erlauben die jeweils erforderlichen
unterschiedlichen Einzeldosierungen.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Für die kurzfristige Anwendung bei vitaler Indikation gibt es sonst keine Kontraindikationen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Behandlung mit Decortin Tabletten kann durch die Immunsuppression zu einem erhöhten Risiko für bakterielle, virale, parasitäre, opportunistische sowie Pilzinfektionen führen. Die Symptomatik einer bestehenden oder sich entwickelnden Infektion kann verschleiert und somit die Diagnostik erschwert werden. Latente Infektionen, wie Tuberkulose oder Hepatitis B, können reaktiviert werden.
Eine Therapie mit Decortin sollte nur unter strengster Indikationsstellung und ggf. zusätzlicher gezielter antiinfektiöser Therapie durchgeführt werden bei folgenden Erkrankungen:
- akuten Virusinfektionen (Hepatitis B, Herpes zoster, Herpes simplex, Varizellen, Keratitis herpetica)
- HBsAg-positiver chronisch-aktiver Hepatitis
- ca. 8 Wochen vor bis 2 Wochen nach Schutzimpfungen mit Lebendimpfstoffen
- systemischen Mykosen und Parasitosen (z.B. Nematoden)
- bei Patienten mit Verdacht auf oder bestätigter Strongyloidiasis (Zwergfadenwurminfektion) können Glucocortikoide zur Aktivierung und Massenvermehrung der Parasiten führen
- Poliomyelitis
- Lymphadenitis nach BCG-Impfung
- akuten und chronischen bakteriellen Infektionen
- bei Tuberkulose in der Anamnese Anwendung nur unter Tuberkulostatika-Schutz
Zusätzlich sollte eine Therapie mit Decortin nur unter strenger Indikationsstellung und Überwachung, ggf. zusätzlicher spezifischer Therapie durchgeführt werden bei:
- Magen-Darm-Ulzera
- Osteoporose
- schwer einstellbarer Hypertonie
- schwer einstellbarem Diabetes mellitus
- psychiatrischen Erkrankungen (auch anamnestisch) einschließlich Suizidalität: neurologische oder psychiatrische Überwachung wird empfohlen
- Eng- und Weitwinkelglaukom; ophthalmologische Überwachung und begleitende Therapie
wird empfohlen
- Hornhautulcerationen und Hornhautverletzungen; ophthalmologische Überwachung und
begleitende Therapie wird empfohlen
Wegen der Gefahr einer Darmperforation darf Decortin nur bei zwingender Indikation und unter entsprechender Überwachung angewendet werden bei:
- schwerer Colitis ulcerosa mit drohender Perforation möglicherweise auch ohne peritoneale Reizung
- Divertikulitis
- Enteroanastomosen (unmittelbar postoperativ)
Die Zeichen einer peritonealen Reizung nach gastrointestinaler Perforation können bei Patienten, die hohe Dosen von Glucocorticoiden erhalten, fehlen.
Das Risiko von Sehnenbeschwerden, Tendinitis und von Sehnenrupturen ist erhöht, wenn Fluorchinolone und Glucocorticoide zusammen verabreicht werden.
Während der Anwendung von Decortin ist bei Diabetikern ein eventuell erhöhter Bedarf an Insulin oder oralen Antidiabetika zu berücksichtigen.
Während der Behandlung mit Decortin ist bei Patienten mit schwer einstellbarer Hypertonie eine regelmäßige Blutdruckkontrolle erforderlich.
Patienten mit schwerer Herzinsuffizienz sind sorgfältig zu überwachen, da die Gefahr einer Verschlechterung besteht.
Bei Behandlung einer Myasthenia gravis kann es initial zu einer Symptomverschlechterung kommen, weshalb die Einstellung auf Corticosteroide stationär erfolgen sollte. Insbesondere bei schwerer facio-pharyngealer Symptomatik und Minderung des Atemvolumens sollte die Therapie mit Decortin einschleichend begonnen werden.
Eine langdauernde Anwendung auch geringer Mengen von Prednison führt zu einem erhöhten Infektionsrisiko auch durch solche Mikroorganismen, die ansonsten selten Infektionen verursachen (sog. opportunistische Infektionen).
Impfungen mit Totimpfstoffen sind grundsätzlich möglich. Es ist jedoch zu beachten, dass die Immunreaktion und damit der Impferfolg bei höheren Dosierungen der Corticoide beeinträchtigt werden kann.
Bei einer langdauernden Therapie mit Decortin sind regelmäßige ärztliche Kontrollen (einschließlich augenärztlicher Kontrollen in dreimonatigen Abständen) angezeigt, bei vergleichsweise hohen Dosen ist auf eine ausreichende Kaliumzufuhr und auf Natriumrestriktion zu achten und der Serum-KaliumSpiegel zu überwachen.
Kommt es während der Behandlung mit Decortin zu besonderen körperlichen Stress-Situationen (fieberhaften Erkrankungen, Unfall, Operation, Geburt etc.) kann eine vorübergehende Dosiserhöhung erforderlich werden. Wegen der möglichen Gefährdung in Stress-Situationen sollte für den Patienten bei länger dauernder Therapie ein Notfall-Ausweis ausgestellt werden.
Schwere anaphylaktische Reaktionen können auftreten.
Abhängig von Dauer und Dosierung der Behandlung muss mit einem negativen Einfluss auf den Calciumstoffwechsel gerechnet werden, so dass eine Osteoporose-Prophylaxe zu empfehlen ist. Dies gilt vor allem bei gleichzeitig bestehenden Risikofaktoren wie familiärer Veranlagung, höherem Lebensalter, nach der Menopause, ungenügender Eiweiß- und Calciumzufuhr, starkem Rauchen, übermäßigem Alkoholgenuss, sowie Mangel an körperlicher Aktivität. Die Vorbeugung besteht in ausreichender Calcium- und Vitamin-D-Zufuhr und körperlicher Aktivität. Bei bereits bestehender Osteoporose sollte zusätzlich eine medikamentöse Therapie erwogen werden.
Bei Beendigung oder gegebenenfalls Abbruch der Langzeitgabe von Glucocortikoiden ist an folgende Risiken zu denken: Exazerbation bzw. Rezidiv der Grundkrankheit, akute NNR-Insuffizienz (insbesondere in Stress-Situationen, z. B. während Infektionen, nach Unfällen, bei verstärkter körperlicher Belastung), Cortison-Entzugssyndrom.
Spezielle Viruserkrankungen (Windpocken, Masern) können bei Patienten, die mit Glucocorticoiden behandelt werden, besonders schwer verlaufen. Insbesondere gefährdet sind abwehrgeschwächte (immunsupprimierte) Patienten ohne bisherige Windpocken- oder Maserninfektion. Wenn diese Personen während einer Behandlung mit Decortin Kontakt zu masern- oder windpockenerkrankten Personen haben, sollte gegebenenfalls eine vorbeugende Behandlung eingeleitet werden.
Kinder und Jugendliche
In der Wachstumsphase von Kindern sollte das Nutzen-Risiko-Verhältnis einer Therapie mit Decortin sorgfältig erwogen werden. Aufgrund der wachstumshemmenden Wirkung von Prednisolon sollte das Längenwachstum bei Langzeittherapie regelmäßig kontrolliert werden.
Die Therapie sollte zeitlich begrenzt oder bei Langzeittherapie alternierend erfolgen.
Ältere Patienten
Da ältere Patienten ein erhöhtes Osteoporoserisko haben, sollte das Nutzen-Risiko-Verhältnis einer
Therapie mit Decortin sorgfältig erwogen werden.
Die Anwendung von Decortin kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-
Malabsorption sollten Decortin nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Zu einzelnen Fragestellungen wurden Wechselwirkungsstudien an Erwachsenen durchgeführt. Andere
Wechselwirkungen wurden aufgrund der klinischen Erfahrung aufgenommen.
- Herzglykoside: Die Glykosidwirkung kann durch Kaliummangel verstärkt werden.
- Saluretika/Laxantien: Die Kaliumausscheidung wird verstärkt.
- Antidiabetika: Die blutzuckersenkende Wirkung wird vermindert.
- Cumarin-Derivate (orale Antikoagulantien): Die Antikoagulanzienwirkung kann abgeschwächt oder verstärkt werden. Eine Dosisanpassung des Antikoagulanz kann bei gleichzeitiger Anwendung notwendig sein.
- Nichsteroidale Antiphlogistika/Antirheumatika (NSAR), Salicylate und Indometacin: Die Gefahr von Magen-Darm-Ulzeration und -Blutungen wird erhöht.
- Nicht-depolarisierende Muskelrelaxantien: Die Muskelrelaxation kann länger anhalten.
- Atropin, andere Anticholinergika: Zusätzliche Augen-Innendrucksteigerungen bei gleichzeitiger Anwendung möglich.
- Praziquantel: Durch Corticosteroide ist ein Abfall der Praziquantel-Konzentration im Blut möglich.
- Chloroquin, Hydroxychloroquin, Mefloquin: Es besteht ein erhöhtes Risiko des Auftretens von Myopathien, Kardiomyopathien.
- Somatropin: Die Wirkung von Somatropin kann vermindert werden.
- Protirelin: Der TSH-Anstieg bei Gabe von Protirelin kann reduziert sein.
- Östrogene (z.B. Ovulationshemmer): Die Halbwertszeit von Glucocorticoiden kann verlängert sein. Deshalb kann die Corticoidwirkung verstärkt werden.
- Antazida: Bei gleichzeitiger Einnahme von Magnesium- oder Aluminiumhydroxid verminderte Resorption von Prednison möglich. Die Einnahme der beiden Arzneimittel sollte daher in einem zeitlichen Abstand erfolgen (2 Stunden).
- CYP3A4 aktivierende Substanzen wie Rifampicin, Phenytoin, Barbiturate, Carbamazepin und Primidon können die Corticoidwirkung abschwächen.
- Ephedrin: Durch beschleunigten Metabolismus kann die Wirksamkeit der Glucocorticoide herabgesetzt werden.
- CYP3A4 hemmende Substanzen (z.B. Ketoconazol, Itraconazol) können die Corticoidwirkung verstärken.
- Immunsuppressive Substanzen: Erhöhte Infektanfälligkeit und mögliche Verschlimmerung oder Manifestation latenter Infektionen. Zusätzlich für Ciclosporin: Die Blutspiegel von Ciclosporin werden erhöht. Es besteht eine erhöhte Gefahr zerebraler Krampfanfälle.
- ACE-Hemmstoffe: Erhöhtes Risiko des Auftretens von Blutbildveränderungen.
- Fluorchinolone können das Risiko für Sehnenbeschwerden erhöhen.
Einfluss auf Untersuchungsmethoden:
Hautreaktionen auf Allergietests können unterdrückt werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Während der Schwangerschaft darf eine Behandlung nur nach sorgfältiger Nutzen/Risiko-Abwägung erfolgen. Bei einer Langzeitbehandlung mit Glucocorticoiden während der Schwangerschaft sind Wachstumsstörungen des Feten nicht auszuschließen. Prednison führte im Tierexperiment zur Ausbildung von Gaumenspalten (siehe 5.3). Ein erhöhtes Risiko für orale Spaltbildungen bei menschlichen Feten durch die Gabe von Glucocorticoiden während des ersten Trimenons wird diskutiert. Werden Glucocorticoide am Ende der Schwangerschaft gegeben, besteht für den Fetus die Gefahr einer Atrophie der Nebennierenrinde, die eine ausschleichende Substitutionsbehandlung des Neugeborenen erforderlich machen kann.
Stillzeit
Prednison geht in die Muttermilch über. Eine Schädigung des Säuglings ist bisher nicht bekannt geworden. Trotzdem sollte die Indikation in der Stillzeit streng gestellt werden. Sind aus Krankheitsgründen höhere Dosen erforderlich, sollte abgestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Bisher liegen keine Hinweise vor, dass Decortin die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zur Bedienung von Maschinen beeinträchtigt, gleiches gilt auch für Arbeiten ohne sicheren Halt.
4.8 Nebenwirkungen Hormonersatztherapie:
Geringes Nebenwirkungsrisiko bei Beachtung der empfohlenen Dosierungen.
Pharm akotherapie:
Folgende Nebenwirkungen können aufitreten, die sehr stark von Dosis und Therapiedauer abhängig sind und deren Häufigkeit daher hier nicht angegeben werden kann:
Infektionen und parasitäre Erkrankungen
Maskierung von Infektionen, Manifestation, Exazerbation oder Reaktivierung von Virusinfektionen, Pilzinfektionen, von bakteriellen, parasitären sowie opportunistischen Infektionen, Aktivierung einer Strongyloidiasis (siehe Abschnitt 4.4).
Erkrankungen des Blutes und des Lymphsystems
Mäßige Leukozytose, Lymphopenie, Eosinopenie, Polyzythämie
Erkrankungen des Immunsystems
Allergische Reaktionen (z.B. Arzneimittelexanthem), schwere anaphylaktische Reaktionen wie Arrhythmien, Bronchospasmen, Hypo- oder Hypertonie, Kreislaufkollaps, Herzstillstand,
Schwächung der Immunabwehr
Endokrine Erkrankungen
Adrenale Suppression und Induktion eines Cushing Syndroms (typische Symptome: Vollmondgesicht, Stammfettsucht und Plethora)
Stoffwechsel- und Ernährungsstörungen
Natriumretention mit Ödembildung, vermehrte Kaliumausscheidung (cave: Rhythmusstörungen), Gewichtszunahme, verminderte Glucosetoleranz, Diabetes mellitus, Hypercholesterinämie und Hypertriglyceridämie. Appetitsteigerung
Psychiatrische Erkrankungen
Depressionen, Gereiztheit, Euphorie, Antriebssteigerung, Psychosen, Manie, Halluzinationen, Affektlabilität, Angstgefühle, Schlafstörungen, Suizidalität
Erkrankungen des Nervensystems
Pseudotumor cerebri, Manifestation einer latenten Epilepsie und Erhöhung der Anfallsbereitschaft bei manifester Epilepsie
Augenerkrankungen
Katarakt, insbesondere mit hinterer subcapsulärer Trübung, Glaukom, Verschlechterung der Symptome bei Hornhautulcus, Begünstigung viraler, fungaler und bakterieller Entzündungen am Auge
Gefäßerkrankungen
Hypertonie, Erhöhung des Arteriosklerose- und Thromboserisikos, Vaskulitis (auch als Entzugssyndrom nach Langzeittherapie), erhöhte Kapillarfragilität
Erkrankungen des Gastrointestinaltraktes Magen-Darm-Ulcera, gastrointestinale Blutungen, Pankreatitis
Erkrankungen der Haut und des Unterhautzellgewebes
Striae rubrae, Hautatrophie, Teleangiektasien, Petechien, Ekchymosen, Hypertrichose, Steroidakne, rosazea-artige (periorale) Dermatitis, Änderungen der Hautpigmentierung
Sklelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Muskelatrophie und -schwäche, Myopathie, Osteoporose (dosisabhängig, auch bei nur kurzzeitiger Anwendung möglich), aseptische Knochennekrosen, Sehnenbeschwerden, Sehnenentzündung, Sehnenrupturen und epidurale Lipomatose, Wachstumshemmung bei Kindern
Hinweis: Bei zu rascher Dosisreduktion nach langdauemder Behandlung kann es zu Beschwerden wie Muskel- und Gelenkschmerzen kommen.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Störungen der Sexualhormonsekretion (in Folge davon Auftreten von: Amenorrhoe, Hirsutismus, Impotenz)
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Verzögerte Wundheilung
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome:
Akute Intoxikationen mit Prednison sind nicht bekannt. Bei Überdosierungen ist mit verstärkten Nebenwirkungen (siehe 4.8.) insbesondere auf Endokrinium, Stoffwechsel und Elektrolythaushalt zu rechnen.
Therapie:
Ein Gegenmittel zu Prednison ist nicht bekannt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Glucocorticoid, ATC-Code: H02AB07 Prednison ist ein nichtfluoriertes Glucocorticoid zur systemischen Therapie.
Prednison beeinflusst dosisabhängig den Stoffwechsel fast aller Gewebe. Im physiologischen Bereich ist diese Wirkung lebensnotwendig zur Aufrechterhaltung der Homöostase des Organismus in Ruhe und unter Belastung sowie zur Regulation von Aktivitäten des Immunsystems.
Bei Ausfall oder Insuffizienz der Nebennierenrinde kann Prednison das endogene Hydrocortison ersetzen. Es beeinflusst dabei im metabolischen Gleichgewicht den Kohlenhydrat-, Eiweiß- und Fettstoffwechsel. Dosiswirkungsbezogen entsprechen dabei etwa 5 mg Prednison 20 mg Hydrocortison. Wegen der nur geringen mineralcorticoiden Wirkung von Prednison muss jedoch in der Substitutionstherapie bei Ausfall der NNR-Funktion zusätzlich ein Mineralocorticoid gegeben werden.
Beim adrenogenitalen Syndrom ersetzt Prednison das durch Enzymdefekt fehlende Cortisol und hemmt die überhöhte Bildung von Corticotropin in der Hypophyse sowie von Androgenen in der NNR. Wenn der Enzymdefekt auch die Synthese von Mineralocorticoid betrifft, muss dieses zusätzlich substituiert werden.
In höheren als den zur Substitution erforderlichen Dosen wirkt Prednison rasch antiphlogistisch (antiexsudativ und antiproliferativ) und verzögert immunsuppressiv. Es hemmt hierbei die Chemotaxis und Aktivität von Zellen des Immunsystems sowie die Freisetzung und Wirkung von Mediatoren der Entzündungs- und Immunreaktionen, z. B. von lysosomalen Enzymen,
Prostaglandinen und Leukotrienen. Bei Bronchialobstruktion wird die Wirkung bronchialerweitemder Betamimetika verstärkt (permissiver Effekt).
Längerdauernde Therapie mit hohen Dosen führt zur Involution des Immunsystems und der NNR.
Der bei Hydrocortison deutlich vorhandene und beim Prednison noch nachweisbare mineralotrope Effekt kann eine Überwachung der Serumelektrolyte erfordern.
Die Wirkung von Prednison bei Atemwegsobstruktion beruht im Wesentlichen auf der Hemmung entzündlicher Prozesse, Unterdrückung oder Verhinderung eines Schleimhautödems, Hemmung der Bronchialkonstriktion, Hemmung bzw. Einschränkung der Schleimproduktion sowie Herabsetzung der Schleimviskosität. Diesen Wirkungen liegen folgende Mechanismen zugrunde: Gefäßabdichtung und Membranstabilisierung, Normalisierung von durch Dauergebrauch verminderter Ansprechbarkeit der Bronchialmuskulatur auf ß2-Sympathomimetika, Dämpfung der Typ-I-Reaktion ab der 2. Therapiewoche.
5.2 Pharmakokinetische Eigenschaften
Prednison wird nach oraler Aufnahme rasch und nahezu vollständig resorbiert, maximale Serumkonzentrationen werden innerhalb von 1 bis 2 Stunden erreicht. Bei der primären Leberpassage wird Prednison zu 80 bis 100 % zu Prednisolon metabolisiert. Es erfolgt reversible Bindung an Transcortin und Plasmaalbumin.
Prednisolon wird hauptsächlich in der Leber zu ca. 70 % durch Glucuronidierung und zu ca. 30 % durch Sulfatierung metabolisiert. Zum Teil erfolgt eine Umwandlung in 11ß,17ß-Dihydroxyandrosta-1,4-dien-3-on und in 1,4-Pregnadien-20-ol. Die Metabolite sind hormonell inaktiv und werden vorwiegend renal eliminiert. Nur ein minimaler Anteil von Prednison/Prednisolon erscheint unverändert im Harn. Die Plasmaeliminations-Halbwertszeit beträgt ca. 3 Std. Sie ist verlängert bei schweren Leberfunktionsstörungen. Die Wirkdauer des Prednison ist länger als die Verweilzeit im Serum, sie beträgt im mittleren Dosisbereich 18 bis 36 Stunden.
Bioverfügbarkeit
Relative Bioverfügbarkeit/Bioäquivalenz 5 mg vs 20 mg
In einer im Jahre 1993 durchgeführten randomisierten 2-fach-Crossover Studie zur relativen Bioverfügbarkeit/Bioäquivalenz wurde an 12 gesunden männlichen Probanden 1 Tablette Decortin 20 mg (Test) gegen 4 Tabletten Decortin 5 mg (Referenz) verglichen, wobei die Einnahme der Tabletten morgens zu einem Standardfrühstück erfolgte.
Es wurden folgende Daten für Prednison und Prednisolon gefunden:
|
Parameter * |
Prednison |
Prednisolon | ||
|
Decortin 20 mg |
Decortin 5 mg |
Decortin 20 mg |
Decortin 5 mg | |
|
Max. Plasmakonzen tration (Cmax) [ng/ml] |
44.91(11.07) |
45.24 (9.37) |
357.3 (73.02) |
337.0 (72.3) |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) [h] |
3.92 (1.00) |
3.04 (1.29) |
1.25 (0.48) |
1.25 (0.71) |
|
Fläche unter der Konzentrations -Zeit - Kurve (AUC) [h x ng/mlf |
297.7 (83.1) 337.5 (94.6) |
287.5 (89.2) 329.0 (97.1) |
1903.5 (333.6) 2019.5 (308.3) |
1934.2 (515.4) 2009.2 (473.7) |
|
Angabe der Werte al |
s Mittelwerte und Standardabweichungen | |||
|
Statist. Methode |
Parameter |
Prednison |
Prednisolon | ||
|
Punktschätzer |
90% Konfidenz intervall |
Punktschätzer |
90% Konfidenz intervall | ||
|
ANOVA ln |
AUC |
102.11 |
81.76 - 127.54 |
100.9 |
87.47-116.6 |
|
ANOVA ln |
C max |
97.89 |
80.54 - 118.97 |
106.22 |
91.27-123.63 |
Basierend auf dem individuellen Vergleich der AUC beträgt die relative Bioverfügbarkeit im Mittel für Prednison 102 %, für Prednisolon 101 %.
Die CV- ANOVA zur Abschätzung der intraindividuellen Variabilität von Prednison bzw. Prednisolon ergibt für AUC 32.70 % bzw. 19.96 %, für C max 25.06 % bzw. 20.91 %.
Mittlere Plasmaspiegelverläufe von Prednison und Prednisolon nach Gabe von 1x Decortin 20 mg und 4x Decortin 5 mg:
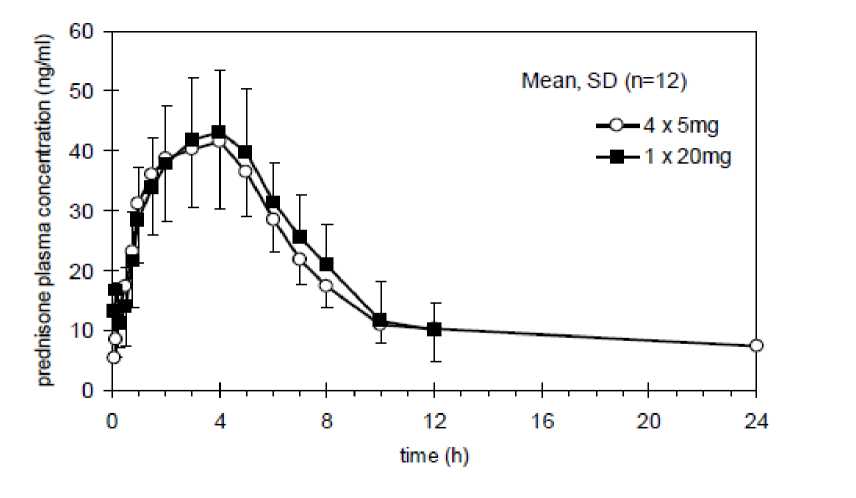

Relative Bioverfügbarkeit/Bioäquivalenz 1 mg vs 5 mg
Ebenfalls 1993 wurden in einer Studie mit demselben Design 5 Tabletten Decortin 1 mg (Test) gegen 1 Tablette Decortin 5 mg (Referenz) verglichen. Dabei wurden folgende Daten für Prednison und Prednisolon gefunden:
|
Parameter * |
Prednison |
Prednisolon | ||
|
Decortin 1 mg |
Decortin 5 mg |
Decortin 1 mg |
Decortin 5 mg | |
|
Max. Plasmakonzen tration (Cmax) [ng/ml] |
14.42 (2.28) |
14.05 (1.19) |
111.8 (15.5) |
109.9 (14.4) |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) [h] |
3.17 (1.03) |
3.12 (0.84) |
1.63 (0.64) |
1.96 (0.75) |
|
Fläche unter der Konzentrations -Zeit - Kurve (AUC)* [h x ng/ml] |
66.3 (12.2) |
68.8 (17.4) |
475.0 (70.2) |
501.3 (73.4) |
* 0 - t, da Restintegrale < 20 %
(Angabe der Werte als Mittelwerte und Standardabweichungen)
|
Statist. Methode |
Parame ter |
Prednison |
Prednisolon | ||
|
Punktschätzer |
90% Konfidenz intervall |
Punktschätzer |
90% Konfidenz intervall | ||
|
ANOVA ln |
AUC* |
97.26 |
90.05 - 105.05 |
94.70 |
91.51- 98.00 |
|
ANOVA ln |
C max |
101.86 |
94.59 - 109.68 |
101.75 |
98.75-104.84 |
* 0-t
Basierend auf dem individuellen Vergleich der AUC beträgt die relative Bioverfügbarkeit im Mittel für Prednison 97 %, für Prednisolon 95 %.
Die CV- ANOVA zur Abschätzung der intraindividuellen Variabilität von Prednison bzw.
Prednisolon ergibt für AUC 11.58 % bzw. 4.51 %, für C max 10.34 % bzw.12.22 %.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Reproduktionstoxizität, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Akute Toxizität
Untersuchungen zur Akuttoxikologie von Prednisolon an der Ratte ergaben eine LD50 (Todeseintritt innerhalb von 7 Tagen) nach Einmalapplikation von 240 mg/kg KG Prednisolon.
Subchronische/chronische Toxizität
Licht- und elektronenmikroskopische Veränderungen an Langerhans-Inselzellen von Ratten wurden nach täglichen i.p. Gaben von 33 mg/kg KG über 7 bis 14 Tage an Ratten gefunden. Beim Kaninchen konnten experimentelle Leberschäden durch tägliche Gabe von 2 bis 3 mg/kg KG über 2 bis 4 Wochen erzeugt werden. Histotoxische Wirkungen im Sinne von Muskelnekrosen wurden nach mehrwöchiger Verabreichung von 0,5 bis 5 mg/kg an Meerschweinchen und 4 mg/kg an Hunden referiert.
Mutagenes und tumorerzeugendes Potential
Vorliegende Untersuchungsbefunde für Glucocorticoide ergeben keine Hinweise auf klinisch relevante genotoxische Eigenschaften.
Reproduktionstoxizität
Prednisolon ruft im Tierexperiment bei Mäusen, Hamstern und Kaninchen Gaumenspalten hervor.
Bei parenteraler Verabreichung traten bei Ratten geringfügige Anomalien an Schädel, Kiefer und Zunge auf. Intrauterine Wachstumsstörungen wurden beobachtet (siehe auch 4.6).
Bei einer Anwendung von hohen Prednisolon-Dosen für einen längeren Zeitraum (30mg/ Tag für mindestens 4 Wochen) sind reversible Störungen der Spermatogenese beobachtet worden, die nach Absetzen des Arzneimittels noch mehrere Monate anhielten.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Magnesiumstearat (Ph. Eur.), Hochdisperses Siliciumdioxid (Ph. Eur.), Carboxymethylstärke-Natrium (Typ C, Ph. Eur.), Hypromellose (Ph. Eur.), Talkum (Ph. Eur.), Lactose-Monohydrat (Ph. Eur.), Maisstärke (Ph. Eur.).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit für Blisterpackungen von Decortin 5 mg/20 mg/50 mg Tabletten beträgt 3 Jahre.
Dieses Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Decortin 5 mg / 20 mg / 50 mg Tabletten:
Nicht über 25° C lagern.
6.5 Art und Inhalt des Behältnisses
Decortin 5 mg Tabletten:
Blisterpackung, bestehend aus PVC und Aluminiumdeckfolie
20 Tabletten
50 Tabletten
100 Tabletten
Klinikpackung
Decortin 20 mg Tabletten:
Blisterpackung, bestehend aus PVC und Aluminiumdeckfolie
10 Tabletten
20 Tabletten
50 Tabletten
100 Tabletten
Klinikpackung
Decortin 50 mg Tabletten:
Blisterpackung, bestehend aus PVC und Aluminiumdeckfolie 10 Tabletten 50 Tabletten Klinikpackung
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen für die Beseitigung.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Merck Serono GmbH Alsfelder Straße 17 D-64289 Darmstadt
E-Mail: Medwiss.Service@merckgroup.com
Kostenfreie Servicenummer:
Tel.: 0800 42 88 373
Telefax: (06151) 6285-816
8. ZULASSUNGSNUMMERN
|
Decortin 5 mg Tabletten: Decortin 20 mg Tabletten: Decortin 50 mg Tabletten: |
8452.00.00 6105503.01.00 8452.01.00 |
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
|
Decortin 5 mg Tabletten: Decortin 20 mg Tabletten: Decortin 50 mg Tabletten: |
03.10.1989 / 29.02.2012 06.07.2004 03.10.1989 / 29.02.2012 |
10. STAND DER INFORMATION
Juli 2015
11. VERKAUFSABGRENZUNG V erschreibungspflichtig.
18