Deponit Nt 5 Mg/24 H Transdermales Pflaster
1
Fachinformation (Zusammenfassung der Merkmale der Arzneimittel/SPC)
1. BEZEICHNUNG DER ARZNEIMITTELS
deponit® NT 5 mg/24 h transdermales Pflaster deponit® NT 10 mg/24 h transdermales Pflaster
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Deponit NT 5 mg/24 h
1 transdermales Pflaster von 9 cm1 2 Fläche enthält 18,7 mg Glyceroltrinitrat.
Freigabe von 5 mg Glyceroltrinitrat auf der Haut innerhalb von 24 h.
Deponit NT 10 mg/24 h
1 transdermales Pflaster von 18 cm2 Fläche enthält 37,4 mg Glyceroltrinitrat.
Freigabe von 10 mg Glyceroltrinitrat auf der Haut innerhalb von 24 h.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Flexible, weiße bis durchsichtige transdermale Pflaster (quadratisch mit gewölbten Kanten und abgerundeten Ecken). Das Pflaster klebt auf einer Schutzfolie mit einer s-förmigen Abziehhilfe.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Prophylaxe und Langzeitbehandlung der Angina Pectoris
4.2 Dosierung und Art der Anwendung
Dosierung
Soweit nicht anders verordnet:
Es wird 1-mal täglich 1 Pflaster auf die Haut geklebt. Bei Bedarf kann die Dosis erhöht werden (z.B. 1-mal täglich 2 Pflaster).
Die zur Verfügung stehenden Daten geben keinen Hinweis darauf, dass die Dosis bei älteren Patienten angepasst werden müsste.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Deponit NT bei Kindern ist bisher noch nicht erwiesen. Art der Anwendung
Das Pflaster sollte auf eine gesunde, unverletzte, relativ faltenarme und unbehaarte Hautstelle aufgeklebt werden.
Die gewählte Stelle sollte frisch gereinigt und trocken sein.
Vor dem Aufkleben des Pflasters, sollte die Haut nicht mit Pflegemitteln behandelt worden sein.
Dieselbe Hautstelle sollte erst nach einigen Tagen wieder benutzt werden.
Bei vorschriftsmäßiger Anwendung haftet Deponit NT gut auf der Haut, und seine Funktion bleibt auch beim Baden, Duschen oder körperlicher Aktivität erhalten. In seltenen Fällen, bei denen sich das Pflaster ablöst, soll ein neues auf eine andere Hautpartie aufgebracht werden.
Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Das Pflaster sollte wegen möglicher Toleranzentwicklung täglich nur ca. 12 Stunden auf die Haut geklebt werden, sodass ein therapiefreies Intervall von ca. 12 Stunden erreicht wird.
Eine zusätzliche antianginöse Therapie mit Arzneimitteln, die keine Nitratverbindungen enthalten, sollte für das nitratfreie Intervall in Betracht gezogen werden.
Das gebrauchte Pflaster ist so zu beseitigen, dass ein Missbrauch (z.B. durch Kinder) verhindert wird.
Das Pflaster sollte nicht zerschnitten werden (siehe auch Abschnitt 6.6).
4.3 Gegenanzeigen
Glyceroltrinitrat darf nicht angewendet werden bei:
• Überempfindlichkeit gegen den Wirkstoff, andere Nitratverbindungen oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
• akutem Kreislaufversagen verbunden mit schwerer Hypotonie (Schock, Kollaps)
• Erkrankungen, die mit einem erhöhten intrakraniellen Druck einhergehen
• kardiogenem Schock, sofern nicht durch intraaortale Gegenpulsation oder positiv inotrope Pharmaka ein ausreichend hoher linksventrikulärer, enddiastolischer Druck gewährleistet ist.
• schwerer Hypovolämie
• schwerer Anämie
• Myokardinsuffizienz infolge einer Obstruktion, wie Aorten- oder Mitralstenose, hypertropher obstruktiver Kardiomyopathie oder konstriktiver Perikarditis
• Perikardtamponade
• schwerer Hypotonie (systolischer Blutdruck unter 90 mmHg)
• gleichzeitiger Anwendung von Phosphodiesterase-5-Hemmern (PDE5) (z.B. Sildenafil, Vardenafil, Tadalafil), da der vasodilatatorische Effekt von Deponit NT durch Phosphodiesterase-5-Hemmer gesteigert werden kann verbunden mit der Gefahr eines starken Blutdruckabfalls (siehe Abschnitte 4.4 und 4.5).
Deponit NT ist nicht geeignet zur Behandlung plötzlicher Herzschmerzen (z.B. akuter Angina-Pectoris-Anfall, akuter Myokardinfarkt).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Deponit NT ist nicht geeignet zur Behandlung von akuten Angina-Pectoris-Anfällen.
Wie bei allen Nitraten kann sich die Wirksamkeit von Glyceroltrinitrat bei manchen Patienten unter Langzeittherapie abschwächen. Diese Patienten sollten das Pflaster vor dem Zubettgehen entfernen. Patienten, die hauptsächlich nachts eine Angina Pectoris-Symptomatik entwickeln, sollten nur nachts ein Pflaster tragen. Wie bei anderen nitrathaltigen Arzneimitteln sollte eine Medikationsänderung bei Patienten unter Erhaltungsdosis mit Glyceroltrinitrat ausschleichend und mit einem zeitlich überlappenden Behandlungsbeginn erfolgen.
Deponit NT enthält kein Aluminium oder andere metallische Bestandteile, daher ist die vorherige Entfernung des Pflasters vor einer Magnetresonanz-Tomografie (MRT) oder einer Kardioversion nicht notwendig, da kein Risiko für Hautverbrennungen durch ein aufgeklebtes Pflaster besteht.
Bei Patienten, die eine signifikante Hypotension entwickeln, sollte die Entfernung des Pflasters als Teil der Behandlung in Betracht gezogen werden.
Glyceroltrinitrat darf nur mit besonderer Vorsicht und nach Anweisung eines Arztes angewendet werden bei:
• niedrigen Füllungsdrücken, z.B. bei akutem Herzinfarkt oder akuter Herzinsuffizienz. In diesen Fällen darf Deponit NT nur mit Vorsicht, unter medizinischer Aufsicht und hämodynamischer Überwachung angewandt werden. Eine Blutdrucksenkung unter 90 mmHg systolisch sollte vermieden werden.
• Orthostatischer Dysfunktion
Hypoxämie
Patienten mit arterieller Hypoxämie aufgrund einer schweren Anämie (einschließlich der durch Glucose-6-Phosphatdehydrogenase-Mangel induzierten Formen) sollten mit Vorsicht behandelt werden, da bei diesen Patienten die Biotransformation von Glyceroltrinitrat vermindert ist.
Vorsicht ist auch geboten bei Patienten mit Hypoxämie und Störungen der Ventilation und Perfusion aufgrund einer Lungenerkrankung oder einer ischämischen Herzinsuffizienz. Patienten mit Angina Pectoris, Myokardinfarkt oder cerebraler Ischämie leiden an Fehlbildungen der kleinen Luftwege (insbesondere alveoläre Hypoxie).
Unter diesen Gegebenheiten kommt es zu einer Vasokonstriktion in der Lunge, die zu einer Verschiebung der Durchblutung von den alveolaren Hypoxiegebieten zu besser belüfteten Lungenregionen führt (Euler-Liljestrand-Mechanismus, siehe auch Abschnitt 4.8). Als ein starker Vasodilatator kann Glyceroltrinitrat diese protektive Vasokonstriktion umkehren und dadurch zu einer verbesserten Durchblutung der schlecht belüfteten Areale sowie zu einer Verschlechterung des Ventilations-/Perfusionsstörungen und einer weiteren Abnahme des arteriellen Sauerstoffpartialdrucks führen.
Verstärkung der Angina Pectoris-Anfälle
Eine mögliche Frequenzsteigerung von Angina Pectoris-Anfällen während einer pflasterfreien Periode sollte berücksichtigt werden. In diesen Fällen ist eine gleichzeitige antianginöse Therapie empfehlenswert.
Toleranz gegenüber sublingual angewandtem Glyceroltrinitrat
Durch eine Toleranz gegenüber Glyceroltrinitrat-Pflastern kann die Wirkung von sublingual verabreichtem Glyceroltrinitrat auf die körperliche Belastbarkeit teilweise vermindert sein.
Eine Toleranzentwicklung (Wirkungsabschwächung) sowie das Auftreten einer Kreuztoleranz gegenüber anderen Nitratverbindungen wurden beschrieben. Die Behandlung mit Deponit NT sollte nicht unterbrochen werden, um Phosphodiesterase-5-Hemmer enthaltende Arzneimittel (z.B. Sildenafil, Tadalafil, Vardenafil) einzunehmen, da das Risiko, einen Angina-Pectoris-Anfall zu provozieren, dadurch erhöht werden könnte (siehe Abschnitte 4.3 und 4.5).
Patienten unter Erhaltungstherapie mit Deponit NT sollten darüber informiert werden, dass sie keine Arzneimittel anwenden dürfen, die Phosphodiesterase-5-Hemmer (wie z.B. Sildenafil, Tadalafil, Vardenafil) enthalten.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen dieser Arzneimittel müssen beachtet werden:
Die gleichzeitige Einnahme von blutdrucksenkenden Arzneimitteln wie Vasodilatatoren (z.B. Phosphodiesterase-5-Hemmer, wie Sildenafil, Vardenafil oder Tadalafil), Kalziumkanalantagonisten, ACE-Hemmern, Antihypertensiva, Beta-Blockern, Diuretika, trizyklischen Antidepressiva, Neuroleptika und stark wirksamen Tranquilizern sowie Alkohol kann die blutdrucksenkende Wirkung von Deponit NT verstärken.
Die blutdrucksenkende Wirkung von Deponit NT steigt insbesondere bei der gleichzeitigen Anwendung von Phosphodiesterase-5-Hemmern, z.B. Sildenafil, Vardenafil oder Tadalafil (siehe Abschnitte 4.3 und 4.4). Dies kann zu lebensbedrohlichen kardiovaskulären Komplikationen führen. Patienten unter einer Therapie mit GTN dürfen daher keine Phosphodiesterase-5-Hemmer (wie z.B. Sildenafil, Tadalafil, Vardenafil) einnehmen.
Deponit NT kann bei gleichzeitiger Anwendung von Dihydroergotamin (DHE) zu einer Erhöhung der Bioverfügbarkeit von DHE führen. Dies verlangt eine besondere Vorsicht bei Patienten mit koronarer Herzkrankheit, da DHE die Wirkung von Glyceroltrinitrat antagonisiert und zu einer koronaren Gefäßverengung führen kann.
Die gleichzeitige Anwendung von Deponit NT mit ASS kann den blutdrucksenkenden Effekt von Deponit NT verstärken.
Die gleichzeitige Anwendung von Deponit NT mit Amifostin und ASS kann den blutdrucksenkenden Effekt von Deponit NT verstärken
Nichtsteroidale Antirheumatika mit Ausnahme von Acetylsalicylsäure (ASS) können die therapeutische Wirksamkeit von Deponit NT vermindern.
Sapropterin (Tetrahydrobiopterin, BH4) ist ein Co-Faktor der Stickstoffmonoxid-Synthetase. Vorsicht ist geboten, wenn sapropterinhaltige Arzneimittel zusammen mit gefäßerweiternden Wirkstoffen, die in den Stoffwechsel oder die Wirkung von Stickstoffmonoxid (NO) eingreifen, einschließlich klassischer NO-Donatoren (z. B. Glyceryltrinitrat (GTN), Isosorbiddinitrat (ISDN), Isosorbid-5-Mononitrat (ISMN) und andere), verabreicht werden.
Bei gleichzeitiger Anwendung von Heparin und Deponit NT kommt es zu einer Wirkungsabschwächung von Heparin. Unter engmaschigen Kontrollen der Blutgerinnungsparameter ist die Heparindosis entsprechend anzupassen. Nach Absetzen von Glyceroltrinitrat kann es zu einer deutlich verminderten Blutgerinnung (sprunghafter Anstieg der PTT) kommen, sodass eine Reduktion der Heparindosis erforderlich sein kann.
Bei mit organischen Nitratverbindungen, z.B. Isosorbiddinitrat, Isosorbid-5-Mononitrat, vorbehandelten Patienten kann eine höhere Dosierung von Glyceroltrinitrat zur Erzielung der gewünschten hämodynamischen Wirkung erforderlich sein.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Studien zur Entwicklungstoxizität an Ratten und Kaninchen zeigten auch bei maternaltoxischen Dosen auf verschiedenen Applikationswegen keinen Einfluss auf Embryos, Feten oder Jungtiere.
In der Schwangerschaft sollte Deponit NT, wie andere Arzneimittel auch, nur mit besonderer Vorsicht angewendet werden, insbesondere im ersten Trimester der Schwangerschaft.
Da tierexperimentelle Studien nicht immer auf den Menschen übertragbar sind, sollte Glyceroltrinitrat während der Schwangerschaft nur bei zwingender Notwendigkeit und ausschließlich unter Anweisung und kontinuierlicher Aufsicht eines Arztes angewandt werden.
Stillzeit
Bisher liegen nur sehr begrenzte Erfahrungen über die Ausscheidung des Wirkstoffes in die menschliche oder tierische Muttermilch vor. Die verfügbaren Daten zur Bestimmung des Säuglingsrisikos während des Stillens sind unzureichend und nicht aussagekräftig. Die Daten zeigen, dass Nitrate in die Muttermilch übergehen und zu Methämoglobinämien beim
Säugling führen können. Das Ausmaß des Übergangs von Nitroglycerin in die menschliche Muttermilch wurde nicht bestimmt. Ein Risiko für das gestillte Kind kann nicht ausgeschlossen werden.
Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Deponit NT verzichtet werden soll bzw. die Behandlung mit Deponit NT zu unterbrechen ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Fertilität
Reproduktionstoxizitätsstudien an Ratten und Kaninchen mit verschiedenen Verabreichungswegen zeigten keine Auswirkung auf das Paarungsverhalten, die Fruchtbarkeit und allgemeine Reproduktionsparameter.
Es liegen keine Daten zur Auswirkung von Deponit NT auf die humane Fertilität vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Deponit NT kann insbesondere zu Beginn der Behandlung oder bei einer Dosisanpassung das Reaktionsvermögen beeinflussen oder in seltenen Fällen zu einer orthostatischen Hypotension und Schwindel führen (ebenso wie in Ausnahmefällen zu einer Synkope nach Überdosierung).
Patienten, die diese Wirkungen erfahren haben, sollten nicht Autofahren oder Maschinen bedienen. Diese Effekte können in Kombination mit Alkohol verstärkt werden.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1000 bis < 1/100)
Selten (> 1/10000 bis < 1/1000)
Sehr selten (< 1/10000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Nervensystems Sehr häufig: Kopfschmerzen
Häufig: Schwindel (einschließlich orthostatischer Schwindel), Schläfrigkeit
Herzerkrankungen Häufig: T achykardie
Gelegentlich: Verstärkung der Angina-Pectoris-Symptomatik Nicht bekannt: Palpitationen
Gefäßerkrankungen
Häufig: bei der Erstanwendung, aber auch bei einer Dosiserhöhung wurden ein Abfall des Blutdrucks und/oder Benommenheit beim Aufstehen beobachtet (orthostatische Hypotonie). Gelegentlich: Kollapszustände (manchmal begleitet von bradykarden Herzrhythmusstörungen und Synkopen).
Selten: Hypotonie, Flush
Erkrankungen des Gastrointestinaltrakts Sehr häufig: Übelkeit, Erbrechen Sehr selten: Sodbrennen
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: allergische Hautreaktionen (z. B. generalisierter Rash), allergische
Kontaktdermatitis
Sehr selten: exfoliative Dermatitis
An der Stelle, an der das Pflaster auf die Haut geklebt wird, können gelegentlich Hautrötungen mit und ohne Juckreiz sowie ein brennendes Gefühl vorkommen. Eine leichte Hautrötung verschwindet in der Regel ohne Gegenmaßnahmen nach Entfernen des Pflasters. Die Applikationsstelle sollte regelmäßig gewechselt werden, um lokalen Hautirritationen vorzubeugen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufig: Asthenie
Gelegentlich: Erythem an der Applikationsstelle, Pruritus, Brennen, Reizung
Untersuchungen
Selten: Herzfrequenzanstieg
Schwerwiegende hypotensive Reaktionen sind bei organischen Nitraten berichtet worden, einschließlich Übelkeit, Erbrechen, Ruhelosigkeit, Blässe und übermäßigem Schwitzen.
Bei der Gabe von Deponit NT kann, bedingt durch eine relative Umverteilung des Blutflusses in hypoventilierte Alveolargebiete, eine vorübergehende Hypoxämie auftreten. Besonders bei Patienten mit koronarer Herzkrankheit kann dies zu einer myokardialen Hypoxie führen.
Wie andere Nitratzubereitungen kann Deponit NT aufgrund zerebraler Vasodilatation häufig dosisabhängige Kopfschmerzen hervorrufen. Diese verschwinden meist trotz der Fortführung der Therapie nach einigen Tagen. Falls die Kopfschmerzen während einer intermittierenden Therapie bestehen bleiben, können diese mit schwach wirksamen Analgetika behandelt werden. Das Fortbestehen der Kopfschmerzen ist eine Indikation zur Reduzierung der Glyceroltrinitrat-Dosis oder zur Unterbrechung der Behandlung.
Eine geringe reflex-induzierte Steigerung der Herzfrequenz kann bei Bedarf durch eine Umstellung auf eine Kombinationstherapie mit Beta-Blockern vermieden werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome
Blutdruckabfall mit orthostatischen Regulationsstörungen, reflektorische Tachykardie und Kopfschmerzen, Asthenie, Schwindel, orthostatischer Schwindel, Flush, Schwitzen, Blässe, schwacher Puls, Kollaps, Synkope, Übelkeit, Erbrechen und Durchfall können auftreten.
Bei chronischer Überdosierung wurden erhöhte Methämoglobinspiegel gemessen, deren klinische Relevanz umstritten ist.
Bei hohen Dosen (größer 20 mg/kg Körpergewicht) ist infolge des beim GTN-Abbau entstehenden Nitrit-Ions mit Methämoglobinbildung, Zyanose, Atemnot und Tachypnoe, Angstzuständen, Bewusstseinsverlust (Synkope), Herzstillstand und Kollaps zu rechnen.
Bei sehr hohen Dosen kann es zur Erhöhung des intrakraniellen Druckes mit cerebralen Symptomen kommen.
Bei einer transdermalen Anwendung ist eine Überdosierung mit Glyceroltrinitrat nicht zu erwarten.
Maßnahmen
Der Nitrateffekt von Deponit NT kann einfach durch Entfernen der (des) Pflaster(s) rasch beendet werden.
Neben allgemeinen Maßnahmen wie Sauerstoffgabe und Horizontallage des Patienten mit Tieferlegen des Kopfes und Hochlegen der Beine oder wenn notwendig, das Anlegen von Kompressionsbandagen an den Beinen des Patienten, müssen unter intensivmedizinischen Bedingungen die vitalen Parameter überwacht und ggf. korrigiert werden.
Bei ausgeprägter Hypotonie und/oder Schock sollte eine Volumensubstitution erfolgen; in Ausnahmefällen kann zur Kreislauftherapie Norepinephrin und/oder Dopamin infundiert werden.
Die Gabe von Epinephrin und verwandter Substanzen ist kontraindiziert.
Je nach Schweregrad bieten sich bei Methämoglobinämie folgende Antidote an:
1. Vitamin C: 1 g p.o. oder als Natriumsalz i.v.
2. Methylenblau1: bis zu 50 ml einer 1%igen Methylenblaulösung i.v.
3. Toluidinblau: initial 2 - 4 mg/kg Körpergewicht streng intravenös; falls
erforderlich mehrfache Wiederholung in einstündigem Abstand mit 2 mg/kg Körpergewicht möglich
4. Sauerstoffbehandlung, künstliche Beatmung, Hämodialyse, Blutaustausch
1
Die Behandlung einer Methämoglobinämie mit Methylenblau ist bei Patienten mit Glukose-6-Phosphat-Mangel oder Methämoglobinreduktase-Mangel kontraindiziert. Da diese Behandlung kontraindiziert oder nicht wirksam ist, werden eine Austauschtransfusion und/oder eine Transfusion der roten Blutkörperchen empfohlen.
Wiederbelebungsmaßnahmen
Bei Anzeichen von Atem- und Kreislaufstillstand sofort Wiederbelebungsmaßnahmen einleiten.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Organische Nitrate ATC-Code: C01DA02
Wirkungsweise
Glyceroltrinitrat wirkt direkt relaxierend auf die glatte Gefäßmuskulatur und führt zu einer Vasodilatation.
Die postkapillären Kapazitätsgefäße und die großen Arterien - insbesondere die noch reagiblen Teile von Koronararterien - sind hierbei stärker betroffen als die Widerstandsgefäße. Die Vasodilatation in der Strombahn führt zur Zunahme der venösen Kapazität („pooling"), der Rückstrom zum Herzen wird vermindert, Ventrikelvolumina und Füllungsdrücke sinken („preload"-Senkung).
Verkleinerter Ventrikelradius und verminderte systolische Wandspannung senken den myokardialen Energie- bzw. O2-Bedarf.
Die Abnahme der kardialen Füllungsdrücke begünstigt die Perfusion ischämiegefährdeter, subendokardialer Wandschichten, regionale Wandbewegung und Schlagvolumen können verbessert werden.
Die Dilatation der großen herznahen Arterien führt zu einer Abnahme sowohl des systemischen („afterload"-Senkung) als auch des pulmonalen Auswurfwiderstandes.
Glyceroltrinitrat bewirkt eine Relaxation der Bronchialmuskulatur, der ableitenden Harnwege, der Muskulatur der Gallenblase, des Gallenganges sowie des Ösophagus, des Dünn- und Dickdarmes einschließlich der Sphinkteren.
Auf molekularer Ebene wirken die Nitrate sehr wahrscheinlich über die Bildung von Stickoxid (NO) und zyklischem Guanosylmonophosphat (cGMP), das als Mediator der Relaxation gilt.
5.2 Pharmakokinetische Eigenschaften
GTN wird intestinal vollständig absorbiert, unterliegt aber einem extensiven hepatischen First-pass-Metabolismus sowie einer Spontanhydrolyse im Blut. Außerdem erfolgt eine hohe Erythrozytenbindung sowie eine Anreicherung in der Gefäßwand.
Bei sublingualer Applikation wird Glyceroltrinitrat aus der Mundhöhle rasch resorbiert.
Der First-Pass-Effekt von GTN wird nach sublingualer und topischer Applikation in unterschiedlichem Ausmaß beobachtet. So beträgt die absolute Bioverfügbarkeit bei sublingualer Gabe ca. 39 % und nach topischer Anwendung als Pflaster ca. 55 %.
Die Plasmaproteinbindung beträgt ca. 60 %.
Die Eliminationshalbwertszeit für GTN ist kurz. Nach sublingualer Gabe werden Werte von 2,5 - 4,4 min, nach intravenöser Gabe von 2 - 2,5 min angegeben. Der GTN-Abbau, der in der Leber, aber auch in vielen anderen Zellen, z.B. in den Erythrozyten, erfolgt, beinhaltet die Abspaltung einer oder mehrerer Nitratgruppen.
Neben der Verstoffwechselung des GTN findet eine renale Elimination der Metaboliten statt.
Therapeutischer Blutspiegelbereich 0,1 ng/ml - 3 (- 5) ng/ml
Plasmaspiegel
Nach sublingualer Applikation wurden große intra- und interindividuelle Schwankungen der Plasmaspiegel beobachtet. Für eine sublinguale Dosis von 0,4 mg betragen die Cmax-Werte
1,9 ± 1,6 ng/ml (Variationskoeffizient 87 %) und die tmax-Werte 5 ± 2 min (Bereich 2 - 10 min).
Toleranz
Trotz gleichbleibender Dosierung und bei konstanten Nitratspiegeln wurde ein Nachlassen der Wirksamkeit beobachtet. Eine bestehende Toleranz klingt nach Absetzen der Therapie innerhalb von 24 Stunden ab. Bei entsprechend intermittierenden Verabreichungen wurde keine Toleranzentwicklung beobachtet.
Bioverfügbarkeit
Deponit NT 5 mg/24 h transdermales Pflaster
Eine im Jahr 1994 durchgeführte Bioverfügbarkeitsstudie an 40 Probanden ergab für das Testpräparat im Vergleich zum Referenzpräparat:
|
Testpräparat |
Referenzpräparat | |
|
maximale Plasmakonzentration (Cmax) [pg/ml] |
377 ± 355 |
369 ± 303 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) [h], median |
8 |
8 |
|
Fläche unter der KonzentrationsZeit-Kurve (AUC0-12) [hpg/ml] |
2105 ± 1768 |
2230 ± 1955 |
Angabe der Werte als Mittelwert und Standardabweichung
siehe Abbildung
Deponit NT 10 mg/24 h transdermales Pflaster
Eine im Jahr 1996 durchgeführte Bioverfügbarkeitsuntersuchung an 46 Probanden ergab im Vergleich zum Referenzpräparat:
|
Testpräparat |
Referenzpräparat | |
|
maximale Plasmakonzentration (Cmax) [pg/ml] |
604 ± 381 |
554 ± 432 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) [h], median |
8 |
8 |
|
Fläche unter der KonzentrationsZeit-Kurve (AUC0.12) [hpg/ml] |
4217 ± 2166 |
3811 ± 2635 |
Angabe der Werte als Mittelwert und Standardabweichung
siehe Abbildung
Deponit NT 5 mg/24 h transdermales Pflaster
Mittlere Plasmaspiegelverläufe von Glyceroltrinitrat in einem Konzentrations-Zeit-Diagramm während einer 12-stündigen Applikation:
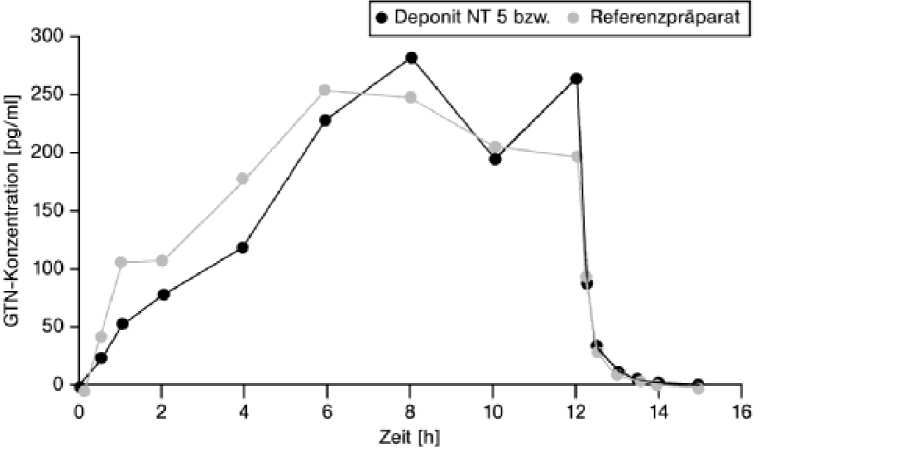
Deponit NT 10 mg/24 h transdermales Pflaster
Mittlere Plasmaspiegelverläufe von Glyceroltrinitrat in einem Konzentrations-Zeit-Diagramm während einer 12-stündigen Applikation:
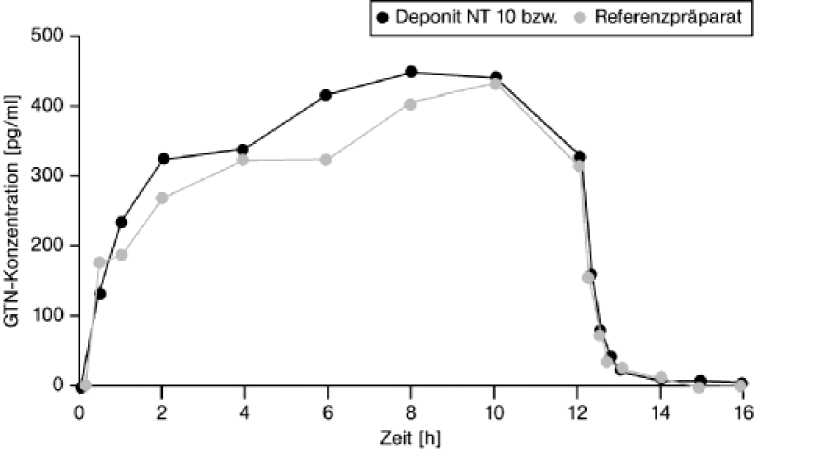
5.3 Präklinische Daten zur Sicherheit
Die Prüfung von Glyceroltrinitrat in Zellkulturen und im Tierversuch zeigte keine für den therapeutischen Dosisbereich relevanten mutagenen oder kanzerogenen Wirkungen.
Reproduktionsstudien an Tieren liegen mit intravenöser, intraperitonealer und dermaler Gabe vor. In Studien zur Embryotoxizität und Fertilität ergaben sich bis in einen für die Elterntiere toxischen Dosisbereich keine Hinweise auf eine Beeinflussung des Embryos oder auf Fertilitätsstörungen. Insbesondere fanden sich keine Anhaltspunkte für teratogene Eigenschaften. Dosen oberhalb von 1 mg/kg KG/Tag (i.p.) und 28 mg/kg KG/Tag (dermal) zeigten fetotoxische Wirkungen (verminderte Geburtsgewichte) nach Anwendung während der Fetalentwicklung bei trächtigen Ratten. Untersuchungen zur Bestimmung der Wirkstoffkonzentrationen in der Muttermilch sind nicht bekannt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Poly[(2-ethylhexyl)acrylat-co-vinylacetat-co-(2-hydroxyethyl)acrylat-co-(2,3-epoxypropyl)methacrylat] (67:28:5:0,15)
Trägerfolie: Polypropylen
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
4 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern!
In der Originalverpackung aufbewahren!
6.5 Art und Inhalt der Behältnisse
Primärpackmittel:
Schutzfolie: HDPE, silikonisiert
Packungen mit einzeln verpackten Pflastern in Multilaminat-Folienbeutel mit Siegelrand
Packungen mit 10, 30 und 100 transdermalen Pflastern Klinikpackungen mit 200 (10 x 20) transdermalen Pflastern
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Gebrauchte Pflaster sollten sachgerecht entsorgt werden, um einen Missbrauch (z.B. durch Kinder) zu vermeiden.
7. INHABER DER ZULASSUNGEN
UCB Pharma GmbH Alfred-Nobel-Straße 10 40789 Monheim Telefon: 0 21 73/48-4848 Telefax: 0 21 73/48-4841
8. ZULASUNGSNUMMERN
Deponit NT 5 mg/24 h transdermales Pflaster 30524.00.00
Deponit NT 10 mg/24 h transdermales Pflaster 30524.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN/VERLÄNGERUNG DER ZULASSUNGEN
Deponit NT 5 mg/24 h transdermales Pflaster
Datum der Erteilung der Zulassung: 04.12.1996
Datum der letzten Verlängerung der Zulassung: 06.07.2004
Deponit NT 10 mg/24 h transdermales Pflaster
Datum der Erteilung der Zulassung: 08.03.1999
Datum der letzten Verlängerung der Zulassung: 13.05.2004
10. STAND DER INFORMATION
Juni 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Deponit NT bezieht sich auf Deponit NT 5 mg/24 h transdermales Pflaster und Deponit NT 10 mg/24 h transdermales
Pflaster