Dextrocap 30 Mg
alt informationen
F achinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Silomat® DMP intensiv gegen Reizhusten Hartkapseln
W irkstoff: Dextromethorphanhydrobromid-Monohydrat
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Hartkapsel enthält 30 mg Dextromethorphanhydrobromid-Monohydrat (entsprechend 22 mg Dextromethorphan).
Sonstiger Bestandteil:
Lactose-Monohydrat
(siehe Abschnitt 4.4 „Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“) Vollständige Auflistung der sonstigen Bestandteile: siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Hartkapseln
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur symptomatischen Behandlung des Reizhustens (unproduktiver Husten).
4.2 Dosierung, Art und Dauer der Anwendung
Soweit nicht anders verordnet, gilt folgende Dosierungsempfehlung:
Jugendliche über 12 Jahre und Erwachsene:
1 Hartkapsel (entsprechend 30 mg Dextromethorphanhydrobromid-Monohydrat) alle 6 Stunden; die maximale Tagesgesamtdosis beträgt 4 Hartkapseln (entsprechend 120 mg Dextromethorphanhydrobromid-Monohydrat).
Die Hartkapseln werden unzerkaut mit ausreichend Flüssigkeit (z.B. ein Glas Wasser) eingenommen.
Bei Selbstbehandlung sollte die Einnahme auf 3 - 5 Tage begrenzt bleiben.
Auch unter ärztlicher Verordnung sollte Silomat DMP intensiv gegen Reizhusten nicht länger als zwei bis drei Wochen eingenommen werden.
4.3 Gegenanzeigen
Silomat DMP intensiv gegen Reizhusten darf nicht angewendet werden bei:
• bekannter Überempfindlichkeit gegen Dextromethorphan oder einen der sonstigen Bestandteile
• Asthma bronchiale
• chronisch obstruktiver Atemwegserkrankung
• Pneumonie
• Ateminsuffizienz
• Atemdepression
• Stillzeit
• bei seltenen angeborenen Unverträglichkeiten gegen einen der Bestandteile (siehe Abschnitt „Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Silomat DMP intensiv gegen Reizhusten sollte nur unter strenger Abwägung des Nutzen-RisikoVerhältnisses angewendet werden bei:
• eingeschränkter Leberfunktion
• gleichzeitiger Anwendung von MAO-Hemmern.
Silomat DMP intensiv gegen Reizhusten ist für Kinder unter 12 Jahren wegen des hohen Wirkstoffgehaltes nicht geeignet. Hierfür stehen Arzneimittel in anderen Zubereitungsformen zur Verfügung.
Bei produktivem Husten mit erheblicher Schleimproduktion ist die antitussive Behandlung mit Silomat DMP intensiv gegen Reizhusten nur unter strenger Nutzen-Risiko-Abwägung mit besonderer Vorsicht durchzuführen.
Chronischer Husten kann ein Frühsymptom eines Asthma bronchiale sein, daher ist Silomat DMP intensiv gegen Reizhusten zur Dämpfung dieses Hustens - insbesondere bei Kindern - nicht indiziert.
Dextromethorphan hat ein geringes Abhängigkeitspotenzial. Bei längerem Gebrauch können sich Toleranz, psychische und physische Abhängigkeit entwickeln. Bei Patienten, die zu Arzneimittelmissbrauch oder Medikamentenabhängigkeit neigen, ist daher eine Behandlung mit Silomat DMP intensiv gegen Reizhusten nur kurzfristig und unter strengster ärztlicher Kontrolle durchzuführen.
Patienten mit der seltenen hereditären Galaktose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Silomat DMP intensiv gegen Reizhusten nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei Vorbehandlung von Patienten mit bzw. bei gleichzeitiger Anwendung von Antidepressiva vom Typ der MAO-Hemmer kann ein sogenanntes Serotoninsyndrom mit folgenden Symptomen auftreten: neuromuskuläre Überaktivität (Tremor, Rigor, Hyperreflexie, Cloni und Myocloni), autonome Überaktivität (Schwitzen, Hyperthermie, Tachykardie, Tachypnoe, Mydriasis) und psychische Veränderungen wie Erregungszustände und Verwirrtheit.
Bei gleichzeitiger Einnahme anderer Arzneimittel mit dämpfender Wirkung auf das Zentralnervensystem kann es zu einer gegenseitigen Wirkungsverstärkung kommen.
Bei gleichzeitiger Anwendung von Arzneimitteln, die das Cytochrom P450-2D6-Enzymsystem der Leber und damit die Metabolisierung von Dextromethorphan hemmen - insbesondere Amiodaron, Chinidin, Fluoxetin, Haloperidol, Paroxetin, Propafenon, Thioridazin, Cimetidin und Ritonavir - kann es zu einem Anstieg der Konzentration von Dextromethorphan kommen.
Diese Angaben können auch für vor kurzem angewandte Arzneimittel gelten.
Bei kombinierter Anwendung von Silomat DMP intensiv gegen Reizhusten mit Sekretolytika (Schleim lösenden Hustenmitteln) kann aufgrund des eingeschränkten Hustenreflexes ein gefährlicher Sekretstau entstehen.
4.6 Schwangerschaft und Stillzeit
Die Ergebnisse epidemiologischer Studien an begrenzten Populationen geben bislang keinen Hinweis auf eine erhöhte Missbildungshäufigkeit bei pränatal Dextromethorphan-exponierten Kindern, jedoch dokumentieren sie nur ungenügend Zeitpunkt und Anwendungsdauer von Dextromethorphan.
Tierexperimentelle Studien zur Reproduktionstoxizität lassen für Dextromethorphan kein Gefahrenpotential für den Menschen erkennen (s. 5.3).
Hohe Dextromethorphan-Dosen können möglicherweise - auch wenn sie nur kurze Zeit verabreicht werden - beim Neugeborenen eine Atemdepression verursachen.
Während der Schwangerschaft sollte die Verabreichung des Arzneimittels daher nur nach strenger Nutzen-Risiko-Abwägung und nur in Ausnahmefällen erfolgen.
Untersuchungen zu einem Übergang von Dextromethorphan in die Muttermilch liegen nicht vor. Da eine atemdepressive Wirkung auf den Säugling nicht auszuschließen ist, ist Dextromethorphan in der Stillzeit kontraindiziert.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann auch bei bestimmungsgemäßem Gebrauch häufig zu leichter Müdigkeit führen und dadurch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol oder Medikamenten, die ihrerseits das Reaktionsvermögen beeinträchtigen können.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
|
Sehr häufig: |
(> 1/10) |
|
Häufig: |
(> 1/100 bis < 1/10) |
|
Gelegentlich: |
(> 1/1.000 bis < 1/100) |
|
Selten: |
(> 1/10.000 bis < 1/1.000) |
|
Sehr selten: |
(< 1/10.000) |
|
Nicht bekannt: |
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
Nebenwirkungen
Erkrankungen des Immunsystems
Nicht bekannt: Überempfindlichkeitsreaktionen
Erkrankungen des Nervensystems, Psychiatrische Erkrankungen, Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: leichte Müdigkeit, Schwindelgefühl
Benommenheit, Halluzinationen, bei Missbrauch Entwicklung einer Abhängigkeit
Sehr selten:
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Magen-Darm-Beschwerden, Erbrechen
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung:
• Erregungszustände
• Schwindelgefühl
• Atemdepression
• Halluzinationen, Bewusstseinsstörungen
• Blutdruckabfall, Tachykardie
• erhöhter Muskeltonus
• Ataxie.
Falls erforderlich, ist ein intensivmedizinisches Monitoring mit symptombezogener Therapie einzuleiten. Naloxon kann als Antagonist angewendet werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Opium-Alkaloide und Derivate ATC-Code: R05 DA 09
Dextromethorphanhydrobromid ist ein 3-Methoxy-Derivat des Levorphanols. Es wirkt antitussiv, besitzt aber in therapeutischen Dosen keine analgetische, atemdepressive, psychotomimetische Wirkung und hat nur eine schwache Abhängigkeitspotenz.
5.2 Pharmakokinetische Eigenschaften
Dextromethorphanhydrobromid wird nach oraler Applikation rasch resorbiert. Innerhalb von 2 Stunden werden maximale Plasmaspiegel erreicht.
Dextromethorphanhydrobromid wird in der Leber metabolisiert (first-pass-Effekt). Wesentliche Schritte sind die oxidative O- und N-Demethylierung und anschließende Konjugation. Der aktive Hauptmetabolit ist Dextrophan, darüber hinaus werden (+)-3-Methoxymorphinan und (+)-3-Hydroxymorphinan gebildet. Der genetische Polymorphismus bei der oxidativen Metabolisierung (Debrisoquin-Typ) beträgt 5 - 10 %. Daher kann der renal ausgeschiedene Anteil bis 48 Stunden nach oraler Applikation zwischen 20 und 86 % der verabreichten Dosis variieren. Im Harn werden freie oder konjugierte Metabolite wiedergefunden, nur ein kleiner Anteil des Wirkstoffes wird unverändert ausgeschieden. In den Faeces sind weniger als 1 % zu finden. Die Plasmaeliminationshalbwertzeit beträgt 1,2 - 2,2 Stunden, kann aber bei abweichender Metabolisierung (Polymorphismus) bis zu 45 Stunden erreichen.
Die Wirkung tritt 15 - 30 Minuten nach oraler Einnahme ein, die Wirkdauer beträgt ca. 3 - 6 Stunden.
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
vgl. Angaben zu Überdosierung unter Punkt 4.9
b) Chronische Toxizität/Subchronische Toxizität
Untersuchungen zur subchronischen und chronischen Toxizität an Hund und Ratte ergaben keine Hinweise auf substanzbedingte toxische Effekte.
c) Mutagenes und Tumor erzeugendes Potenzial
Dextromethorphanhydrobromid ist unzureichend bezüglich mutagener Wirkungen untersucht worden. Ein bakterieller Test auf Punktmutationen verlief negativ. Ein mutagenes Potenzial kann nicht ausreichend beurteilt werden. Langzeituntersuchungen am Tier auf ein Tumor erzeugendes Potenzial liegen nicht vor.
d) Reproduktionstoxizität
Studien zur Embryotoxizität, peri/postnataler Toxizität und Fertilität an der Ratte verliefen bis zu einer Dosis von 50 mg/kg/Tag negativ.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Hartkapselinhalt:
Mikrokristalline Cellulose
Lactose-Monohydrat
Magnesiumstearat
Hartkapselhülle:
Gelatine
Titandioxid (E171)
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
Das Arzneimittel soll nach Ablauf des Verfallsdatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
Blisterpackung aus PVC-/Aluminiumfolie
Originalpackung mit 12 Hartkapseln
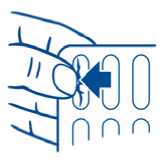
Hinweis zur Kapselentnahme:
Der Blister hat eine spezielle Schutzversiegelung. Zur Entnahme der Kapsel bitte die Alufolie vor dem Herausdrücken der Kapsel mit dem Fingernagel durchstoßen.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
Boehringer Ingelheim Pharma GmbH & Co. KG
Vertriebslinie Thomae
Binger Straße 173
55216 Ingelheim am Rhein
Telefon: 0 800/77 90 900
Telefax: 0 61 32/72 99 99
8. ZULASSUNGSNUMMER
56502.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
09. Januar 2006
10. STAND DER INFORMATION
Mai 2014
11. VERKAUFSABGRENZUNG
Apothekenpflichtig
Seite 6 von 6